黑龙江某猪场哺乳仔猪腹泻病因分析
高国强,曹 禹,吴丹丹,刘 宇,周玉龙,侯喜林
(黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319)
黑龙江某猪场哺乳仔猪腹泻病因分析
高国强,曹 禹,吴丹丹,刘 宇,周玉龙,侯喜林
(黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319)
近年来,随着养猪业快速发展,猪病也愈加复杂,尤其是仔猪腹泻已经成为当前影响养猪业发展的主要因素之一。引起仔猪腹泻的因素比较复杂,主要分为三类,一是环境和生产管理因素,如卫生条件差,环境湿度过大,温度不稳定,日粮配比不合理等;二是细菌性腹泻,病原主要有大肠杆菌、沙门菌、C型产气荚膜梭菌等;三是病毒性腹泻,主要有猪流行性腹泻病毒、轮状病毒、猪传染性胃肠炎病毒等;此外,猪圆环病毒Ⅱ型、猪伪狂犬病病毒、猪繁殖与呼吸综合征病毒、附红细胞体等有时也可导致仔猪出现腹泻症状。
目前,哺乳仔猪腹泻以猪流行性腹泻病毒感染最为常见,一旦与其他病原混合感染,使病情更加复杂。关于猪流行性腹泻病毒与猪伪狂犬病病毒和圆环病毒Ⅱ型混合感染的病例少见报道。2016年4月份,黑龙江某猪场哺乳仔猪暴发腹泻,经实验室诊断确诊病原为猪流行性腹泻病毒、猪伪狂犬病病毒和猪圆环病毒Ⅱ型混合感染,现将该病例报道如下。
1 材料
1.1 主要试剂 TRIZol Reagent(invitrogen);Rever-Tra Ace qPCR RT Master Mix、pMD18-T载体和DNA Marker DL-2 000(TaKaRa公司);碧云天DNA提取试剂盒;引物由上海生工生物工程技术服务有限公司合成。
1.2 引物 参照文献和国家或者地方诊断标准合成 PEDV(NY/T 544-2015)、TGEV(NY/T 548-2015)、RV[1]、CSFV[2]、PRRSV(DB33/T 822-2011)、PRV(GBT 18641-2002)和PCV(GBT 21674-2008) PCR诊断引物,PEDV M和 ORF3基因扩增引物[3]等。
1.3 样本 无菌采集3日龄、10日龄和15日龄发病仔猪的内脏器官和肠道内容物。
2 方法
2.1 临床诊断 通过流行病学、临床症状和病理剖检进行初步诊断。
2.2 实验室诊断 根据临床诊断结果对能够引起哺乳仔猪腹泻的主要病原体,猪流行性腹泻病毒(PEDV)、猪轮状病病毒(RV)、猪传染性胃肠炎病毒(TGEV)、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)、圆环病毒(PCV)和大肠杆菌等进行检测。
2.2.1 病毒检测 应用PCR方法对PEDV、TGEV、RV、CSFV、PRRSV、PRV和PCV等病毒进行检测。
2.2.1.1 病毒的核酸制备 不同组织或者肠内容物总RNA制备按照TRIZol Reagent 试剂盒说明书
2.2.1.2 cDNA合成 按照Rever Tra Ace qPCR RT Master Mix试剂盒操作。取8μL RNA,65℃水浴5 min,迅速放入冰盒冰浴2 min。再加入2μL 5×RT Master Mix。37℃15 min,50℃5 min,98℃5 min。
2.2.1.3 PCR 反应体系25μL:r Taq Mix 12.5μL,去离子水 8.5μL,上、下游引物(25 pmol/μL)各1μL,cDNA 2.0μL。反应条件:94℃10 min;94℃45 s,55℃(PEDV)/55℃(TGEV)/56℃(RV)/ 56℃(CSFV)/55℃(PRRSV)/65℃(PRV)/62℃(PCV)/56℃(PEDV ORF3)45 s,72℃90 s,35个循环;72℃10 min,取反PCR产物15μL,在1%琼脂糖凝胶中电泳23 min,在凝胶成像系统中观察结果。
2.3 PEDV M和ORF3基因序列分析 为了探讨该猪场流行的PEDV与当前流行毒株和疫苗毒株的系统进化关系,为PEDV的防控提供理论依据,对3头病死猪体内的PEDV M和ORF3基因进行测序分析。按照常规方法,将纯化后的M和ORF3 PCR产物分别连接到pMD18-T载体上,再转化到DH5α大肠杆菌感受态细胞当中得到重组菌,提取质粒用限制性内切酶SalⅠ和Bam HⅠ进行双酶切鉴定。鉴定阳性的重组菌株委托北京华大基因研究中心进行测序。将测序结果在GenBank中进行Blast分析,然后选取典型PEDV毒株应用DNA-Star软件进行同源性分析。
2.4 病原菌检测 分别把仔猪内脏器官和小肠内容物接种TSA、血液营养琼脂培养基、S.S.琼脂和麦康凯培养基,培养24 h后观察菌落形态特征,进行革兰染色镜检和纯培养。
2.5 细菌致病性试验 将小肠内分离的大肠杆菌接种到普通营养肉汤培养基中,于空气浴摇床中180 r/min,37℃培养12 h。然后腹腔接种5只小鼠体重(18~25)g,1×109CFU/只,同时设对照组5只小鼠,注射同等计量的营养肉汤,连续观察1周。
3 结果
3.1 临床诊断结果 发病猪场存栏母猪2 000头,哺乳仔猪暴发腹泻,发病率60%,死亡率80%。哺乳仔猪各日龄段均有腹泻发生,多数伴有震颤、抽搐、鸣叫等神经症状。产房的仔猪出现体温升高,有的邻窝仔猪却无异常。尸体剖检可见仔猪消瘦,体表有粪便附着;全身淋巴结肿大;肾脏畸形,表面有针尖状出血点,肾盂内有尿酸盐沉积;膀胱黏膜有散在出血点;肺脏膈叶轻微水肿;肝脏肿大、边缘有出血点,腹面有针尖状坏死灶;小肠壁变薄,内容物稀薄,其他脏器未见异常。
3.2 病毒PCR鉴定结果 PEDV、PRV和PCV-2分别扩增出与目的基因大小相符的特异性DNA片段,目的基因分别为774 bp、217 bp和1154 bp(见图1、2、3)。CSFV、PRRSV、RV和 TGEV PCR结果为阴性。
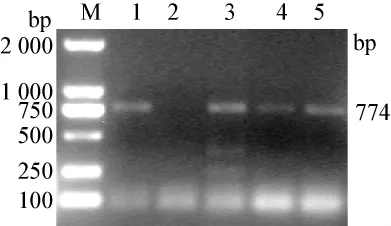
图1 PEDV基因序列RT-PCR扩增结果
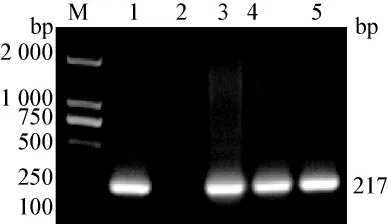
图2 PRV基因序列PCR扩增结果
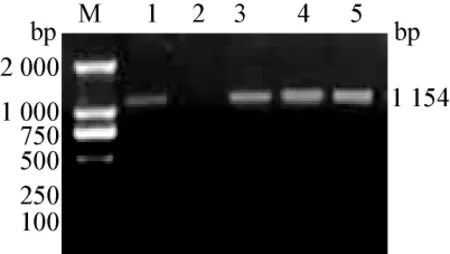
图3 PCV基因序列PCR扩增结果
3.3 PEDV病毒M基因序列分析结果 3株PEDV中国ZD毒株M基因全长均为681 bp。基于M基因的核苷酸序列分析显示,与标准株CV777相比,M基因37位由G→C,125位由T→C,180位由G→A,198、213、222、234、258位由C→T,285、618位由T→C,348位由T→A,640位由G→T。另外,毒株China ZD-1(KX852349)的17、146位由T→C,毒株China ZD-2(KX852350)的71位由T→A,659位由A→G。毒株China ZD-3(KY010201)的6位由T→C,320、604位由A→G。所推导的氨基酸序列分析显示,China ZD-1的49位由M→T,China ZD-2的24位由I→N。其他结果如图4所示。
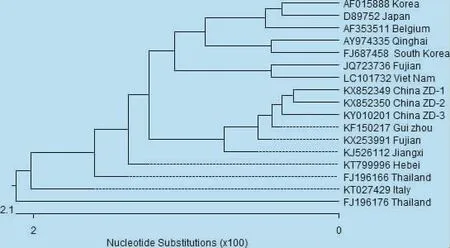
图4 M基因核苷酸序列的遗传进化分析
3.4 M基因的核苷酸及其推导的氨基酸同源性分析 3株PEDV中国ZD毒株M基因核苷酸和氨基酸的同源性分别为99.3%~99.4%和97.8%。与国内疫苗株CV777(AF353511)相比,核苷酸和氨基酸的同源性为97.7%~97.8%和97.4%。与意大利毒株Italy/178509/2014(KT027429)同源性最近为100%。与2011年1株中国毒株ZY(KF150217)相对较近为99.6%和99.1%,与泰国毒株08NP05 (FJ196176)同源性相差最大为87.1%,其他结果如图6所示。
3.5 PEDV病毒ORF3基因序列分析结果 3株PEDV中国ZD毒株ORF3基因全长为675 bp。基于ORF3基因的核苷酸序列分析显示,与标准株CV777相比,ORF3基因497、517位由A→G,160、235、301位由G→A,162、360、393、501位由T→C,237、243、264、274、369、439、450、489位由 C→T,238、546位由 T→G。另外,毒株 China ZD-1 (KX852337)的54位由G→A,62位由T→C,63位由C→T,毒株China ZD-2(KX852325)的32位由A→G,54位由G→A,62位由T→C,63位由C→T,毒株China ZD-3(KX852324)的152位由G→A。所推导的氨基酸序列分析显示,80位由F→V,92位由L→F。其他结果如图5所示。
3.6 ORF3基因的核苷酸及其推导的氨基酸同源性分析 3株PEDV中国ZD毒株ORF3基因核苷酸和氨基酸的同源性分别为99.7% ~99.9%和98.7%~99.1%。它们与2014年1株日本毒株14JM-40(KT968512)为99.4% ~99.6%和98.7% ~99.1%;与2014年1株中国毒株LNCT2(KT323980)为99.4%~99.6%和93.3%~99.1%,与国内疫苗株 CV777(AF353511)和韩国疫苗株 DR13 (EU054930)基因和氨基酸亲源性较远,基因同源性分别为96.6%~96.7%和97.6%~97.8%,氨基酸同源性分别为95.1%~95.6%和97.1%~97.6%,但是与3株毒株同源性最近的是2011年中国毒株CH/HLJHRB/2011(JQ027026)、CH/HBXX3/11 (JQ664731)和2013年美国毒株USA/Tennesse56/ 2013(KJ645654),同源性为98.7%~99.1%。其他结果如图7所示。
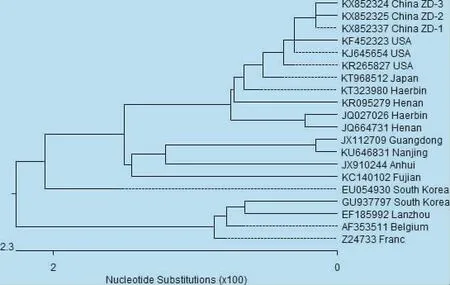
图5 ORF3基因核苷酸序列的遗传进化分析
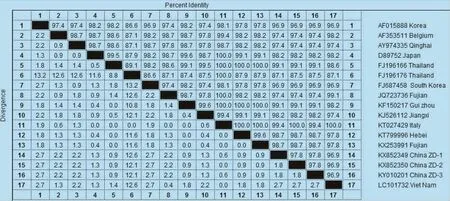
图6 M基因氨基酸序列的遗传进化分析
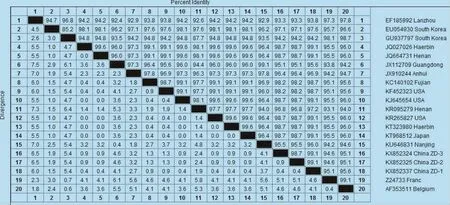
图7 ORF3基因氨基酸同源性的遗传进化分析
3.7 细菌分离鉴定结果 在3头被检测仔猪肠道内均分离到1种革兰阴性杆菌,在麦康凯培养基上呈粉红色,在伊红美蓝培养基上紫色有金属光泽,在S.S.培养基上呈粉色菌落,与大肠杆菌特征相符[6],其他内脏器官中未分离出细菌。大肠杆菌接种小鼠以后,连续观察7 d试验组与对照组小鼠均无异常反应,说明该大肠杆菌无致病性。
4 讨论
综合临床诊断和实验室诊断结果表明,该猪群暴发的哺乳仔猪腹泻主要是由PEDV、PRV和PCV-2三种病毒混合感染所致。新生仔猪腹泻目前已成为阻碍养猪业健康发展的主要因素之一,其病因复杂多样导致临床上防控该病异常困难。近几年PEDV引起的新生仔猪腹泻7日龄之内死亡率较高,本次哺乳仔猪暴发腹泻与以往不同之处表现为各个日龄段均有腹泻,而且各个阶段死亡率均较高,同时新生仔猪伴发神经症状,这与PEDV混合感染PRV和PCV-2有直接关系。一般情况下,在新生仔猪腹泻方面进行病原学诊断时优先检测PEDV、TGEV、RV以及大肠杆菌,而本次病例警示我们,在哺乳仔猪腹泻诊断时不要忽视PRV和PCV-2。通过最近报道来看,PEDV、PRV和PCV-2混合感染可能有增加的趋势,这为目前的仔猪腹泻防控提出了新的挑战[4-5]。因此,PRV和PCV-2的有效防控对于降低新生仔猪腹泻的发病率和死亡率具有重要意义。
冠状病病毒ORF5基因编码的M蛋白是膜糖蛋白,在病毒粒子的组装和出芽过程中具有重要的作用,同时也是病毒刺激机体产生免疫保护重要的结构蛋白。对于不同的冠状病病毒来说,M基因的同源性是很低的,但是对于同种冠状病病毒来说M基因确是高度保守的。而ORF3对于PEDV来说,被认为是一个重要的毒力基因[6-8]。ORF3基因在野生型和减毒型之间的差异可以作为分子标记,并作为研究分子流行病学的潜在工具[7]。因此,M和ORF3基因常用于分析PEDV的分子流行病学。通过对本次腹泻仔猪体内的PEDV M和ORF3基因序列分析结果表明,本次检测的3份样本的PEDV M和ORF3基因同源性99.3% ~99.4%和99.7% ~99.9%,说明本场流行的PEDV毒株为不同的毒株。该3株毒株与国内外的毒株都存在着差异。目前没有特效药物用于治疗PEDV,其防控主要依靠疫苗,而不同地域的PEDV毒株差异较大,可能是本猪场免疫了PEDV、TGEV和RV三联弱毒疫苗还依然暴发仔猪腹泻的原因,可见研制适合本地区或者猪场的特色疫苗对于防控PEDV具有重要意义。
[1] 张坤,何启盖.猪流行性腹泻病毒、猪传染性胃肠炎病毒和猪A群轮状病毒多重RT-PCR检测方法的建立及临床应用[J].畜牧兽医学报,2010,41(8):1 001-1 005.
[2] 刘建柱.猪瘟病毒猪细小病毒猪伪狂犬病病毒PCR检测方法的建立[J].中国兽医杂志,2005,41(10):17.
[3] Xia Yang,Jin-yao Huo,Feng-mei Zheng,etal.Genetic variation analysis of reemerging porcine epidemic diarrhea virus prevailing in central China from 2010 to 2011[J].Virus Genes,2013,46:337-344.
[4] 才让卓玛,宋秀红.PRV、PCV-2、PRRSV与HPs混合感染的核酸检测[J].家畜生态学报,2013,34(10):69-72.
[5] 陶长城,朱保权,李波.PEDV、PRV和PCV-2混合感染引起新生仔猪腹泻的诊治与分析[J].湖北畜牧兽医,2015,36(5):15-16.
[6] 陈如敬.猪流行性腹泻病毒FJ-11 A株的分离与ORF3基因序列分析[J].福建农业学报,2011,26(6):947-951.
[7] Xia Yang,Jin-yao Huo,Feng-mei Zheng,etal.Genetic variation analysis of reemerging porcine epidemic diarrhea virus prevailing in central China from 2010 to 2011[J].Virus Genes,2013,46:337-344.
[8] Chen J F,Sun D B,Wang C B,et al.Molecular characterization and phylogenetic analysis ofmembrane protein genes ofporcine epidemic diarrhea virus isolates in China[J].Virus Genes,2008,36:355-364.
2016-11-17
高国强(1991-),男,硕士,主要从事兽医传染病学的研究,E-mail:2426456777qq.com
周玉龙,E-mail:zhouyulong1980@163.com进行,DNA制备按照碧云天DNA提取试剂盒说明书操作。

