鲜茧生丝多酚微量组分提取方法
王聪磊, 马明波, 潘璐璐, 董锁拽, 唐志荣, 周文龙
(1.浙江理工大学 材料与纺织学院,杭州 310018;2.浙江出入境检验检疫局 丝类检测中心,杭州 310012)
研究与技术
鲜茧生丝多酚微量组分提取方法
王聪磊1, 马明波1, 潘璐璐2, 董锁拽2, 唐志荣1, 周文龙1
(1.浙江理工大学 材料与纺织学院,杭州 310018;2.浙江出入境检验检疫局 丝类检测中心,杭州 310012)
为对鲜茧生丝微量组分的提取方法进行探究,文章通过高效液相色谱(HPLC)研究了不同质量分数乙醇/水溶液的提取溶剂和提取条件(温度、时间和浴比)对鲜茧生丝多酚微量组分提取效率的影响,并采用正交试验优选出较佳提取条件。结果表明,不同溶剂鲜茧生丝提取物的HPLC图有明显差异,表现为乙醇质量分数越高,色谱峰强度越低,组分含量越低。不同提取条件对保留时间为10~16 min组分含量均有影响,其中以温度的影响最为显著。同时研究表明,纯水是鲜茧生丝多酚微量组分最佳提取溶剂,以纯水为提取溶剂的较佳提取条件为:温度40 ℃,时间90 min,浴比1︰25。
生丝;鲜茧;多酚;提取;高效液相色谱
由于鲜茧缫丝法工序少,能够节省能耗,缫丝成本低,且蚕蛹更可有效利用,故鲜茧生丝的综合效益比缫制干茧生丝好,越来越多的缫丝企业开始生产鲜茧生丝。但是,据丝绸企业反映,鲜茧生丝的织造性能不如干茧生丝,绸面易出现质量问题[1]。目前市场上并没有对鲜茧生丝进行标注,很重要的原因是还没有一种有效的方法可鉴别鲜茧生丝和干茧生丝。虽然国内已报道了多个可鉴别鲜茧生丝和干茧生丝的方法,其依据均是基于生丝白度、含胶率、单丝强度等物理性能的差异[2-4]。这些方法有一定的科学性,但不同产地缫制的生丝质量差异较大,因此并不具有普遍性。Gulrajani等[5]认为茧丝中除丝胶、丝素外,还有少量的蜡质、色素、多酚类小分子和无机物等物质。Chikara Hirayama等[6]从桑蚕茧丝中发现了槲皮素、山柰酚等多种黄酮类化合物。这些多酚类小分子物质附着在丝胶上,热稳定性差,在干茧缫丝的烘茧、煮茧工序中,受到高温很容易变性或发生降解,导致这些小分子在茧丝中的含量减少。有研究表明,利用高效液相色谱对鲜茧生丝和干茧生丝中多酚微量组分进行分析,对两者进行鉴别是可行的[7]。为了进一步优化该方法,需要对样品中多酚微量组分的提取方法进行详细研究。
茧丝微量组分存在于茧丝内部[8],提取这些组分需先将茧丝剪碎。常规的提取方法如普通浸提和回流提取均存在效率低、耗时长等缺点[9-10],为提高提取效率、缩短提取周期,采用超声波辅助提取技术对鲜茧生丝进行提取[11]。为探索鲜茧生丝多酚微量组分的最佳提取方法并提取到稳定的组分,本研究采用正交试验法对超声波辅助提取条件进行探索。通过改变提取溶剂和超声波辅助提取条件(温度、时间和浴比),对提取物的HPLC图进行分析,比较各种提取条件对微量组分的提取效率的影响,并通过UV光谱法对提取物结构进行了初步分析。为鲜茧生丝和干茧生丝的商业鉴别、性能分析、产品开发提供借鉴。
1 试 验
1.1 材料与仪器
材料:桑蚕鲜茧生丝(浙江出入境检验检疫局),去离子水、超纯水、乙醇为分析纯(杭州高晶精细化工有限公司),甲醇为色谱纯(杭州高晶精细化工有限公司)。
仪器:R201D型旋转蒸发仪(上海亚荣仪器有限公司),JP-100S型超声清洗机(深圳洁盟超声清洗机有限公司),DHG-9146A型电热恒温鼓风干燥箱(上海浦东荣丰科学仪器有限公司),OHRUS电子分析天平(AR124CN,奥豪斯仪器上海有限公司),TU-1950双光束紫外可见分光光度计(北京普析通用仪器有限公司),Waters-E2695高效液相色谱仪(美国沃特斯科技有限公司)。
1.2 方 法
1.2.1 乙醇/水溶剂体系对鲜茧生丝组分的提取
将鲜茧生丝剪碎或粉碎,精确称量鲜茧生丝粉末5.0 g置于250 mL烧杯中,按浴比1︰25(g/mL)分别加入一定比例的乙醇/水溶液,并在40 ℃超声波清洗机中,300 W超声波辅助提取90 min,抽滤。将滤液置于旋转蒸发仪上50 ℃旋转蒸发浓缩至干,加入1 mL一定比例的乙醇/水溶液置于超声波清洗机中超声1~2 min加速溶解提取物,将提取液经0.45 μm的过滤膜过滤后,转移至样品瓶中备用。
1.2.2 超声条件对鲜茧生丝组分提取的影响
称取鲜茧生丝粉末5.0 g,采用单因素试验分别在不同温度、时间和浴比条件下进行超声波辅助提取,抽滤,按照1.2.1方法浓缩制样,备用。
1.2.3 正交试验
经1.2.2单因素试验确定每个影响因素的三个水平,以保留时间为10~16 min组分的提取效率为考察目标,用L9(34)正交表设计试验[12]。
1.2.4 紫外-可见分光光度计检测
采用紫外-可见分光光度计对1.2.1所得滤液进行检测,空白样为去离子水,检测波长为200~800 nm。
1.2.5 HPLC测试
采用Waters-E2695高效液相色谱仪对样品进行检测。HPLC检测条件:色谱柱Spursil C18(250×4.6 mm,3.5 μm),柱温30 ℃,进样量20 μL,流速1 mL/min,检测波长280 nm。流动相为甲醇(A相)、水(B相),梯度洗脱,流动相配比:0 min(15%A,85%B);17 min(100%A,0%B);20 min(100%A,0%B);30 min(15%A,85%B)。
2 结果与分析
2.1 乙醇/水溶剂体系对鲜茧生丝组分的提取
2.1.1 鲜茧生丝提取物的UV光谱分析
茧丝中含有微量的来源于桑叶的天然多酚类化合物,多酚类化合物极性较大,易溶于水、甲醇、乙醇等极性溶剂,考虑到安全性,选择乙醇/水溶剂体系作为鲜茧生丝组分的提取溶剂。图1为鲜茧生丝不同质量分数乙醇/水溶液提取液,各提取液均浓缩至一定体积。从图1可以看出,纯水和30%乙醇/水溶液提取出的物质颜色为淡黄色,50%和70%乙醇/水溶液提取出的物质颜色很浅,当乙醇质量分数提高到90%和100%时,提取物几乎呈无色透明状。说明在本研究选用的溶剂体系下溶剂极性越大,越有利于鲜茧生丝中色素类物质的提取。总体来说,乙醇/水溶剂体系中乙醇质量分数的提高,不利于多酚类物质的提取。

图1 不同质量分数乙醇/水溶液鲜茧生丝提取物Fig.1 Extracts from fresh raw silk with ethanol/water solution of different mass fractions
图2为不同质量分数乙醇/水溶液的鲜茧生丝提取液的紫外-可见吸收光谱图。从图2可以看出,各提取物在220、280 nm左右处含有芳香族化合物所具有的E带及B带紫外特征吸收,符合多酚类化合物的紫外吸收特征,说明这些成分很可能是多酚类化合物[13]。不同质量分数乙醇/水溶液提取物的紫外-可见吸收光谱比较相似,均在220 nm和280 nm左右处有最大吸收。但由于提取物在220 nm处有很强的检测信号,液相色谱检测时,以220 nm为检测波长时,各提取物的HPLC图差异并不显著,而以280 nm作为检测波长时,HPLC图中的组分信息最显著,因此选择280 nm作为HPLC的检测波长。纯水、30%乙醇、50%乙醇和70%乙醇溶液提取物在323 nm处有一较明显的肩峰出现,乙醇质量分数越高,肩峰越不明显。当用100%乙醇提取鲜茧生丝时,其提取物只在220 nm和280 nm处有最大吸收。即使是90%和100%乙醇溶液提取得到的无色提取物,其类别也和图1中纯水提取到的有色物质相似。

图2 不同质量分数乙醇/水溶液的鲜茧生丝 提取物的UV光谱图Fig.2 UV spectrograms of extracts from fresh raw silk with ethanol/water solution of different mass fractions
2.1.2 鲜茧生丝提取物的高效液相色谱分析
不同质量分数乙醇/水溶液鲜茧生丝提取物的HPLC分离效果如图3所示(检测波长280 nm)。从图3可以看出,在保证进样质量分数相同时,不同质量分数乙醇/水溶液提取物有很大差异,表现为乙醇质量分数越高,色谱峰强度越低,表明提取物含量越少。纯水和30%乙醇/水溶液提取物在保留时间为2.37 min处均有很强的检测信号,在保留时间为10~16 min内有一系列的峰,且主要在保留时间为10.13、13.25 min和15.23 min处有中等强度的色谱峰,在保留时间为7.07 min和18.34 min处的检测信号很弱。随着乙醇质量分数的提高,这些色谱峰的强度均有不同程度的衰减。90%和100%乙醇/水溶液提取物仅在保留时间为2.37 min和10.13 min处有非常弱的色谱峰出现。分析认为是因为附着在丝胶上的多酚类物质极性较大,乙醇质量分数越高,越不利于这些物质的提取。文献[7]表明,鲜茧生丝和干茧生丝提取物的HPLC图主要区别就在于是否含有保留时间为10~16 min组分色谱峰。为了更有效地鉴别鲜茧生丝和干茧生丝,必须保证保留时间为10~16 min组分的提取效率,因此选取纯水作为提取溶剂。
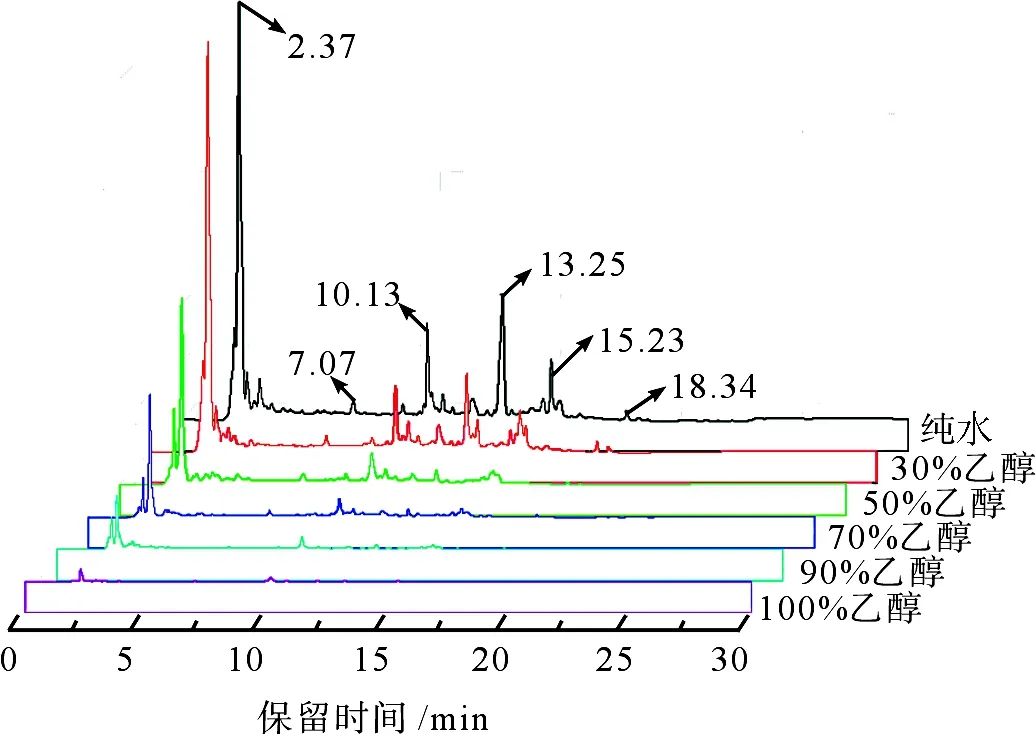
图3 不同质量分数乙醇/水溶液鲜茧生丝提取物的HPLC图Fig.3 HPLC chromatograms of extracts from fresh raw silk with ethanol/water solution of different mass fractions
2.2 超声提取条件对鲜茧生丝多酚微量组分提取效果的影响
2.2.1 提取温度对鲜茧生丝多酚微量组分提取效果的影响
普通浸提和回流提取法耗时长,提取效率低,这对于生丝大批次鉴别是不合适的。超声辅助提取能够提高效率,缩短提取周期,因此,对鲜茧生丝组分的超声波提取条件进行了研究。不同温度下鲜茧生丝提取物色谱图(检测波长280 nm)和提取温度对保留时间为10~16 min组分提取效率的影响,分别如图4和图5所示。从图5可以看出,随着提取温度的升高,保留时间为10~16 min组分的检测信号逐渐增强,其峰面积占比也越来越大,说明提取温度对鲜茧生丝多酚微量组分的提取效率具有积极影响。但由于丝胶本身具有亲水性,较高的温度会促进丝胶溶解,导致提取液中的丝胶含量增多。在HPLC检测过程中,样品液中的丝胶遇到高质量分数甲醇会发生变性而沉淀下来,最终导致色谱柱堵塞。因此在茧丝提取过程中,一般不宜选择较高温度。在保证具有较高提取效率的前提下,选择30、40、50 ℃作为正交试验的三个水平。

图4 不同温度下鲜茧生丝提取物的HPLC图Fig.4 HPLC chromatograms of extracts from fresh raw silk at different temperatures

图5 提取温度对鲜茧生丝多酚微量组分提取效率的影响Fig.5 Effect of extraction temperature on extraction efficiency of polyphenols trace components in fresh raw silk
2.2.2 提取时间对鲜茧生丝多酚微量组分提取效率的影响
图6为不同提取时间鲜茧生丝提取物的HPLC图(检测波长280 nm),图7为提取时间与微量组分相对含量的关系。从图7可以看出,随着提取时间的增加,前5 min组分色谱峰基本不变,10~16 min组分的色谱峰强度逐渐升高,说明提取时间越长,提取物中多酚微量组分含量越多。在开始提取的前90 min,微量组分相对含量提高较快,在90 min后,随着提取时间的延长,多酚微量组分得率增加缓慢。考虑到生丝检测的效率,将提取时间为60、90、120 min作为正交试验的三个水平。
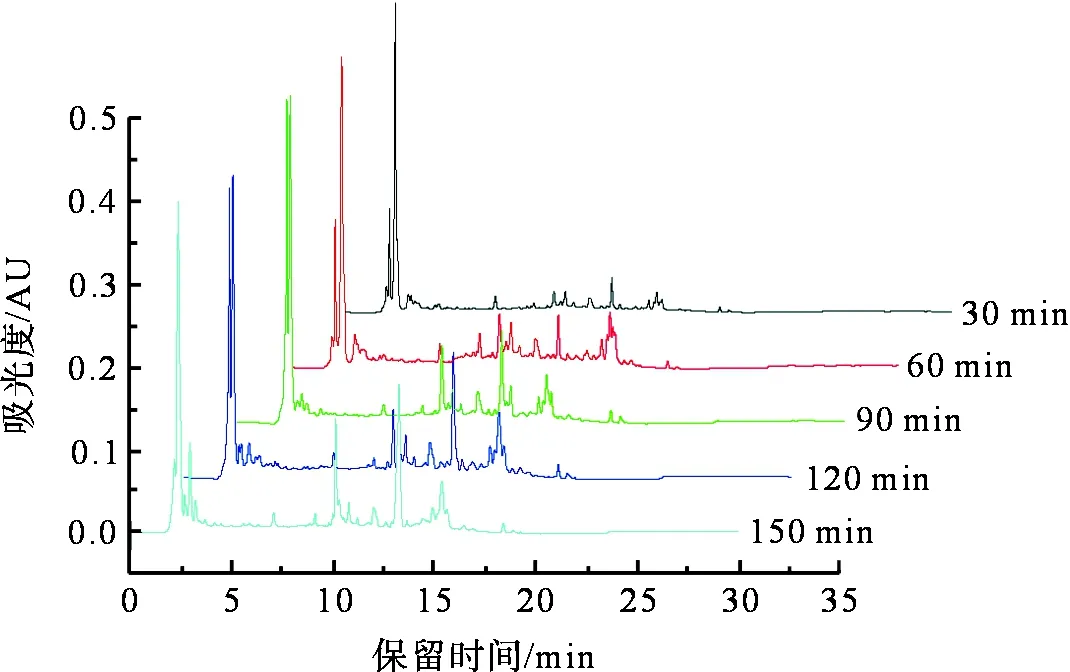
图6 不同时间鲜茧生丝提取物的HPLC图Fig.6 HPLC chromatograms of extracts from fresh raw silk of different durations

图7 提取时间对鲜茧生丝多酚微量组分提取效率的影响Fig.7 HPLC chromatograms of extracts from fresh raw silk of different durations
2.2.3 浴比对鲜茧生丝微量组分提取效率的影响
图8和图9分别为不同浴比鲜茧生丝提取物的HPLC图(检测波长280 nm)及浴比对多酚微量组分提取效率的影响。从图8可以看出,浴比为1︰10和1︰20时,保留时间为10~16 min组分色谱峰强度较低,而浴比为1︰25及以上时,保留时间为10~16 min组分色谱峰的峰形明显,说明溶剂用量越多,提取到的多酚微量组分就越多。图9反应出微量组分提取效率随着浴比的增加而升高,但是考虑到后续蒸发浓缩的耗时及检测的效率,选定浴比1︰20、1︰25和1︰30作为正交试验的三个水平。

图8 不同浴比鲜茧生丝提取物的HPLC图Fig.8 HPLC chromatograms of extracts from fresh raw silk with different liquor ratios

图9 浴比对鲜茧生丝多酚微量组分提取效率的影响Fig.9 Effect of liquor ratio on extraction efficiency of polyphenols trace components in fresh raw silk
2.3 正交试验
根据单因素试验的结果,选取每个影响因素的三个水平做正交试验,并对结果进行分析,确定较佳的提取条件。采用L9(34)正交表,以温度(A)、时间(B)和浴比(C)作为3个考察因素,选择3个水平进行试验(表1)。试验设计及结果见表2,方差分析见表3。

表1 正交试验因素水平Tab.1 Factor level of orthogonal test
由表2中的极差R值可知,以保留时间为10~16 min组分的提取效率为指标,各因素的影响大小依次为A>B>C,即温度>时间>浴比。通过表3方差分析可知,三个因素中,A具有显著影响,其他因素影响较小。通过正交试验优选出的提取方法为A3B3C3,即提取温度50 ℃,时间120 min,浴比1︰30。由于提取时间和浴比不同水平之间的影响差异并不大,因此从提高生丝检测效率和减少浓缩耗时角度考虑,选择提取条件为:时间90 min、浴比1︰25。另外,较高的温度会促进丝胶溶解,在HPLC检测时样品液中的丝胶遇到高质量分数甲醇会因变性而沉淀,导致色谱柱堵塞,故选择40 ℃作为提取温度。综上,确定较佳提取条件为:温度40 ℃,时间90 min,浴比1︰25。
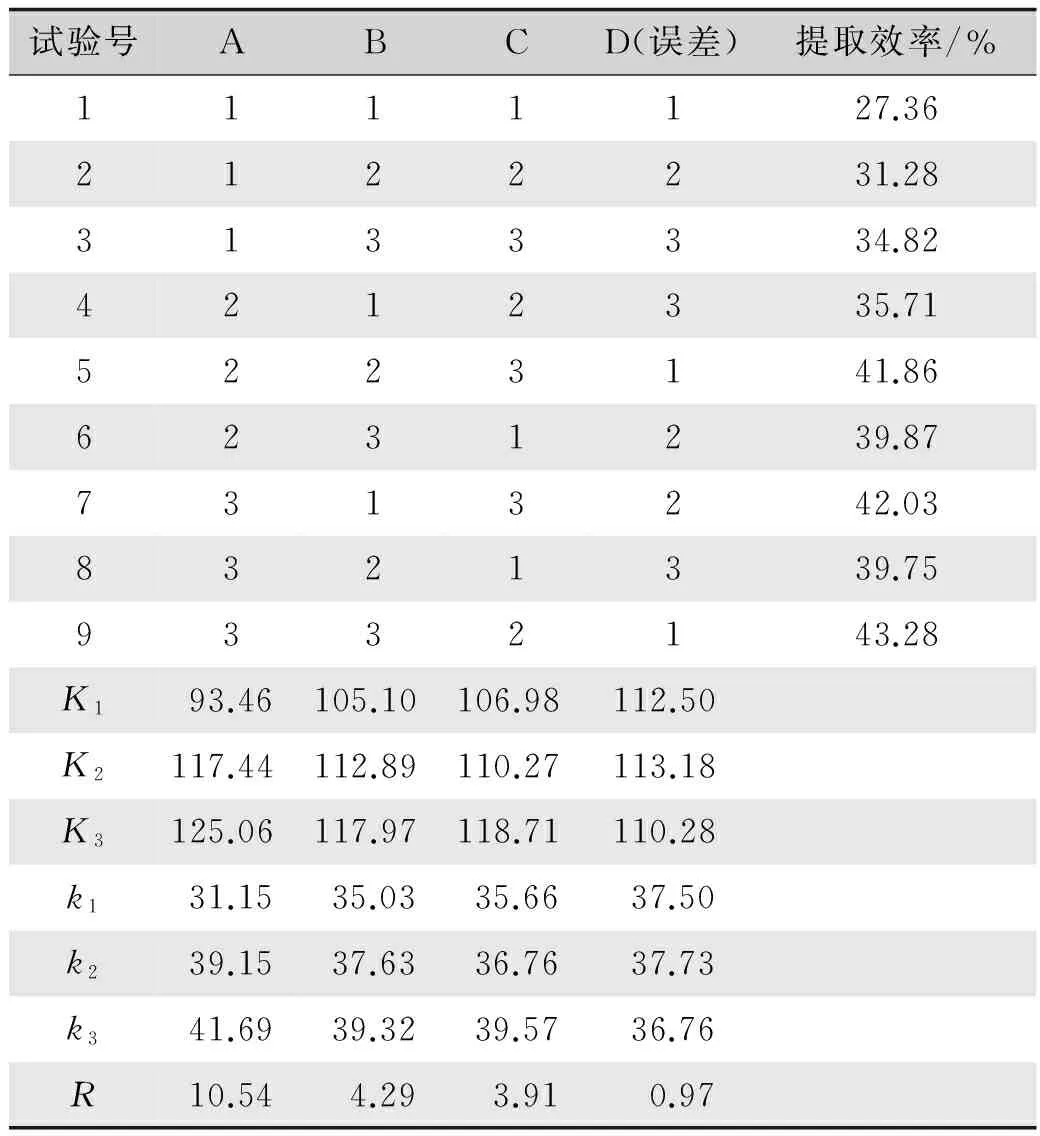
表2 正交试验设计及结果Tab.2 Design and result of orthogonal test
注:K1、K2、K3是三个因素同一水平的提取效率之和;k1、k2、k3是三个因素同一水平的平均提取效率。
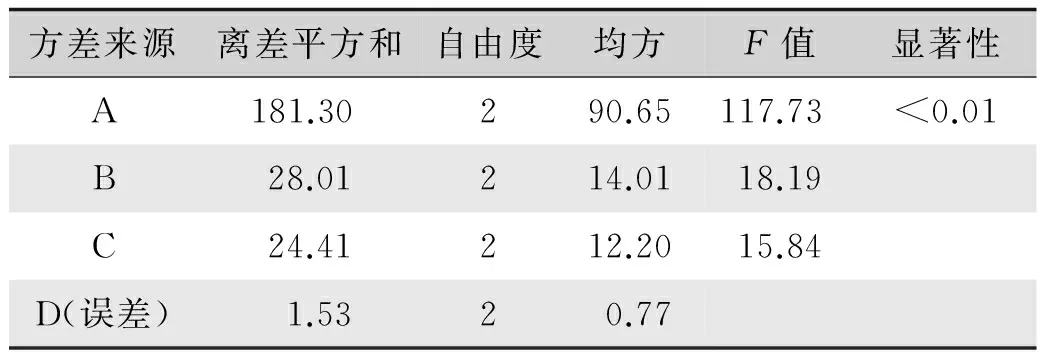
表3 方差分析结果Tab.3 Result of variance analysis
注:F0.05(2,2)=19.00,F0.01(2,2)=99.00。
2.4 验证试验
称取一定量的鲜、干茧生丝粉末,分别在原方法[7]和上述条件下进行提取,浓缩制样过程同1.2.1,在保证进样质量分数相同时经HPLC检测得到的色谱图如图10所示。从图10可以看出,干茧生丝和鲜茧生丝的HPLC图主要区别就在于是否含有保留时间为10~16 min组分色谱峰[7]。对比不同提取方法鲜茧生丝提取物HPLC图可以发现,在经正交试验优选后的条件下进行提取,鲜茧生丝提取物HPLC图具有更显著的特征,即在保留时间为10~16 min组分的相对含量较高,这说明本研究所确定的提取方法合理。
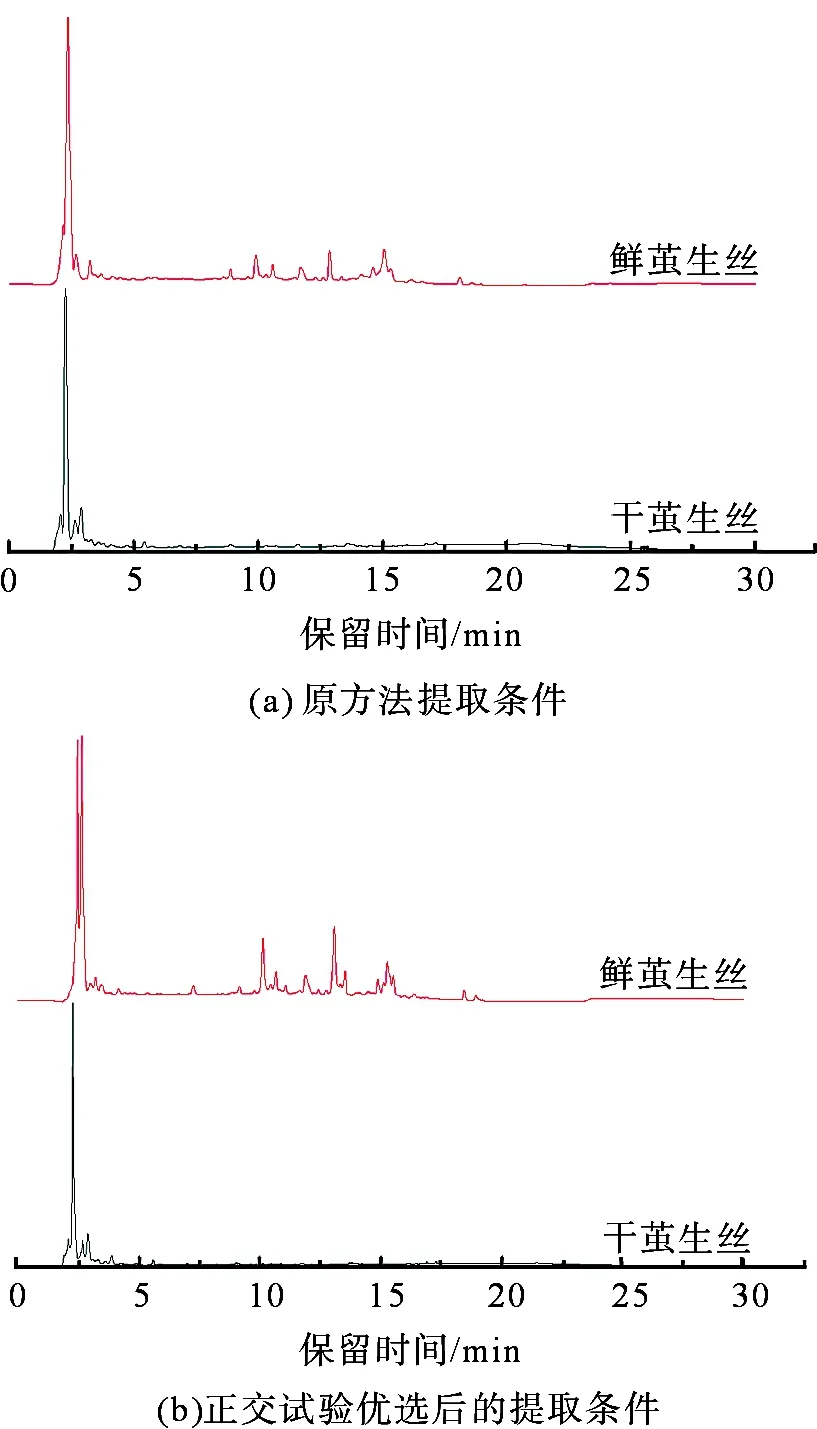
图10 鲜茧生丝和干茧生丝提取物HPLC图Fig.10 HPLC chromatograms of extracts from fresh raw silk and from dry raw silk
3 结 论
1)以不同质量分数乙醇/水溶液作溶剂时,鲜茧生丝多酚提取物组分有明显的差异,表现为乙醇质量分数越低,色谱峰强度越高,组分含量越高,因此鲜茧生丝组分的最佳提取溶剂是纯水。
2)超声提取温度、时间和浴比对鲜茧生丝多酚微量组分的提取均有一定的影响,其中温度对多酚得率影响最大。综合各因素,确定较佳的提取条件为:温度40 ℃,时间90 min,浴比1︰25。
[1]乔铁军,王仑,张秀琍,等.干茧丝与鲜茧丝抱合指标的差异性实验与分析[J].丝绸,2009(10):32-33. QIAO Tiejun, WANG Lun, ZHANG Xiuli, et al. The cohesive force difference experiment and analysis between drying-cocoon silk and fresh-cocoon silk[J]. Journal of Silk,2009(10):32-33.
[2]朱良均.测色仪检验鲜茧生丝的方法:103115873 A[P].2015-05-22. ZHU Liangjun. Method of testing fresh cocoon raw silk by color measuring instrument: 10115873 A [P].2015-05-22.
[3]朱良均.一种通过丝胶溶解性鉴别鲜茧生丝与干茧生丝的方法:104614277 A[P].2015-05-13. ZHU Liangjun. A method for distinguishing fresh cocoon raw silk and dry cocoon raw silk by solubility of sericin: 104614277 A [P].2015-05-13.
[4]朱良均.单丝拉伸检验鲜茧生丝方法:103091165 A[P].2015-05-08. ZHU Liangjun. Test method of fresh cocoon raw silk by monofilament tensile test: 103091165 A[P].2015-05-08.
[5]GULRAJANI M L. Degumming of silk [J]. Review of Progress in Coloration and Related Topics,1992,22(1):79-89.
[6]HIRAYAMA C, ONO H, TAMURA Y, et al. Regioselective formation of quercetin 5-O-glucoside from orally administered quercetin in the silkworm, Bombyx mori[J]. Phytochemistry,2008,69(5):1141-1149.
[7]周文龙,马明波.快速鉴别鲜茧缫生丝和干茧缫生丝的方法:105116065 A[P].2015-12-02. ZHOU Wenlong, MA Mingbo. Rapid identification of fresh cocoon raw silk and dry cocoon raw silk: 105116065 A[P].2015-12-02.
[8]VOEGELI R, MEIER J, BLUST, R. Sericin silk protein: unique structure and properties[J]. Cosmetics Toiletries,1993,108:101-108.
[9]杨昱,白靖文,俞志刚.超声辅助提取技术在天然产物提取中的应用[J].食品与机械,2011,27(1):170-174. YANG Yu, BAI Jingwen, YU Zhigang. Progress in ultrasound-assisted extraction in natural product[J]. Food & Machinery,2011,27(1):170-174.
[10]LIU W, WANG X. Extraction of flavones analogues from propolis with ultrasound[J]. Food Science,2004,25(6):35-39.
[11]李海祥,唐志荣,毛文涛,等.超声波辅助萃取天然绿色棉色素[J].纺织学报,2011,32(10):16-20. LI Haixiang, TANG Zhirong, MAO Wentao, et al. Ultrasonic-assisted extraction of pigment from natural green cotton [J]. Journal of Textile Research,2011,32(10):16-20.
[12]张吉祥,欧来良.正交试验法优化超声提取枣核总黄酮[J].食品科学,2012,33(4):18-21. ZHANG Jixiang, OU Lailiang. Optimization by orthogonal array design of ultrasonic extraction of total flavonoids from Chinese date seeds [J]. Food Science,2012,33(4):18-21.
[13]宋立江,狄莹,石碧.植物多酚研究与利用的意义及发展趋势[J].化学进展,2000,12(2):161-170. SONG Lijiang, DI Ying, SHI Bi. The significance and development trend in research of plant polyphenols[J]. Progress in Chemistry,2000,12(2):161-170.
Extraction method of polyphenols trace components in fresh raw silk
WANG Conglei1, MA Mingbo1, PAN Lulu2, DONG Suozhuai2, TANG Zhirong1, ZHOU Wenlong1
(1.College of Materials and Textiles, Zhejiang Sci-Tech University, Hangzhou 310018, China; 2.Silk Inspection Center,Zhejiang Entry-Exit Inspection & Quarantine Bureau, Hangzhou 310012, China)
To explore the extraction method of trace components in fresh raw silk, this paper is intended to study the effect of extraction solvents (ethanol/water solution) of different mass fractions and extraction conditions (temperature, time and liquor ratio) on extraction efficiency of polyphenols trace components in fresh raw silk via high performance liquid chromatography (HPLC), figure out the optimum extraction conditions via orthogonal test. The results indicate that the HPLC chromatograms of extracts from fresh raw silk with different solvents significantly differ. Specifically, with the mass fraction of ethanol is in negative correlation with both the intensity of chromatographic peaks and the content of components. All the extraction conditions have impact on the content of components having retained for 10 to 16 min, and the impact of temperature is most significant. Meanwhile, researches show that pure water is the best extraction solvent of polyphenols trace components in fresh raw silk, of which the optimum extraction conditions are: temperature of 40 ℃, duration of 90 min, and liquor ratio of 1︰25 (g/mL).
raw silk; fresh cocoon; polyphenols; extract; HPLC
10.3969/j.issn.1001-7003.2017.07.001
2016-11-08;
2017-05-25
国家质检总局科技项目(2016IK282)
王聪磊(1990-),男,硕士研究生,研究方向为新型纺织材料与绿色纺织品的研究。
周文龙,教授,wzhou@zstu.edu.cn。
TS102.1
A
1001-7003(2017)07-0001-06 引用页码: 071101