参麦注射液对线粒体毒素致豚鼠药物性耳聋模型的影响
王秋荣,朱红玲,陈德森
(1.十堰市太和医院湖北医药学院附属医院耳鼻喉科,湖北十堰442000;2.湖北医药学院基础医学院,湖北十堰442000)
参麦注射液对线粒体毒素致豚鼠药物性耳聋模型的影响
王秋荣1,朱红玲1,陈德森2
(1.十堰市太和医院湖北医药学院附属医院耳鼻喉科,湖北十堰442000;2.湖北医药学院基础医学院,湖北十堰442000)
目的观察参麦注射液对豚鼠药物性耳聋眼肌前庭诱发肌源性电位(oVEMP)和血管内皮生长因子(VEGF)的影响,分析其作用机制。方法将30只健康雄性豚鼠经听泡骨窗向圆窗龛滴入0.5 mol/L的3-硝基丙酸(3-NP)6 μL造成药物性耳聋,将其中24只成模豚鼠采用随机数表法分为模型组和参麦组。另取12只健康雄性豚鼠不做处理作为对照组。参麦组按0.5 m L/kg经尾静脉注射参麦注射液,模型组注射等体积生理盐水,治疗7 d。观察豚鼠前庭功能受损行为学改变,采用气导短纯音诱发豚鼠治疗前后oVEMP、记录其主要参数N1和P1潜伏期、N1和P1振幅、N1-P1波间期并计算oVEMP引出率,记录听性脑干反应(ABR)波Ⅲ反应阈及在80 dB nHL短声刺激时Ⅰ~Ⅵ波潜伏期,监测豚鼠局部脑血流(rCBF),采用反转录一聚合酶链反应(RT-PCR)法检测耳蜗VEGF及VEGF-mRNA表达。结果治疗后,参麦组的N1和P1振幅分别为(10.22±0.74)μV和(11.03±0.82)μV,oVEMP引出率为(92.01± 8.72)%,rCBF为(77.21±8.36)m L/(100 g·m in),比模型组的(7.03±0.52)μV、(8.95±0.54)μV、(43.32±5.77)%、(57.73± 6.21)m L/(100 g·min)明显提高,差异均有统计学意义(P<0.05);N1和P1潜伏期分别为(10.14±1.97)ms和(9.52± 1.04)ms,ABRⅡ波为(1.37±0.19)ms,Ⅲ波潜伏期为(3.01±0.35)ms,Ⅰ~Ⅲ波间期为(2.02±0.24)ms,比模型组的(13.54±2.98)ms、(12.30±1.81)ms、(3.72±0.26)ms、(4.39±0.33)ms、(3.03±0.22)ms明显缩短,差异均有统计学意义(P<0.05)。ABRⅢ波反应阈为(31.47±4.63)dB,比模型组的(50.42±5.41)dB明显降低,差异有统计学意义(P<0.05);VEGF和VEGF-mRNA分别为(18.42±1.34)GAPDH和(39.01±2.05)、比模型组的(10.71±1.23)GAPDH和(28.04±1.96)明显高表达,差异均有统计学意义(P<0.05)。结论参麦注射液可提高耳蜗受损组织血流量,改善受损内耳血管内皮功能,促进耳蜗毛细胞和前庭神经功能的再生和修复,对线粒体毒素诱导药物性耳聋模型豚鼠有一定的治疗作用。
药物性耳聋;参麦注射液;眼肌前庭诱发肌源性电位;血管内皮生长因子;听性脑干反应
药物性耳聋是指使用耳毒性药物所引起的感音神经性聋,滥用耳毒性药物是我国聋儿的主要病因[1]。如氨基糖甙类、非氨基糖甙类抗菌素、水杨酸盐、利尿剂、抗肿瘤药物、中药等均可能导致药物性耳聋[2]。这类药物均有可能造成内耳微循环障碍、内耳毛细胞变性坏死并最终导致高频听力渐向低频扩展的听力损失[3-4]。研究表明,脑干可接受双侧耳蜗传入的语声刺激信息,并对其进行处理整合,故记录听性脑干反应(ABR)可客观地反映刺激声信息的听觉信息[5]。而眼肌前庭诱发肌源性电位(oVEMP)主要评估前庭及椭圆囊上神经功能,可客观地反映患者前庭功能[6]。两者对诊断及评估听力损伤程度具有重要意义[7]。在治疗药物性耳聋时,除及时停用耳毒性药物外,还应及时消除其对内耳微循环的影响,促进听力恢复。中药制剂参麦注射液具有可靠的扩张血管、改善微循环的功能,临床上有报道其具有治疗耳聋的作用[8-9]。由于其对于药物性耳聋的影响及其机制鲜有研究,为研究其是否具有治疗药物性耳聋的作用,本实验建立豚鼠药物性耳聋模型,经尾静脉注射参麦注射液进行治疗,系统观察其对豚鼠药物性耳聋的影响,为其临床治疗此类疾病提供实验及理论依据。
1 材料与方法
1.1 仪器及药品听性脑干反应诱发电位仪(丹麦,MEDSEN-MCU90型);佳能5D MarkⅢ单反相机(日本);3-硝基丙酸(3-NP,南京森贝伽生物科技有限公司);参麦注射液(杭州正大青春宝药业有限公司,批号:010873);血管内皮生长因子(VEGF)及VEGF-mRNA检测试剂盒(南京建成生物工程研究所)。
1.2 动物36只雄性豚鼠,体质量190~210 g,实验动物由十堰市太和医院科研动物房提供[SYXK(鄂) 2011-0031],动物造模和实验观察在标准实验室进行[SCXK(鄂)2011-0008]。
1.3 豚鼠SSNH模型制备及分组随机抓取30只豚鼠,造模前夜禁食不禁水。用2%戊巴比妥钠(120 mg/kg)腹腔注射麻醉,豚鼠麻醉后取卧位用小动物定位仪固定,剃去左耳局部鼠毛、皮肤用碘伏消毒后铺无菌巾,在手术显微镜下切开皮肤,从耳后入路暴露左耳听泡,小心寻找圆窗龛。找到圆窗龛后先滴入6 μL的3-NP,然后在圆窗龛上放入一小块浸泡有饱和3-NP的明胶海绵,贴敷30 m in后取出,将术中翻转的豚鼠肌肉组织覆盖于听泡骨窗,然后缝合切口,再次碘伏消毒。本手术为无菌手术,不需要注射抗生素[10]。以术后24 h有中、重度听力减退,听力阈值提高达50%以上,动物出现自发性眼震和严重步态障碍(转圈行为、头部倾斜和桶状翻滚)等前庭功能受损改变者为造模成功[11]。本实验豚鼠全部存活,其中有27只出现典型眩晕等前庭功能受损症状,造模成功率为90%,挑选其中24只,按随机原则均分为模型组和参麦组,每组12只。
1.4 治疗方法参麦组豚鼠按2 m L/(kg·d)的剂量从尾静脉注射参麦注射液,用药剂量是按成人体表面积换算而来。模型组术后按2 m L/(kg·d)的剂量从尾静脉注射0.9%氯化钠注射液作为对照,两组均连续给药治疗7 d。
1.5 检测指标和方法
1.5.1 ABR、oVEMP和局部脑血流(rCBF)测试方法术前、术后1 d和治疗7 d后分别进行ABR测试参照文献[12]:用80 dB nHL短声刺激,记录豚鼠Ⅰ~Ⅳ波潜伏期,记录Ⅲ波反应阈。记录电极置于头顶皮肤,参考电极置于耳廓,接地电极均置于鼻尖,极间电阻和电阻均≤5 kQ,记录ABR各波潜伏期及波间期。前庭功能受损行为学观察:用佳能5D MarkⅢ单反相机记录豚鼠眼震现象及行为学反应:严重步态障碍(转圈行为、头部倾斜和桶状翻滚),表明单侧前庭功能受损,动物出现眩晕症状;轻度步态障碍(仅有头部倾斜),动物出现轻度眩晕症状。采用气导短纯音诱发豚鼠治疗前后oVEMP、记录其主要参数N1和Pl潜伏期、N1和Pl振幅、N1-Pl波间期并计算oVEMP引出率,同时监测豚鼠rCBF[13]。
1.5.2 RT-PCR两组豚鼠在给药前及给药后7 d各取6只,在ABR、oVEMP和rCBF测试完后断头处死,取豚鼠耳蜗放入预冷匀浆液中,研磨后5 000 r/m in低温离心20 m in,提取上清液总RNA,逆转录为cDNA,以其为模板加入引物进行PCR扩增。引物序列见表1。反应条件:95℃预变性5 m in后,按95℃30 s、58℃30 s、72℃30 s扩增40个循环,最后72℃延伸10 m in、50℃2 m in。PCR产物经1.5%琼脂糖凝胶电泳,拍照后采用美国Bio-Rad蛋白凝胶分析软件Quantity One对电泳条带进行吸光度扫描分析,以内参β-actin吸光度值进行校正,计算VEGF及VEGF-mRNA表达。
1.6 统计学方法采用SPSS17.0统计软件进行数据处理,实验数据以均数±标准差()表示,组间比较采用Dunnet t检验,以P<0.05为差异有统计学意义。

表1 引物序列表
2 结果
2.1 两组动物前庭功能受损行为学比较模型组和参麦组动物造模后1 d均记录到豚鼠有眼震现象,并出现严重步态障碍(转圈行为、头部倾斜和桶状翻滚)等前庭功能受损行为学改变,表明两组均有单侧前庭功能受损,动物出现眩晕症状,说明用3-NP造模成功可靠。治疗后,模型组眼震现象及前庭功能受损无明显改善,参麦组自发性眼震现象全部消失,步态基本恢复正常,前庭功能受损明显改善,仅有3只有轻度眩晕症状(头部倾斜)。
2.2 参麦注射液对豚鼠oVEMP引出率及相关参数的影响模型组豚鼠N1和Pl振幅、oVEMP引出率明显降低,N1和Pl潜伏期延长,与对照组比较差异有统计学意义(P<0.05)。参麦组N1和Pl振幅及oVEMP引出率均明显提高,N1和Pl潜伏期缩短,与同组治疗前和模型组比较差异有统计学意义(P<0.05),见表2。
2.3 参麦注射液对豚鼠Ⅰ~Ⅵ波潜伏期及Ⅲ波间期的影响对照组豚鼠Ⅱ、Ⅲ波潜伏期和Ⅰ~Ⅲ波间期治疗前后无明显改变。模型组豚鼠Ⅱ、Ⅲ波潜伏期和Ⅰ~Ⅲ波间期均延长,与对照组比较差异有统计学意义(P<0.05)。参麦组Ⅱ、Ⅲ波潜伏期和Ⅰ~Ⅲ波间期均明显缩短,与同组治疗前和模型组比较差异有统计学意义(P<0.05),见表3。
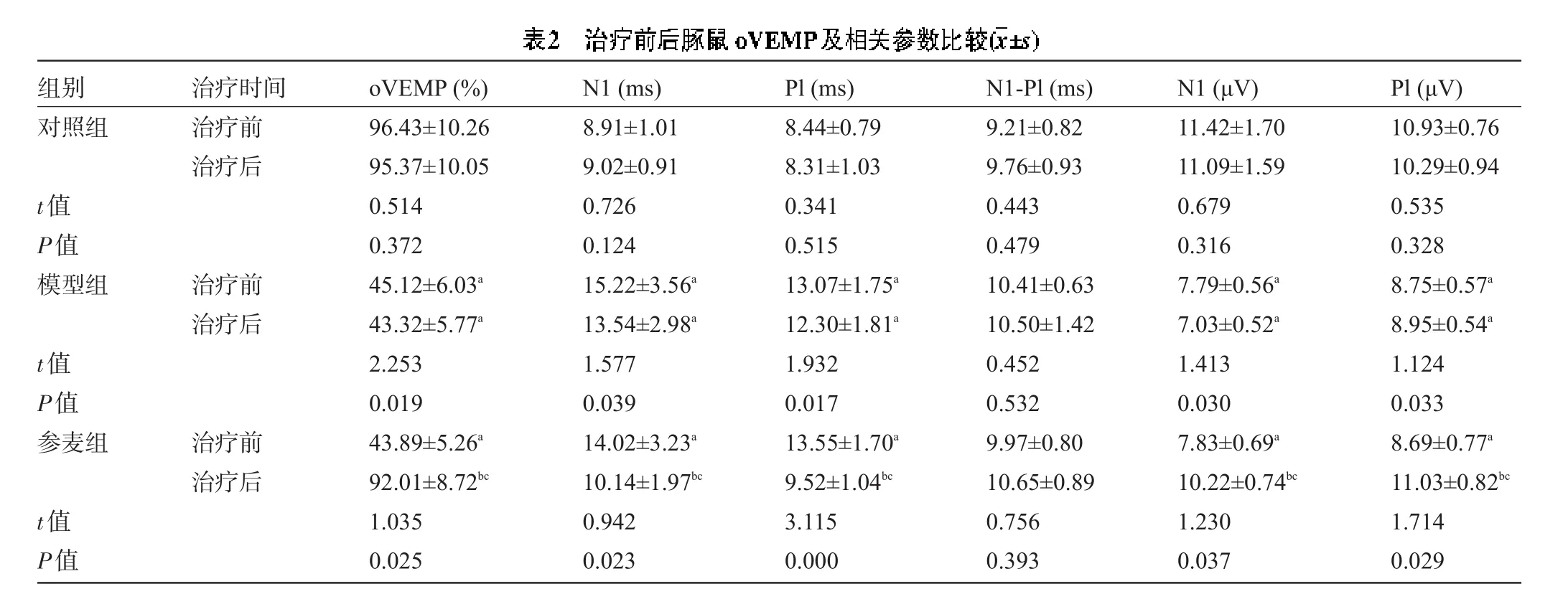
注:与对照组比较,aP<0.05;与同组治疗前比较,bP<0.05;与模型组比较,cP<0.05。
2.4参麦注射液对豚鼠rCBF和ABR波Ⅲ反应阈的影响对照组豚鼠rCBF和ABR治疗前后无明显改变。模型组rCBF降低、ABRⅢ波反应阈显著增高,与对照组比较,差异有统计学意义(P<0.05)。参麦组治疗后rCBF明显提高,ABRⅢ波反应阈降低,与同组治疗前和模型组比较,差异有统计学意义(P<0.05),但ABRⅢ波反应阈未降到正常值,与对照组比较,差异有统计学意义(P<0.05),见表4。
2.5 参麦注射液对豚鼠VEGF及VEGF-mRNA表达的影响模型组豚鼠VEGF及VEGF-mRNA治疗后低表达,与同组治疗前比较,差异有统计学意义(P<0.05)。参麦组治疗后VEGF及VEGF-mRNA高表达,与同组治疗前和模型组比较,差异均有统计学意义(P<0.05),见表5。
表3 治疗前后豚鼠80 dB nHL短声刺激时Ⅰ~Ⅵ波潜伏期及Ⅰ~Ⅲ波间期比较(ms,n=6)
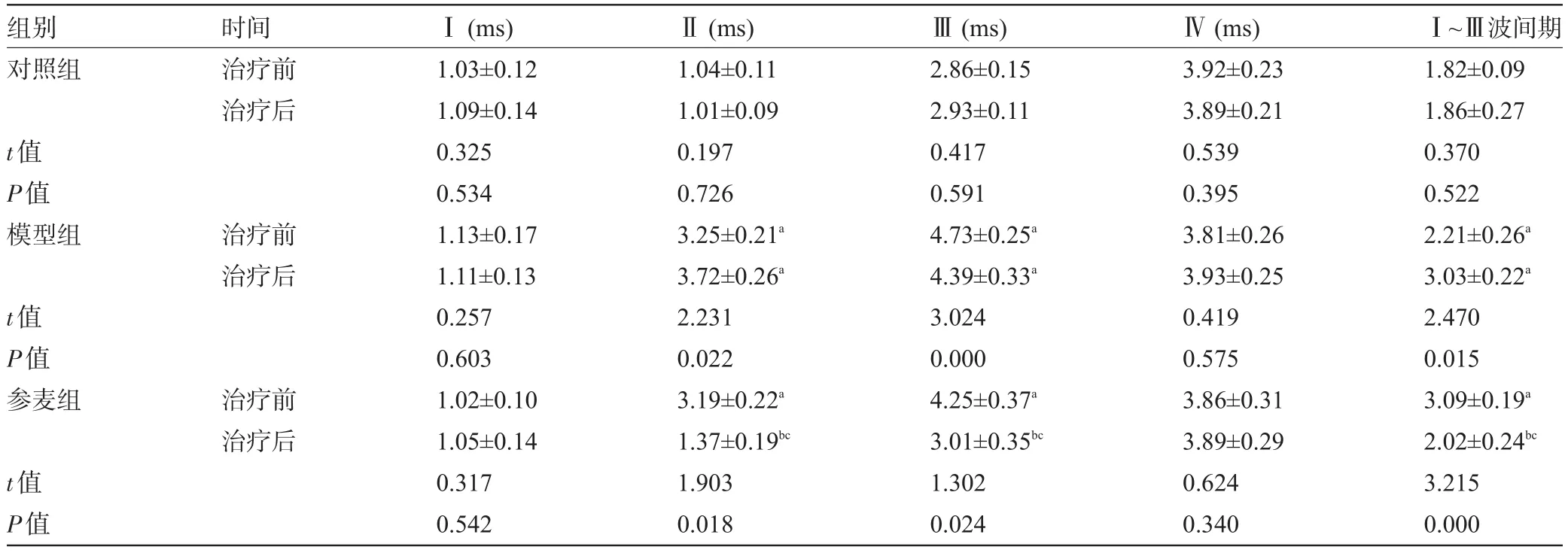
表3 治疗前后豚鼠80 dB nHL短声刺激时Ⅰ~Ⅵ波潜伏期及Ⅰ~Ⅲ波间期比较(ms,n=6)
注:与对照组比较,aP<0.05;与同组治疗前比较,bP<0.05;与模型组比较,cP<0.05。
组别对照组时间治疗前治疗后t值P值模型组治疗前治疗后t值P值参麦组治疗前治疗后t值P值Ⅰ(ms) 1.03±0.12 1.09±0.14 0.325 0.534 1.13±0.17 1.11±0.13 0.257 0.603 1.02±0.10 1.05±0.14 0.317 0.542Ⅱ(ms) 1.04±0.11 1.01±0.09 0.197 0.726 3.25±0.21a3.72±0.26a2.231 0.022 3.19±0.22a1.37±0.19bc1.903 0.018Ⅲ(ms) 2.86±0.15 2.93±0.11 0.417 0.591 4.73±0.25a4.39±0.33a3.024 0.000 4.25±0.37a3.01±0.35bc1.302 0.024Ⅳ(ms) 3.92±0.23 3.89±0.21 0.539 0.395 3.81±0.26 3.93±0.25 0.419 0.575 3.86±0.31 3.89±0.29 0.624 0.340Ⅰ~Ⅲ波间期1.82±0.09 1.86±0.27 0.370 0.522 2.21±0.26a3.03±0.22a2.470 0.015 3.09±0.19a2.02±0.24bc3.215 0.000
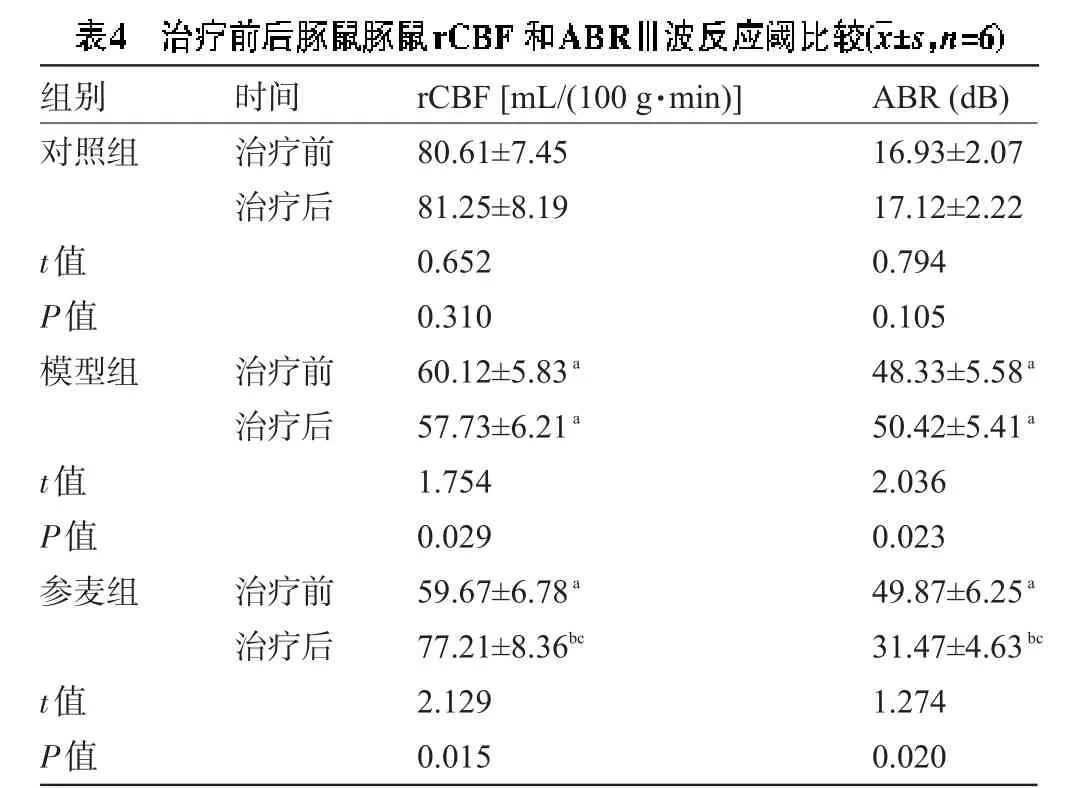
注:与对照组比较,aP<0.05;与同组治疗前比较,bP<0.05;与模型组比较,cP<0.05。
表5 治疗前后豚鼠VEGF及VEGF-m RNA表达比较(,n=6)
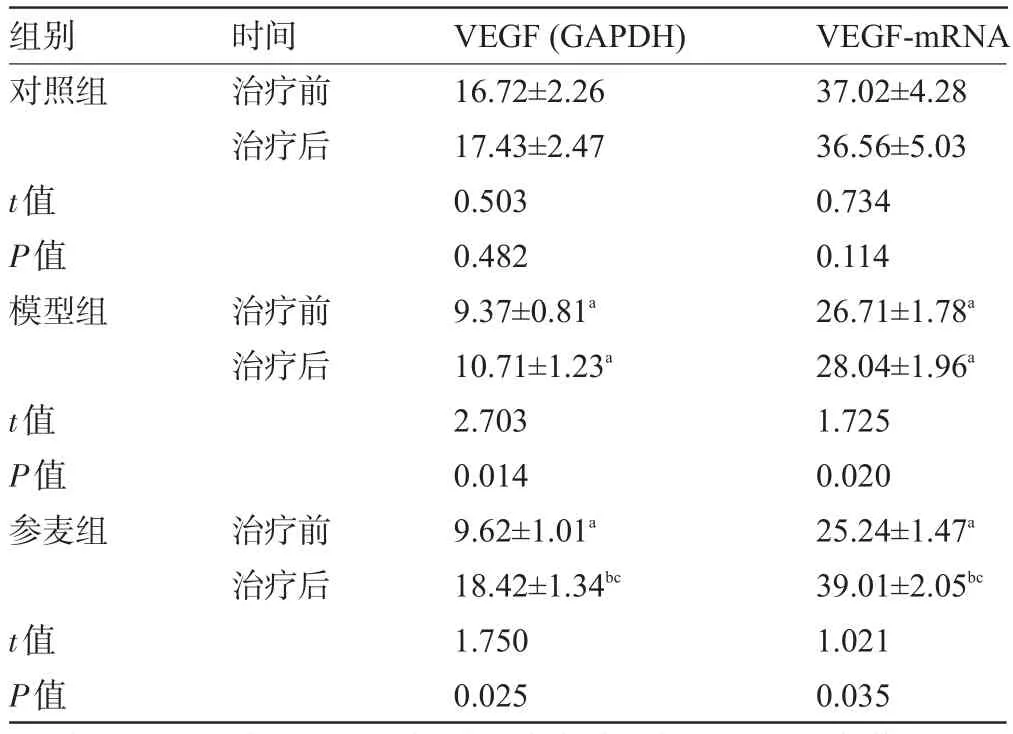
表5 治疗前后豚鼠VEGF及VEGF-m RNA表达比较(,n=6)
注:与对照组比较aP<0.05;与同组治疗前比较,bP<0.05;与模型组比较,cP<0.05。
组别对照组时间治疗前治疗后t值P值模型组治疗前治疗后t值P值参麦组治疗前治疗后t值P值VEGF(GAPDH) 16.72±2.26 17.43±2.47 0.503 0.482 9.37±0.81a10.71±1.23a2.703 0.014 9.62±1.01a18.42±1.34bc1.750 0.025 VEGF-mRNA 37.02±4.28 36.56±5.03 0.734 0.114 26.71±1.78a28.04±1.96a1.725 0.020 25.24±1.47a39.01±2.05bc1.021 0.035
3 讨论
参麦注射液是红参和麦冬两味中药制成的注射用灭菌注射液,主要有效药理成分为人参皂甙、麦冬皂甙等,具有扩张血管、改善微循环、清除氧自由基、改善心、脑供血不足等作用[14]。研究表明,3-NP是呼吸链琥珀脱氢酶不可逆性抑制剂,可抑制ATP酶活性,造成线粒体功能障碍,导致前庭功能兴奋性降低而出现听力下降和自发性眼震及眩晕等症状[15]。本实验经听泡骨窗向圆窗龛滴入3-NP造成药物性耳聋动物模型,经尾静脉注射参麦注射液进行治疗,通过诱导oVEMP,ABR潜伏期、反应阈,并通过记录rCBF等指标来观察是否有改善听力前庭功能受损的作用,为临床用药提供实验依据。
经7 d治疗,参麦组前庭功能受损行为学改变明显好转,N1和Pl振幅、oVEMP引出率和rCBF明显提高,N1和Pl潜伏期、ABRⅡ波、Ⅲ波潜伏期和Ⅰ~Ⅲ波间期均明显缩短,ABRⅢ波反应阈明显降低,VEGF及VEGF-mRNA高表达。现代医学研究发现,迷路动脉是内耳血供的重要动脉,且其侧支循环血管比较纤细,微循环障碍性疾病均可造成血管水肿、痉挛,耳蜗血流急剧减少,耳蜗螺旋器毛细胞和螺旋神经节供血不足可导致基底膜毛细胞变性、水肿、脱落和功能丧失,听神经萎缩、变性、坏死而最终导致听力丧失[16]。在本实验中,一方面,参麦注射液吸收后产生活血化瘀的作用,通过改善微循环来增加内耳血供,并有可能通过促进ATP酶活性恢复,增强钠钾ATP酶活力,改善组织能量代谢,促进耳蜗螺旋器毛细胞和螺旋神经功能恢复[17]。VEGF是促血管生长因子,可促进血管内皮细胞增殖、再生功能,并参与动脉侧支循环形成的调节[18]。在本实验中,参麦组治疗后VEGF及VEGF-mRNA治疗后高表达,提示参麦注射液具有促进VEGF的分泌、诱导缺血区的血管再生,促进受损血管内皮修复的功能[19]。在应用参麦注射液后,rCBF明显提高,rCBF增加后缺氧状态得以改善后,这对提高耳蜗螺旋器毛细胞和螺旋神经节血供、改善缺血缺氧耳蜗组织的能量代谢,改善病灶区缺血、水肿,促进神经细胞功能恢复起到至关重要的作用[8]。oVEMP和ABR在评价神经传导功能方面具有指导意义,ABR可客观反映听力[20]。正常耳oVEMP可引导出来,oVEMP引出率低预示听力损失严重且难以恢复,引导不出则听力完全丧失[21-22]。参麦组治疗后,内耳缺氧状态改善,螺旋神经功能得以恢复,故参麦组oVEMP电位得以引出,且oVEMP引出率提高,ABRⅢ波反应阈降低,听力提高。
[1]王玎,张丁宁,孙进军,等.不可忽视的儿童药物性耳聋[J].中国社区医师,2014,30(9):15-16.
[2]丁大连.内耳科学[M].北京:中国科学技术出版社,2010:222-223.
[3]熊浩,褚汉启,黄孝文,等.卡那霉素联合呋塞米快速诱导耳蜗损伤[J].中华耳鼻咽喉头颈外科杂志,2010,45(3):222-228.
[4]舒卫宁,赵立东,张小兵,等.内耳毛细胞再生的前体细胞及其发育调控基因[J].中国听力语言康复科学杂志,2010,38(1):21-24.
[5]符秋养,梁勇,邹岸,等.不同强度言语声诱发听性脑反应及听处理偏侧化分析[J].听力学及言语疾病杂志,2016,24(2):116-122.
[6]王佩杰,罗伟.眼性前庭诱发肌源性电位的研究现状及临床应用[J].听力学及言语疾病杂志,2015,23(2):202-206.
[7]李菊兰,梁传余,蒋涛.耳毒性药物使用时的听力学监测现状[J].四川医学,2003,24(12):1310-1312.
[8]张美霞,赵金池,吕红旗,等.参麦注射液配合针灸治疗突发性耳聋疗效分析[J].中国医药导报,2007,4(4Z):94-95.
[9]郭萍,李莉,李翠芳,等.参麦注射液对局灶性脑缺血再灌注大鼠血管内皮功能的影响[J].国际中医中药杂志,2015,37(5):427-430.
[10]张亚,邹静,Pyykko L,等.线粒体毒素诱导伴有眩晕的突发性耳聋模型的建立[J].上海交通大学学报(医学版),2007,27(1):14-18.
[11]Zou J,Pyykko I,Counter SA,et al.In vivo observation of dynamic perilymph formation using 4.7 TMRI w ith gadolinium as a tracer[J]. Acta Otolaryngol,2003,123(8):910-915.
[12]刘文杰,傅仲鹰,刘淑芳,等.不同部位参考电极诱发的豚鼠听性脑干反应差异分析[J].听力学及言语疾病杂志,2015,23(6):612-616.
[13]舒博,叶胜难,林有辉,等.突发性耳聋豚鼠眼肌前庭诱发肌源性电位特点[J].中华耳科学杂志,2016,14(1):75-78.
[14]左霞,陈红英,陈德森,等.参麦注射液对大鼠脑缺血再灌注损伤的影响[J].环球中医药,2015,8(4):407-410.
[15]Okam oto Y,Hoya N,Kamiya K,et al.Permanent threshold shift caused by acute cochlear m itochondrial dysfunction is primarily mediated by degeneration of the lateral wall of the cochlea[J].Audiol Neurootol,2005,10(4):220-233.
[16]赵晓红.39例突发性耳聋临床治疗体会[J].中国现代药物应用, 2010,4(8):49-50.
[17]贾凤玖,姚卫华,赵青山.参麦注射液和参麦注射液联合应用对急性心肌梗死患者肌钙蛋白T的影响[J].中西医结合心脑血管病杂志,2013,11(11):1384-1385.
[18]李翠芳,邹佩霞,姚远,等.参麦注射液对兔实验性心肌缺血预处理的实验研究[J].现代中西医结合杂志,2015,24(10):1049-1051.
[19]陈红英,李贤玉,王文杰,等.参麦对大鼠急性心肌缺血血管内皮生长因子表达的影响[J].世界中医药,2015,10(9):1387-1390.
[20]张晓东,于丽玫,孙喜斌,等.中国听力残疾致残原因分析[J].2010, 19(3):23-26.
[21]张青,胡娟,牛晓蓉,等.年龄因素对气导声刺激诱发的眼肌和颔肌前庭诱发肌源性电位的影响[J].中华耳鼻咽喉头颈外科志,2014, 49(11):897-901.
[22]Skinner LJ,Enée V,Beurg M,et al.Contribution of BKCa2+activated K+channels to auditory neurotransm ission in the guinea pig cochlea [J].JN Europhysiol,2003,90(1):320-332.
Effects of Shenmai injection on drug induced deafness in guinea pigs induced by m itochondrial toxin.
WANG Qiu-rong1,ZHU Hong-li1,CHEN De-sen2.1.Department of ENT,Shiyan Taihe Hospital,the Affiliated Hospital of Hubei Medical College,Shiyan 442000,Hubei,CHINA;2.The Clinical Medicine College of Hubei Medical College,Shiyan 442000,Hubei,CHINA
Objective To observe the effect of Shenmai injection on guinea pig grow th factor drug deafness ocular vestibular evoked myogenic potentials and vascular endothelial cells,and to analysis its mechanism.Methods A total of 30 healthy male guinea pigs were injected w ith 0.5 mol/L 3-nitropropionic acid(3-NP)6 μL into the round w in-dow niche to cause drug-induced deafness through transbullar bone-w indow,24 of them were random ly divided into the model group and Shenmai group.Another 12 healthy male guinea pigs were selected as the control group.Shenmai group was injected w ith 0.5 m L/kg Shenmai Injection through tail vein,and the model group was injected w ith the same volume of normal saline,for 7 d.The behavioral changes of guinea pig vestibular dysfunction were observed.Ocular vestibular evoked myogenic potentials(oVEMP)in guinea pigs was induced by tone burst,the main parameters of N 1 and Pl,N1 and Pl latency,amplitude,N1-Pl wave duration were recorded,and the oVEMP formation rate was calculated.The waveⅢthreshold value of auditory brainstem response(Auditory brainstem,response,ABR)andⅠ~Ⅵlatency of 80 dB nHL of short sound stimulation were recorded.Regional cerebral blood flow in guinea pigs(rCBF)was monitored,the reverse transcription polymerase chain reaction(RT-PCR)was used to detect the expression of VEGF in cochlea and VEGF-mRNA.Results After the treatment,N1 and Pl amplitude,oVEMP formation rate,rCBF wave of the Shenmai group were respectively(10.22±0.74)μV,(11.03±0.82)μV,(92.01±8.72)%,(77.21±8.36)m L/(100 g·min),which were significantly higher than corresponding(7.03±0.52)μV,(8.95±0.54)μV,(43.32±5.77)%,(57.73±6.21)m L/(100 g·m in) of the model group(P<0.05).The N1 and Pl latency,ABRⅡwave,Ⅲwave latency,Ⅰ~Ⅲwave interval of the Shenmai group were respectively(10.14±1.97)ms,(9.52±1.04)ms,(1.37±0.19)ms,(3.01±0.35)ms,(2.02±0.24)ms,which were significantly shorter than corresponding(13.54±2.98)ms,(12.30±1.81)ms,(3.72±0.26)ms,(4.39±0.33)ms,(3.03± 0.22)ms of the model group(P<0.05).ABR waveⅢthreshold of the Shenmai group was(31.47±4.63)dB,which was significantly lower than(50.42±5.41)dB of the model group(P<0.05).VEGF and VEGF-mRNA in the Shenmai group were respectively(18.42±1.34)GAPDH and(39.01±2.05),which were significantly higher than(10.71±1.23)GAPDH and(28.04±1.96)in the model group(P<0.05).Conclusion Shenmai injection can improve the blood flow of the cochlea damaged tissue and the vascular endothelial function of the damaged inner ear,and promote the regeneration and repair of the hair cells in the cochlea and vestibular nerve function,which has certain therapeutic effect on the mitochondrial toxin-induced deafness model guinea pig.
Drug deafness;Shenmai injection;Ocular vestibular evoked myogenic potentials(oVEMP);Vascular endothelial grow th factor(VEGF);Auditory brainstem response
R-332
A
1003—6350(2017)13—2071—05
10.3969/j.issn.1003-6350.2017.13.002
2017-01-05)
湖北省教育厅基金(编号:B20122423)
陈德森。E-mail:wangxinlingjob@126.com

