红椒根际促生菌液体发酵条件研究
孙兆远,翟玮玮,张丽芳,曹阳
(江苏食品药品职业技术学院,江苏淮安223003)
红椒根际促生菌液体发酵条件研究
孙兆远,翟玮玮*,张丽芳,曹阳
(江苏食品药品职业技术学院,江苏淮安223003)
为了合理开发利用PGPR生物菌肥,以600 nm波长处的吸光度(OD600)和IAA产量为评价指标,对红椒根际促生细菌(PGPR)的发酵条件进行研究,探讨了碳源、氮源、培养时间、培养温度、溶液pH值和装液量等因素对PGPR菌株生长和IAA产量的影响,并通过正交试验对发酵条件进行了优化。结果表明:最佳发酵条件为培养时间60 h、培养温度35℃、发酵液pH值6、装液量50 mL;各因素对IAA产量的影响顺序为装液量>培养时间>溶液pH值>培养温度。
辣椒;根际细菌;液态发酵;吲哚乙酸
植物根际促生细菌(plant growth-promoting rhizobacteria,PGPR)是指自由生活在土壤或附生于植物根际的一类可促进植物生长、提高作物产量、防治病害的有益菌类[1]。PGPR能够通过解磷、自生固氮和螯合Fe3+等方法给植物提供更多的营养物质,以达到促进植物根系生长,改变根系形态,增加根毛度、根毛数、侧根数、根重量和根表面积的作用[2];还可以分泌IAA等植物激素,提升细胞壁的疏松度和可塑性,促进RNA和蛋白质的合成,溶解细胞壁糖,改变细胞内环境,进而起到促进细胞生长,增加细胞体积和质量的作用[3,4]。
早在1953年我国生物学家就从陕西径阳县老苜蓿根系土壤中分离出“5406”PGPR菌株(细黄链霉菌乳糖变种),经诱变处理制成生物菌肥,该菌肥具有防病保苗、促进生长、肥地松土的作用[5]。但由于当时发酵设备和技术较为落后,所产生物菌肥肥效稳定性差,特效菌株繁殖性能弱,杂菌污染严重,因此,大大限制了该生物菌肥的大规模应用[6]。近年来,发酵设备和发酵工艺的快速发展,为规模化生产PGPR生物菌肥提供了物质和技术支撑[7]。
PGPR生物菌肥的促生防病效果,不仅取决于菌株本身,而且还取决于外界条件,如培养基成分和培养条件等[8]。为此,采用单因素试验和正交试验对PGPR菌株液态发酵条件进行优化,得到其最适的培养基和培养条件,以期为合理开发利用PGPR生物菌肥提供理论依据。
1 材料与方法
1.1 试验材料
红椒根际PGPR,分离自淮安红椒根际。由江苏食品药品职业技术学院微生物实验室分离、筛选、鉴定和保存。
种子培养基:蛋白胨10 g,酵母提取物5 g,氯化钠10 g,琼脂20 g,蒸馏水1 000 mL,pH值7.0~7.2,121℃灭菌20 min。
基础发酵培养液:L-色氨酸100 mg,(NH4)2SO42 g,NaH2PO40.50 g,K2HPO40.50 g,MgSO40.20 g,CaCl20.10 g,蒸馏水1 000 mL。
试剂:3-IAA标准品为Sigma公司产品,其余化学试剂均为分析纯。
1.2 试验方法
1.2.1 种子液制备将斜面保存的红椒根际PGPR菌株接种到种子培养基中,在温度30℃、转速150 r/min的恒温振荡箱中培养60 h,制成活菌含量>108CFU/mL的种子液[9]。
1.2.2 碳源和氮源的选择
1.2.2.1 碳源的选择。分别向基础发酵培养液中加入1%(W/V)的葡萄糖、木糖、蔗糖、果糖、甘露醇、乳糖,配制成不同碳源的发酵培养液。装入250 mL三角瓶中,装液量100 mL/瓶,灭菌后加入5%(V/V)的种子液,在温度30℃、转速150 r/min的恒温振荡箱中培养60 h,比较不同碳源对PGPR菌株生长状况和IAA产量的影响,确定最佳碳源种类。
1.2.2.2 氮源的选择。分别向基础发酵培养液中加入1%(W/V)的蛋白胨、酵母粉、硝酸钾、谷氨酸、硫酸铵、硝酸铵,配制成不同氮源的发酵培养液。按照“1.2.2.1”所述方法培养,比较不同氮源对PGPR菌株生长状况和IAA产量的影响,确定最佳氮源种类。
1.2.3 发酵条件的选择与优化
1.2.3.1 培养时间的选择。应用优化的发酵培养液,用磷酸将pH值调节至7,按照“1.2.2.1”所述方法接种,在温度30℃、转速150 r/min的恒温振荡箱中分别培养12、24、36、48、60、72和84 h,比较不同培养时间对PGPR菌株生长状况和IAA产量的影响。
1.2.3.2 培养温度的选择。应用优化的发酵培养液,用磷酸将pH值调节至7,按照“1.2.2.1”所述方法接种,分别在温度20、25、30、35、40和45℃,转速150 r/min的恒温振荡箱中培养48 h,比较不同培养温度对PGPR菌株生长状况和IAA产量的影响。
1.2.3.3 pH值的选择。应用优化的发酵培养液,用磷酸将pH值分别调节至4、5、6、7、8、9和10,按照“1.2.2.1”所述方法接种,在温度35℃、转速150 r/min的恒温振荡箱中培养48 h,比较不同pH值对PGPR菌株生长状况和IAA产量的影响。
1.2.3.4 装液量的选择。应用优化的发酵培养液,用磷酸将pH值调节至6,分别取25、50、75、100和150 mL装入三角瓶中,按照“1.2.2.1”所述方法接种,在温度35℃、转速150 r/min的恒温振荡箱中培养48 h,比较不同装液量对PGPR菌株生长状况和IAA产量的影响。
1.2.3.5 最佳发酵条件的优化。采用L9(43)正交试验设计(表1),考察培养时间、培养温度、培养液pH值和装液量对IAA产量的影响,确定PGPR菌株的最佳发酵条件。
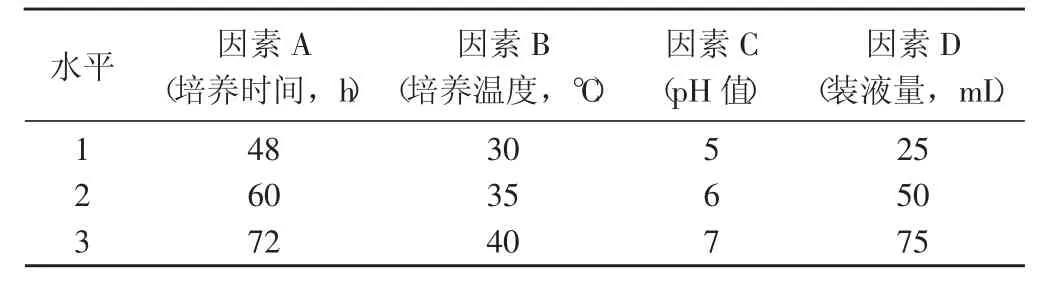
表1 L9(43)正交试验的因素及其水平Table 1 Factors and levels in orthogonal array design
1.2.4 测定项目与方法
1.2.4.1 PGPR菌株生长状况。用600 nm波长处的吸光度(OD600)表示。取发酵后的菌悬液10 mL,稀释适当倍数后,在600 nm波长处测定吸光度[10]。
1.2.4.2 IAA产量。采用Salkowski比色法测定。将菌悬液10 000 r/min离心10 min,取上清液,加入等体积的Salkowski比色液,避光静置30 min,取出后立即在530 nm波长处测定吸光度[11]。根据IAA标准曲线(采用3-IAA标准品绘制),计算IAA产量。
2 结果与分析
2.1 碳源种类对PGPR菌株生长和IAA产量的影响
菌株生长测定结果(图1)显示,6种碳源均对PGPR菌体生长有促进作用,其中,葡萄糖、蔗糖和甘露醇的效果较为明显;果糖和乳糖对PGPR菌体生长有一定的作用;而木糖对OD600影响很小。说明PGPR对葡萄糖、蔗糖和甘露醇的吸收利用效果较好,但基本不吸收木糖。
从IAA产量测定结果看,蔗糖可以大幅提高IAA产量,其次是甘露醇和果糖,木糖的效果仍然不明显。值得注意的是,葡萄糖并没有大幅度提升IAA产量,这可能是因为高浓度的葡萄糖在反应终止时仍会大量残留,而残留的葡萄糖则与IAA形成无活性的糖基-IAA复合体,降低了游离态IAA的产量[3]。
综合分析不同碳源种类对PGPR菌株生长和IAA产量的影响,确定最佳碳源为蔗糖。
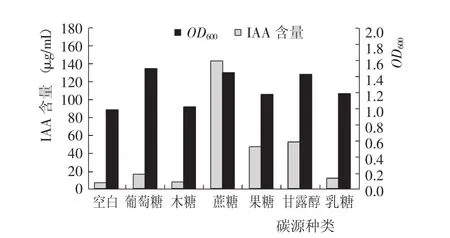
图1 不同碳源种类对PGPR菌株生长和IAA产量的影响Fig.1 Effect of carbon sources on grow th of PGPR and IAA concentration
2.2 氮源种类对PGPR菌株生长和IAA产量的影响
菌株生长测定结果(图2)显示,蛋白胨和酵母粉2种有机氮源对PGPR菌体生长和IAA产量均有明显的促进作用;硝酸钾能够显著提高IAA产量,但对PGPR菌体生长影响甚微;谷氨酸和硫酸铵对PGPR菌体生长增效不显著,但硫酸铵明显提高了IAA产量,而谷氨酸对IAA产量作用不大;硝酸铵能较大幅度地提高IAA产量,但却阻碍了PGPR菌体生长。
综合分析不同氮源种类对PGPR菌株生长和IAA产量的影响,确定最佳氮源为酵母粉。
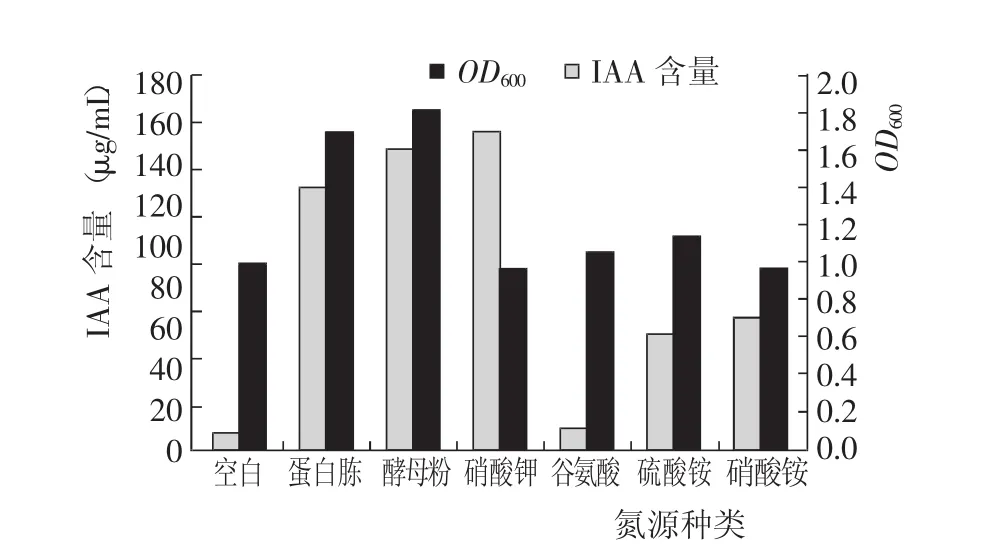
图2 不同氮源种类对PGPR菌株生长和IAA产量的影响Fig.2 Effect of nitrogen source on grow th of PGPR and IAA concentration
2.3 培养时间对PGPR菌株生长和IAA产量的影响
菌株生长测定结果(图3)显示,在0~24 h内,PGPR菌株快速进入对数生长期;24 h后逐渐进入稳定期,并在48 h后达到最高点,当发酵时间超过60 h时OD600略有下降,说明PGPR细菌开始死亡。
从产量测定结果看,在12~24 h内,有少量IAA产生,且IAA产量变化不大;当发酵时间超过24 h后,IAA产量快速提高,这主要是因为IAA是PGPR的次级代谢产物,只有在PGPR成熟稳定后才能大量产生并积累;当发酵时间超过60 h后,IAA产量略有下降,这主要是因为细胞死亡导致的次生代谢产物降低和IAA降解酶将IAA分解[12]。
综合分析不同培养时间对PGPR菌株生长和IAA产量的影响,确定最佳培养时间为60 h。
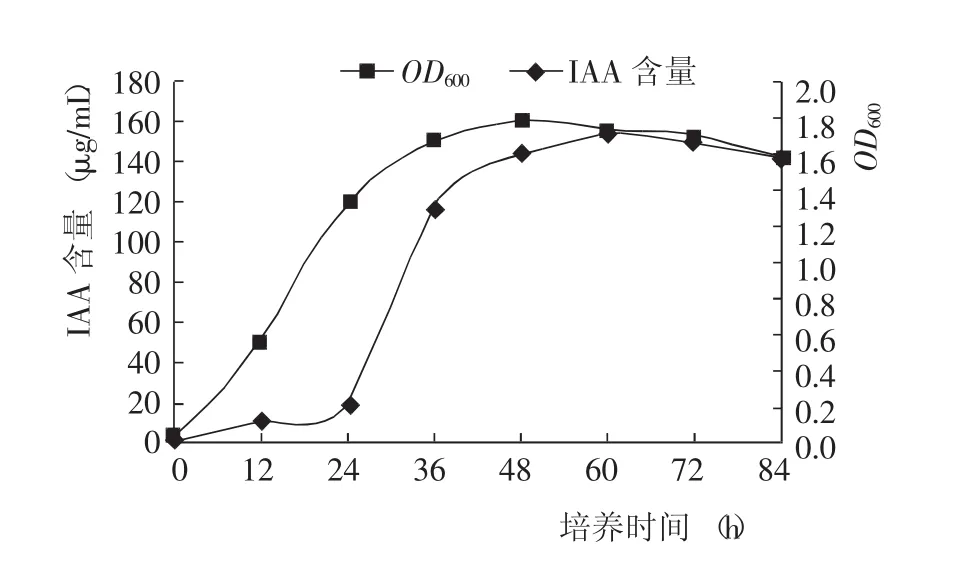
图3 不同培养时间对PGPR菌株生长和IAA产量的影响Fig.3 Effect of fermentation time on grow th of PGPR and IAA concentration
2.4 培养温度对PGPR菌株生长和IAA产量的影响
测定结果(图4)显示,随着温度的升高,OD600和IAA产量均呈先快速增加后快速降低的变化趋势,且指标值均在培养温度为35℃时达到最大。说明PGPR菌株生长的最适温度为35℃,且在此条件下,菌株次级代谢产物IAA产量最高。
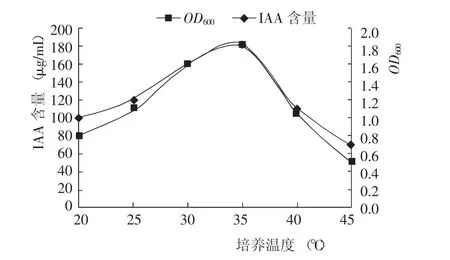
图4 不同培养温度对PGPR菌株生长和IAA产量的影响Fig.4 Effect of tem perature on grow th of PGPR and IAA concentration
2.5 pH值对PGPR菌株生长和IAA产量的影响
菌株生长测定结果(图5)显示,pH值为4和10时,PGPR菌体均不生长,也不产生IAA,这是因为PGPR为中性微生物,在强酸和强碱环境下均不能生长;当pH值为5~9时,PGPR菌体均能较好地生长,说明PGPR生长具有较宽的pH值适应范围,但是pH值>6后IAA产量有所降低,说明PGPR积累IAA的最适pH值为6左右。
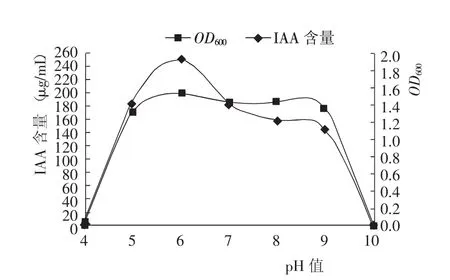
图5 发酵培养液不同pH值对PGPR菌株生长和IAA产量的影响Fig.5 Effect of pH of solutions on grow th of PGPR and IAA concentration
2.6 装液量对PGPR菌株生长和IAA产量的影响
菌株生长测定结果(图6)显示,装液量为25 mL时,三角瓶中的氧气最为充足,但PGPR菌株生长量和IAA产量并不是最大,说明过多的氧气并不适合PGPR菌株生长和IAA的产生,这可能是因为高浓度的氧气会对PGPR菌株生长产生抑制作用,影响了菌体的分裂和次生产物的代谢;装液量为50 mL时,PGPR菌株生长量和IAA产量均为最大;当装液量>50 mL后,随着装液量的增加,PGPR菌株生长量和IAA产量均逐渐降低,这是因为装液量增加,PGPR细菌数量增加,三角瓶中相对溶解氧气的数量就会减少,菌体生长变慢,IAA产量下降。这也说明PGPR为严格好氧菌,IAA的合成是好氧代谢,培养基中溶氧量的减少将会影响菌株的生长和IAA产量[13]。
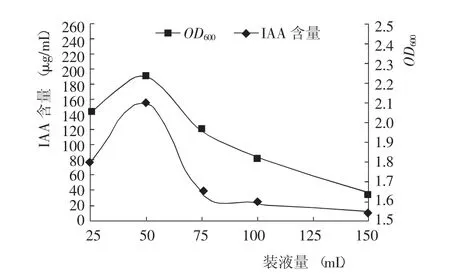
图6 不同装液量对PGPR菌株生长和IAA产量的影响Fig.6 Effect of quantity of sam ples on grow th of PGPR and IAA concentration
2.7 最佳发酵条件的确定
极差分析结果(表2)显示,试验因素对PGPR菌株发酵效果的影响顺序为D>A>C>B。说明装液量对PGPR菌株发酵效果影响最大,培养时间次之,培养温度的影响最小。
从各水平对应的k值可以看出,最佳发酵条件为A2B2C2D2,即:培养时间60 h,培养温度35℃,发酵液pH值6,装液量50 mL。
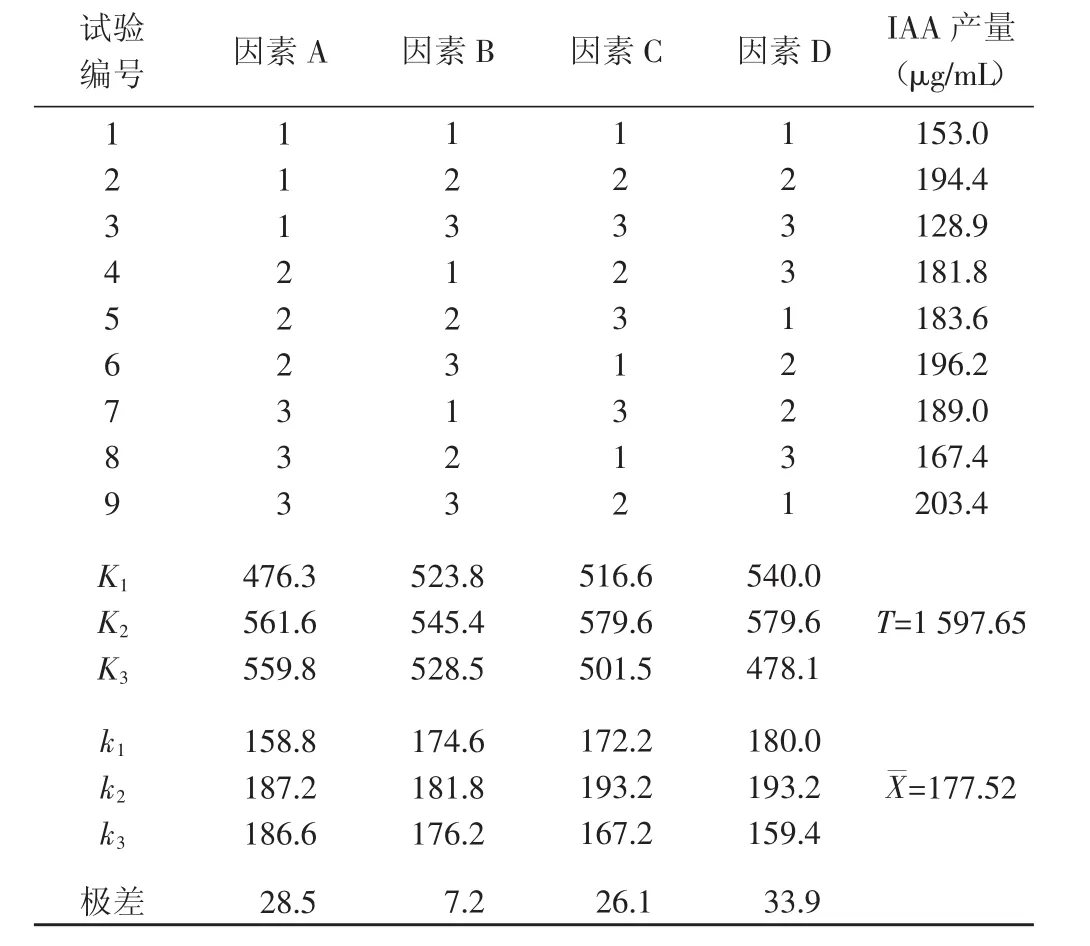
表2 正交试验的IAA产量Table 2 IAA concentration of the orthogonal test
3 结论与讨论
PGPR菌株发酵过程极其复杂,影响因素众多,对其发酵培养条件进行优化显得尤为重要[14~16]。作者在前期试验的基础上,通过单因素试验和正交试验对影响PGPR菌株发酵的培养条件进行了研究,结果表明,不同的发酵液成分(碳源、氮源)和培养条件(培养时间、培养温度、发酵液pH值和装液量)均会影响PGPR菌体的生长和IAA产量,这与前人的研究结果[17,18]相吻合。发酵液成分试验结果表明,葡萄糖、蔗糖、甘露醇、蛋白胨和酵母粉对PGPR菌体生长有较好的促进作用,而蔗糖、蛋白胨、酵母粉和硝酸钾可以大幅度提高IAA产量,这与文献报道的观点[19,20]略有不同,可能是因为菌株不同造成的;通过正交试验发现,发酵条件对IAA产量的影响顺序为装液量>培养时间>溶液pH值>培养温度,最佳发酵条件为培养时间60 h、培养温度35℃、发酵液pH值6、装液量50 mL,与前人对不同菌株的发酵条件和培养基成分研究结果[21]相比较,不同种类菌株之间差异很大。
参考文献:
[1]张英,朱颖,姚拓,祁娟,荣良燕.分离自牧草根际四株促生菌株(PGPR)互作效应研究[J].草业学报,2013,22(1):29-37.
[2]陈治宇,郎南军,李甜江.解磷微生物研究进展[J].绿色科技,2014,(10):232-234.
[3]张东艳,刘晔,吴越,王国文,万兵兵,姜瑛.花生根际产IAA菌的筛选鉴定及其效应研究[J].中国油料作物学报,2016,38(1):104-110.
[4]吴瑛,席琳乔.燕麦根际固氮菌分泌IAA的动态变化研究[J].安徽农业科学,2007,35(15):4424-4425.
[5]顾龙云.5406(北京二号)的分类鉴定[J].甘肃农业科技,1979,(2):25-26.
[6]穆燕魁,王占武,张翠绵,李洪涛,田洪涛.根际益生菌链霉菌S506固体发酵条件优化[J].微生物学通报,2008,35(10):1600-1605.
[7]陆雅海,张福锁.根际微生物研究进展[J].土壤,2006,38(2):113-121.
[8]韩丽,常建民,张柏林,孙薇,王雨.白桦木材蓝变生防菌(Bacillus subtilis)B26液体发酵条件的优化[J].东北林业大学学报,2011,39(12):71-73.
[9]郭丹钊,陈钧,杜向萍,张春晓,潘静.具杀螺活性的商陆根际真菌Aspergillus fumigatus SL-30发酵条件优化[J].天然产物研究与开发,2012,24(9):1176-1181.
[10]Erturk Y,Ercisli S,Haznedar A,Cakmakci R.Effects of plant growth promoting rhizobacteria(PGPR)on rooting and root growth of kiwifruit(Actinidia deliciosa)stem cuttings[J].Biological Research,2010,43(1):91-98.
[11]Rahman A,Sitepu I R,Tang S Y,Hashidoko Y. Salkowski’s reagent test as a primary screening index for functionalities of rhizobacteria isolated from wild dipterocarp saplings growing naturally on medium-strongly acidic tropical peat soil[J].Bioscience Biotechnology and Biochemistry,2010,74(11):2202-2208.
[12]吴登如,赵毓橘.表油菜素内酯对绿豆上胚轴内源IAA及其氧化酶的影响[J].植物生理学报,1991,17(4):327-332.
[13]陈国民,肖静,李友国,周俊初.从植物根际分离的8株细菌的促生作用与初步鉴定[J].湖北农业科学,2008,47(1):39-41.
[14]方敦煌,赵玉虎,沐应祥,谭仲夏,李天飞.拮抗菌株GP13的基本生物学特性研究[J].西南大学学报:自然科学版,2002,24(5):406-408.
[15]康贻军,程洁,梅丽娟,胡健,朴哲.植物根际促生菌作用机制研究进展[J].应用生态学报,2010,21(1):232-238.
[16]汤春梅,陈秀蓉,姚拓,龙瑞军.九种根际促生菌最适培养条件初探[J].草原与草坪,2005,(3):27-30.
[17]胡江春,薛德林,马成新,王书锦.植物根际促生菌(PGPR)的研究与应用前景[J].应用生态学报,2004,15(10):1963-1966.
[18]张东艳,刘晔,吴越,王国文,万兵兵.花生根际产IAA菌的筛选鉴定及其效应研究[J].中国油料作物学报,2016,38(1):104-110.
[19]马海林,邢尚军,刘方春,马丙尧,丁延琴.樱桃根际促生细菌YT3的培养基及发酵条件优化[J].东北林业大学学报,2013,41(5):127-130.
[20]陈翠,陈丹丹,冯清,陈祁怡,吴向华.根际促生菌D5菌株发酵条件优化[J].江苏农业科学,2016,44(6):516-518.
[21]郑文波,申飞,闫小梅,张舒玄,孙波.红壤中产吲哚乙酸并具解磷作用的促生菌筛选鉴定及促生效果研究[J].土壤,2015,47(2):361-368.研究[J].
Optim ization of Submerged Fermentation of Plant Grow th-promoting Rhizobacteria From Hot Pepper
SUN Zhao-yuan,ZHAI Wei-wei*,ZHANG Li-fang,CAO Yang
(Jiangsu Food&Pharmaceutical Science College,Huaian 223003,China)
Fermentation conditions of a plant growth-promoting rhizobacteria(PGPR)from hot pepper were optimized by OD600and content of indoleacetic acid.The effects of six reaction parameters,including carbon sources,nitrogen source,fermentation time and temperature,pH of solutions and quantity of samples,on the growth of PCRR and content of indoleacetic acid were conducted to explore by single factor experiments and orthogonal experiment.The results showed that an optimum yield of indoleacetic acid was obtained by 50 mL samples,at pH 6 and 35℃with standing time of 60 h.In addition,other factors had the largest impact on the yield of indoleacetic acid followed by quantity of sample,fermentation time,pH of solutions and fermentation temperature.
Hot pepper;Rhizosphere bacteria;Liquid state fermentation;IAA
S144.9
:A
:1008-1631(2017)02-0061-05
2016-08-31
江苏省政策引导类计划(产学研合作)项目(BY2015054-01)
孙兆远(1978-),男,江苏沛县人,讲师,硕士,主要从事天然产物活性成分提取与应用研究。E-mail:sun_zyuan@126.com。
翟玮玮(1968-),女,江苏淮安人,教授,硕士,主要从事天然产物活性成分提取与应用研究。E-mail:zaiww6810@126.com。

