不同浸泡方法对绿豆吸水特性的影响
王大为,董 欣,张 星,任华华(吉林农业大学食品科学与工程学院,吉林 长春 130118)
不同浸泡方法对绿豆吸水特性的影响
王大为,董 欣,张 星,任华华
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
为研究浸泡方式对绿豆软化处理的影响,采用不同温度条件浸泡、超声波和微波辅助浸泡处理、化学法辅助浸泡处理以及酶法辅助浸泡处理绿豆,考察不同方法对绿豆浸泡时吸水率、体积膨胀率的影响,同时采用扫描电子显微镜观察绿豆内部微观结构,并对其吸水动力学进行初步研究。结果表明,随着浸泡时间延长及温度提高,绿豆吸水率及体积膨胀率呈现增长态势直至饱和,但随着温度的升高,绿豆的饱和吸水率明显降低,不同浸泡处理方式的饱和吸水率及膨胀率不同。4 种浸泡软化方法的吸水动力学方程为:1)不同温度条件浸泡:y20=0.056x+0.002(R2=0.945,20 ℃)、y40=0.235x+0.085(R2=0.978,40 ℃)、y60=1.057x+0.332(R2=0.983,60 ℃);2)超声波和微波辅助浸泡处理:yu=0.182x+0.001(R2=0.988,超声波)、ym=0.116x+0.081(R2=0.982,微波);3)化学法辅助浸泡处理:ya=0.029x+0.051(R2=0.963,乙酸)、ysb=0.036x+0.027(R2=0.838,碳酸氢钠)、ysc=0.057x+0.054(R2=0.957,碳酸钠);4)酶法辅助浸泡处理:yc=0.122x+0.051(R2=0.999,纤维素酶)、yh=0.101x+0.103(R2=0.854,半纤维素酶)、yp=0.098x+0.002(R2=0.990,果胶酶)。绿豆吸水动力学研究结果表明,物理、化学辅助浸泡处理均能提高绿豆的吸水速率,超声波、酶法辅助浸泡处理能显著缩短浸泡时间。
绿豆;软化处理;吸水率;吸水动力学
绿豆(Vigna radiata (Linn.) Wilczek,mung bean),别名植豆、青小豆、录豆,是我国主要食用豆类作物,已有2 000多年的栽培历史[1-2]。在我国各地均有种植,主产区集中在黄河、淮河流域及东北地区[3-4],我国常年种植面积约80万hm2,总产量保持在近100万 t[5]。
绿豆营养丰富,含有多种维生素、矿物质和多种生物活性物质[6-8],具有很好的药用价值和保健功能,是广大人民非常喜爱的食品之一,通常制成绿豆汤、绿豆粥、绿豆糕等常见的解热消暑的饮品及甜点食用[9]。由于干燥绿豆质地坚硬,在绿豆食品加工过程中,软化处理是十分重要和必需的步骤,常见的软化方法是常温浸泡、蒸煮,此过程不但可以使绿豆吸水膨胀,同时还可以去除绿豆内的单宁、植酸等。但是,水浸泡软化处理过度会使绿豆中的营养物质流失[10-13]。目前关于浸泡绿豆的工艺已有一些相关报道,但方法单一或只研究对豆芽生长的影响[14]。另外动力学的研究主要集中在食品功能成分提取方面[15-18],对绿豆不同软化方法的吸水动力学研究报道甚少。本实验主要研究不同浸泡温度(20、40、60 ℃)、超声波和微波辅助浸泡处理、化学法(乙酸、碳酸氢钠、碳酸钠)辅助浸泡处理以及酶法(纤维素酶、半纤维素酶、果胶酶)辅助浸泡处理对绿豆吸水率及体积膨胀率的影响,同时采用扫描电子显微镜观察绿豆内部微观结构,并对以上4 种方法进行吸水动力学实验,建立相应的吸水动力学模型,以便在保证绿豆软化效果同时,尽量缩短软化时间、提高绿豆食品生产效率、减少用水量、保护环境,不但为绿豆食品加工时绿豆浸泡复水处理高效进行提供一定的理论依据,同时也为其他豆类或杂粮食品加工中出现同类或相似问题的解决提供参考。
1 材料与方法
1.1 材料与试剂
绿豆产自吉林省白城市。
碳酸氢钠、乙酸、碳酸钠(均为食品级) 河北源创生物科技有限公司;纤维素酶(酶活力700 EGU /g)、半纤维素酶(酶活力100 FEB/g)、果胶酶(酶活力1 000 U/mg) 诺维信(中国)生物技术有限公司。
1.2 仪器与设备
DIKW-4双列四位电热恒温水浴锅 北京中兴伟业仪器有限公司;PHS-3BW微机型精密酸度计 上海理达仪器厂;GBB02电子精密天平 梅特勒-托利多仪器(上海)有限公司;UWave-1000型微波/紫外/超声波三位一体合成萃取反应仪 上海新仪微波化学科技有限公司;SU8010扫描电子显微镜 日本Hitachi公司。
1.3 方法
1.3.1 浸泡温度对绿豆吸水率和吸水速率的影响
准确称取绿豆3 份,每份10.00 g,置于容器中加入30 mL蒸馏水,分别于20、40、60 ℃条件下浸泡,每隔1 h取样,测定不同温度条件下浸泡后的绿豆质量,按公式(1)计算吸水率。
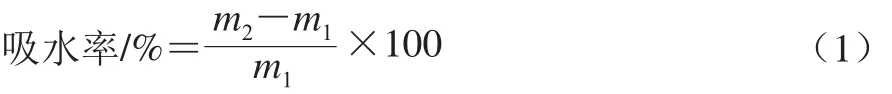
式中:m1为浸泡前绿豆质量/g;m2为浸泡后绿豆质量/g。
绿豆吸水速率计算方法可由公式(2)、(3)推出。

式中:Ct为在t时刻时绿豆的含水量/(g/g);CH为绿豆浸泡后的饱和含水量/(g/g);k为绿豆的吸水速率;t为浸泡时间/h。
将式(2)两边积分得式(3)。

式中:C0为绿豆最初(t=0 h)的含水量/(g/g)。
由式(3)可知,绿豆在一定条件下吸水时,以ln((CH-C0)/(CH-Ct))为纵坐标(y值),时间t为横坐标(x值),绘制曲线,计算方程斜率k即可得绿豆吸水速率。
1.3.2 超声波、微波处理对绿豆吸水率和吸水速率的影响
准确称取绿豆2 份,每份10.00 g,置于烧杯中,加入30 mL蒸馏水,分别于超声波功率400 W、超声波时间10 min及微波温度40 ℃、微波时间10 min条件下处理,然后取出常温浸泡,每隔1 h取样,测定在两种处理方法浸泡后的绿豆质量,按1.3.1节的方法计算吸水率和吸水速率。
1.3.3 化学法辅助处理对绿豆吸水率和吸水速率的影响
准确称取绿豆3 份,每份10.00 g,置于容器中,分别加入体积分数为5%的乙酸、5 g/100 mL碳酸氢钠、5 g/100 mL碳酸钠溶液30 mL,浸泡处理 20 min,然后取出绿豆冲洗至中性,常温浸泡,每隔1 h取样,测定在不同化学法辅助处理浸泡后的绿豆质量,按1.3.1节的方法计算吸水率和吸水速率。
1.3.4 酶法辅助浸泡处理对绿豆吸水率和吸水速率的影响
准确称取绿豆3 份,每份10.00 g,置于容器中,加入30 mL蒸馏水,用食品级乙酸和碳酸钠调整pH值后,分别加入2%纤维素酶、2%半纤维素酶及2%果胶酶,分别在酶的最适温度和pH值下(半纤维素酶45 ℃、pH值3.5;纤维素酶55℃、pH值5.0;果胶酶50℃、pH值3.5)水浴处理20 min,然后取出绿豆冲洗至中性,常温浸泡,每隔1 h取样,测定不同酶处理浸泡后的绿豆质量,按1.3.1节的方法计算吸水率和吸水速率。
1.3.5 绿豆体积膨胀率的测定
准确称取绿豆10.00 g,精确测量处理前绿豆体积(V1),然后分别用1.3.1~1.3.4节中的方法处理绿豆,检测上述不同条件下处理后绿豆的体积(V2),按公式(4)计算绿豆体积膨胀率。
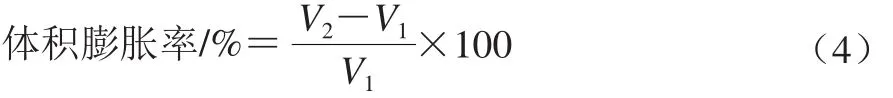
1.3.6 扫描电子显微镜观察
取上述4 种方法浸泡软化后的绿豆颗粒及浸泡前绿豆颗粒,分别截取其横截面放置于双面胶上,喷涂铂-钯合金,置于扫描电子显微镜下观察其微观结构。扫描电子显微镜的条件为:加速电压7 kV、发射电流19 900 nA、放大倍数1 000 倍、工作距离9.1 mm、电子探头为二次电子检测器。
1.4 数据统计分析
数据采用Microsoft Office Excel 2003和Origin 8.0软件进行处理。
2 结果与分析
2.1 浸泡温度对绿豆软化的影响
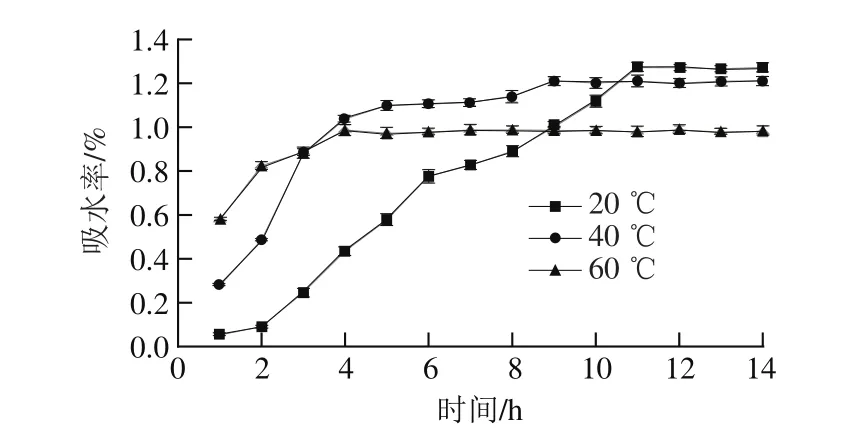
图1 绿豆浸泡过程中吸水率的变化Fig. 1 Changes in water absorption percentage of mung beans during hot water soaking
由图1可知,20 ℃浸泡时绿豆在0~6 h内吸水率持续快速增长,6~11 h进入缓慢增加状态,11 h后达到平衡吸水饱和态,饱和吸水率为1.272%;40 ℃浸泡时绿豆在0~5 h其吸水率进入快速增长状态,且较20 ℃时更为迅速,5~9 h吸水率持续缓慢增长,9 h后达到平衡吸水饱和态,吸水率为1.251%;60 ℃浸泡时绿豆吸水率于0~4 h内快速增加,而后迅速达到饱和状态且保持不变,吸水率为0.987%。由此可知,随着浸泡温度的升高,绿豆饱和吸水率反而下降,这是由于随着温度的升高,绿豆中的淀粉会发生糊化,蛋白质会产生变性,从而导致水分难以吸收[19]。
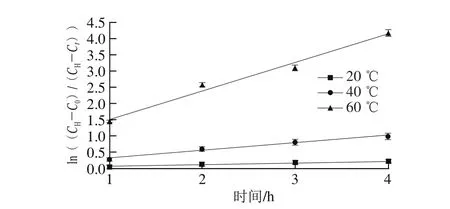
图2 绿豆浸泡过程中吸水速率的变化Fig. 2 Changes in water absorption rate of mung beans during hot water soaking
将所得数据代入Kon[11]提出的方法中,通过确定绿豆此条件下的最大饱和吸水率及吸水前绿豆含水量,并以时间为横轴作图。由图2可知,在0~4 h内,不同温度(20、40、60 ℃)浸泡绿豆的吸水动力学方程分别为y20=0.056x+0.002(R2=0.945,20 ℃)、y40=0.235x+0.085(R2=0.978,40 ℃)、y60=1.057x+0.332(R2=0.983,60 ℃)。在20、40、60 ℃浸泡条件下得到的绿豆吸水动力学模型具有很好的线性关系。当浸泡温度20 ℃时,k值为0.056;40 ℃时,k值为0.235;60 ℃时,k值为1.057。斜率k值随着浸泡温度的升高而增大,吸水速率顺序为60 ℃>40 ℃>20 ℃。此现象的原因可能是绿豆内的淀粉随着温度升高发生糊化作用[20],导致饱和吸水量减少,与图1显示结果一致。
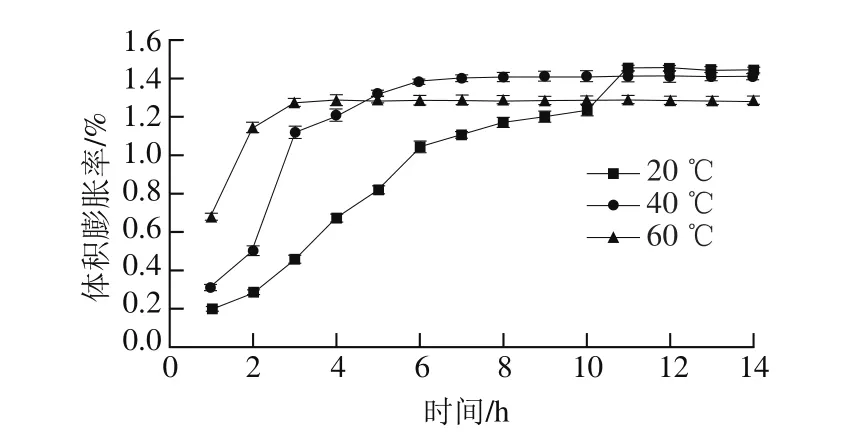
图3 绿豆浸泡过程中体积膨胀率的变化Fig. 3 Changes in volume expansion percentage of mung beans during hot water soaking
由图3可知,在20 ℃的浸泡条件下,11 h后体积膨胀率达到最大,为1.453%;在40 ℃的浸泡处理条件下,浸泡9 h体积膨胀率达到1.412%;60 ℃浸泡处理后4 h其体积膨胀率为1.286%。结果表明,在较高温度条件下水分容易进入绿豆内部,而温度过高的条件下绿豆体积膨胀率反而下降,与各因素对绿豆吸水率的影响趋势一致,表明绿豆体积膨胀率与绿豆吸水率之间呈正相关性。
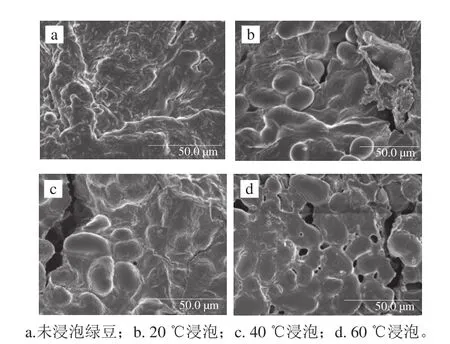
图4 绿豆浸泡前后的微观结构Fig. 4 Scanning electron microscope pictures of mung beans before and after hot water soaking
由图4a可知,在未吸水状态下,绿豆横切面为非光滑、凹凸褶皱表面,未见清晰肾形淀粉颗粒[21];图4b为绿豆处于20 ℃的浸泡处理状态,可见绿豆内部结构完整,淀粉由于吸水膨胀而呈现出清晰可见的肾形颗粒且表面光滑、未发生黏连,但当温度达到40 ℃以上时,由图4c、d可以看出绿豆内部结构发生破坏,内溶物流出,当温度过高时,就会使淀粉粒发生糊化,且温度越高糊化效果越强,淀粉之间黏连作用越强,颗粒清晰度越低,从而阻碍了绿豆的吸水[22-24]。
由实验结果可知,采用较高温度的水对绿豆进行浸泡软化处理虽能获得一定的效果,但耗时较长,为维持一定温度将产生较大能源消耗,不符合节能减排的生产模式,综合考虑最大饱和吸水率及最快复水时间,加热浸泡绿豆的最佳温度为40 ℃。
2.2 超声波、微波辅助浸泡处理对绿豆软化的影响
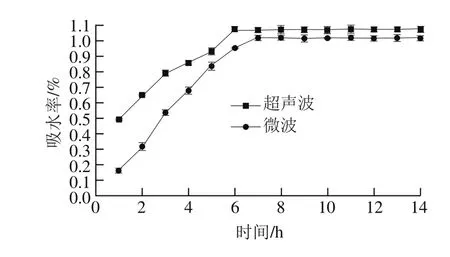
图5 超声波、微波辅助浸泡处理绿豆吸水率的变化Fig. 5 Changes in water absorption percentage of mung beans during soaking after ultrasonic and microwave pretreatments
由图5可知,超声波辅助浸泡处理绿豆在0~6 h内吸水率持续快速增长,6 h后达到平衡吸水饱和态,饱和吸水率为1.074%;微波辅助浸泡处理绿豆在0~7 h其吸水率进入快速增长状态,7 h后达到平衡吸水饱和态,饱和吸水率为1.018%。超声波辅助处理较微波辅助处理后绿豆饱和吸水时间提前了1 h。两种软化处理方法绿豆饱和吸水率相差不多。另外,超声波和微波辅助处理之后,随着浸泡时间的延长,绿豆吸水率逐渐升高直至饱和,这是由于超声波和微波辅助处理能够使种子内胚细胞膜的亚微观结构产生变化、发生不稳定性,促使种子吸水膨胀,增加种子的吸水能力[25],而微波辅助处理的破壁效果又远不及超声波,从而导致其饱和吸水率下降。
由图6可知,在1~4 h内,超声波、微波辅助浸泡处理绿豆的吸水动力学方程分别为yu=0.182x+0.001(R2=0.988,超声波)、ym=0.116x+0.081(R2=0.982,微波)。超声波、微波辅助浸泡处理绿豆吸水动力学模型具有很好的线性关系。超声波辅助处理时,k值为0.182;微波辅助处理时,k值为0.116。超声波、微波辅助浸泡处理时,k值随着浸泡温度的升高而增大,但超声波辅助浸泡处理其斜率k值较微波辅助处理更大,说明超声波辅助浸泡处理绿豆膨胀吸水效果更为明显,绿豆吸水速率更快,其原因可能是超声波的振动作用破坏了绿豆种皮的蜡质角质层结构,减少水分子进入绿豆籽粒内部的阻碍物含量,使水分快速渗透到绿豆籽粒中[26]。但其饱和吸水率低于常温浸泡下绿豆饱和吸水率,原因可能是超声波和微波辅助浸泡处理使绿豆内部结构发生改变,加速内溶物流出,部分淀粉发生糊化作用[27],从而抑制了绿豆的吸水速率,导致此种现象的产生。由图7可知,超声波辅助浸泡处理绿豆,6 h后体积膨胀率达到最大,为1.306%;在微波辅助浸泡处理条件下,浸泡7 h体积膨胀率达到1.290%。表明超声波辅助法更有效地促使绿豆吸水膨胀。从图8a可以看出,有众多饱满肾形突起,原因是由于超声波作用破坏了绿豆皮部分结构,加速了内部淀粉吸水作用;图8b中由于微波的快速加热作用导致绿豆内部结构被破坏,部分淀粉丧失吸水性能,使绿豆淀粉的边缘呈不清晰的状态。将超声波、微波处理应用于绿豆软化,所得饱和吸水率与其他方法相比较低,但能够大幅度缩短绿豆加工处理时间,提高工作效率。
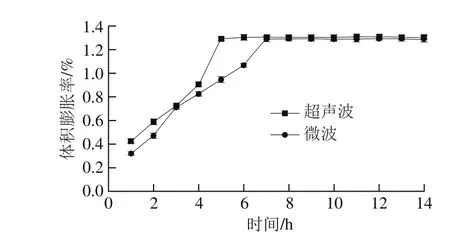
图7 超声波、微波辅助浸泡处理绿豆体积膨胀率的变化Fig. 7 Changes in volume expansion percentage of mung beans during soaking after ultrasonic and microwave pretreatments

图8 超声波、微波辅助浸泡处理绿豆的微观结构Fig. 8 Scanning electron microscope pictures of soaked mung beans with ultrasonic and microwave pretreatments bean by enzymatic method
2.3 化学法辅助浸泡处理对绿豆吸水率的影响
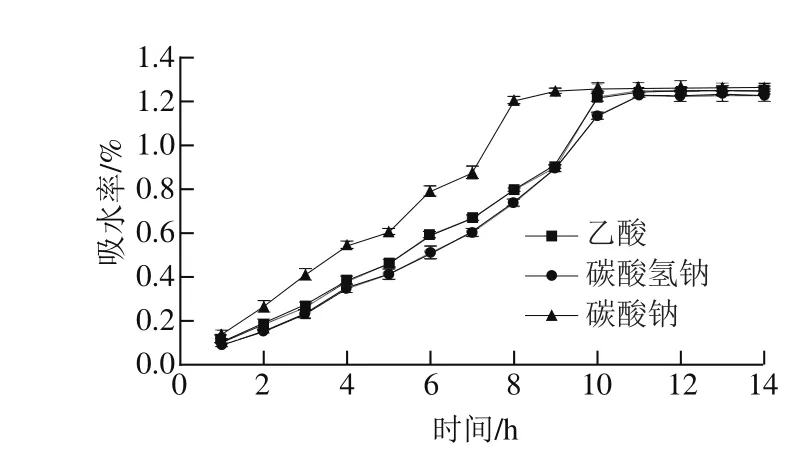
图9 不同化学法辅助浸泡处理绿豆吸水率的变化Fig. 9 Changes in water absorption percentage of mung beans during soaking after different chemical pretreatments
由图9可知,乙酸辅助浸泡处理绿豆在0~10 h内吸水率持续快速增长,10 h后达到平衡吸水饱和态,饱和吸水率为1.249%;碳酸氢钠辅助浸泡处理绿豆在0~10 h内吸水率持续快速增长,10 h后达到平衡吸水饱和态,饱和吸水率为1.227%;碳酸钠浸泡处理绿豆在0~9 h内吸水率持续快速增长,9 h后达到平衡吸水饱和态,饱和吸水率为1.265%。经过化学法辅助浸泡处理后的绿豆随着浸泡时间的延长其达到饱和吸水量的时间较普通常温浸泡法有所减少,碳酸钠浸泡效果更为明显。化学法辅助处理有利于提高绿豆种皮的通透性,从而加快绿豆吸水,缩短绿豆浸泡时间[28]。
由图10可知,在0~4 h内,化学法辅助处理后浸泡绿豆的吸水动力学方程分别为ya=0.029x+0.051(R2=0.963,乙酸)、ysb=0.036x+0.027(R2=0.838,碳酸氢钠)、ysc=0.057x+0.054(R2=0.957,碳酸钠)。乙酸、碳酸氢钠、碳酸钠辅助处理得到的绿豆吸水动力学模型具有很好的线性关系。此外,当使用乙酸辅助浸泡处理绿豆时,k值为0.029;当使用碳酸氢钠辅助浸泡处理绿豆时,k值为0.036;当使用碳酸钠辅助浸泡处理绿豆时,k值为0.057。不同的化学法辅助处理绿豆浸泡吸水速率的顺序是碳酸钠>碳酸氢钠>乙酸。
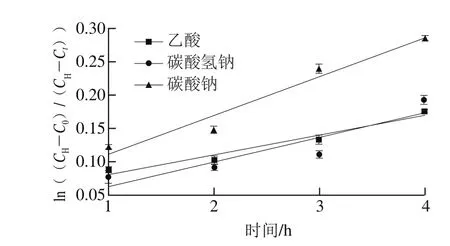
图10 不同化学法辅助浸泡处理绿豆吸水速率的变化Fig. 10 Changes in water absorption rate of mung beans during soaking after different chemical pretreatments
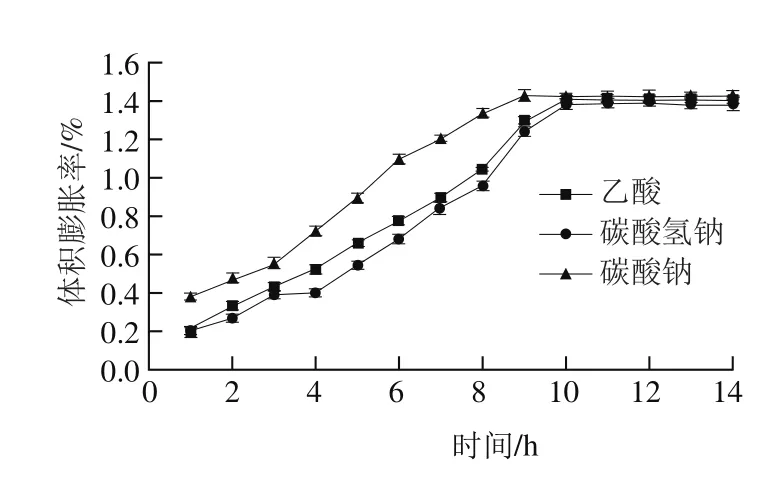
图11 不同化学法辅助浸泡处理绿豆体积膨胀率的变化Fig. 11 Changes in volume expansion percentage of mung beans during soaking after different chemical pretreatments
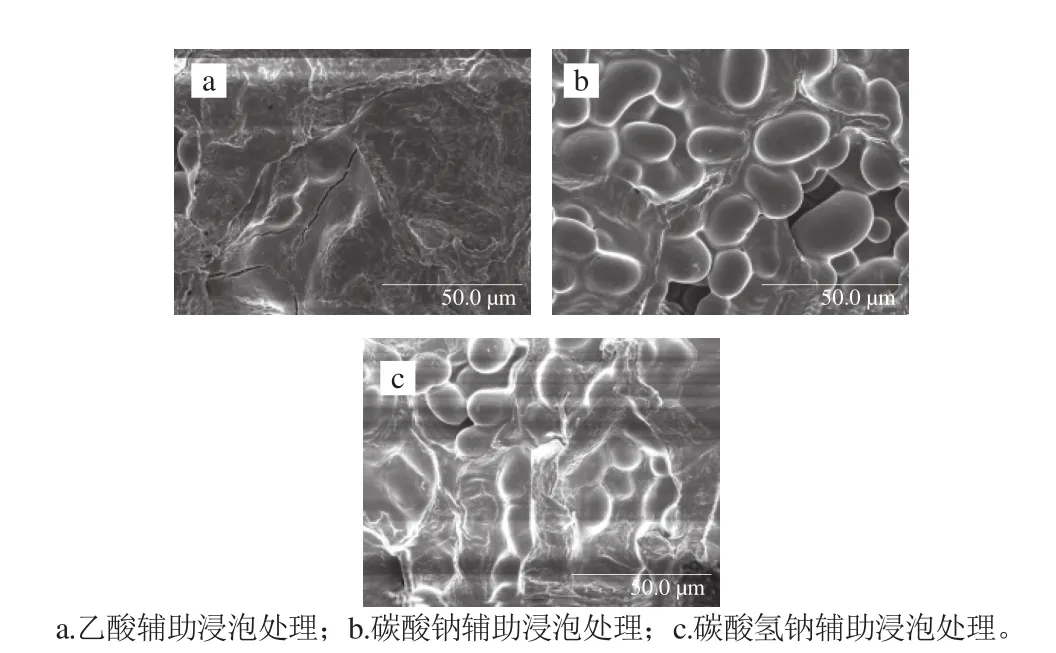
图12 不同化学法辅助处理绿豆的微观结构Fig. 12 Scanning electron microscope pictures of soaked mung beans with different chemical pretreatments bean by enzymatic method
由图11可知,在乙酸辅助浸泡绿豆的条件下,10 h后体积膨胀率达到最大,为1.408%;在碳酸氢钠辅助浸泡处理条件下,浸泡10 h体积膨胀率达到1.382%;在碳酸钠辅助浸泡处理绿豆的条件下,体积膨胀率在9 h达到最大,为1.427%。表明碳酸钠辅助法更有效地促使绿豆吸水膨胀,与绿豆的吸水率变化结果相符。图12b较图12a、c中淀粉颗粒更加圆滑饱满、完整,说明其吸水性较强,而其他两种处理方法次之。由实验结果可知,化学法辅助处理后浸泡软化绿豆,可以得到较高的饱和吸水率,但所需时间较长,且对所选溶剂安全性要求较高,必须为食品级。
2.4 酶法辅助浸泡处理对绿豆吸水率的影响
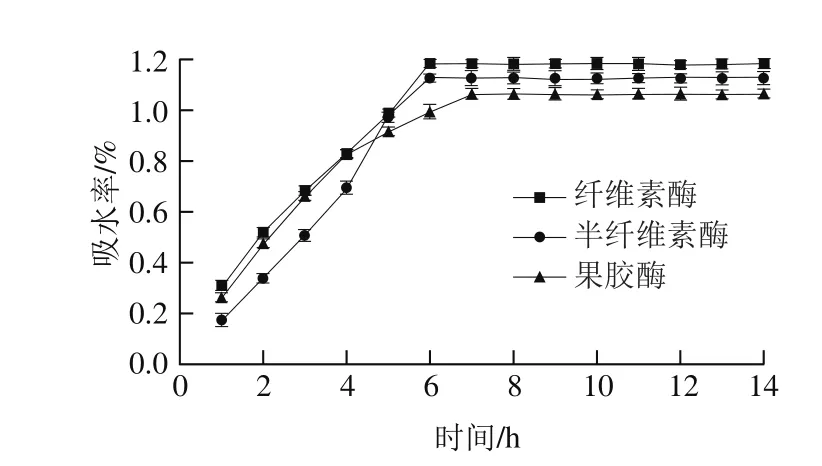
图13 酶法辅助浸泡处理绿豆吸水率的变化Fig. 13 Changes of soak-absorbing rate of mung beans by enzymatic method
由图13可知,纤维素酶处理后浸泡绿豆在0~6 h内吸水率持续快速增长,6 h后达到平衡吸水饱和态,饱和吸水率为1.183%;半纤维素酶处理后浸泡绿豆在0~6 h内吸水率持续快速增长,6 h后达到平衡吸水饱和态,饱和吸水率为1.126%;果胶酶处理后浸泡绿豆在0~7 h内吸水率持续快速增长,7 h后达到平衡吸水饱和态,饱和吸水率为1.064%。酶处理的绿豆随着浸泡时间的延长其达到饱和吸水量的时间较普通常温浸泡有所减少,原因可能是酶处理时,需要加热到酶的最适温度,加热时会导致部分内溶物溶出,造成绿豆内部结构发生变化,从而降低了吸水率。但从吸水效率角度看,酶处理后较大程度缩短了绿豆浸泡复水的时间,因为绿豆皮中含有75%左右的膳食纤维[29-30],而酶可以使绿豆皮表面的膳食纤维发生降解疏松,提高绿豆表面通透性,加快绿豆吸水。
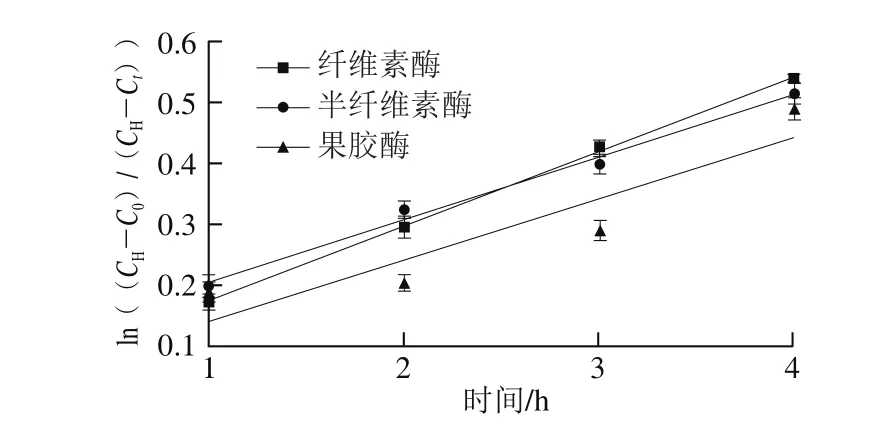
图14 酶法辅助浸泡处理绿豆吸水速率的变化Fig. 14 Changes of water-absorbing rate of mung beans by enzymatic method
由图14可知,在0~4 h内,酶处理后浸泡绿豆的吸水动力学方程分别为yc=0.122x+0.051(R2=0.999,纤维素酶)、yh=0.101x+0.103(R2=0.854,半纤维素酶)、yp=0.098x+0.002(R2=0.990,果胶酶)。纤维素酶、半纤维素酶、果胶酶处理绿豆吸水动力学模型具有很好的线性关系。当使用纤维素酶处理绿豆时,k值为0.122;当使用半纤维素酶处理绿豆时,k值为0.101;当使用果胶酶浸泡处理绿豆时,k值为0.098。不同酶处理绿豆浸泡其吸水速率顺序是纤维素酶>半纤维素酶>果胶酶。
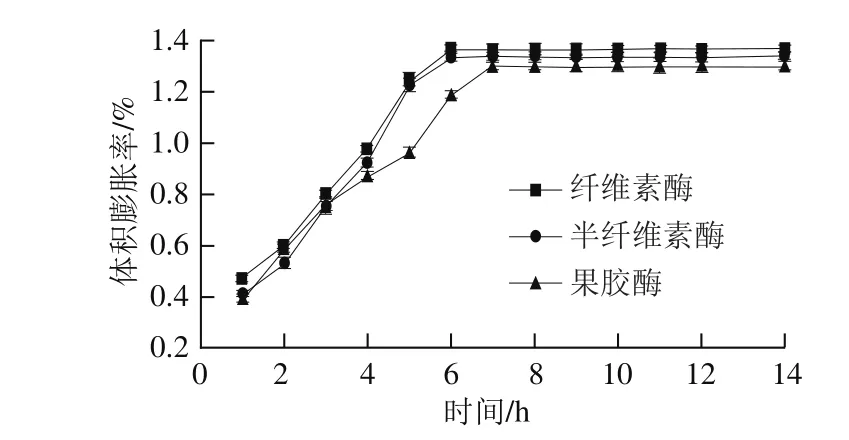
图15 酶法辅助浸泡处理绿豆体积膨胀率的变化Fig. 15 Changes of volume expansion rate of mung beans by enzymatic method bean by enzymatic method
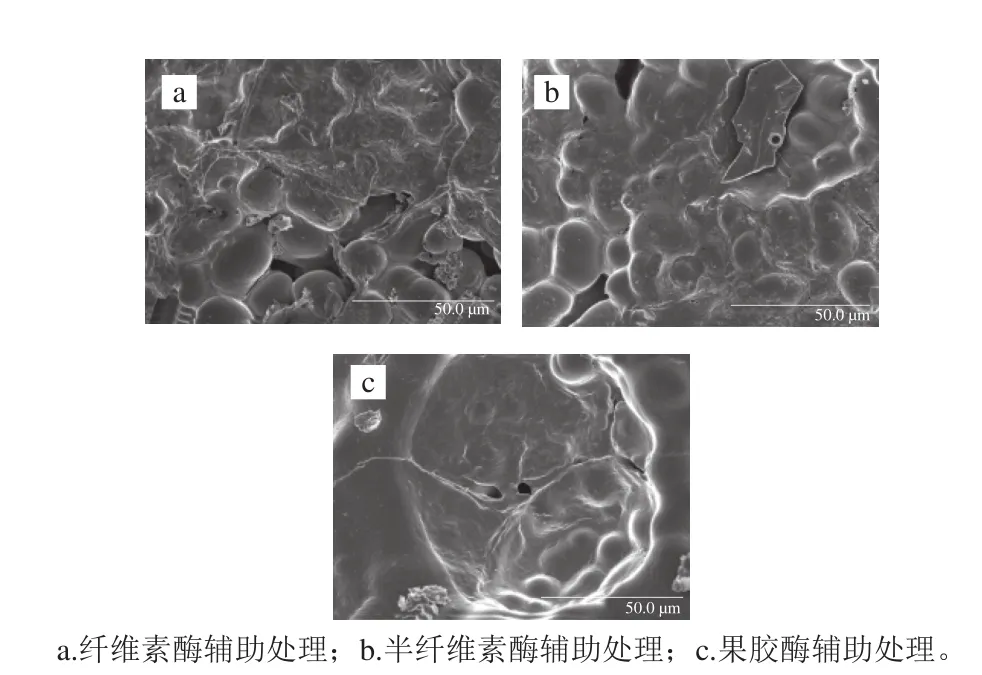
图16 酶法辅助浸泡处理绿豆的扫描电子显微镜图Fig. 16 Scanning electron microscope pictures of mung beans by enzymatic method
由图15可知,在纤维素酶辅助浸泡处理绿豆的条件下,6 h后体积膨胀率达到最大,为1.365%;在半纤维素酶辅助浸泡处理条件下,浸泡6 h体积膨胀率达到1.337%;果胶酶辅助浸泡处理后7 h其体积膨胀率为1.298%。图16a、b较图16c肾形颗粒的饱满程度及数量都更明显,可知纤维素酶及半纤维素酶辅助浸泡处理的绿豆吸水率更高,两者之间比较肾形颗粒数量无明显差异,但图16a绿豆饱满程度更高,与上述吸水率及膨胀率变化趋势相符。由实验结果可知,酶辅助处理后浸泡软化绿豆,均能够在较短的时间内达到饱和吸水率与膨胀率,从而提高工作效率。
3 结 论
绿豆随着浸泡时间延长以及温度的升高,吸水率呈现增长趋势,但随着温度的升高,绿豆的饱和吸水率明显降低,通过吸水动力学研究得到4 种方法的动力学方程为:1)不同温度浸泡处理:y20=0.056x+0.002(R2=0.945,20 ℃)、y40=0.235x+0.085(R2=0.978,40 ℃)、y60=1.057x+0.332(R2=0.983,60 ℃),其吸水速率顺序为60 ℃>40 ℃>20 ℃,在60 ℃时绿豆吸水速率最快,但其饱和吸水率下降。2)超声波和微波辅助浸泡处理:yu=0.182x+0.001(R2=0.988,超声波)、ym=0.116x+0.081(R2=0.982,微波),其吸水速率顺序为超声波>微波,即超声波辅助浸泡处理绿豆更有利于绿豆膨胀吸水。3)化学法辅助浸泡处理:ya=0.029x+0.051(R2=0.963,乙酸)、ysb=0.036x+0.027(R2=0.838,碳酸氢钠)、ysc=0.057x+0.054(R2=0.957,碳酸钠),其吸水速率顺序为碳酸钠>碳酸氢钠>乙酸,即碳酸钠处理绿豆吸水速率最快。4)酶法辅助浸泡处理:yc=0.122x+0.051(R2=0.999,纤维素酶)、yh=0.101x+0.103(R2=0.854,半纤维素酶)、yp=0.098x+0.002(R2=0.990,果胶酶),其吸水速率顺序为纤维素酶>半纤维素酶>果胶酶,纤维素酶处理绿豆可明显提高绿豆的吸水速率。
采用物理或化学法辅助浸泡处理均可以提高绿豆吸水速率,在短时间内达到绿豆复水软化目的。以绿豆达到饱和吸水率的时间来衡量绿豆浸泡复水工作效率,相比于20 ℃常温水浸泡绿豆,40 ℃水浸泡时间缩短18.18%,60 ℃浸泡时间缩短63.63%,超声波辅助处理浸泡时间缩短45.45%,微波辅助浸泡处理时间缩短36.36%,乙酸和碳酸氢钠辅助浸泡处理时间缩短9.09%,碳酸钠辅助浸泡处理时间缩短18.18%,纤维素酶和半纤维素酶辅助浸泡处理时间缩短45.45%,果胶酶辅助浸泡处理时间缩短36.36%。60 ℃条件下浸泡绿豆达到饱和吸水率最快,但需消耗大量能源,而且高温改变绿豆蛋白质及淀粉结构,影响绿豆的应用。超声波辅助浸泡处理处理省时、高效且节能环保,所应用设备也为基础设备。酶法辅助浸泡处理处理不仅省时、节能,而且所需酶种类较为简单,操作简便易行。但这两种方法的生产成本比常温浸泡要高,在实际生产中需要综合考虑。
本研究结果不但为绿豆食品加工时的绿豆浸泡复水处理提供有效方法,同时也为其他豆类食品加工时的高效浸泡复水提供了借鉴。
[1] 汪少芸. 绿豆生物活性物质的研究[D]. 福州: 福州大学, 2005: 1.
[2] 程须珍, 王素华. 中国绿豆小豆产业现状及发展对策[C]//中国绿豆产业发展与科技应用论文集. 北京: 中国农业科技出版社, 2002: 3-8.
[3] 曾志红, 王强, 林伟静, 等. 绿豆的品质特性及加工利用研究概况[J].作物杂志, 2011(4): 16-19. DOI:10.3969/j.issn.1001-7283.2011.04.004.
[4] 纪花, 陈锦屏, 卢大新. 绿豆营养价值及综合利用[J]. 现代生物医学进展, 2006, 6(10): 143-145. DOI:10.3969/j.issn.1673-6273.2006.10.048.
[5] 柴岩, 万富世. 中国小杂粮产业发展报告[M]. 北京: 中国农业科学技术出版社, 2007: 91-98.
[6] 江苏新医学院. 中药大词典[M]. 上海: 上海科技出版社, 2005: 2270-2274.
[7] 范媛媛, 李新华. 绿豆黄酮提取工艺研究[J]. 沈阳农业大学学报, 2005, 36(5): 619-622. DOI:10.3969/j.issn.1673-6273.2006.10.048.
[8] 张洪微, 冯传威. 绿豆皮膳食纤维提取的研究[J]. 农产品加工, 2006(7): 38-40. DOI:10.3969/j.issn.1671-9646-B.2006.07.011.
[9] 段佐萍. 绿豆营养价值及综合开发利用[J]. 农产品加工, 2005(2): 10-12. DOI:10.3969/j.issn.1671-9646-C.2005.02.033.
[10] SEFA-DEDEH S, STANLEY D W, VOISEY P W. Effect of soaking time and cooking conditions on texture and microstructure of cowpeas (Vigna unguiclata)[J]. Journal of Food Science, 1978, 43: 1832-1838. DOI:10.1111/j.1365-2621.1978.tb07426.x.
[11] KON S. Effect of soaking temperature on cooking and nutrition quality of beans[J]. Journal of Food Science, 1979, 44: 1329-1334. DOI:10.1111/j.1365-2621.1979.tb06432.x.
[12] HINCKS M J, McCANNEL A, STANLEY D W. Hard-to-cook defect in black beans soaking and cooking processes[J]. Journal of Agricultural and Food Chemistry, 1987, 35(4): 576-583. DOI:10.1021/ jf00076a034.
[13] SAMBUDI H, BUCKLE K A. Characteristics of winged bean (Psophocarpus trragonolobus) seeds during soaking and boiling[J]. Journal of Sciences and Food Agricultural, 1991, 57(4): 585-595. DOI:10.1002/jsfa.2740570411.
[14] 吴小勇, 曾庆孝, 田金河, 等. 绿豆的浸泡工艺及其对绿豆种子萌发的影响研究[J]. 食品工业科技, 2004, 25(2): 104-108. DOI:10.13386/ j.issn1002-0306.2004.02.025.
[15] 张娣, 赵英文, 戎晋华, 等. 加压提取槐米黄铜的动力学研究[J].食品科技, 2014, 39(4): 191-194.
[16] KOSTIĆ M D, JOKOVIĆ N M, STAMENKOVIĆ O S, et al. The kinetics and thermodynamics of hempseed oil extraction by n-hexane[J]. Industrial Crops and Products, 2014, 52(1): 679-686. DOI:10.1016/j.indcrop.2013.11.045.
[17] DONG Zhizhe, GU Feng, XU Fei, et al. Comparison of four kind of extraction techniques and kinetics of microwave-assisted extraction of vanillin from Vanilla planifolia Andrews[J]. Food Chemistry, 2014, 149: 54-61. DOI:10.1016/j.foodchem.2013.10.052.
[18] RODRÍGUEZ Ó, ORTUÑO C, SIMAL S, et al. Acoustically assisted supercritical CO2extraction of cocoa butter: effects on kinetics and quality[J]. The Journal of Supercritical Fluids, 2014, 94: 30-37. DOI:10.1016/j.supflu.2014.06.017.
[19] SCHWENKE K D, ZIRWER D, GAST K, et al. Changes of the oligomeric structure of legumin frame pea (Pisum sativuml) after succinylation[J]. European Journal of Biochemistry, 1990, 194(2): 621-627. DOI:10.1111/j.1432-1033.1990.tb15661.x.
[20] 赵思明, 熊善柏, 张升华. 淀粉老化动力学研究述评[J]. 农业机械学报, 2000, 31(6): 114-117. DOI:10.3969/j.issn.1000-1298.2000.06.035. [21] 王绍清, 王琳琳, 范文浩, 等. 扫描电镜法分析常见可食用淀粉颗粒的超微形貌[J]. 食品科学, 2011, 32(15): 74-79.
[22] 李积华, 黄茂芳, 钟业俊. 绿豆浸泡过程研究[J]. 食品科技, 2008, 33(11): 161-165. DOI:10.13684/j.cnki.spkj.2008.11.053.
[23] 吴小勇. 绿豆的浸泡工艺及其对绿豆种子萌发的影响[J]. 食品信息与技术, 2004(5): 24. DOI:10.13386/j.issn1002-0306.2004.02.025.
[24] 许鑫, 韩春然, 袁美娟, 等. 绿豆淀粉和芸豆淀粉理化性质比较研究[J].食品科学, 2010, 31(17): 173-176.
[25] 叶常丰, 戴心维. 种子学[M]. 北京: 中国农业出版社, 1994: 334-337. [26] 胡晋, 李永平, 胡伟民, 等. 种子生活力测定原理和方法[M]. 北京:中国农业出版社, 2009: 18-19.
[27] 许永亮, 程学勋, 陈建峰, 等. 大米淀粉的微波糊化特性研究[J]. 食品工业科技, 2006, 27(12): 98-100. DOI:10.3969/ j.issn.1002-0306.2006.12.029.
[28] 毕辛华, 戴心维. 种子学[M]. 北京: 中国农业出版社, 2002: 220-221.
[29] 王大为, 赵鑫, 董欣, 等. 发芽对绿豆皮膳食纤维结构及性质的影响[J].食品科学, 2016, 37(23): 111-117. DOI:10.7506/spkx1002-6630-2016.
[30] 于畅. 超声波辅助提取绿豆皮中色素和膳食纤维的研究[D]. 长春:吉林农业大学, 2012: 3-4.
Effects of Different Soaking Methods on Water Absorption Characteristics of Mung Bean
WANG Dawei, DONG Xin, ZHANG Xing, REN Huahua
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
The aim of this research was to explore the effects of different soaking methods namely, hot water soaking, and soaking in water at ambient temperature after ultrasonic and microwave pretreatments, and chemical and enzymatic pretreatments on the water adsorption percentage and volume expansion percentage of mung bean. At the same time, the internal microstructure of mung bean was observed by microstructure electron microscope and kinetic studies on the water absorption were carried out. The results showed that the water absorption percentage of mung bean increased reaching saturation as immersion time and temperature increased, but the saturated water absorption percentage was significantly reduced with increasing immersion time. The saturated water absorption percentages and expansion percentages with different soaking treatments were different. The water absorption kinetic equations for four soaking treatments were as follows: 1) hot water soaking at different temperatures: y20= 0.056x + 0.002 (R2= 0.945, 20 ℃), y40= 0.235x + 0.085 (R2= 0.978, 40 ℃), and y60= 1.057x + 0.332 (R2= 0.983, 60 ℃); 2) ultrasonic and microwave treatment: yu= 0.182x + 0.001 (R2= 0.988, ultrasonic treatment), and ym= 0.116x + 0.081 (R2= 0.982, microwave); 3) chemical treatment: ya= 0.029x + 0.051 (R2= 0.963, acetic acid), ysb= 0.036x + 0.027 (R2= 0.838, sodium bicarbonate), ysc= 0.057x + 0.054 (R2= 0.957, sodium carbonate); 4) enzymatic treatment: yc= 0.122x + 0.051 (R2= 0.999, cellulase), yh= 0.101x + 0.103 (R2= 0.854, hemicellulase), and yp= 0.098x + 0.002 (R2= 0.990, pectase). The results of kinetic studies showed that both physical and chemical treatments could increase the water absorption percentage of mung bean, and ultrasonic and enzymatic treatments could significantly shorten the soaking time.
mung bean; soaking treatment; water absorption percentage; water absorption kinetics
10.7506/spkx1002-6630-201713014
TS214.9
A
1002-6630(2017)13-0083-07
2017-01-21
国家高技术研究发展计划(863计划)项目(2011AA100805)
王大为(1960—),男,教授,博士,研究方向为粮油植物蛋白工程与功能食品。E-mail:xcpyfzx@163.com
王大为, 董欣, 张星, 等. 不同浸泡方法对绿豆吸水特性的影响[J]. 食品科学, 2017, 38(13): 83-89. DOI:10.7506/ spkx1002-6630-201713014. http://www.spkx.net.cn
WANG Dawei, DONG Xin, ZHANG Xing, et al. Effects of different soaking methods on water absorption characteristics of mung bean[J]. Food Science, 2017, 38(13): 83-89. (in Chinese with English abstract)
10.7506/spkx1002-6630-201713014. http://www.spkx.net.cn

