豌豆抗豌豆象育种及其综合防治研究进展
王昶,贺春贵,张丽娟,杨晓明*
(1.甘肃省农业科学院作物研究所,甘肃 兰州 730070;2.甘肃省农业科学院,甘肃 兰州 730070)
豌豆抗豌豆象育种及其综合防治研究进展
王昶1,贺春贵2,张丽娟1,杨晓明1*
(1.甘肃省农业科学院作物研究所,甘肃 兰州 730070;2.甘肃省农业科学院,甘肃 兰州 730070)
豌豆是重要的豆科经济作物,世界范围内均有种植,因其营养价值高深受人们喜爱。豌豆象是严重危害豌豆的害虫,全球普遍发生。豌豆象幼虫可蛀食籽粒超过50%的子叶部分,导致籽粒空瘪,发芽率降低,品质变差,商品价值丧失。豌豆象已成为严重制约豌豆产业健康持续发展的因素之一。豌豆栽培种中尚未发现可遗传的豌豆象抗性资源,然而在豌豆近缘野生种中发现了抗性资源,遗传研究表明3对隐性基因控制豆象抗性。α-淀粉酶抑制剂(α-amylase inhibitor,α-AI)和豌豆neoplastic pod(Np)基因突变体植株可有效减轻豌豆象危害。豌豆转基因抗虫育种虽然已获成功,但由于安全性问题,目前唯一有效的防治方法仍然是化学药剂的使用。为了解和掌握豌豆象最新研究前沿动态,促进豌豆象有效防治,本研究从豌豆象、豌豆抗豆象及豌豆象综合防治等3方面研究进展进行了综述。基于此,指出我国目前研究中存在的问题,并提出豌豆象、豌豆抗豆象育种及其综合防治领域未来的研究重点和方向。
豌豆;豌豆象;α淀粉酶抑制剂;Np突变体;抗豆象基因;防治
豌豆(Pisumsativum)为一年生攀援草本植物,自花授粉,二倍体(2n=2x=14),属豆科(Fabaceae),世界范围内均有种植,是世界第四大豆类作物[1]。据联合国粮农组织统计数据库(FAOSTAT)2014年数据[2]显示,世界干豌豆种植面积686.8万hm2,产量1133.3万t,主要生产国有加拿大、中国、印度、法国、澳大利亚。我国2014年干豌豆种植面积90.7万hm2,产量157.5万t,居世界第二位,仅次于加拿大。豌豆富含蛋白质和淀粉,是人类重要的食物来源,动物的优质饲料[3]。因其特殊的固氮效应,豌豆在轮作倒茬,改良土壤[4],改善生态环境及农业可持续发展等方面发挥着重要作用。
豌豆象(Bruchuspisorum)属鞘翅目(Coleoptera),豆象科(Bruchidae),是危害豌豆的昆虫中具有经济重要性的害虫之一[5-6],豌豆象在世界几乎所有豌豆种植区均有发生[7]。豌豆象是澳大利亚豌豆生产中最重要的害虫,其造成的产量损失可达40%[8]。在埃塞俄比亚豌豆象严重威胁豌豆生产,每年导致60%的产量损失[9]。据推测豌豆象在我国是抗战时期随着侵华日军马料传入,此后由于济荒调运粮食传播蔓延开来[10]。20世纪50年代在江苏北部[10]、陕西中部[11]、60年代在甘肃武威[12]、80年代在宁夏[13]、90年代在甘肃定西[14]等地豌豆象猖狂发生,给农户造成了严重的经济损失,一度导致豌豆播种面积锐减。“十二五”期间,国家食用豆产业技术体系对我国豌豆象的发生危害作了系统调查,发现豌豆象普遍发生,危害率在1%~85%之间,已严重制约了我国豌豆产业的健康持续发展,为此,国家食用豆体系将豌豆象的防控列为重点任务,开展了大量工作,取得了良好的效果。为了更好地掌握国内外研究动态和未来研究方向,本研究就豌豆抗豆象育种及其综合治理方面国内外研究进展进行综述和展望,以期为豌豆抗虫品种的培育和豌豆象综合治理提供参考和指导。
1 豌豆象研究进展
1.1 分布
豌豆象在世界广泛分布。豌豆象是和豌豆在长期协同进化过程中发展而来,中东肥沃新月地区(fertile Crescent)是其起源中心。由于人类的活动以及全球气候变暖等原因,豌豆象传播蔓延迅速,目前已在世界除南极洲外的其余六大洲发生[7](图1)。据文献报道,美国、智利[15-16]、西班牙、葡萄牙、塞尔维亚、中国[17]、南非和澳大利亚[18]豌豆象发生普遍,并且是豌豆生产中最难防治的害虫之一[19-20]。
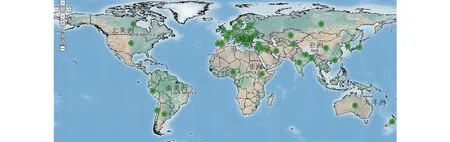
图1 豌豆象的世界分布Fig.1 Map of pea weevil (B. pisorum) distribution in the world 绿点代表该地区豌豆象发生。Green points indicate the districts of pea weevil occurrence. 来源:国际农业和生物科学中心(CABI)的植物智慧计划 (2014)。 Source: Plantwise from CABI(2014).
1.2 生物学特性
豌豆象一年发生1代,春天气温回升至16~20 ℃时,豌豆象成虫从树木、树叶、篱笆、杂物、仓库缝隙、豆粒内等越冬场所出现。豌豆象飞翔能力强,可飞越5 km远[21]。田间豌豆花开时成虫飞往田间采食花粉、花蜜。豌豆象雄虫冬眠后性成熟,但雌虫需要采食豌豆花粉后才能成熟[22]。有报道雌性豆象也采食其他非寄主植物的花粉[22-23],但更多学者认为豌豆是豌豆象所需花粉的唯一来源。雌性豆象到达豌豆田2~2.5周后开始产卵,第一次选择将卵产在花朵即将凋谢的鲜嫩豆荚上,其后选择任意大小的豆荚[21],但更倾向于在长度为10~20 mm豆荚表面产卵[8],但从不把卵产在豌豆干籽粒上[24]。雌虫产卵15~140粒,卵椭圆形、黄色,21 d左右成熟,孵化前两天在卵末端出现黑色的小点,幼虫孵化后在豆荚壁咬食一个大约0.2 mm的洞,穿过豆荚壁和种皮,蛀入未成熟的豆粒内部。尽管几头幼虫可以同时侵染一粒豌豆,但最终只有一头能够成活,并且完成生活史[25]。幼虫以子叶为食,经4~8周的时间,完成1~4龄幼虫的发育后在籽粒中化蛹,蛹期持续12~14 d[26]后羽化为成虫。豌豆象危害后在种子外部不易观察,但仔细检查会发现一个圆形的小窗口,其内是蛹或成虫,受到扰动或条件适宜时成虫从圆形窗口飞出,在种子上形成一个直径3 mm左右的洞口。
1.3 危害特性
豌豆象的危害主要发生在幼虫时期蛀食豌豆子叶造成。豌豆象单主寄生,危害豌豆,有学者认为可危害蚕豆(Viciafaba)和其他作物[27],不过后来得以纠正。豌豆象世界范围内的危害率为10%~90%[28]。豌豆象的危害主要发生在幼虫时期(1~4龄),幼虫能够蛀食籽粒30%~40%的子叶[29],收获后2~3个月可蛀食超过50%的子叶[30],豌豆象幼虫发育到4龄时对籽粒产生的危害最大[31]。
1.4 豌豆象的寄主选择性
植食性昆虫通过植物释放的挥发性化学物质作为信息物质寻找定位寄主植物[32-33],昆虫通过感官系统基于挥发性物质和接触-化学感应来评判寄主植物是否适合取食和产卵[34],而昆虫的取食和产卵行为可激发植物信息物质的释放[35]。
豌豆象在长期协同进化过程中同豌豆形成了相互适应机制。豌豆象通过感知豌豆的挥发物来判断、鉴别后选择其作为寄主植物进而完成取食、交配、产卵等一系列生命活动。豌豆各物候期挥发性物质鉴定主要为萜烯类(terpenes)和绿叶挥发物(green leaf volatiles,GLVs),但在不同物候期释放的挥发性物质的种类和数量不同[36]。豌豆在营养生长和开花阶段释放的挥发物浓度最高[37],花期释放的主要是萜烯类化合物,如α和β萜烯,这些单萜烯类物质可高度吸引甲虫。Ceballos等[36]通过Y型嗅觉仪测定发现豌豆花挥发物可吸引豌豆象成虫。嗅觉偏爱指数(olfactometric-preference index,OPI)反映了植物挥发性物质对昆虫刺激的效应,即昆虫对挥发性物质的偏好程度。Ceballos等[36]通过嗅觉测定获得的数据转换成OPI,发现豌豆象雌性和雄性成虫均偏爱豌豆花和荚的挥发物,但雌性表现出更强的偏好。触角电位图(electroantennography,EAG)测定表明,与雄性豆象(1.02 mV)相比,雌性豆象(1.35 mV)对豆荚挥发性物质表现出更大的EAG响应[36]。这可能是因为雌性昆虫需要找到适合的寄主为其后代提供更好的食物和栖居环境[38]。
2 豌豆抗豌豆象研究进展
2.1 豌豆象抗性测定和评价
豌豆对豌豆象的抗性测定有各种不同的方法。有学者将豌豆抗性分为:1)荚抗性(pod resistance):荚抗性(%)=100-(ep/p)×100,式中:ep为幼虫蛀入豆荚的刺孔数,p为放置在豆荚表面的卵粒数;2)荚壁/种皮抗性(pod wall/seed coat resistance):荚壁/种皮抗性(%)=100-(esc/ep)×100,式中:esc为种皮的刺孔数;ep为幼虫蛀入豆荚的刺孔数;3)种皮抗性(seed coat resistance):种皮抗性(%)=100-(ec/esc)×100,式中:ec为子叶刺孔数,esc为种皮的刺孔数;4)种子抗性(seed resistance)[39]:有3种方法可用来评价种子的抗性,一是用带有刺孔和出孔口种子所占比例来表示,另一种方法是用带有刺孔的种子赋予值“1”,没有刺孔的种子赋予值“0”来表示,最后一种方法是用带有出孔口的种子所占的比例来表示。Clement等[30]提出了种子损害评价分级标准(a seed damage rating scale,SDRS):SDR=1,子叶未被1龄幼虫采食;SDR=2,1龄幼虫接触子叶,但采食子叶<5%;SDR=3,2~4龄幼虫采食子叶≥5%;SDR=4,发育到预蛹阶段,对子叶产生较大程度的危害;SDR=5,发育到成虫阶段,伴有出孔口和出孔窗,产生实质性的危害。总的SDR≤2被认为具有豌豆象抗性。
Hardie等[8]提出了种子豆象抗性百分比(percentage pea weevil resistance in seeds,PWR)和种子损害率(seed damage rating,SDR),SDR测定方法要求解剖每一粒种子检查幼虫的发育程度,耗时耗力,相对麻烦,而PWR测定方法是通过快速检察种子上出孔口判断豆象的存在,这种方法得到了Redden等[40]及Fernandez等[41]的支持,后来这一方法也被用来测定绿豆象(Callosobruchuschinensis)抗性[42]。豌豆象侵染率百分比(percentage pea weevil infestation ratio)常作为豆象抗性指数用来评价豌豆种质的抗性[8,20],因其精准也被用作绿豆象[43]和四纹豆象(Callosobruchusmaculatus)[44]抗性测定。
2.2 豌豆抗豆象基因型鉴定与评价
作物栽培种与野生种在长期进化过程中形成了对昆虫不同的防御机制。在栽培种驯化过程中人们往往更多关注农艺性状而忽视了抗虫性,在缺乏昆虫压力条件下导致栽培种抗虫基因丧失。而野生种在进化过程中遵从优胜劣汰自然法则,易受昆虫侵染的个体被淘汰,而具有一定抗性水平的个体则存活下来,最终导致野生种群中抗性基因频率增加,驯化种群中抗性基因频率减少甚至丧失。野生种质资源中抗虫基因的存在为作物抗虫育种提供了基因源,育种家常利用富含抗性基因的野生种或野生近缘种来改良栽培种,这在西红柿(Lycopersiconesculentum)[45]、甜菜(Betavulgaris)[46]和小麦(Triticumaestivum)[47]等作物上已获成功。栽培作物改良的首要条件是抗性基因的获得。因此,对栽培种、野生种及野生近缘种等种质资源进行抗性基因的鉴定、评价和筛选显得尤为重要。豌豆种质资源对豌豆象的抗性鉴定始于20世纪70年代[16,30,39,48],但鲜有成功。Hardie等[48]利用4年时间在超过9个地点对1900份豌豆属(Pisum)种质进行了17个田间抗性鉴定试验,以种子危害百分率(percent seed damage,PSD)小于10%作为具有潜在抗性评判标准,结果只有19份属于豌豆近缘野生种(Pisumfulvum)的种质具有潜在抗性,其余1881份属于栽培豌豆(P.sativum)的种质全部淘汰。Teshome等[3]对来自埃塞俄比亚的602份豌豆种质资源连续两年利用田间和温室相结合的鉴定方法筛选出种子危害率小于40%的种质两份(32454和235002),PSD值分别为17%和33%。大量研究[6,16,30,48]证实栽培豌豆种质具有较低的抗性水平,而目前在栽培豌豆中还未发现可遗传豆象抗性[49]。有学者在栽培种中筛选出抗豆象豌豆品系,然而随后在智利、美国、澳大利亚的试验中证实这些品系不抵抗豌豆象的侵染[48]。在栽培种中及关联半野生亚种(associated semi-wild subspecies)中虽然没有发现可遗传的豆象抗性,但是在近缘野生种(P.fulvum)中发现了可遗传的豆象抗性[8,48]。研究发现采自以色列耶路撒冷以西2 km森林中(原代号Z708)[50]的豌豆近缘野生种(P.fulvum)“ATC113”对豌豆象表现出较好的抗性[8,30]。此后,围绕该抗性种质开展了大量的豆象抗性遗传规律、抗虫机制和抗虫基因鉴定的研究工作[51-53]。
2.3 豌豆抗豆象机理
2.3.1 α淀粉酶抑制剂 普通菜豆(Phaseolusvulgaris)种子中的α-淀粉酶抑制剂(α-amylase inhibitor,α-AI)对豆象科害虫具有较好的抑制效应。普通菜豆种子中至少含有α-淀粉酶抑制剂-1(α-AI-1)和α-淀粉酶抑制剂-2(α-AI-2)两种不同的α-AI[54]。前者广泛分布于大多数栽培种中[55-56],能够抑制绿豆象(C.chinensis)和四纹豆象(C.maculatus)中肠淀粉酶以及几种哺乳动物的淀粉酶,但对巴西豆象(Zabrotessubfasciatus)中肠淀粉酶无效[57]。α-AI-2存在于某些野生菜豆种质中,与α-AI-1的氨基酸有78%的一致性,但α-AI-2不能抑制哺乳动物的淀粉酶[58-59],却能够抑制巴西豆象中肠淀粉酶[58-60]。研究发现当有针对性地在食物中加入1%浓度的α-AI时对豆类仓储期两种重要害虫绿豆象和四纹豆象幼虫表现抑制效应[57],低浓度的α-AI-1对绿豆象表现抗性,而较高浓度则对四纹豆象和豌豆象均有抗性[61-62]。
菜豆中的α-AI基因已被转入栽培豌豆中成功用来防治豌豆象[54,62]。Schroeder等[62]用农杆菌介导法将普通菜豆种子编码α-AI的cDNA转入栽培豌豆中,由菜豆的另一种植物血凝素的启动子驱动表达,α-AI基因在转基因豌豆种子中稳定表达至T5代,T5代种子中豌豆象早期幼虫发育受阻;α-AI在该种子中积聚浓度达可溶性蛋白的3%,而这一水平比菜豆中正常含量还要高1%~2%;α-AI基因由来自种子特有的菜豆凝集素[bean PHA (dlec2)]基因的侧翼序列调控,它们的表达被限制在种子子叶和胚轴的位置,因此在转入α-AI基因的豌豆种子中豌豆象幼虫到达子叶后其早期幼虫(1或2龄)发育很快停止,与未转入α-AI基因的豌豆相比这些品系种子被害率明显降低。α-AI通过阻止豌豆象幼虫对种子中淀粉的消化,削弱和阻碍幼虫发育,导致其死亡[3]。α-AI-1可通过抑制1或2龄幼虫体内淀粉酶,阻止消化种子中淀粉而导致其死亡;但α-AI-2对豌豆象的抑制效应较小,仅仅延迟了大约30 d左右的幼虫发育时间,对总的死亡率没有影响[54]。
α-AI的抑制效应与豆象体内pH值密切相关。α-AI-1在pH值4.5~6.5范围内可抑制豌豆象80%的淀粉酶,而α-AI-2仅在pH值4.0~4.5范围内抑制40%的淀粉酶。基于a-AI表达的pH值范围不同,α-AI-1在温室和大田条件下与α-AI-2相比均对豌豆象表现出较高的抑制效应。因此,明确豆象肠道pH值,推测α-AI在该pH值条件下的抑制效应尤为重要。目前未有文献报道豌豆象消化道的pH值,但最近研究发现豆象科Bruchuidaeaffinis中肠的pH值是5.5~6.5,淀粉酶发挥活性的最佳pH值为5.5[63]。而研究发现α-AI-2在pH值5.5~6.5范围内的抑制效应很低,据此推测α-AI-2延缓豌豆象幼虫发育很可能是在豌豆象中肠pH值环境下淀粉酶活性部分被抑制所致[54],也有学者认为豌豆象很可能像其他昆虫一样拥有多种α-淀粉酶[64-65],这些淀粉酶不能全部被α-AI-2抑制[54]。
α-AI对大多数哺乳动物淀粉酶的抑制无效。用含有α-AI-1的转基因豌豆饲养老鼠,当食物中含30%的转基因豌豆时老鼠体重正常增加,对碳水化合物、氮代谢及内脏的生长无不良影响。而人类[66]食用α-AI-1蛋白(20世纪80年代在美国α-AI-1蛋白被用作减肥食品消费)后对碳水化合物的代谢也无影响。α-AI在哺乳动物中的失效可能由于以下几个因素:α-AI可能在胃液中失活[66];α-AI表达的最适pH值低于人类十二指肠中pH值[67];人类消化道中α-淀粉酶过量生产[68]。
2.3.2Np突变体 研究发现携带Neoplastic pod(Np)基因的豌豆突变体植株可有效减轻豌豆象的侵染危害。其作用机理为:1)Np基因型豌豆豆荚在雌性豌豆象产卵位置形成瘤状突起(neoplastic)(也有学者称之为愈伤组织,callus),使豆荚肿大变厚,延迟和阻碍了豆象幼虫穿透荚壁侵入籽粒蛀食危害[69-70];2)愈伤组织(callus)在死亡后随同附着在其上的卵一起掉落离开豆荚而减轻了豆象的侵染危害[69]。但多数情况愈伤组织死亡前大部分幼虫已经蛀入豆荚,因此,由Np基因型提供的抗性有限。
基于豆荚抗性的研究发现单个显性基因控制豆荚上瘤状突起。Nuttall等[71]在温室条件下用Np突变体和正常豌豆(正常豌豆植株作为花粉受体,Np突变体作为花粉供体)杂交,F1代植株豆荚表现瘤状突起。Doss等[70]以C887-332(Np/Np)和I3(np/np)杂交获得的F4代为试验材料,通过田间豌豆象自然侵染研究发现携带纯合隐性基因np/np豌豆种子侵染率为85.4%,而携带纯合显性基因Np/Np种子侵染率为62.2%。有研究发现在温室条件下通过避免紫外线照射Np基因型豌豆也可形成瘤状突起,Np基因型豌豆在大田和高粱(Sorghumbicolor)间作,因高粱的遮挡而减少了紫外线的照射可导致大约30%的豌豆豆荚瘤状突起形成[71],但在大田生产过程中通过抑制紫外线使豌豆植株表达Np基因形成豆荚瘤状突起是十分困难的[3]。携带Np基因的豌豆栽培种[70]和近缘野生种[72]豆荚瘤状突起是由于豆荚上豌豆象产卵部位受“Bruchins”物质刺激形成。“Bruchins”最初从四纹豆象上分离得到,是第一个从昆虫上分离出的天然产物,鉴定为单酯3-羟基丙酸(monoester of 3-hydroxypropanoic acid)和长链脂肪醇[a long-chain fatty alcohol (diol)]等化合物,这类化合物可导致细胞的去分化和有丝分裂,刺激细胞分裂[70]。豌豆象产卵刺激形成的瘤状突起来源于豆荚气孔复合体细胞[73],是豆荚气孔愈伤组织的产物[74]。由于豌豆豆荚保卫细胞周围的构造和茎叶组织中的差异[73-74],“Bruchins”不能诱导茎和叶组织形成瘤状突起。用“Bruchins”处理携带纯合的隐性np/np基因豌豆植株,豆荚变淡褐色,轻微肿胀,无瘤状突起的形成。“Bruchins”物质是植物防御反映的激发子,引发自发荧光,增加防御物质的水平。“Bruchins”物质处理激发了植物抗毒素(phytoalexin)、酚类防御化合物(phenolic defense compound)、豌豆素(pisatin)的积累表达[75-76]。关于“Bruchins”物质刺激和抑制紫外线导致Np基因型豌豆植株豆荚产生瘤状突起的不同机理,还有待深入研究。
2.3.3 豌豆生物学特性与豆象抗性 豌豆生物学特性与豆象抗性的关系并无确切的定论。有学者研究发现豌豆的花色[48]、籽粒颜色[49]和豆象的抗性没有必然关系。Peshoet等[16]发现花梗长度和豆象抗性呈负相关,花梗越短,对豆象抗性越高,解释为较短的花梗有利于花朵和豆荚在叶片和植株群体间隐藏,可避免豌豆象取食和产卵。但后来有学者发现当豌豆象种群密度较大时这一现象并不存在[48]。Teshome等[3]发现在埃塞俄比亚白色籽粒的豌豆相比其他颜色的更容易感染豆象,解释可能原因为:众多白色籽粒的豌豆是圆形的,圆形籽粒相对具有更多子叶,这保证了充足的豌豆象幼虫发育所需食物;其次,可能是与褶皱籽粒相比,圆形籽粒为豆象提供了更大的生存空间。豌豆象产卵对豆荚大小有选择性,豌豆象倾向于在扁平、饱满,长度为10~20 mm的豆荚表面产卵[8]。此外,豆荚和种子表面的蜡状物、绒毛、二氧化硅等物质也是阻碍豆象侵染的天然障碍物。鉴于此,在筛选、鉴定抗豆象种质时,应该更多地关注褶皱、绿色、褐色等特征的豌豆资源。
2.4 豌豆抗豆象基因的遗传分析
野生豌豆和栽培豌豆之间存在染色体不亲和性,但在实践中发现以野生豌豆为花粉供体,与栽培豌豆杂交可获得重组子代,这为野生豌豆抗豆象基因的遗传分析研究提供了可能的途径。2005年Bryne[51]通过对感豆象栽培种“Pennant”和抗豆象野生豌豆“ATC113”杂交获得的F2代种子的抗性检测发现符合1∶37∶26(抗、混合反映、感)和3基因遗传模式(1∶63),说明至少有3对隐性基因控制豆象抗性,通过分别测定F1代(n=7)和F2代(n=270)豆荚和种子抗性,确定抗豆象遗传位点位于子叶内,豆象的完全抗性是由3个隐性等位基因控制(pwr1,pwr2,pwr3),完全感性是由3个显性等位基因控制(PWR1,PWR2,PWR3)。2008年Byrne等[52]再次通过对Pennant/ATC113杂交获得的F2代豆荚和种子的危害率检测表明,豆荚抗性为数量遗传,具有越亲分离现象,豆荚抗性从F2代遗传到F3代已经很弱,但种子抗性能够从F2代连续遗传到F5代,并且通过回交能够成功转入新的群体中,基于F2群体的63∶1的分离比例证明了3基因模式,提出完全抗性由3个成对隐性等位基因(pwr1pwr1)、(pwr2pwr2)和(pwr3pwr3)控制,中抗到高抗植物至少含有1个显性等位基因(pwr1pwr1)、(PWR2-)、(pwr3pwr3),中感到高感至少含有2个显性等位基因(PWR1-)、(PWR2-)、(pwr3pwr3),完全感性则是由3个显性等位基因(PWR1-)、(PWR2-)、(PWR3-)控制。
2.5 豌豆抗豆象基因遗传图谱构建和分子标记
现代分子生物学的不断发展,为豌豆抗豌豆象基因的研究提供了新的途径。近年来,通过分子标记技术发掘了许多抗豆象基因与主效QTL(quantitative trait locus),为抗性基因的发掘与利用、分子标记辅助选择抗虫育种奠定了基础。2014年澳大利亚学者Aryamanesh等[53]首次在豌豆属(Pisum)种质资源中用QTL检测到抗豆象基因,他们利用抗豆象近缘野生种ATC113(PI 595933) (P.fulvum)和感豆象栽培种Pennant(P.sativum)杂交,对获得的270个F2群体采用SSR分子标记技术对豆粒子叶、豆荚壁/种皮、豆荚壁抗性研究表明,3个主效的QTL基因定位在连锁群LG2、LG4和LG5上,这3个主效基因解释子叶抗性表型变异率为80%;2个主效QTL基因定位在连锁群LG2和LG5上,解释了豆荚壁/种皮抗性表型变异率为70%;对子叶和豆荚壁/种皮抗性的QTL共线性分析结果表明,这两个性状的抗性机制可能存在共同的信号调控途径,仅仅1个主效QTL基因定位在连锁群LG7,解释了豆荚壁抗性表型变异率为9%。Bryne[51]2005年通过对感豆象栽培种“Pennant”和抗豆象近缘野生豌豆“ATC113”杂交构建F3群体,用AFLP标记(amplified fragment length polymorphisms)探寻亲本及F3抗感后代多态性,通过约束最大似然法(restricted maximum likelihood,REML)分析确定13个与豌豆象抗性相关的AFLP标记以及23个与豌豆象感性相关AFLP标记的统计显著性,主成分分析(principal coordinate analysis,PCO)显示AFLP标记位点在PCO的空间形成聚类,显示可能存在3个基因位点。8个AFLP标记被克隆、测序并转换成序列特征性扩增区域标记(sequence characterized amplified regions,SCAR),两个SCAR标记,SC47359和SC47435在抗性亲本与感性亲本之间具有多态性,这两个标记都与抗性后代及30%~36%的感性后代共分离。
2.6 豌豆抗豌豆象育种
利用抗性品种防治病虫害是最简便、经济、有效和绿色的方法,而利用野生种或近缘种进行远缘杂交和基因渗入改良作物是进行抗性育种的有效途径。在前期豌豆资源抗豆象鉴定的基础上,多位学者已将野生豌豆的抗豆象基因[20,49]、菜豆中的α-淀粉酶抑制基因[54,62]分别成功转入栽培豌豆中用来防治豌豆象,但关于转基因豌豆的安全性一直存在争议,导致转基因豌豆品种应用受阻。有学者研究发现用含有α-淀粉酶抑制剂的转基因豌豆饲喂老鼠后引发肺炎[77]。因此,有人指出转基因豌豆不适宜人类的消费和动物的饲养[78]。此外,由于近缘野生豌豆具有种子黑色柔软、无限生长[50,79]、豆荚上卷和种子弹射[80]等习性,这些不良性状会因为连锁被转入栽培豌豆中而不受欢迎。
总之,由于转基因豌豆的健康安全问题,不同环境条件下基因的表达差异[81],不良性状的连锁以及消费者对转基因豌豆的认知和接受能力等诸多因素限制了转基因豌豆的发展,使得转基因豌豆商业化应用困难[78]。
3 豌豆象综合防治研究进展
豌豆象综合防治策略(integrated pest management,IPM)包括物理防治、化学防治、应用栽培措施、天敌和抗虫品种等多种措施。
3.1 栽培措施
栽培措施因简便、绿色、环保的特点在农作物病虫害防治中发挥着重要的作用,但实践证明栽培措施对豌豆象的防效有限。在澳大利亚通过适时早播、补种、早收和轮作等栽培措施防治豆象均表现出较低的防效,不过早播、早收、收获后放牧采食残茬、侵染的种子及幼虫,可有效减少来年豆象的种群数量和危害程度[3,82]。由于豆象具有飞翔性,同一地区农民能否协作防治是影响栽培措施防效大小的关键。
栽培与其他措施(如抗性品种)结合能达到较好的防效。利用不同品种混种可有效抑制害虫的发生[83-84],其作用机理在于不同基因型品种混种产生的补偿和增效作用抵抗了生物和非生物胁迫[85],例如,选择基因型品种与间作和轮作结合,则寄主植物的中等抗性会得到加强,这为我们防治豆象提供了一种新的思路。
3.2 物理防治
物理防治是指采用物理的方法消灭害虫或改变其物理环境,创造一种对害虫有害或阻隔其侵入的一种方法[86],研究显示物理防治可有效灭杀豌豆象幼虫、减轻危害。高温灭虫是物理防治害虫常用的方法之一,其作用机理是持续高温使昆虫体内蛋白质变性失活,破坏酶系统而使有机体的生理功能紊乱,最终导致死亡[87]。夏季太阳直射温度达50 ℃左右时,几乎对所有储粮害虫都有致死作用[87]。豌豆收获后,选择晴天,将豌豆置于阳光下暴晒,当温度达到50 ℃左右,持续8 h,豌豆象幼虫因不耐高温而死亡[88]。开水烫种法因操作简便,防效好,早在20世纪50年代就在我国湖北地区被广泛应用[17]。开水烫种法是将豌豆种子置于容器中,以热开水冲烫,用水量以覆盖豆种为宜,持续时间20~30 s,烫种后滤水晒干。开水烫种时间把握至关重要,时间过短防效较低,时间过长影响发芽,最好控制在20~30 s。此外,还可以通过气调法、辐射法、微波法等措施进行防治,但对农户来说这些方法操作相对复杂,成本过高,不宜实施。
3.3 化学防治
目前为止,豌豆象在世界范围内唯一有效的防治方法是田间杀虫剂的喷施和储藏期化学药剂的熏蒸[49]。田间喷施杀虫剂仅对成虫有效,对豆荚表面的卵和籽粒内的幼虫无效[51],因此,在田间豆象成虫产卵前通过灭杀抑制其虫口密度,减少卵和幼虫数量是防治豆象唯一有效的途径[18]。豌豆象成虫采食花粉花蜜后才能交配产卵,因此,田间豌豆开花期喷施杀虫剂对豆象防效至关重要。
在澳大利亚,Horne等[28]分别以每hm2有效成分40 g氯氰菊酯(cypermethrin)和350 g硫丹(endosulfan)药剂单独喷施,豆象危害率从未喷施的11%减少到4%,以每hm2有效成分340 g灭多威(methomyl)和有效成分40 g的氰戊菊酯(fenvalerate)喷施,危害率分别降为6%和8%,通过室内实验进一证实氯氰菊酯是豌豆象最有效的杀虫剂。豆象的虫态、大小和持续时间决定了喷施药剂的种类和数量[48]。豌豆象的侵染危害能持续几周,而许多化学药剂最长药效期为7 d,因此,田间需多次喷施才能达到较好的防效。
储藏期豌豆籽粒内豆象可通过化学药剂熏蒸灭杀[51]。化学药剂熏蒸能显著减少豌豆籽粒上的豆象虫孔数量[82]。豌豆成熟后及时收获,豆象蛀食最大仅能造成26%的种子重量损失,其余74%的损失由储藏期豌豆象幼虫在种子内蛀食危害(至少蛀食两个月以上)造成。因此,储藏期种子重量损失完全可以通过收获后及时熏蒸而挽回。熏蒸越及时损失越小,成熟后1周收获熏蒸处理与成熟后2、3和4周收获处理相比产量损失最低[82]。
化学杀虫剂长期、不合理使用容易产生环境污染和抗药性[89],且价格昂贵,特别增加了农民经济负担[49]。因此,开发和研制防效高、环境友好、价格低廉的生物农药是今后豆象防治的研究热点。
3.4 生物防治
利用天敌防治农田作物害虫是生物防治最重要的方法,应在生产实践中大力倡导。豌豆象天敌种类较多,如小黄蜂(Chalcidoidwasps)[90]、Uscanasenex[91]、U.chiliensissp.nov[92]、Triaspisthoracicus[21,90]、Eupteromalusleguminis和Microdontomerusanthonomi,这些天敌都是豌豆象幼虫或蛹的拟寄生物。Annis等[90]研究发现虽然Chalcidoidwasps通过豆象羽化孔能进出豆粒中,却不能有效防治豆象。T.thoracicus可寄生田间豆荚上豌豆象的卵[90]。澳大利亚联邦科学与工业研究组织(CSIRO)从法国引进了T.thoracicus来防治豌豆象,但因其不能在澳大利亚越冬而宣告失败[93]。在过去,生物防治豆象很少被重视,因此,全面系统研究这些天敌防治豌豆象的作用、效果和机理显得尤为重要[24]。
4 展望与讨论
豌豆作为豆科重要的经济作物,可粮、菜、饲兼用,被称作“三营养作物”,即营养人类、营养畜禽、培肥地力。豌豆因其适应性强、用途广泛、营养价值高、经济效益好而深受人们喜爱,在改善人们膳食结构和可持续农业发展方面发挥了重要作用。豌豆象严重危害豌豆,因其完全变态发育的特点,再加之生活环境多变、危害时间长,其防治十分困难。各国学者围绕豌豆象[21-22,36]、豌豆抗豌豆象种质资源的筛选与鉴定[16,30,39,48-50]、抗性遗传及抗性基因的挖掘与分子定位[51-53]、抗豌豆象育种[20,49,54,62]和豌豆象综合防治[17,28,82,93]等方面开展了大量工作,取得了阶段性成果。
豌豆在我国是小宗作物,长期以来不受重视,与大宗作物相比,研究基础相对薄弱。目前,在我国关于豌豆抗豌豆象育种及豌豆象综合防治方面的研究鲜有报道,且仅有的研究还停留在20世纪豌豆象的调查和简单防治方面[10-12,17]。时过境迁,21世纪豌豆象在我国发生十分猖獗(如在甘肃定西、临夏危害率达65%以上,严重地块达80%以上),导致豌豆播种面积锐减,严重制约豌豆产业的健康持续发展。因此,加强豌豆象、豌豆抗豌豆象育种及豌豆象综合防治方面的研究,非常紧迫,势在必行。基于此,我们应加大人力、物力和财力的投入力度,提高研究水平,从基础理论和应用实践两个层面做好豌豆象及其综合防治研究工作,力争解决好我国豌豆产业发展的瓶颈问题。
综上所述,豌豆作为一种重要的豆科作物,在农业可持续发展中发挥着重要的作用。豌豆象作为危害豌豆最严重的害虫,其防治刻不容缓。为了今后的研究更有靶向性,在分析国内外研究现状的基础上,我们提出今后研究工作的重点: 1)我国地缘辽阔,气候类型多样,豌豆种质资源丰富,但对这些种质资源的抗性鉴定鲜见,加强我国地方豌豆资源的豌豆象抗性鉴定,充分挖掘潜在的抗虫基因,为抗虫新种质的创制创造条件;2) “Bruchins”物质刺激和抑制紫外线导致Np基因型豌豆植株豆荚产生瘤状突起的不同机理未能很好解释,有待深入研究;3)α-淀粉酶的表达与pH值密切相关,目前未有豌豆象消化道pH值的报道,探明豌豆象消化道的pH值对解析α-淀粉酶对豌豆象的抑制机理与效应至关重要;4)信息化学物质,如利他素(kairomones)、性信息素(sex pheromones)[94]等可用来检测和诱捕防治豌豆象,但鲜有信息化学物质用于豌豆象防控方面的研究,加强研究会有现实意义;5)过去生物防治豆象被忽视,随着人们环保和生态意识的提高,今后利用天敌防治豌豆象将成为研究者关注的焦点;6)化学杀虫剂的应用是目前防治豌豆象唯一有效的方法,但面临环境污染、抗药性产生和成本过高的问题,研制高效、环保、低廉的生物农药是今后豆象防治的发展趋势;7)通过杂交或转基因方法利用近缘野生种、Np突变体、α-淀粉酶抑制基因等创制抗豆象新种质时,利用现代分子生物学手段尽量摒弃亲本的不良性状,创制品质好、性状优、抗性强的种质;8)加强转基因豌豆的安全评估,提高消费者对转基因的认知水平,使得含有α-淀粉酶抑制剂的转基因豌豆早日商业化应用。
References:
[1] FAO. FAOSTAT Database[DB/OL]. 2010 [2016-08-08]. http: //www.fao.org/faostat.
[2] FAO. FAOSTAT Database[DB/OL]. 2014 [2016-08-08]. http: //www.fao.org/faostat.
[3] Teshome A, Mendesil E, Geleta M,etal. Screening the primary gene pool of field pea (PisumsativumL.) in Ethiopia for resistance against pea weevil (BruchuspisorumL.). Genetic Resources and Crop Evolution, 2015, 62(4): 525-538.
[4] Messiaen C M, Seif A A, Jarso M,etal.PisumsativumL.[DB/OL]//Brink M, Belay G. Record from PROTA4U. (2013-11-18) [2016-08-08]. http://www.prota4u.org/search.asp.
[5] Sharma H C, Srivastava C P, Durairaj C,etal. Pest management in grain legumes and climate change[M]//Yadav S S, McNeil D L, Redden R,etal. Climate Change and Management of Cool Season Grain Legume Crops[M]. Berlin: Springer, 2010: 115-139.
[6] Ali K, Chichaybelu M, Abate T,etal. Two decades of research on insect pests of grain legumes[C]//Tadesse A. Increasing Crop Production Through Improved Plant Protection. Addis Ababa: Plant Protection Society of Ethiopia (PPSE) and EIAR, 2008: 38-84.
[7] Plantwise.BruchuspisorumDistribution Map[DB/OL]. (2014-01-22) 2016-08-08. http://www.plantwise.org/KnowledgeBank.
[8] Hardie D, Clement S. Development of bioassays to evaluate wild pea germplasm for resistance to pea weevil (Coleoptera: Bruchidae). Crop Protection, 2001, 20(6): 517-522.
[9] Teka W. The importance and distribution of pea weevil (Bruchuspisorum) in the Amhara region[C]//Proceedings of a National Workshop on the Management of Pea Weevil (Bruchuspisorum). Ethiopia: Bahir Dar Press, 2002: 25-27.
[10] Xu Z D. Various measures of control the pea weevil and broad bean weevil by farmers in Northern Jiangsu Province. Scientia Agricultura Sinica, 1952, 7: 28-29. 徐忠谠. 苏北农民防治蚕豆象和豌豆象的各种措施. 中国农业科学, 1952, 7: 28-29.
[11] Zhu X S. The studies on pea weevil investigation and its control in North Western China. Acta Entomologica Sinica, 1955, 5(1): 105-114. 朱象三. 北区豌豆象调查与防治的研究. 昆虫学报, 1955, 5(1): 105-114.
[12] Shou Z B. Occurrence and verification in Wuwei district. Plant Protection, 1965, 3(3): 112. 首章北. 武威地区豌豆象的发生与检验. 植物保护, 1965, 3(3): 112.
[13] Xie C J. Determination of the egg development temperature threshold and effective accumulated temperature of pea weevil. Plant Quarantine, 2003, 17(4): 220-223. 谢成君. 豌豆象卵发育起点温度和有效积温测定. 植物检疫, 2003, 17(4): 220-223.
[14] Lian R F, Wang M C, Mo J P. Occurrence and control of pea weevil in Dingxi city of Gansu. Gansu Agricultural Science and Technology, 2008, 10: 59-60. 连荣芳, 王梅春, 墨金萍. 豌豆象在定西市的发生与防治. 甘肃农业科技, 2008, 10: 59-60.
[15] Brindley T A. Some notes on the biology of the pea weevilBruchuspisorumL.(Coleoptera, Bruchidae) at Moscow, Idaho. Journal of Economic Entomology, 1933, 26(6): 1058-1062.
[16] Pesho G R, Muehlbauer F J, Harberts W H. Resistance of pea introductions to pea weevil. Journal of Economic Entomology, 1977, 70(2): 30-33.
[17] The Luotian Field Crop Disease and Insect Pests Forecast Station. Biology and control of the pea weevil in Luotian, Hubei. Acta Entomologica Sinica, 1966, 15(4): 288-293. 罗田县农作物病虫预测预报站. 湖北罗田豌豆象的生物学和防治. 昆虫学报, 1966, 15(4): 288-293.
[18] Clement S L, Wightman J A, Hardie D C,etal. Opportunities for integrated management of insect pests of grain legumes[M]//Knight R. Linking Research and Marketing Opportunities for Pulses in the 21st Century. Dordrecht: Kluwer Academic Publishers, 2000: 467-480.
[19] Girsch L, Cate P C, Weinhappel M. A new method for determining the infestation of field beans (Viciafaba) and peas (Pisumsativum) with bean beetle (Bruchusrufimanus) and pea beetle (Bruchuspisorum), respectively. Seed Science and Technology, 1999, 27: 377-383.
[20] Clement S L, McPhee K E, Elberson L R,etal. Pea weevil,BruchuspisorumL. (Coleoptera: Bruchidae), resistance inPisumsativum×Pisumfulvuminterspecific crosses. Plant Breeding, 2009, 128(5): 478-485.
[21] Brindley T A, Chamberlin J C, Schopp R. The pea weevil and methods for its control[M]//Farmers’ Bulletin. Washington: US Department of Agriculture, 1956: 1-24.
[22] Pesho G R, van Houten R J. Pollen and sexual maturation of the pea weevil (Coleoptera: Bruchidae). Annals of the Entomological Society of America, 1982, 75(4): 439-443.
[23] Annis B A, O’Keeffe L E. Response of twoLathyrusspecies to infestation by the pea weevil,BruchuspisorumL. (Coleoptera: Bruchidae). Entomologia Experimentalis Et Applicata, 1984, 35(1): 83-87.
[24] Amosa E M. Evaluation of Plant Resistance in Field Pea by Host Plant Choice Behaviour of Pea Weevil (BruchuspisorumL.): Implications for Pest Management[D]. Alnarp: Swedish University of Agricultural Sciences, 2015: 1-43.
[25] Smith J H, O’Keeffe L E, Muehlbauer F J. Methods of screening dry peas for resistance to the pea weevil (Coleoptera:Bruchidae): variability in seed infestation levels. Journal Economic Entomology, 1982, 75: 530-534.
[26] Brindley T A, Chamberlin J C. The pea weevil[C]//Yearbook of Agriculture 1952. Washington: U.S. Department of Agriculture, 1952: 530-537.
[27] Al-Rawy M A, Kaddou I K. Pea weevil,Bruchuspisorum(L.) (Coleoptera, Bruchidae) infestingViciafabaL. in Iraq. Acta Entomologica Bohemoslovaca, 1971, 68(6): 365-371.
[28] Horne J, Bailey P.BruchuspisorumL. (Coleoptera, Bruchidae) control by a knockdown pyrethroid in field peas. Crop Protection, 1991, 10(1): 53-56.
[29] Makasheva R K. The Pea[M]. New Delhi, India: Oxonian Press, 1983.
[30] Clement S L, Hardie D C, Elberson L R. Variation among accessions ofPisumfulvumfor resistance to pea weevil. Crop Science, 2002, 42(6): 2167-2173.
[31] Smith A M. Pea weevil (BruchuspisorumL.) and crop loss implications for management[M]//Fujii K, Gatehouse A M R, Johnson C D,etal. Bruchids and Legumes: Economics, Ecology and Coevolution. Dordrecht: Kluwer Academic Publishers, 1990: 105-114.
[32] Visser J H. Host odor perception in phytophagous insects. Annual Review of Entomology, 2003, 31(1): 121-144.
[33] Bruce T J A, Wadhams L J, Woodcock C M. Insect host location: a volatile situation. Trends in Plant Science, 2005, 10(6): 269-274.
[34] Bernays E A, Chapman R E. Host-plant Selection by Phytophagous Insects[M]. New York: Chapman & Hall, 1994.
[35] Schoonhoven L M, van Loon J J A, Dicke M. Insect-plant Biology[M]. Oxford: Oxford University Press, 2005.
[36] Ceballos R, Fernández N, Zúiga S,etal. Electrophysiological and behavioral responses of pea weevilBruchuspisorumL. (Coleóptera: Bruchidae) to volatiles collected from its hostPisumsativumL. Chilean Journal of Agricultural Research, 2015, 75(2): 202-209.
[37] Dudareva N, Pichersky E, Gershenzon J. Biochemistry of plant volatiles. Plant Physiology, 2004, 135(4): 1893-1902.
[38] Paukku S, Kotiaho J S. Female oviposition decisions and their impact on progeny life-history traits. Journal of Insect Behavior, 2008, 21(6): 505-520.
[39] Simmonds M S J, Blaney W M, Birch A N E. Legume seeds: the defence of a wild and cultivated species ofPhaseolusagainstattack by bruchid beetles. Annals of Botany, 1989, 63: 177-184.
[40] Redden R J, McGuire J. The genetic evaluation of bruchid resistance in seed of cowpea. Australian Journal of Agricultural Research, 1983, 34(6): 707-715.
[41] Fernandez G C J, Talekar N S. Genetics and breeding for bruchid resistance in AsiaticVignaspecies[M]//Fujii K, Gatehouse A M R, Johnson C D,etal. Bruchids and Legumes: Economics, Ecology and Coevolution. Dordrecht: Kluwer Academic Publishers, 1990: 209-217.
[42] Young N D, Kumar L, Menancio-Hautea D,etal. RFLP mapping of a major bruchid resistance gene in mungbean (Vignaradiata, L. Wilczek). Theoretical and Applied Genetics, 1992, 84(7): 839-844.
[43] Souframanien J, Gupta S, Gopalakrishna T. Identification of quantitative trait loci for bruchid (Callosobruchusmaculatus) resistance in black gram [Vignamungo(L.) Hepper]. Euphytica, 2010, 176(3): 349-356.
[44] Fatunla T, Badaru K. Inheritance of resistance to cow-pea weevil (Callosobruchusmaculatus, Fabr.). The Journal of Agricultural Science (Cambridge), 1983, 101(2): 423-426.
[45] Lawson D M, Lunde C F, Mutschler M A. Marker-assisted transfer of acylsugarmediated pest-resitance from the wild tomato,Lycopersiconpennellii, to the cultivated tomato,Lycopersiconesculentum. Molecular Breeding, 1997, 3(4): 307-317.
[46] Jung C, Cai D, Kleine M. Engineering nematode resistance in crop species. Trends in Plant Science, 1998, 3(7): 266-271.
[47] Gallun R L, Patterson F L. Monosomic analysis of wheat for resistance to Hessian-fly. Journal of Heredity, 1977, 68(4): 223-226.
[48] Hardie D C, Baker G J, Marshall D R. Field screening ofPisumaccessionsto evaluate their susceptibility to the pea weevil (Coleoptera: Bruchidae). Euphytica, 1995, 84(2): 155-161.
[49] Aryamanesh N, Byrne O, Hardie D C,etal. Large-scale density-based screening for pea weevil resistance in advanced backcross lines derived from cultivated field pea (PisumsativumL.) andPisumfulvum. Crop & Pasture Science, 2012, 63(7): 612-618.
[50] Ben-Ze’ev N, Zohary D. Species relationships in the genusPisumL. Israel. Journal of Botany, 1973, 22: 73-91.
[51] Bryne O M T. Incorporation of Pea Weevil Resistance from Wild Pea (Pisumfulvum) into Field Pea (PisumsativumL.)[D]. Perth: The University of Western Australia, 2005.
[52] Byrne O M, Hardie D C, Khan T N,etal. Genetic analysis of pod and seed resistance to pea weevil in aPisumsativum×P.fulvuminterspecific cross. Australian Journal of Agricultural Research, 2008, 59(9): 854-862.
[53] Aryamanesh N, Zeng Y, Byrne O,etal. Identification of genome regions controlling cotyledon, pod wall/seed coat and pod wall resistance to pea weevil through QTL mapping. Theoretical & Applied Genetics, 2014, 127(2): 489-497.
[54] Morton R L, Schroeder H E, Bateman K S,etal. Bean α-amylase inhibitor 1 in transgenic peas (Pisumsativum) provides complete protection from pea weevil (Bruchuspisorum) under field conditions. Proceedings of the National Academy of Sciences, 2000, 97(8): 3820-3825.
[55] Ho M F, Whitaker J R. Purification and partial characterization of white kidney bean (Phaseolusvulgaris) β-amylase inhibitors from two experimental cultivars. Journal of Food Biochemistry, 1993, 17(17): 15-33.
[56] Ho M F, Whitaker J R. Subunit structures and essential amino acid residues of white kidney bean (Phaseolusvulgaris) α-amylase inhibitors. Journal of Food Biochemistry, 1993, 17(1): 35-52.
[57] Ishimoto M, Kitamura K. Growth inhibitory effects of an α-amylase inhibitor from theKidneybean,Phaseolusvulgaris(L.) on three species of bruchids (Coleoptera: Bruchidae). Applied Entomology & Zoology, 1989, 24(3): 281-286.
[58] Suzuki K, Ishimoto M, Kikuchi F,etal. Growth inhibitory effect of an alpha-amylase inhibitor from the wild common bean (Phaseolusvulgaris)resistant to the Mexican bean weevil (Zabrotessubfasciatus). Japanese Journal of Breeding, 1993, 43(2): 257-265.
[59] Mirkov T E, Wahlstrom J M, Hagiwara K,etal. Evolutionary relationships among proteins in the phytohemagglutin in-arcelin-alpha-amylase inhibitor family of the common bean and its relatives. Plant Molecular Biology, 1994, 26(4): 1103-1113.
[60] Grossi de Sa M F, Mirkov T E, Ishimoto M,etal. Molecular characterization of a bean α-amylase inhibitor that inhibits the α-amylase of the Mexican bean weevilZabrotessubfasciatus. Planta, 1997, 203(3): 295-303.
[61] Shade R E, Schroeder H E, Pueyo J J,etal. Transgenic pea seeds expressing the alpha-amylase inhibitor of the common bean are resistant to bruchid beetles. Nature Biotechnology, 1994, 12(8): 793-796.
[62] Schroeder H E, Gollasch S, Moore A,etal. Bean alpha-amylase inhibitor confers resistance to the pea weevil (Bruchuspisorum) in transgenic peas (PisumsativumL.). Plant Physiology, 1995, 107(4): 1233-1239.
[63] Lagadic L. Some characteristics of digestive α-glycosidases from adults ofBruchusaffinisFrölich, in relation with intestinal pH. Comparative Biochemistry & Physiology Part A Physiology, 1994, 108(2/3): 249-253.
[64] Cheng M S, Feng G, Zen K C,etal. α-amylases from three species of stored grain coleoptera and their inhibition by wheat and corn proteinaceous inhibitors. Insect Biochemistry & Molecular Biology, 1992, 22(3): 261-268.
[65] Silva C P, Terra W R, Xavier-Filho J,etal. Digestion in larvae ofCallosobruchusmaculatusandZabrotessubfasciatus(Coleoptera: Bruchidae) with emphasis on α-amylases and oligosaccharidases. Insect Biochemistry & Molecular Biology, 1999, 29(4): 355-366.
[66] Carlson G L, Li B U K, Bass P,etal. A bean alpha-amylase inhibitor formulation (starch blocker) is ineffective in man. Science, 1983, 219: 393-395.
[67] Le Berre-Anton V, Bompard-Gilles C, Payan F,etal. Characterization and functional properties of the alpha-amylase inhibitor (alpha-AI) from kidney bean (Phaseolusvulgaris) seeds. Biochimica Et Biophysica Acta, 1997, 1343(1): 31-40.
[68] Fogel M R, Gray G M. Starch hydrolysis in man: an intraluminal process not requiring membrane digestion. Journal of Applied Physiology, 1973, 35(2): 263-267.
[69] Berdnikov V A, Trusov Y A, Bogdanova V S,etal. The neoplastic pod gene (Np) may be a factor for resistance to the pestBruchuspisorumL. Pisum Genetics, 1992, 24: 37-39.
[70] Doss R P, Oliver J E, Proebsting W M,etal. Bruchins: insect-derived plant regulators that stimulate neoplasm formation. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97: 6218-6223.
[71] Nuttall V W, Lyall L H. Inheritance of neoplastic pod in the pea. Journal of Heredity, 1964, 55(4): 184-186.
[72] Dodds K S, Matthews P. Neoplastic pod in the pea. Journal of Heredity, 1966, 57(3): 83-88.
[73] Snoad B, Matthews P. Neoplasms of the pea pod. Chromosomes Today, 1969, 2: 126-131.
[74] Burgess J, Fleming E N. The structure and development of a genetic tumour of the pea. Protoplasma, 1973, 76(3): 315-325.
[75] Doss R P. Treatment of pea pods with Bruchin B results in up-regulation of a gene similar to MtN19. Plant Physiology and Biochemistry, 2005, 43(3): 225-231.
[76] Cooper L D, Doss R P, Price R,etal. Application of Bruchin B to pea pods results in the up-regulation of CYP93C18, a putative isoflavone synthase gene, and an increase in the level of pisatin, an isoflavone phytoalexin. Journal of Experimental Botany, 2005, 56: 1229-1237.
[77] Lee R Y, Reiner D, Higgins T J V. Effect on alpha-amylaseKinhibitorgeneticallymodified (GM) pea consumption on lung inflammation in a mouse model of allergic asthma. Clinical & Translational Allergy, 2011, 1(Suppl 1): 1.
[78] OGTR. The Office of the Gene Technology Regulator[DB/OL]. 2005 [2016-08-08]. http://www. ogtr. gov. au.
[79] Hoey B K, Crowe K R, Jones V M,etal. A phylogenetic analysis ofPisumbased on morphological characters, and allozyme and RAPD markers. Theoretical and Applied Genetics, 1996, 92(1): 92-100.
[80] Blixt S. The Pea[M]//King R C. Handbook of Genetics. New York: Plenum Press, 1974: 181-221.
[81] Sousa-Majer de M J, Turner N C, Hardie D C,etal. Response to water deficit and high temperature of transgenic peas (PisumsativumL.) containing a seed-specific α-amylase inhibitor and the subsequent effects on pea weevil (BruchuspisorumL.) survival. Journal of Experimental Botany, 2004, 55: 497-505.
[82] Mihiretu E, Wale M. Effect of harvesting and threshing time and grain fumigation of field peas (PisumsativumL.) on pea weevil (BruchuspisorumL.) (Coleoptera: Bruchidae) development and damage. Ethiopian Journal of Science & Technology, 2013, 6(1): 13-24.
[83] Ratnadass A, Fernandes P, Avelino J,etal. Plant species diversity for sustainable management of crop pests and diseases in agroecosystems: a review. Agronomy for Sustainable Development, 2012, 32(1): 273-303.
[84] Tooker J F, Frank S D. Genotypically diverse cultivar mixtures for insect pest management and increased crop yields. Journal of Applied Ecology, 2012, 49: 974-985.
[85] Doring T F, Knapp S, Kovacs G,etal. Evolutionary plant breeding in cereals-into a new era. Sustainability, 2011, 3: 1944-1971.
[86] Zhang Z B, Cao J. Pest Control: Strategies and Methods[M]. Beijing: Science and Technology Press, 1990: 504-562. 张宗炳, 曹骥. 害虫防治: 策略与方法[M]. 北京: 科学技术出版社, 1990: 504-562.
[87] Wang Y W, Zhang G Z. Effective control way of the pests. Journal of Anhui Agricultural Sciences, 2003, 31(1): 120-122, 124. 王亚维. 张国洲. 农业害虫农业防治和物理防治方法的研究. 安徽农业科学, 2003, 31(1): 120-122, 124.
[88] Zhong W W, Yang X M. Current progress on research of pea weevil. Crops, 2014, 2: 21-25. 仲伟文, 杨晓明. 豌豆象的发生、危害、防治对策及豌豆抗豌豆象的遗传机理综述. 作物杂志, 2014, 2: 21-25.
[89] Khan T N, Croser J S. Pea: Overview[M]//Wrigley C, Corke H, Walker C E. Encyclopedia of Grain Science. Amsterdam: Elsevier Press, 2004: 287-295.
[90] Annis B, O’Keeffe L E. Influence of pea genotype on parasitization of the pea weevil,Bruchuspisorum(Coleoptera: Bruchidae) byEupteromalusleguminis(Hymenoptera: Pteromalidae). Environmental Entomology, 1987, 16: 653-655.
[91] Hormazabal R L, Gerding P M. Release density ofUscanasenexGrese (Hymenoptera: Trichogrammatidae) for control ofBruchuspisorumL. (Coleoptera: Bruchidae). Agro-Ciencia, 1998, 14: 157-161.
[92] Pintureau B, Gerding M, Cisternas E. Description of three new species of Trichogrammatidae (Hymenoptera) from Chile. The Canadian Entomologist, 1999, 131(1): 53-63.
[93] Wilson F. A review of the biological control of insects and weeds in Australia and Australian. Entomophaga, 1960, 6(1): 76.
[94] Bruce T J A, Martin J L, Smart L E,etal. Development of semiochemical attractants for monitoring bean seed beetle,Bruchusrufimanus. Pest Management Science, 2011, 67(10): 1303-1308.
Advances in breeding of pea (Pisumsativum) with resistance to pea weevil (Bruchuspisorum) and its integrated management
WANG Chang1, HE Chun-Gui2, ZHANG Li-Juan1, YANG Xiao-Ming1*
1.InstituteofCropsResearch,GansuAcademyofAgriculturalSciences,Lanzhou730070,China; 2.GansuAcademyofAgriculturalSciences,Lanzhou730070,China
Pea (Pisumsativum) is an important economic legume crop that is cultivated around the world for its high nutritional value. The pea weevil (Bruchuspisorum) is the most destructive pest of pea crops worldwide. The boring of pea weevil larvae can destroy more than 50% of the cotyledon parts in pea grains, leading to empty grains, poor seed germination, and poor seed quality. The pea weevil has become one of the most serious factors restricting the sustainable development of the pea industry. Genetic resources for pea weevil resistance have not been found in cultivated pea varieties, but have been detected in wild pea. Genetic studies have revealed that the inheritance of resistance to pea weevil is controlled by at least three recessive genes. In other studies, α-amylase inhibitor (α-AI) and neoplastic pod (Np) mutants of pea showed a degree of resistance to pea weevil. Although transgenic pea lines have been developed, their potential threats to human and animal health mean that chemical pesticides are still the most efficient methods to control pea weevil. In this paper, we review recent advances in pea weevil research, including breeding for resistance and integrated management systems. We discuss the current state of research on pea weevil in China and the problems remaining to be solved.
pea; pea weevil; α-amylase inhibitor;Npmutant; pea weevil resistance gene; management
10.11686/cyxb2016360
2016-09-22;改回日期:2017-02-23
国家食用豆产业技术体系建设(CARS-09-G8),国家自然科学基金项目(31460382)和兰州市农业科技攻关项目(2015-3-54)资助。
王昶(1979-),男,甘肃陇南人,助理研究员,硕士。E-mail:chang288@163.com
*通信作者Corresponding author. E-mail:yangxm04@hotmail.com
http://cyxb.lzu.edu.cn
王昶, 贺春贵, 张丽娟, 杨晓明. 豌豆抗豌豆象育种及其综合防治研究进展. 草业学报, 2017, 26(7): 213-224.
WANG Chang, HE Chun-Gui, ZHANG Li-Juan, YANG Xiao-Ming. Advances in breeding of pea (Pisumsativum) with resistance to pea weevil (Bruchuspisorum) and its integrated management. Acta Prataculturae Sinica, 2017, 26(7): 213-224.

