核酸生物标志物专利分析
胡文彬
核酸生物标志物专利分析
胡文彬⋆
本文对近年来我国涉及人类疾病的核酸生物标志物的专利申请状况进行了分析,通过对专利申请量、专利审查状态、主要申请人、技术主题、应用领域进行统计,力图全面系统地反映核酸生物标志物领域专利技术的发展及现状,剖析相关专利技术在发展中存在的问题,并针对这些问题提出了改进建议,以期对我国精准医疗的发展以及知识产权战略的实施提供参考。
核酸生物标志物基因专利申请精准医疗
一、引 言
自从美国总统奥巴马在2015年1月20日国情咨文演讲中谈到了“人类基因组计划”所取得的成果,并宣布了新的项目——精准医疗计划后,“精准医疗”的概念在全球引发热议。对于精准医疗的定义业内有着多种见解。美国国立卫生研究院(NIH)对精准医疗的定义为:精准医疗是一个建立在了解个体基因、环境以及生活方式的基础上的新兴疾病治疗和预防方法。而中国工程院院士詹启敏指出,所谓精准医疗,就是应用现代遗传技术、分子影像技术、生物信息技术,结合患者生活环境和临床数据,实现精准的疾病分类和诊断,制定具有个性化的疾病预防和诊疗方案,包括对风险的精确预测、对疾病的精确诊断、对疾病的精确分类、药物的精确应用、对疗效的精确评估、对疗后的精确预测等。
从精准医疗的上述定义可知,精准医疗是以个体化医疗为基础,随着基因组测序技术的发展以及生物信息与大数据科学的交叉应用而发展起来的新型医学概念与医疗模式。其本质是通过基因组、蛋白质组等组学技术和医学前沿技术,对于大样本人群与特定疾病类型进行生物标记物的分析与鉴定、验证与应用,从而精确寻找到疾病的原因和治疗的靶点,并对疾病不同状态和过程进行精确分类,最终实现对疾病和特定患者进行个体化精准治疗的目的,提高疾病诊治与预防效益。
从上述精准医疗本质的表述中可知,生物标志物的分析与鉴定是实现精准医疗的关键。在精准医疗的框架下,未来几乎每个药物、疾病和治疗方案都要先通过分子检测对人群加以有效区分,因此生物标志物的开发势在必行。
本文以SOOPAT数据库公开的核酸生物标记物的全部专利申请为数据分析基础,对核酸生物标记物领域国内、国外来华专利申请状况进行了统计和分析,同时部分分析主题以美国的核酸生物标志物专利申请为对照,以期对我国精准医疗的发展以及知识产权战略的实施提供参考。
二、研究方法
以SOOPAT中收录的国内申请人和国外申请人向中国国家知识产权局提交并公开的涉及人类疾病核酸生物标志物的全部专利申请为数据检索范围,以关键词(诊断、治疗、标志物、标识、标记、靶标、血液、组织、尿液、循环肿瘤细胞、exosome、循环肿瘤DNA、ctDNA、游离DNA、cfDNA、tRNA、rRNA、基因、lncRNA、miRNA、mtDNA、突变、表达量、表达水平、含量、SNP、单核苷酸多态性、缺失、插入、拷贝数、甲基化、药物敏感性、药物反应性、治疗反应性、应答、响应、耐药)和分类号(C12Q 1/68)为主要检索信息手段来获取初始专利申请信息。由于上海博德基因开发有限公司、上海博道基因技术有限公司、上海博容基因开发有限公司在2000年前后申请的大量核酸专利仅仅保护了核酸序列并没有研究核酸功能而导致专利申请无一被授权,因此将上述3家公司申请的核酸专利视为无效专利。从检索到的初始专利申请信息中排除上述3家公司的无效专利信息后,共获得11936篇文献用于本文的分析。检索时间截至2016年11月21日。
以Lindenpat数据库中收录的在美国申请并公开的涉及人类疾病核酸生物标志物的全部专利申请为数据检索范围,利用检索式“TAC=(Diagnostic OR treatment OR markers OR mark OR target)AND IPC=(C12Q1/68)AND AC=(US)”检索获得的22 779件美国专利申请用于本文的分析。
三、专利申请情况分析结果
(一)专利年度申请量趋势分析
截至2016年11月21日,中国的核酸生物标志物专利申请共有11 936件,其中,最早的为1985年递交的1件专利申请。1992年之前,核酸生物标志物专利的年申请量在5件以下,之后核酸生物标志物专利的申请量逐年递增,到1998年专利申请量达到了61件。随着新世纪一天天临近,人们对于基因技术的研究与开发产生了越来越浓厚的兴趣。许多富有远见和实力的工业界巨头普遍看好基因技术广阔的发展前景和优厚的投资回报,纷纷把投资和发展的重点转向基因技术领域,并由此在全球掀起了投资基因工程的热潮,在基因开发热潮的影响下,1998年之后的核酸生物标志物专利申请量则进入了快速增长期,到2003年核酸生物标志物专利数量达到了441件。核酸生物标志物专利数量在经历了2003~2007年的小小波动之后,再次呈现快速增长趋势,到2014年申请量增至1257件。鉴于精准医疗浪潮袭来,国内外加大了对生物标志物专利的研发投入力度,我们相信未来核酸生物标志物专利的申请量会继续猛增(见图1)。图1中2015年和2016年的数据有所降低,是由于专利申请延迟公开所造成的。
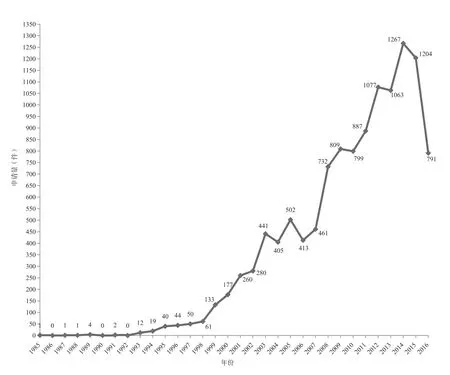
图1 中国核酸生物标志物专利年申请量趋势
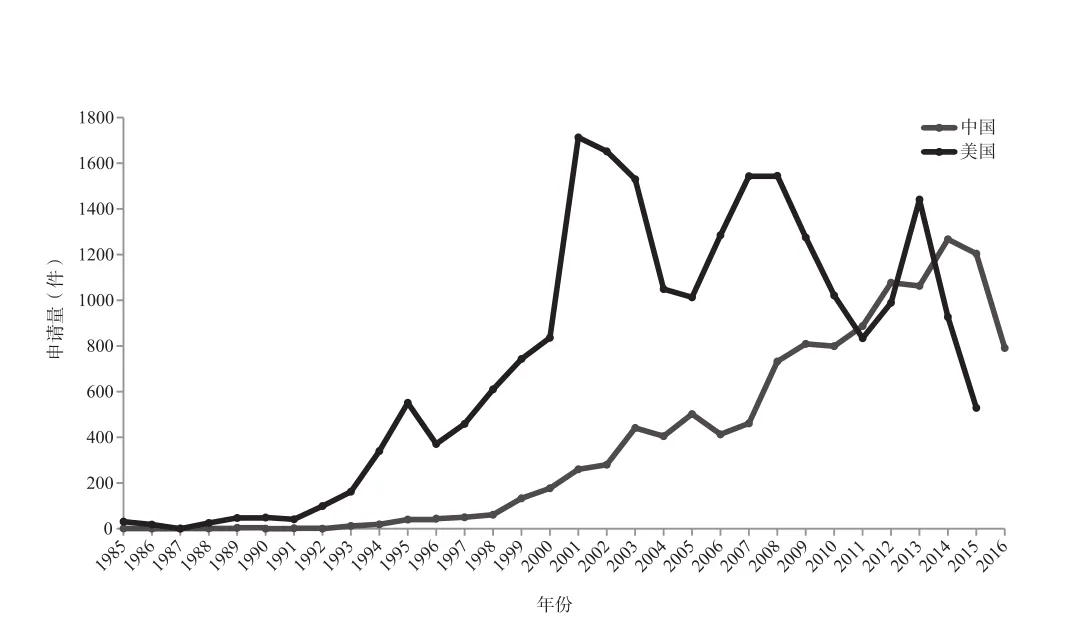
图2 中国与美国的核酸生物标志物专利年申请量趋势对比
另外,我们统计了核酸生物标志物专利在美国的申请情况。截至2015年,美国的核酸生物标志物专利申请量为22 779件,中国的核酸生物标志物专利申请量为11 087件,申请总数相差2倍。通过分析图2可知,美国的核酸生物标志物专利申请量在很长的一段时间内遥遥领先于中国,直到2010年中国的核酸生物标志物专利申请量与美国的基本持平,而此时的申请量才与美国在2000年申请的核酸生物标志物专利数量相当。以上数据表明中国在核酸生物标志物领域的相关技术发展速度远远落后于美国。
(二)专利案件审查状态分析
经统计分析,在11 936件中国核酸生物标志物专利申请中,处于授权维持状态的专利为3 204件,未缴年费的授权专利为930件,届满的授权专利为17件,占全部申请量的34.8%;撤回的专利为21件,视为撤回的专利为2 872件,占全部申请量的24.2%;驳回的专利为1 036件,占全部申请量的8.7%;视为放弃的专利共64件,占总申请量的0.5%;处于首次未结案状态的专利为3 792件,其中,公开状态的专利387件,处于实质审查状态的专利为3 405,全部申请量的31.8%。(见图3)在已经审结的专利申请中,核酸生物标志物专利申请的授权率为51.8%;撤回率为35.5%,驳回率为12.7%,(见图4)另外,核酸生物标志物专利申请的维持率为39.3%。以上数据表明,核酸生物标志物专利授权前景可观,但由于部分授权专利质量不高,因此不再维持。
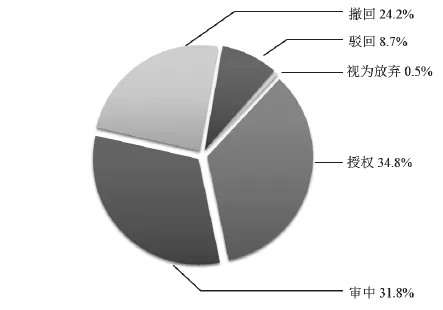
图3 核酸生物标志物专利申请案件审查状态
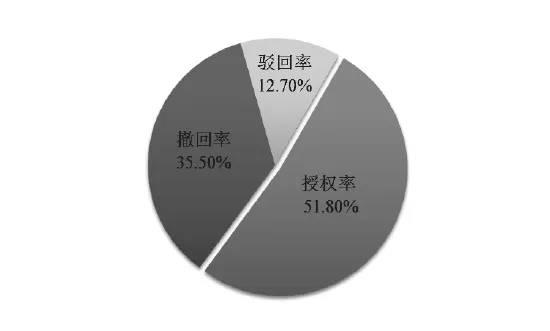
图4 已审结的核酸生物标志物专利申请案件审查状态
(三)专利申请人排名分析
中国核酸生物标志物专利申请的前20位申请人排名及各类申请人申请量占比见图5和图6。复旦大学、上海人类基因组研究中心、浙江大学分别位列第1位、第2位、第3位,可见上述单位在核酸生物标志物的研发中具备一定优势,相关企业可以寻求与上述单位的合作开发;北京泱深生物信息技术有限公司位列第4位,在涉足核酸生物标志物领域的企业中排名第1位,该公司的专利申请最早开始于2014年,表明该公司对核酸生物标志物的研究虽然起步晚,但是投入力度很大,核酸生物标志物的研发是该公司近年来的研发重点。芮屈生物技术(上海)有限公司、上海交通大学、武汉大学、中国科学院上海生命科学研究院、中山大学、霍夫曼-拉罗奇有限公司、深圳华大基因科技有限公司、中南大学、中山大学达安基因股份有限公司、中国检验检疫科学研究院、中国人民解放军第二军医大学、扬州大学、北京大学、中国人民解放军总医院、南京医科大学、清华大学分别位列第5位至第20位。前20位申请人中高校和科研院所占14席、公司占5席、医院占1席。国内申请人占19席,外国申请人仅占1席。
同时统计了美国核酸生物标志物专利申请量排名,见图7。数据显示,美国核酸生物标志物专利申请量前15位的申请人中,公司占11席、大学占4席。数据表明,美国核酸生物标志物专利申请以企业为主,核酸生物标志物技术的产业化程度高。(见图8)
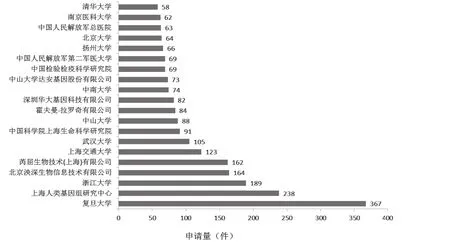
图5 中国核酸生物标志物专利申请人排名
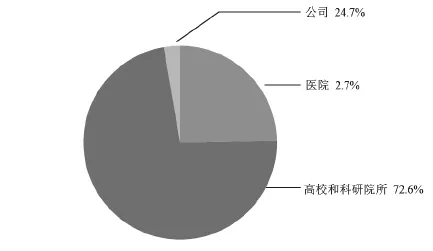
图6 中国核酸生物标志物专利不同类型申请人专利申请数量占比
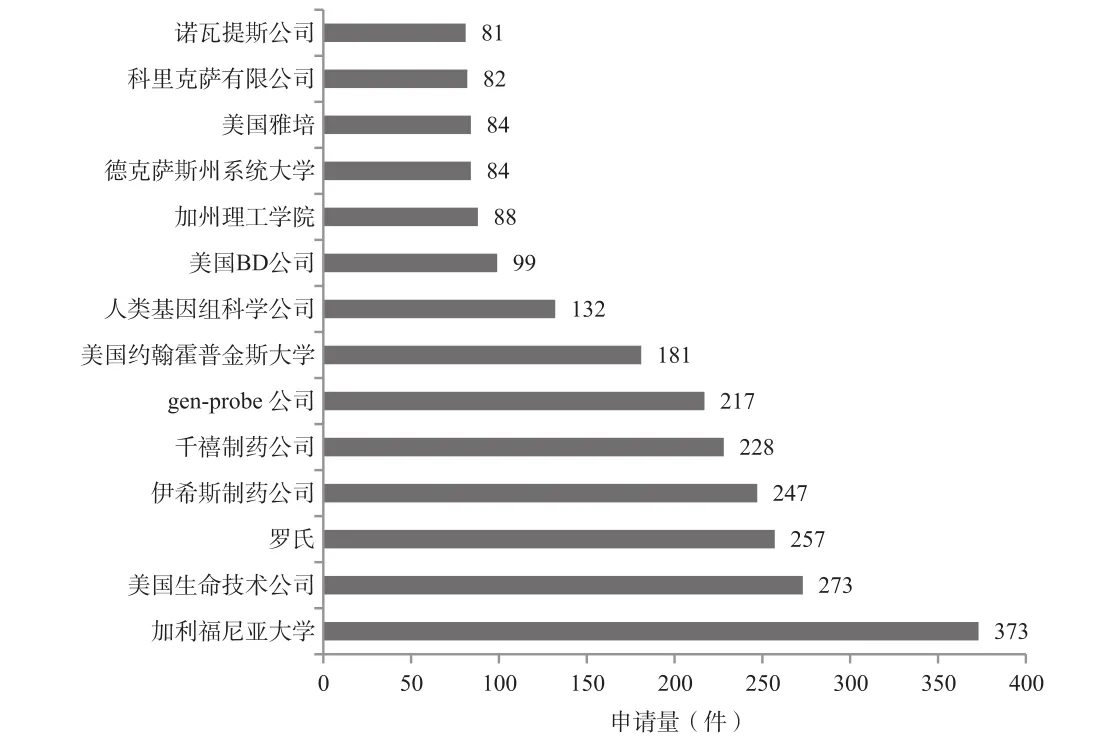
图7 美国核酸生物标志物专利申请人排名
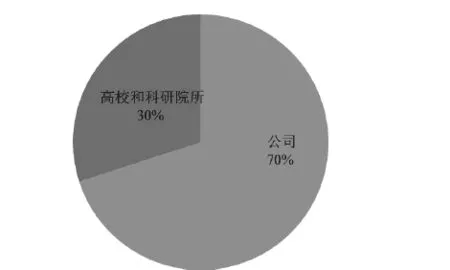
图8 美国核酸生物标志物专利不同类型申请人专利申请数量占比
上述分析结果反映了中国核酸生物标志物领域专利申请的几个问题。
(1)中国核酸生物标志物专利申请以国内高校和科研院所为主。高校和科研院所本身具有强大的技术实力和优秀的科研队伍,利用自身的技术优势,在该领域开展了大量的研究和开发工作。
(2)企业对核酸生物标志物研究关注度不高。企业总申请量比高校和科研院所的总申请量少很多。
(3)与美国相比,中国核酸生物标志物相关技术更多停留在研发层面,市场推广应用还处于起步阶段,产业化程度严重不足。高校和科研院所在研发能力上具有一定优势,但在推动产业化时往往缺少动力和资金保障,作为市场主体的企业应该寻求与上述高校和科研院所合作,推动高校和科研院所的专利市场化。
(4)医院在核酸生物标志物相关技术上的研发投入力度小,医院拥有大量的临床病例样本,应利用其优势资源增加在核酸生物标志物研究方面的投入。
(四)专利技术主题分析
1.核酸生物标志物类型分析
统计11 936件中国核酸生物标志物专利申请中涉及基因、miRNA、rRNA、cfDNA、tRNA、lncRNA ctDNA mtDNA的专利数量,分别计算每种类型的核酸生物标志物专利申请数量在以上几种类型核酸生物标志物专利申请总数中的占比,统计结果见图9。
统计结果显示,对于基因标志物的研究投入较大,关注度高,而对其他类型标志物的研究投入少,关注度低。这与基因种类多,基因相关技术发展快(尤其是基因组测序和转录组测序技术的发展)有直接关系。其中,值得关注的是cfDNA和ctDNA的研究,虽然到2016年11月21日为止,上述两种类型标志物的专利申请量少,但是cfDNA和ctDNA标志物的研究起步较晚,随着人们对早期无创诊断技术的需求越来越迫切,加上测序技术的发展与成熟,未来几年内,cfDNA和ctDNA标志物的研究将成为研发热点。
2.核酸生物标志物来源分析
统计11 936件中国核酸生物标志物专利中不同来源的核酸生物标志物的专利数量,来源包括血液、组织、尿液、循环肿瘤细胞、外泌体(exosome),分别计算每种来源的核酸生物标志物专利申请量在上述几种来源的核酸生物标志物专利申请总量中的占比,统计结果见图10。
结果显示,血液(不包括循环肿瘤细胞和外泌体)中核酸生物标志物研究比重最大,其次为组织,循环肿瘤细胞研究较少。由于缺乏有效的循环肿瘤细胞富集与鉴定技术,因此关于循环肿瘤细胞的研究关注度不高,技术限制导致了目前循环肿瘤细胞来源的核酸生物标志物的专利申请量少。但是循环肿瘤细胞是从肿瘤组织中脱落下来进入血液中的,能够反映原位肿瘤组织的状况,并且还可以解决肿瘤异质性的问题,因此循环肿瘤细胞将是未来研发的热点。
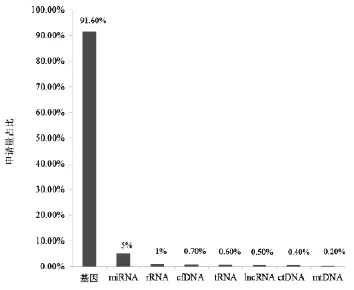
图9 不同类型核酸生物标志物专利申请数量占比
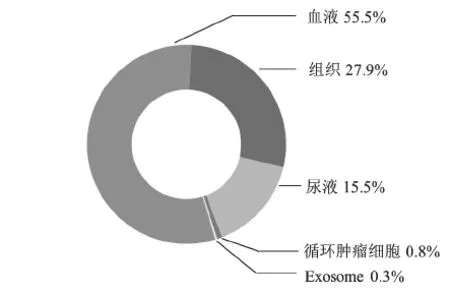
图10 不同来源的核酸生物标志物专利数量占比
3.核酸生物标志物的特征变化类型分析
分子之所以能够成为疾病的标志物,是因为该分子在疾病中发生了特征变化,导致其与对照存在不同,因此可以通过检测该分子是否存在特征变化来诊断疾病。统计11 936件中国核酸生物标志物专利申请中生物标志物发生不同类型特征变化的专利数量,特征变化包括点突变、SNP、表达量高低、缺失、插入、拷贝数变化、甲基化。分别计算生物标志物发生每种类型特征变化的专利数量在上述几种类型特征变化的专利总量中的占比,统计结果见图11。
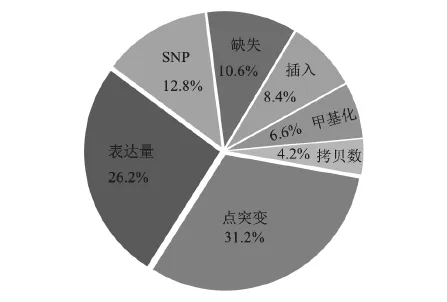
图11 不同特征变化类型的核酸生物标志物专利数量占比
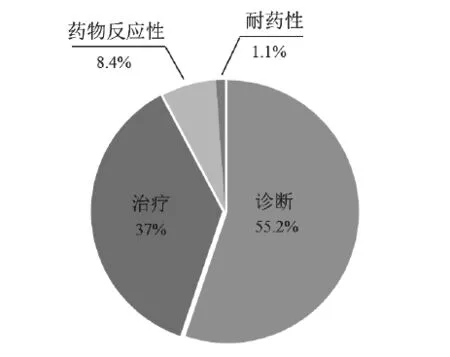
图12 不同应用领域的核酸生物标志物专利数量占比
结果显示,对于点突变、表达量和SNP的研究较多,而对于缺失、插入、拷贝数变化和甲基化的研究相对较少。究其原因主要有两点:第一,点突变、SNP、基因表达量的分析技术发展快、成熟度高,而缺失、插入、拷贝数变化和甲基化的分析技术发展滞后、有效性差;第二,点突变、SNP在人类疾病发生中出现的频率高,因此研究获得了更多的关注度,而各种类型的特征变化往往导致基因表达量改变,因此,对表达量的研究投入力度也较大。
4.核酸生物标志物应用领域分析
统计11 936件中国核酸生物标志物专利申请中涉及不同应用领域的专利的数量,应用领域包括诊断(包括预测风险、确诊、判断预后、判断复发、判断转移)、治疗(基因治疗、药物开发(激动剂、拮抗剂))、药物反应性、耐药性。分别计算不同应用领域的专利申请数量在上述几种应用领域专利总量中的占比,统计结果见图12。
结果显示,生物标志物在诊断和治疗方面应用的比重较大,而在药物敏感性和耐药性方面的研究比重小。主要原因可能在于:(1)研究用于诊断和治疗的核酸生物标志物,研究成果可以直接指导诊断工具的开发以及治疗药物的筛选,市场前景大;(2)对于药物反应性和耐药性核酸生物标志物的研究,需收集大量的临床样本,研究难度大。
5.核酸生物标志物专利转化分析
11 936件中国核酸生物标志物专利中有3 204件专利处于有权状态,统计3 204件有权专利中发生权利转移、进行许可备案以及质押的专利数量。统计结果如下:发生权利转移的专利为375件,占全部有权专利的11.7%,进行许可备案的专利为48件,占全部有权专利的1.5%,进行质押的专利为14件,占全部有权专利的0.7%。可知,中国核酸生物标志物专利成果的转化率为13.9%。(见图13)鉴于我国专利转化率不足5%,核酸生物标志物领域的专利技术成果高于10%的转化率表明该领域的专利技术成果相对其他领域更容易产业化。但是与世界其他国家的专利转化情况相比,中国核酸生物标志物相关专利技术的转化率较低,一方面说明中国核酸生物标志物专利技术的含金量不高,另一方面说明中国在专利转化方面制定的政策和制度不完善。
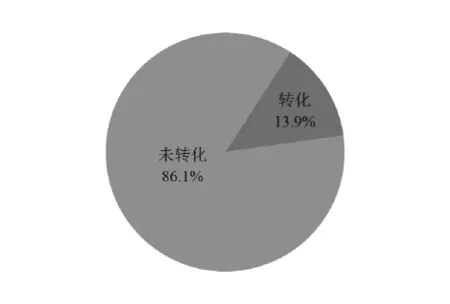
图13 核酸生物标志物专利转化情况
四、生物标志物专利的商业价值
生物标志物专利是开发生物标志物相关产品的基础,专利权人可以通过专利转让、专利许可、专利作价入股、专利合作等方式获得收益,还可以从根据生物标志物专利开发的靶向药物以及其他衍生产品的后期销售收入中按一定比例提成。生物标志物专利的商业价值可从以下案例中得以体现。
2014年10月16日,华大基因将其领先全球的无创产前基因检测技术转移予意大利bioscience Genomics,成为少数的中国基因技术输出案例,该项技术转移的金额是456万欧元,经济利益是1 440万欧元。
2010年8月26日,中国科学院上海生命科学研究院知识产权与技术转移中心宣布,将一项蛋白抗肿瘤药物专利授权给跨国制药集团赛诺菲-安万特公司,合同金额超过4亿元,并外加日后销售额提成。
2001年,第二军医大学南京医学院分子医学研究所徐根兴教授的人体内皮生长抑制素endostatin“饿死肿瘤”技术获得了400万元技术转让费,他将与江苏吴中生物医药研究所共同开发“饿死肿瘤”基因针剂和基因治疗雾化剂。
美国Amgen公司依赖促红细胞生成素(EPO)基因专利的开发应用,从一个濒临破产的企业成为美国生物工程医药领域的领头羊,其EPO1998年的销售收入达到13.6亿美元,而EPO的全球市场现已达到34亿美元的销售额。
1998年9月,Millennium公司与Bayer公司签订了5年的基因药物合作协议,Bayer公司将向Millennium支付总计4.65亿美元费用,委托Millennium公司开发225种基因药靶。
1997年,Amgen公司将FKBP神经免疫因子配体转让给Guilford公司,转让费用高达3.92亿美元,是迄今为止单个基因交易的最高价格。
1997年3月,美国Geron公司与Pharmacia&Upjohn签订协议,合作开发抑制端粒酶基因的新一代抗癌药物,Pharmacia&Upjohn向Geron支付5800万美元,包括1000万美元的股权投资、研究基金和阶段性付费,Geron公司还将获得后期产品销售收入的提成和部分美国市场合作销售权。
1996年7月,美国Millennium公司与Wyeth-Ayerst公司签订中枢神经系统疾病相关基因合作协议,Wyeth-Ayerst公司在7年内向Millennium公司支付专利使用费和研发费用约9 000万美元,该费用并不包括阶段性付费和产品提成。
五、总结和建议
鉴于生物标志物专利的巨大商业价值,未来核酸生物标志物的研究依然是生物医药行业的热点,通过以上对中国的核酸生物标志物专利申请的统计和分析可以看出,中国的核酸生物标志物相关技术发展中存在一些问题。
(1)核酸生物标志物专利整体质量不高。近年来,我国专利申请数量猛增,其中有国家经济迅速发展、技术水平大幅提高以及政府大力支持的硬性支撑等原因的推动,也不乏由政策中片面追求数量的导向及考核指标的数量化倾向而造成的“专利泡沫”等现象。
(2)核酸生物标志物相关技术的产业化程度低。核酸生物标志物的中国专利申请的申请人以高校和科研院为主,涉足该领域的企业较少。一方面说明企业的知识产权意识相对薄弱,另一方面说明产学研没有很多的结合,科技成果向产业化转化过程中存在脱节。
(3)核酸生物标志物专利技术成果的转化率低。中国的核酸生物标志物专利的转化率不足15%。
(4)核酸生物标志物的研究不均衡。在核酸生物标志物的类型方面,对于miRNA、lncRNA、cfDNA、ctDNA的研究较少;在核酸生物标志物的来源方面,对于循环肿瘤细胞的研究较少;在核酸生物标志物的特征变化方面,对于缺失、插入、拷贝数和甲基化的研究较少;在核酸生物标志物的应用方面,对于药物敏感性和耐药性方面的应用研究较少。以上情况会导致我国在核酸生物标志物技术领域留有技术空白点或者薄弱点,专利布局不完善。
(5)虽然国内申请人已积累了一定数量自主研发的核心专利,但后续申请量较少,外围专利布局不够,留给了国外技术实力雄厚的大企业遏制国内专利技术应用的进攻点。
(6)医院在核酸生物标志物领域的研发动力不足,未能充分利用其丰富的临床资源优势。
针对以上问题,笔者提出以下改进建议:
(1)建议高校和科研院所完善发明创新考核制度,对高校或者科研院所人员进行绩效考核时更加注重专利质量,而不是专利数量。
(2)推动高校和科研院所专利成果转化:①引导更多高校和科研院所建立健全知识产权工作机构,尽快成立独立的知识产权业务处,完善科技成果转化中介服务体系建设,促使专利成果走向市场;②建议政府推动并完善企业与高校和科研院所的合作机制,建立高校和科研院所与企业的合作联盟,通过企业加大研发资金的投入,拓展应用市场,优化利用高校的研究资源,将高校的研究成果积极推向市场,完成产业转化。
(3)建议政府加大对国内相关企业的政策和资金扶持力度,不断提高企业的专利保护意识以及自主研发的创新能力,在企业内部制定知识产权战略规划,关注重要竞争对手的专利申请以及布局情况,真正重视专利申请,增强自身在国际市场的竞争力。
(4)加强核酸生物标志物领域的多样化研究。在cfDNA、ctDNA、循环肿瘤细胞、基因缺失、基因插入、基因拷贝数、基因甲基化、药物敏感性和耐药性方面投入更多的研发精力,推动相关技术快速发展。
(5)对于重大科研成果,我国相关企业、高校和科研院所应及时提出专利申请以保护自主核心技术,然后围绕核心专利继续创新并申请外围专利,构建密集的专利网,使我国在生物标志物领域占据市场主导地位。
(6)建议完善医院知识产权管理机制,提高医生的技术创新热情,充分利用其临床资源,加大在药物敏感性和耐药性方面的核酸生物标志物的研究力度,使其研究成果可以有效地指导患者个体化用药,减轻国家和患者的经济负担。
知识产权出版社有限责任公司。

