3个菊花品种对高温胁迫的耐受性研究
付 凯 (上海市农药研究所有限公司,上海市徐汇区 200032)
3个菊花品种对高温胁迫的耐受性研究
付 凯 (上海市农药研究所有限公司,上海市徐汇区 200032)
为给切花菊的夏季生产提供优质耐高温品种,以菊花品种“黄中黄”、“神马”、“黄金金”的扦插苗为试验材料,研究了3个菊花品种对高温胁迫的耐受性。结果表明,“黄金金”和“神马”均较耐热,其中“黄金金”比“神马”更耐热,“黄中黄”最不耐热,在夏季高温中容易死亡。
菊花;高温胁迫;耐受性
菊花(Chrysanthemummorifolium)是原产于我国的菊科菊属宿根性花卉,是我国十大传统名花和世界四大切花之一,用途和栽培地域极广,有较高的观赏价值和经济价值,在现代花卉生产中占有重要地位。我国的切花菊生产面积大,多数进行设施栽培,但由于我国大部分地区夏季炎热,会出现40 ℃以上的极端高温,不仅会对菊花的设施栽培造成巨大损失,还会导致夏季切花菊的生产和出口出现断档[1]。经相关文献报道,许多植物品种具有耐热性[1-4],但有关菊花品种的耐热性报道则较少。为此,本试验以菊花品种“黄中黄”、“神马”、“黄金金”的扦插苗为试验材料,研究了3个菊花品种对高温胁迫的耐受性,以期为切花菊的夏季生产提供优质耐高温品种。
1 材料与方法
1.1 试验材料
试验于2016年5-7月设在上海市农药研究所基地进行。供试材料为菊花品种“黄中黄”、“黄金金”、“神马”扦插苗。采取旺盛生长的菊花顶芽进行扦插,以蛭石做插床,扦插后20d上盆,进行正常养护,选生长一致、具有6~8张叶片的植株进行高温试验。
试验仪器设备有分光光度计、电子天平(感量0.01g)、研钵、水浴锅、电导率仪、离心机、烧杯、漏斗、试管、冰箱、剪刀。试剂有95%乙醇、石英砂、0.05mol/L磷酸缓冲液(pH 7.8)、5%三氯乙酸溶液、0.5%硫代巴比妥酸溶液、蒸馏水。
1.2 试验设计
试验以在自然条件下生长的菊花植株为对照,供试材料在3种高温胁迫下培养1d、2d、3d,观察植株的反应,采集植株上相同部位、生长充实的叶片用于测定。高温胁迫(昼/夜温度)处理设置为:(1)23 ℃/18 ℃,(2)33 ℃/ 28 ℃,(3)40 ℃/35 ℃。试验中光照强度为450 umol/ (m2·s),光周期均设为白天16 h、黑夜8 h[5]。
1.3 试验方法
1.3.1 叶绿素浓度的测定
参照张志良等[6]的方法,取新鲜叶片,擦净组织表面污物,去掉中脉,剪碎,混匀。称取剪碎的新鲜样品0.2g,共3份,分别放入研钵中,加少量石英砂及95%乙醇2~3mL,研成匀浆,再加95%乙醇10mL,继续研磨至组织变白。静置3~5min后,取1张滤纸,置漏斗中,用95%乙醇湿润,沿玻棒把提取液倒入漏斗,过滤到25mL棕色容量瓶中,用少量95%乙醇冲洗研钵、玻璃棒及残渣数次,最后连同残渣一起倒入漏斗中。用滴管吸取95%乙醇,将滤纸上的叶绿体色素全部洗入容量瓶中。直至滤纸和残渣中无绿色为止。最后用95%乙醇定容至25mL,摇匀。把叶绿体色素提取液倒入半径1cm的比色杯内,以95%乙醇为空白,在波长665、649 nm下测定吸光度。
1.3.2 丙二醛(MDA)含量的测定
参照张志良等[6]的方法,取0.5g剪碎新鲜的样品,加入2mL预冷的0.05mol/L磷酸缓冲液(pH 7.8),并加入少量石英砂,在经过冰浴的研钵内研磨成匀浆后,转移到5mL刻度离心试管,将研钵用缓冲液冲净,冲洗液体也倒入离心试管中,最后用缓冲液定容至5mL。在4 500 r/min转速下离心10min。上清液即为丙二醛提取液。吸取2mL提取液于刻度试管中,加入含0.5%硫代巴比妥酸的5%三氯乙酸溶液3mL,于沸水浴上加热10min,迅速冷却。于4 500 r/min转速下离心10min。以蒸馏水为空白,调透光率为100%,取上清液于532、600 nm波长下测定吸光度。
1.3.3 电导率的测定
取剪碎的新鲜样品0.1g,共3份,分别放入烧杯中,加10mL蒸馏水,静置浸泡5~6 h。用电导率仪测定,测定时要搅匀。
2 结果与分析
2.1 不同品种菊花在不同温度下的叶绿素浓度变化
由表1表明,3个菊花品种在不同高温协迫下的叶绿素浓度变化。由图1可看出,在处理(1)条件下,3个菊花品种的耐高温顺序为“黄金金”>“神马”>“黄中黄”,随着试验天数的增加,3个菊花品种的叶绿素浓度都呈上升趋势,所以3个菊花品种在处理(1)条件下都生长良好,其中“神马”叶绿素浓度上升速度最为明显,呈直线上升趋势。
由图2可看出,在处理(2)条件下,3个菊花品种的耐高温顺序为“神马”>“黄金金”>“黄中黄”,随着试验天数的增加,“黄金金”的叶绿素浓度在第2天有明显下降的趋势,第3天又有所上升,而“黄中黄”、“神马”的叶绿素浓度一直均呈上升趋势,其中“神马”叶绿素浓度较高。
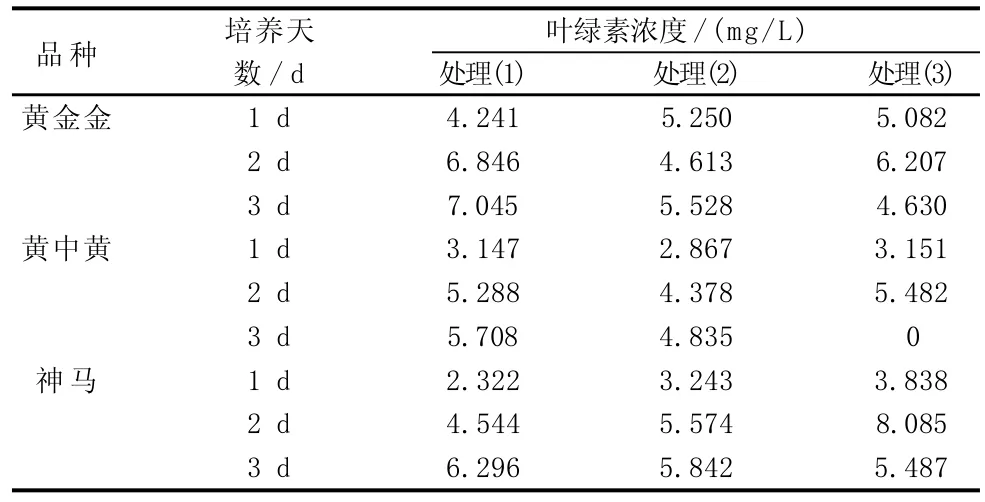
表1 不同品种菊花在不同温度下的叶绿素浓度变化
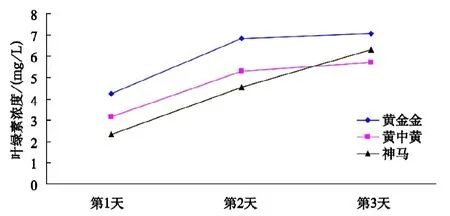
图1 不同菊花品种在处理(1)条件下的叶绿素浓度变化
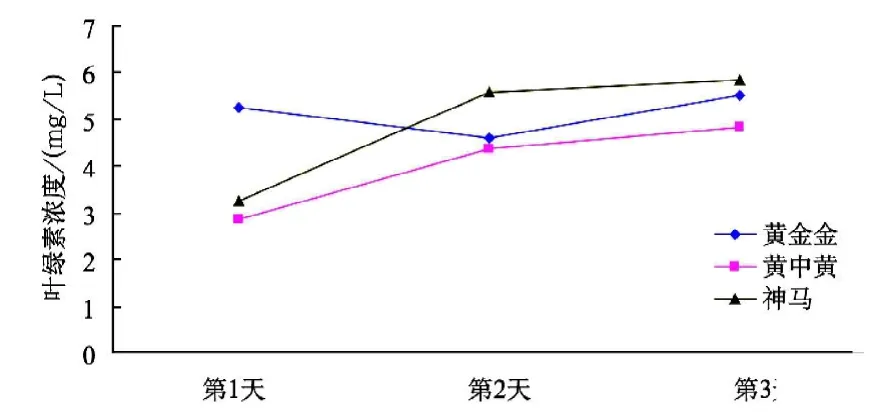
图2 不同菊花品种在处理(2)条件下的叶绿素浓度变化
由图3可看出,在处理(3)条件下,3个菊花品种的耐高温顺序为“神马”>“黄金金”>“黄中黄”,随着试验天数的增加,3个品种的菊花叶绿素浓度第2天相比第1天都有所上升,其中“神马”上升趋势最为显著,“黄中黄”次之;而随着试验天数的增加,“黄金金”、“神马”在第3天的叶绿素浓度比第2天有所下降,其中“黄中黄”在第3天已经死亡,“神马”生长较好。

图3 不同菊花品种在处理(3)条件下的叶绿素浓度变化
2.2 不同品种菊花在不同温度下的丙二醛含量变化
由表2表明,3个菊花品种在不同高温胁迫下的丙二醛含量变化。由图4可看出,在处理(1)条件下,3个菊花品种的耐高温顺序为“神马”>“黄金金”>“黄中黄”,随着试验天数的增加,3个菊花品种的丙二醛含量都呈上升趋势,其中“黄中黄”的丙二醛含量最高,“神马”的丙二醛含量最低。
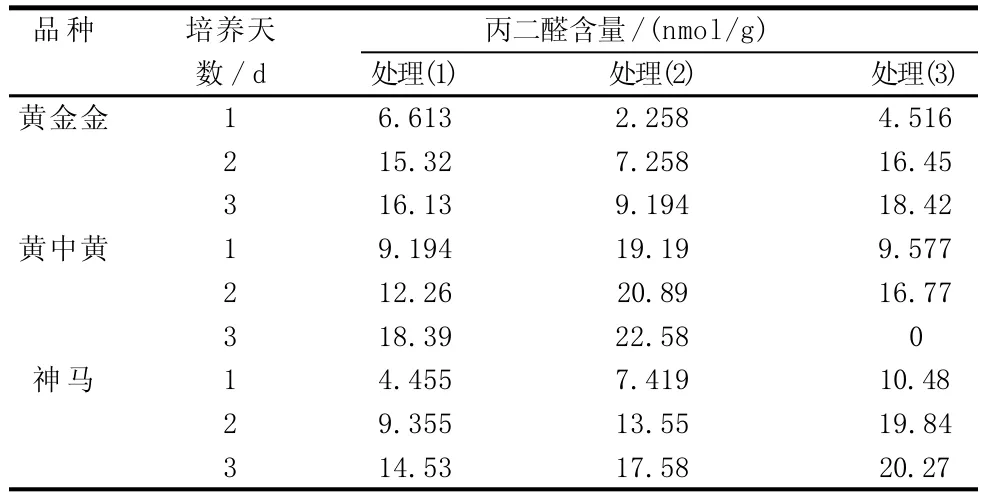
表2 不同品种菊花在不同温度下的丙二醛含量变化
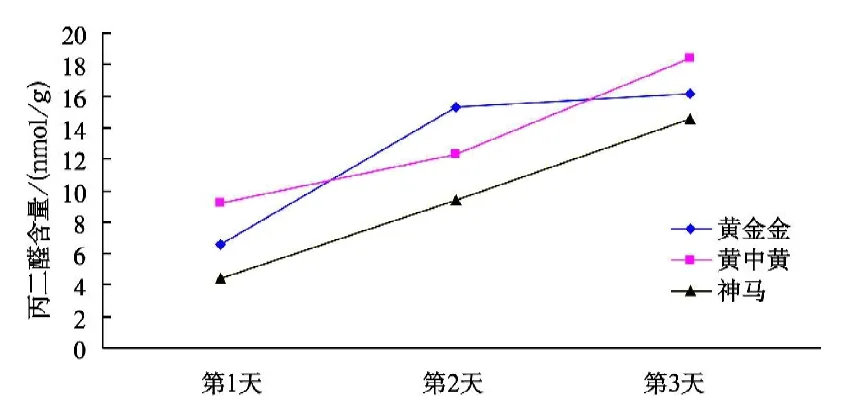
图4 不同品种菊花在处理(1)条件下的丙二醛含量变化
由图5可看出,在处理(2)条件下,3个菊花品种的耐高温顺序为“黄金金”>“神马”>“黄中黄”,随着试验天数的增加,3个品种菊花的丙二醛含量都呈上升趋势,其中“黄中黄”的丙二醛含量远远高于其他2个品种,“神马”的丙二醛含量处于3个品种的中间。
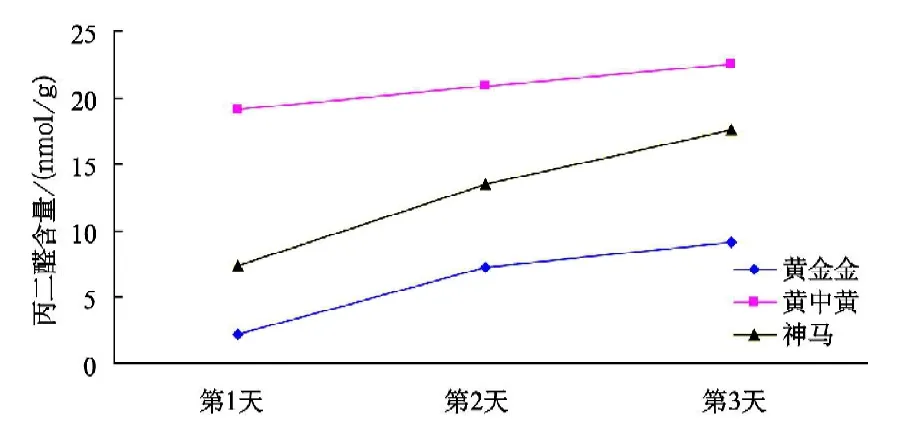
图5 不同品种菊花在处理(2)条件下的丙二醛含量变化
由图6可看出,在处理(3)条件下,3个菊花品种的耐高温顺序为“黄金金”>“神马”>“黄中黄”,且其丙二醛含量第2天比第1天有所增加,其中“黄金金”增加程度最大,“神马”次之;到第3天时,“黄中黄”已经死亡,“黄金金”与“神马”的丙二醛含量仍在增加,且丙二醛含量“神马”多于“黄金金”。
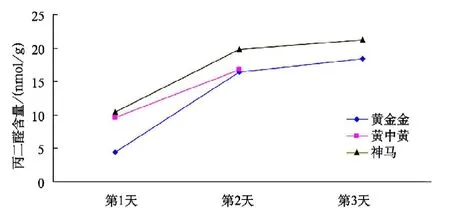
图6 不同品种菊花在处理(3)条件下的丙二醛含量变化
2.3 不同品种菊花在不同温度下的电导率变化
由表3表明,3个菊花品种在不同高温胁迫下的电导率变化。由图7可知,在处理(1)条件下,3个菊花品种的耐高温顺序为“黄金金”>“黄中黄”>“神马”,且其电导率均呈下降趋势,但“黄中黄”和“神马”2个品种的电导率下降幅度不明显,可认为基本上没有变化,属于试验误差和生理变化合理范围,同时,“黄中黄”和“神马”最后一天的电导率都比“黄金金”高,而“神马”的电导率稍高于“黄中黄”。
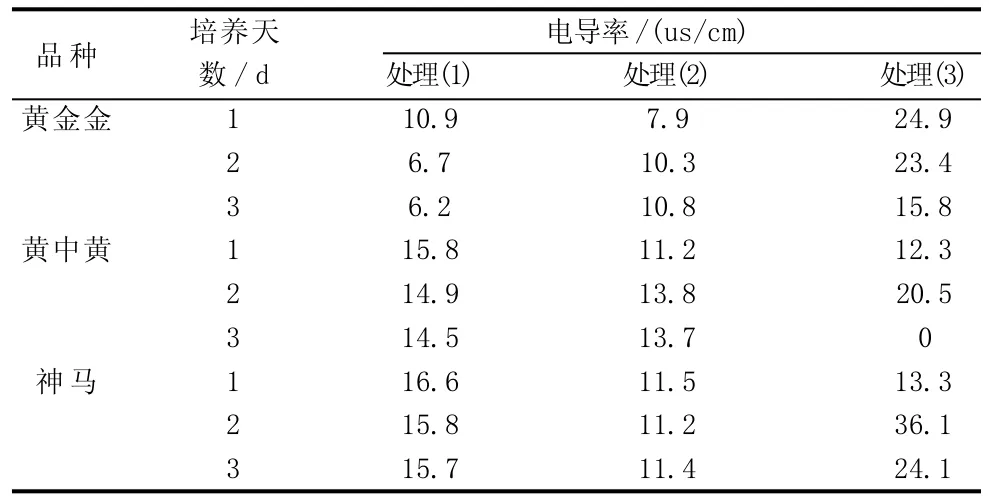
表3 不同菊花品种在不同温度下的电导率变化

图7 不同品种菊花在处理(1)条件下的电导率变化
由图8可知,在处理(2)条件下,3个菊花品种的耐高温顺序为“黄金金”>“神马”>“黄中黄”,由于高温影响,“黄金金”的电导率呈上升趋势,“黄中黄”的电导率则先升高后下降,“神马”的电导率为先降后升但幅度不大,可视为无变化。
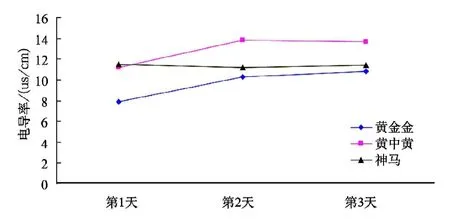
图8 不同品种菊花在处理(2)条件下的电导率变化
由图9可知,在处理(3)条件下,3个菊花品种的耐高温顺序为“黄金金”>“神马”>“黄中黄”,其中“黄金金”的电导率呈下降趋势,“神马”的电导率第2天剧烈上升但第3天显著下降,“黄中黄”的电导率第2天剧烈上升后在第3天已死亡。
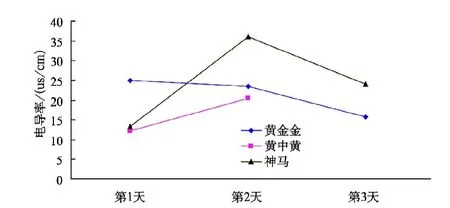
图9 不同品种菊花在处理(3)条件下的电导率变化
3 结论与讨论
3.1 结 论
本试验对叶绿素的测定结果表明,3个菊花品种在处理(1)条件下的耐高温顺序为“黄金金”>“神马”>“黄中黄”,在处理(2)条件下的耐高温顺序为“神马”>“黄金金”>“黄中黄”,在处理(3)条件下的耐高温顺序为“神马”>“黄金金”>“黄中黄”。对丙二醛的测定结果表明,3个菊花品种在处理(1)条件下的耐高温顺序为“神马”>“黄金金”>“黄中黄”,在处理(2)条件下的耐高温顺序为“黄金金”>“神马”>“黄中黄”,在处理(3)条件下的耐高温顺序为“黄金金”>“神马”>“黄中黄”。对电导率的测定结果表明,3个菊花品种在处理(1)条件下的耐高温顺序为“黄金金”>“黄中黄”>“神马”,在处理(2)条件下的耐高温顺序为“黄金金”>“神马”>“黄中黄”,在处理(3)条件下的耐高温顺序为“黄金金”>“神马”>“黄中黄”。
综上所述,3个菊花品种中,“黄金金”和“神马”都耐热,其中“黄金金”比“神马”更耐热一些,而“黄中黄”最不耐热,所以3个菊花品种的耐高温顺序为“黄金金”>“神马”>“黄中黄”。
3.2 讨 论
前人研究表明,高温是改变生物膜结构和破坏其功能的一个重要的胁迫因子,所以细胞膜被认为是受热害影响的主要部位[7];丙二醛是膜脂过氧化产物,膜透性增大会引起电导率升高;高温胁迫可诱导光系统Ⅱ活性中心转化为无活性中心,导致叶绿体的结构发生改变,引起叶绿素降解[7];电导率法测定细胞膜渗透性和叶绿素荧光法测定光合器官的稳定性作为一个有效手段已被广泛用于植物的抗热性研究。参考以上研究,本试验以3个菊花品种为材料,设置了3个不同高温梯度,对植株进行了3d的高温胁迫,依此来判断3个菊花品种的耐热性,最终得出了“黄金金”最耐热、“神马”次之、“黄中黄”最不耐热的结论。但由于以前的研究中没有其它菊花品种耐热性比较试验的报道,所以在菊花品种扩充、温度梯度设置和处理天数方面还有待进一步研究。
同时,在试验条件方面,所用的光照培养箱加温方式是热吹风加热,易造成局部温度不均,对植株造成水分胁迫、烧伤等方面的伤害,这可能是导致“黄中黄”在第3天死亡的原因,也是需要加以改进的方面。
此外,关于菊花植株苗龄的选择没有相关报道,本试验选用的植株苗龄可能不适合,导致植株对高温胁迫的抵抗力弱,这可能也是导致“黄中黄”在第3天死亡的原因,故植株苗龄的选择也有待进一步研究。
[1] 李云,张钢,杨际双.热激锻炼对高温胁迫下菊花生理代谢的影响[J].植物科学学报,2008,26(2):175-178.
[2] 何亚丽,刘友良,陈权,等.水杨酸和热锻炼诱导的高羊茅幼苗的耐热性与抗氧化的关系[J].分子植物,2002,28(2):89-95.
[3] 周人纲,樊志和,李晓芝,等.热锻炼对小麦叶片细胞膜及有关酶活性的影响[J].作物学报,1995,21(5):568-572.
[4] 耶兴元,范宏伟,仝胜利,等.热激锻炼诱导猕猴桃耐热性研究[J].果树学报,2005,22(6):630-633.
[5] 吴斌.萝卜耐热性鉴定与热激蛋白基因克隆[D].南京:南京农业大学,2007.
[6] 张志良,瞿伟菁,李小方.植物生理学试验指导[M].4版.北京:高等教育出版社,2009.
[7] 商侃侃,张德顺,王铖.高温胁迫下植物抗性生理研究进展[J].园林科技,2008(1):1-5.
2017-03-22

