稳定同位素标记衍生化结合液相色谱串联质谱在生物样本中小分子代谢物分析的研究进展
何昀潞++罗彦波++陈欢++侯宏卫++胡清源+��
摘要稳定同位素标记衍生化 (Isotope coded derivatization,ICD)是通过化学衍生化反应对目标物的特定官能团进行同位素标记的技术,结合液相色谱串联质谱(LCMS/MS),可对具有相同标记反应特性的生物分子进行系统分析。该技术可以有效解决复杂生物基质分析中灵敏度不足与定量分析中同位素内标化合物有限的问题,近年来在代谢组学研究领域得到了广泛的应用。本文介绍了ICD方法及试剂的设计,对近年来针对羧基、氨基、羰基、巯基和羟基的ICD试剂以及结合LCMS/MS在生物样本中小分子代谢物分析的研究进展进行了评述。
关键词同位素标记; 衍生化; 液相色谱串联质谱; 代谢物; 生物样本; 评述
1引 言
小分子代谢物作为人体内生物过程的中间体和终产物,是正常生理过程、病理过程以及对治疗干预的药理学反应的重要指标\[1\]。研究体液和组织中小分子代谢物水平的变化,可深入了解代谢通路和疾病机制并有助于疾病的诊疗与预后。但复杂生物样本中的代谢物,一般含量较低,基质对分析和测定的干扰较大,直接对其进行分析往往难以达到理想的检测要求。而衍生化可以通过化学反应改变目标化合物的结构和性质,将难于分析检测的目标物定量地转化为更适合特定分析的化合物\[2\]。随着对生命科学领域研究的不断深入,代谢组学研究中对小分子代谢物的定量分析日益重要。基于同位素标记内标化合物的同位素稀释法可获得精准可靠的绝对定量分析结果,但同位素内标物合成困难且昂贵,商品化的种类有限,难以获取所有目标分析物的同位素内标是不现实的,从而限制了该定量方法的广泛应用\[3\]。
近年来,为了克服对同位素标记内标化合物的依赖,一些课题组采用稳定同位素标记衍生化(Isotope coded derivatization,ICD)技术\[4~7\],通过衍生化反应分别向生物样本及其对照组引入化学结构相同,但质量不同的稳定同位素标签,再利用LCMS/MS对两组样本进行比较,确定目标物的含量变化。这种标记方法使具有相同官能团的一类分析物同时获得相应的同位素衍生物,将同位素标记的分析物作为内标可以提高定量分析的精确度和准确度,并解决同位素内标物获取困难的问题。此外,ICD借助衍生化反应引入的同位素标签,能够增加分析物的电离效率,改善其在LCMS/MS中的色谱质谱行为,提高方法的灵敏度与选择性\[8~10\]。基于ICD的LCMS/MS方法能够对复杂生物基质中具有相同标记反应特性的生物分子进行定量分析、差异分析及谱图分析,具有广泛的应用前景。现已有数篇关于小分子代谢物\[3, 11~15\]和定量蛋白组学\[15~17\]等方面的ICD综述,而本文是以ICD试剂靶向的目标物官能团进行分类,以ICD试剂为导向,总结了近几年报道的ICD试剂及其结合LCMS/MS在动物样本中小分子代谢物的最新进展。
2穩定同位素标记衍生化技术
ICD最早出现在蛋白组学相对定量研究中,主要用于鉴定和定量分析不同时期生物样本中蛋白质表达的差异。随着新型ICD试剂的不断出现,该技术已扩展到代谢组学和转化医学等领域。这种标记策略将化学反应与生物分析有机结合在一起,产生了更大的实际应用价值。
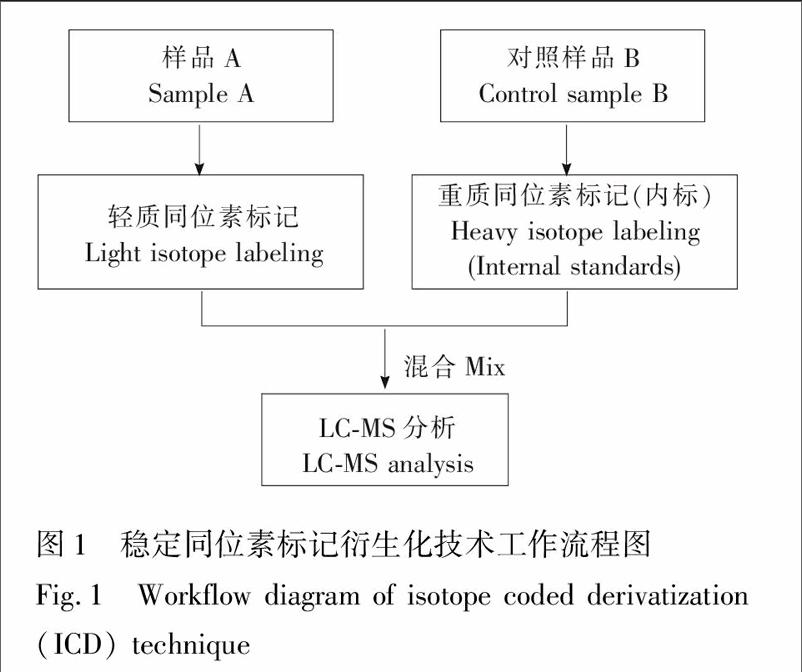
ICD技术是以待分析物的目标基团为反应活性部位,通过特定的化学反应使其与ICD试剂相连,从而将不同同位素标记形式的质量差异标签引入到目标物中。应用ICD进行相对定量分析的基本原理是:轻质和重质同位素标记试剂分别与两份样本中的目标物进行衍生化反应,按比例混合后进入LCMS/MS分析,最后根据“轻”“重”衍生物产生的离子对的峰面积比值即可对含相同功能基团的系列组分进行相对定量分析,其工作流程见图1\[3\]。当其中一组样本是浓度已知的标准品时,将其衍生物作为内标物,可以实现样本中目标组分的绝对定量分析。如ICD试剂采用多种同位素编码的标签,可对目标物进行多重定量分析标记,适用于多组样本间的同时比较及生物学过程的动态监测,提高了分析效率和实验的重复性。其中利用同位素标记相对和绝对定量分析(iTRAQ)和串联质量标签(TMT)可对多肽的氨基分别实现八重\[18\]和十重\[19\]标记。Dephoure等\[20\]将三重代谢标记与六重TMT结合,实现了18组样本的同时分析,大大提高了蛋白质组相对定量分析的通量。
由于“轻”“重”衍生物只相差几个确定的质量数,具有相同的结构,理化性质相似,洗脱时间和质谱离子化能力几近相同,通过比较衍生物的质谱响应信号,可实现两个比较样本中代谢物的差异分析,随后进行数据统计分析和数据库搜索,有助于潜在生物标志物的发现。ICD还可以有效解决次级代谢物分析时感兴趣的目标物与背景峰区分困难的问题。所有衍生的分析物在质谱图中呈现特定质量差值(等于同位素标签的质量差×标记位点数量,如:H4/D4标记试剂的质量差为4 Da×官能团数量)且保留时间相同的一对峰,而背景峰和未衍生的分析物呈现单峰,从而有利于目标物的鉴定\[21\]。
ICD试剂的设计和选择是ICD技术的关键步骤。ICD试剂一般由三部分组成:与目标物官能团反应的反应基团;为目标物的衍生物提供不同质量的同位素标签;用于提高目标分析物分离性和可检测性的性能修饰基团,包括质子亲和、易离子化、带电荷和疏水基团。当目标物的疏水性提高时,反相色谱(RPLC)可以采用有机溶剂比例更高的流动相,这种流动相适合电喷雾电离(ESI)中带电液滴的产生,因而ESIMS响应更高\[8\]。理想的ICD试剂需满足如下要求\[3, 22\]:(1)“轻”“重”同位素试剂易合成,且成本较低;(2)衍生化反应足够稳健以抵抗各种复杂的基质成分,并在温和的条件下获得高产量;(3)特异性地与目标物官能团反应,过量的衍生化试剂或副产物不干扰样本的分离和检测;(4)“轻”“重”同位素试剂衍生化的反应时间、过程及产率均相同;(5)“轻”“重”衍生物在色谱分离中同位素效应不明显,色谱行为一致,可以有效地校正保留时间漂移产生的基质效应;(6)衍生物通过低能碰撞诱导裂解(CID)产生相同的特征子离子或中性碎片(来源于ICD试剂),与母离子结构无关等。
ICD与 LCMS/MS相结合具有以下优势,可以在大气压化学电离(APCI)模式下向分析物引入高亲电或亲核的结构,在ESI模式下引入永久性带电荷或易离子化的结构,提高检测灵敏度\[8\];增加高极性和高亲水性化合物的疏水能力,使其在RPLC上得以保留并分离;增加分析物的稳定性以及低分子量化合物的分子量;标记对象广泛,同时获得具有相同标记反应特性的某类分析物的同位素内标物;校正基质效应和每次运行间的电离差异,提高定量分析的精确度和准确度\[23\];易于未知代谢物的鉴定等。
3稳定同位素标记衍生化的应用
ICD 结合LCMS/MS的方法适用于生物样本中代谢物的定量分析、差异分析及次级代谢物的谱图分析。本文以ICD试剂靶向的目标物官能团进行分类,重点介绍了针对不同基团的ICD试剂并对该方法在动物样本中羧酸类、胺类、含羰基、含巯基和含羟基代谢物研究中的应用进行评述。
3.1羧酸类化合物羧酸类化合物在生物分子中占有极大的比例,已被证明与2型糖尿病、肥胖和代谢综合征等疾病和生理病理学紊乱有着极为重要的关系。羧酸类化合物可在MS负离子模式下检测,但灵敏度通常较低,同时用于分离羧酸类化合物的流动相并不总与ESIMS相容\[12\]。因此,常在分析前将其衍生为易离子化、更疏水或碱性的衍生物,使其在ESI或APCI正离子模式下具有更高的灵敏度。常用于靶向羧基的ICD试剂及其应用分别示于图2与表1中。
Guo等\[31\]设计并合成了一对羧基ICD试剂12C2/13C2对二甲氨基苯甲酰甲基溴(DMPABr,图2A)。DMPABr衍生物主要包含三个部分:提高检测灵敏度的叔胺基团,增加疏水性进而改善RPLC保留的芳环以及利于代谢物鉴定和准确量化的同位素标签。DMPABr衍生物的信号增强了2~4个数量级,但胺类可与DMPABr反应抑制羧酸类化合物的信号。Peng等\[24\]对该方法加以改进,在DMPABr标记前使用液液萃取富集羧酸化合物。液液萃取在酸性条件下(pH约为1)可有效地分离胺类与羧酸类化合物,并将样本中降低标记效率的水移除\[24\]。
2,4二甲氧基6哌嗪基嘧啶(DMPP,图2B)是一种高专一性的羧基标记试剂,在基于碳二亚胺缩合的标记条件下,15 s即可实现快速标记且不需要诸如高温等苛刻的反应条件。DMPP具有高质子亲合能(嘧啶环)和适中的疏水性,可提高多种含羧基化合物,如小分子有机酸、脂肪酸、多肽、蛋白质等底物的质谱响应\[5\]。H6/D6DMPP试剂已应用于尿液\[5\]和甲状腺组织\[25, 26\]中脂肪酸的定量分析及差异分析。
二甲基乙二胺(DMED,图2C)中的叔胺基团能够提高羧酸类化合物的质子亲和力,使其在ESI源中更易电离。Zhu等\[27\]借助H4/D4DMED将血清中19种类花生酸的灵敏度增加了5~138倍,实现了类花生酸同分异构体的色谱分离。该课题组将H4/D4DMED试剂与双中性丢失扫描(QNLS)相结合实现了脂溶性羧酸类代谢物的全面分析,在ESI源中,轻重标记的DMED衍生物分别特异性地丢失质量为45和49 Da的中性碎片二甲胺,产生含有特定质量差(4 Da×羧基数)且保留时间相同的离子对,与全扫描模式相比,QNLS能显著提高檢测准确度和选择性,有益于目标物的鉴定(图3)\[21\]。
Ogawa等\[28\]合成了H4/D41\[(4二甲基氨基苯基)羰基\]哌嗪(DAPPZ,图2D),用于二十碳五烯酸(EPA)和花生四烯酸(AA)的定量分析,衍生物的酰胺键断裂产生特征性产物离子m/z 148。EPA和AA的羧基经衍生化后,MS检测灵敏度分别提高了100和300倍。
Han等\[29\]利用12C6/13C63硝基苯肼(3NPH,图2E)对10种肠道微生物来源的2~6个碳的短链脂肪酸(SCFA)进行定量分析,获得了良好的精密度(≤8.8%)和准确度(93.1%~108.4%)。但该方法缺乏衍生化后的淬灭步骤,可能导致NPH与残留乙酸(LCMS系统常见的共溶剂)发生非预期反应。而Chan等\[30\]利用12C6/13C6苯胺(图2F)对15种SCFAs建立的定量分析方法,优化了苯胺衍生化反应的淬灭条件,几乎消除了乙酸的在线衍生。
上述ICD试剂衍生化反应简单易行,标记效率高,不仅凭借同位素标签实现了羧酸类化合物的准确定量分析,还通过引入质子亲合能高和疏水性强的基团(哌嗪基、嘧啶基和苯环等),大大提高了质谱仪从复杂生物样本中检测羧酸类化合物的能力。与上述LCMS/MS方法相比,ICD较少应用于气相色谱串联质谱(GCMS/MS)对羧酸类代谢物的分析中。Bruheim等\[11\]综述了3种ICD结合GCMS的分析策略,其中H3/D3氯甲酸甲酯(MCF,图2G)\[32\]和H6/D6N(特丁基二甲基硅)N甲基三氟乙酰胺(MTBSTFA,图2H)\[33\]可用于分析羧酸代谢物。由于氯甲酸烷基酯在水相介质中与氨基和/或羧基衍生化快速,衍生物稳定,并且可以对氨基和羧基分别进行标记,最近,Tumanov等\[34\]将H3/D3MCF应用于大鼠肝脏、血浆和尿液中氨基酸和非氨基有机酸的定量分析。
3.2胺类化合物
胺类代谢物,如氨基酸、神经递质和生物胺等在生物功能中起着重要作用。研究表明,体液中胺类代谢物的失调与帕金森、阿尔茨海默症和肾癌等疾病相关\[1\]。胺类物质在酸性条件下通常容易质子化,在ESIMS正离子模式下能达到合适的灵敏度,但其碱性、强极性及高水溶性等特点,使其难以在RPLC中保留,离子抑制效应严重\[35\]。而通过衍生化将胺转化为疏水性更高的化合物,可以使得衍生物在RPLC上更易与干扰物分离且提高检测灵敏度。图4与表2分别显示了靶向氨基的ICD试剂及其应用。
丹磺酰试剂在碱性介质中可以对一级胺、二级胺和酚羟基实现快速标记,而不包括叔胺和醇羟基类化合物。丹磺酰化能够改善分析物的带电性和疏水性,引入的碱性叔胺基在酸性LC流动相中易离子化,萘基能增加衍生物的疏水性及其在RPLC上的保留\[36\]。丹磺酰氯(DNSCl,图4A)可将胺、氨基酸和苯酚ESI正离子响应信号增强1~3个数量级\[4\], 该试剂现已应用于尿液\[4, 38~40\]、 汗液\[36\]、 脑脊液\[37\]和粪便\[39\]等样本的次级代谢物分析及生物标志物的发现。5二乙基氨基萘1磺酰氯(DENSCl,图4B)在结构上与DNSCl类似,其中连接到萘基胺的两个甲基被乙基替代,乙基可以增加疏水性并提供更强的给电子倾向,使得DENSCl衍生物在离子化时有更强的表面活性而易生成更多的气相离子,并具有更高的质子亲和力\[41\]。此外,DENSCl可形成3种同位素质量差异标签(12C4/12C213C2/13C4),能同时对3个样本进行分析,比DNSCl双重同位素试剂(12C2/13C2)具备更高的灵敏度和分析速度\[41\]。
N羟基琥珀酰亚胺(NHS)酯为羧酸活性酯, 是一级胺和二级胺的高反应性亲电试剂, 且具有副产物及过量试剂不干扰分离和检测的优点,除了已实现商品化的iTRAQ试剂(图4C)外,近年也开发了焦谷氨酸NHS酯(PGAOSu,图4D)\[7\]、苯甲酸NHS酯(BZOSu,图4E)\[45\]、4二甲基氨基苯甲酰氨基乙酸NHS酯(DBAANHS,图4F)\[44\]、4甲氧基苯甲酰氨基乙酸NHS酯(MBAANHS,图4G)\[44\]、甲基哌嗪基丁酸NHS酯(MPBS,图4H)\[43\]和二甲基氨基丁酸NHS酯(DMABS,图4I)\[43\]等ICD试剂。Wagner 等\[45\]利用12C6/13C6BZOSu相对定量分析含氨基代谢物,未衍生的胺类代谢物大多在1.5 min内洗脱,而BZOSu衍生物因苯基的引入,色谱保留增加,分离度改善且具有更高的信号响应(图5)。Toyo′oka课题组开发了一系列用于手性氨基酸和羧酸次级代谢组学的衍生化试剂\[7, 4649\]。借助手性试剂H5/D5LPGAOSu, 9种疏水性D/L氨基酸在1.7 μm的十八烷基甲硅烷基(ODS)柱上实现对映体分离\[7\]。Zhou等\[44\]设计并合成了两种氨基ICD试剂DBAANHS和MBAANHS,由于二甲基氨基在ESI源中更易质子化,DBAANHS比MBAANHS提高代谢物灵敏度的能力更显著。但MBAANHS衍生物在MS3(源内CID加MS/MS)中可以产生更多有价值的碎片离子以提供目标物的结构信息,从而有助于代谢物的鉴定\[44\]。
上述氨基标记试剂的衍生条件简单,衍生物稳定且可以显著增强胺类化合物的离子化效率。但由于丹磺酰基和NHS酯较高的反应活性,这些氨基ICD试剂还能与酚羟基类和巯基类化合物发生反应,不能实现对氨基专一性的标记。因此,进一步开发新型氨基特异性ICD试剂是很有必要的。
3.3含羰基化合物
内源性含活性羰基的醛和酮,通常与糖代谢和氧化应激相关,其参与神经退行性疾病、糖尿病及并发症和动脉粥样硬化等多种疾病的发展\[50\]。在使用大气压离子化技术时,醛和酮的中性羰基会降低离子化效率。通过衍生化反应引入带电荷的结构,可以提高羰基化合物的电离效率,消除脂肪醛和脂肪酮的挥发性和反应性,使其更适于LCMS分析。常用于标记含羰基化合物的ICD试剂及其应用分别示于图6与表3中。
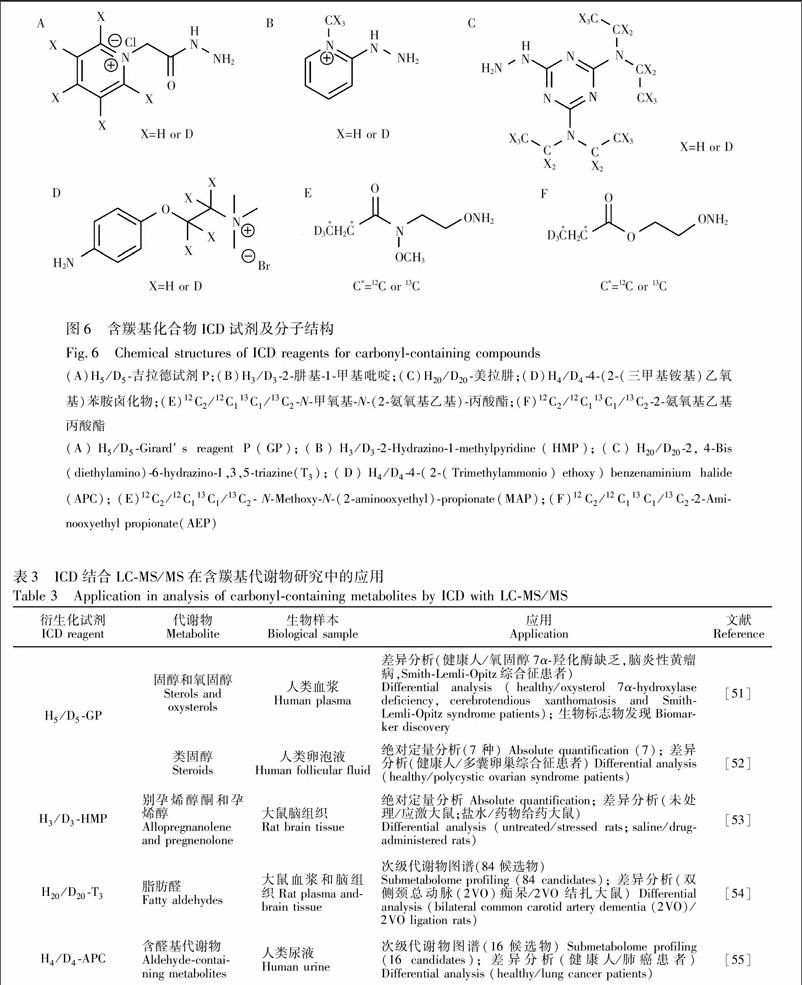
羰基ICD试剂吉拉德试剂P(GP,图6A)主要由能够改善分析物色谱质谱行为的季铵和与羰基反应的肼两部分组成,H5/D5GP已应用于血清中含3酮和3β羟基的固醇\[51\]及人卵泡液中7种类固醇\[52\]的分析。
2肼基1甲基吡啶(HMP,图6B)可用于含羰基化合物的标记,HMP衍生物的电离效率相当高且在CID下产生特征性的子离子m/z 108。但由于会形成多个带电离子(\[M-H\]
Symbolm@@ 和\[M\]2+)及其它碎片离子,HMP并不适用于多羰基化合物的衍生化\[56\]。Higashi等\[53\]利用H3/D3HMP对大鼠脑内别孕烯醇酮(AP)及其前体孕烯醇酮(PREG)进行量化和差异分析,AP和PREG的灵敏度分别提高了500和3000倍,方法的精密度和准确度也得以显著提高。
Tie等\[54\]建立了利用美拉肼(T3,图6C)对内源性脂肪醛进行全面表征的策略,衍生化在37℃反应15 min,衍生化效率>98%,检测限低至0.1~1.0 pg/mL。T3能增加脂肪醛的疏水性及色谱保留,改善分离度,并通过引入的碱性基团大幅增强了离子化效率。
4(2(三甲基铵基)乙氧基)苯胺卤化物(APC,图6D)是一种醛基标记试剂,其中的苯胺能选择性地与含醛基化合物快速反应,季铵基团可以改善MS灵敏度。Yu等\[55\]在QNLS下通过特异性地监测H4/D4APC衍生物碰撞产生的中性碎片(87和91 Da),实现了对尿液中含醛基代谢物的非靶向分析。
(A)H5/D5吉拉德试剂P;(B)H3/D32肼基1甲基吡啶;(C)H20/D20美拉肼;(D)H4/D44(2(三甲基銨基)乙氧基)苯胺卤化物;(E)12C2/12C113C1/13C2N甲氧基N(2氨氧基乙基)丙酸酯;(F)12C2/12C113C1/13C22氨氧基乙基丙酸酯
(A)H5/D5Girard′s reagent P(GP);(B)H3/D32Hydrazino1methylpyridine(HMP);(C)H20/D202,4Bis(diethylamino)6hydrazino1,3,5triazine(T3);(D)H4/D44(2(Trimethylammonio)ethoxy)benzenaminium halide(APC); (E)12C2/12C113C1/13C2 NMethoxyN(2aminooxyethyl)propionate(MAP);(F)12C2/12C113C1/13C22Aminooxyethyl propionate(AEP)
GP、HMP和T3这类含有肼基的ICD试剂,衍生化条件相对苛刻(如高温或酸性介质),同时由于肼还能与小分子羧酸发生反应,标记反应缺乏特异性\[57\]。而APC衍生化反应条件温和(pH 5.7,10℃),无需额外的样本预处理步骤,对醛的特异性较高。此外,氨氧基试剂,如N甲氧基N(2氨氧基乙基)丙酸酯(MAP,图6E)\[58\]和2氨氧基乙基丙酸酯(AEP,图6F)\[59\]可用于羰基化合物的GCMS/MS分析中,利用AEP或MAP与羰基发生肟化反应生成的肟醚在电子轰击源中碎裂生成同位素标记的乙基碳鎓离子(m/z 32~34),可实现多重分析中羰基化合物的鉴定与相对定量分析。
3.4含巯基和羟基化合物
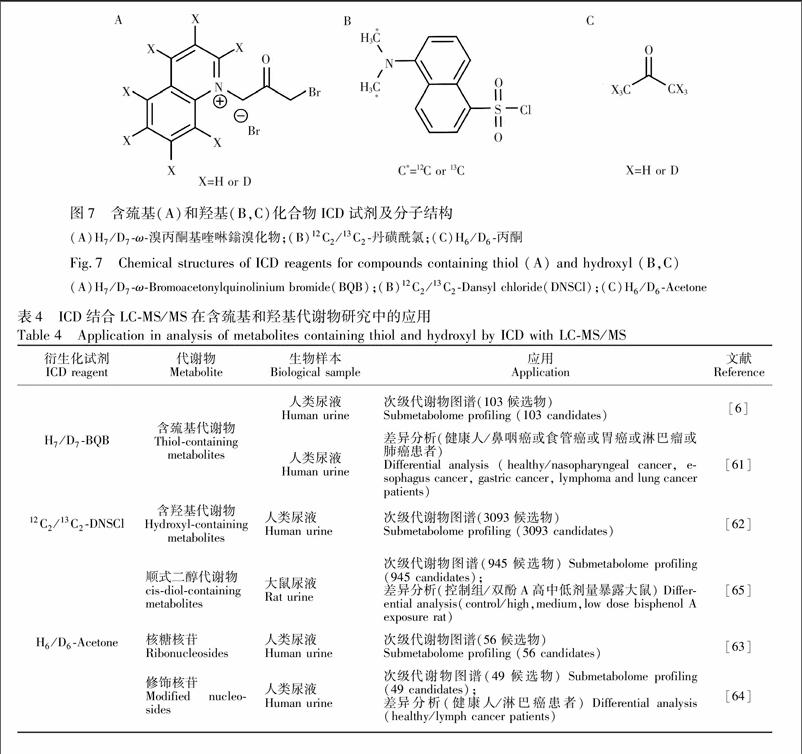
硫醇分析的主要问题在于不稳定性,因为游离的巯基反应活性高,可通过自氧化和硫醇二硫化物的交换反应转化为氧化硫醇\[60\]。而ω溴丙酮基喹啉鎓溴化物(BQB,图7A)可与巯基烷基化反应生成硫醇喹啉鎓加合物,稳定巯基的同时引入永久带电的结构,增加MS检测灵敏度。Liu等\[6\]利用H7/D7BQB在母离子扫描模式下监测衍生物CS键断裂产生的离子(m/z 218和225),实现了含巯基代谢物的非靶向分析。该课题组也将H7/D7BQB应用于健康人和5种癌症患者尿液中含巯基代谢物的差异分析\[61\]。
含羟基化合物在LC流动相的酸度范围内通常是中性的,缺乏可电离的基团,MS响应低,且一些羟基化合物较强的亲水性使其难以在RPLC中很好地保留。靶向羟基的ICD试剂能够增加含羟基化合物的色谱保留和电离效率,从而提高分析方法的灵敏度和重现性(应用列于表4)。DNSCl除了用于标记胺外,还可用于含羟基化合物的分析,通过液液萃取将羟基代谢物富集到乙酸乙酯层,干燥后复溶于乙腈中,接着将代谢物提取物用经碱激活的12C2/13C2DNSCl标记\[62\]。丙酮(图7C)可选择性地与含顺式二醇化合物反应,通过引入更疏水的异丙亚基阻断顺式邻二羟基以降低极性,从而改善其在反相色谱柱上的分离。Li等\[63\]利用H6/D6丙酮在QNLS下监测目标衍生物产生的中性碎片172 Da(H标核苷)和178 Da(D标核苷),对核糖核苷进行鉴定。Chu等\[64\]采用二氧化铈分散固相萃取法富集尿液中的
修饰核苷,同时选择性地捕获修饰核苷中的顺式邻二羟基,再用H6/D6丙酮对其进行同位素标记和分析,该方法可以显著降低基质效应,提高检测灵敏度并将非核糖结合物等假阳性结果最小化。
4总结与展望
随着ICD的不断发展,该项技术已经在简化样品复杂性、提高方法的灵敏度和准确度等方面逐渐显示出了强大的功能,为结构多样、样本来源复杂的代谢物的定量分析、差异分析以及谱图分析提供了很好的思路。但该技术仍存在诸多限制,如ICD试剂高昂的成本、衍生化苛刻的反应条件及时间的耗费、标记效率的有限性、部分ICD试剂与待分析物的专一性不强、后续分离检测过程引入的定量分析误差等。此外,H/D同位素標记试剂的衍生物存在同位素效应,其色谱行为差异会影响定量分析结果的准确性。但该问题可以通过减少D的个数,并将标记位点选择在亲水基团附近,或者选用12C/13C或14N/15N同位素标记试剂而得以缓解。 ICD试剂在廉价易得、对靶标分析物具有更高的反应性及特异性、更加准确灵敏、适合高通量及大规模定量分析等方面仍具有很大的发展空间。相信随着新型ICD试剂与标记策略的不断发展和改进,ICD技术将为生物体内重要分子的代谢途径、疾病作用机制的阐述,生物标志物的发现以及疾病的诊疗和预后提供更可靠的信息,必将得到更广泛的应用。
References
1Mamas M, Dunn W B, Neyses L, Goodacre R. Arch. Toxicol., 2011, 85(1): 5-17
2Zhu Y T, Deng P, Zhong D F. Bioanalysis, 2015, 7(19): 2557-2581
3Toyo′oka T. J. Pharm. Biomed. Anal., 2012, 69: 174-184
4Guo K, Li L. Anal. Chem., 2009, 81(10): 3919-3932
5Leng J, Wang H, Zhang L, Zhang J, Wang H, Guo Y. Anal. Chim. Acta, 2013, 758: 114-121
6Liu P, Huang Y Q, Cai W J, Yuan B F, Feng Y Q. Anal. Chem., 2014, 86(19): 9765-9773
7Mochizuki T, Todoroki K, Inoue K, Min J Z, Toyo′oka T. Anal. Chim. Acta, 2014, 811: 51-59
8Xu F, Li Z, Liu Y, Zhang Z, Ong C N. Mass Spectrom. Rev., 2011, 30(6): 1143-1172
9Ilisz I, Berkecz R, Péter A. J. Pharm. Biomed. Anal., 2008, 47(1): 1-15
10Qi B L, Liu P, Wang Q Y, Cai W J, Yuan B F, Feng Y Q. TrACTrends Anal. Chem., 2014, 59: 121-132
11Bruheim P, Kvitvang H F N, VillasBoas S G. J. Chromatogr. A, 2013, 1296: 196-203
12Baghdady Y Z, Schug K A. J. Sep. Sci., 2016, 39(1): 102-114
13Higashi T, Ogawa S. J. Pharm. Biomed. Anal., 2016, 130: 181-193
14Freund D M, Hegeman A D. Curr. Opin. Biotechnol., 2017, 43: 41-48
15Chapman H M, Schutt K L, Dieter E M, Lamos S M. Bioanalysis, 2012, 4(20): 2525-2541
16Zhou Y, Shan Y, Zhang L, Zhang Y. J. Chromatogr. A, 2014, 1365: 1-11
17Chahrour O, Cobice D, Malone J. J. Pharm. Biomed. Anal., 2015, 113: 2-20
18Ow S Y, Cardona T, Taton A, Magnuson A, Lindblad P, Stensj K, Wright P C. J. Proteome Res., 2008, 7(4): 1615-1628
19Werner T, Sweetman G, Savitski M F, Mathieson T, Bantscheff M, Savitski M M. Anal. Chem., 2014, 86(7): 3594-3601
20Dephoure N, Gygi S P. Sci. Signal., 2012, 5(217): rs2
21Zhu Q F, Zhang Z, Liu P, Zheng S J, Peng K, Deng Q Y, Zheng F, Yuan B F, Feng Y Q. J. Chromatogr. A, 2016, 1460: 100-109
22Higashi T, Ogawa S. J. Steroid Biochem. Mol. Biol., 2016, 162: 57-69
23Fang N, Yu S, Ronis M J, Badger T M. Exp. Biol. Med., 2015, 240(4): 488-497
24Peng J, Li L. Anal. Chim. Acta, 2013, 803: 97-105
25Leng J, Guan Q, Sun T, Wu Y, Cao Y, Guo Y. J. Pharm. Biomed. Anal., 2013, 84: 256-262
26Leng J P, Guan Q, Sun T Q, Wang H Y, Cui J L, Liu Q H, Zhang Z X, Zhang M Y, Guo Y L. Anal. Chim. Acta, 2015, 887: 148-154
27Zhu Q F, Hao Y H, Liu M Z, Yue J, Ni J, Yuan B F, Feng Y Q. J. Chromatogr. A, 2015, 1410: 154-163
28Ogawa S, Tomaru K, Matsumoto N, Watanabe S, Higashi T. Biomed. Chromatogr., 2016, 30(1): 29-34
29Han J, Lin K, Sequeira C, Borchers C H. Anal. Chim. Acta, 2015, 854: 86-94
30Chan J C Y, Kioh D Y Q, Yap G C, Lee B W, Chan E C Y. J. Pharm. Biomed. Anal., 2017, 138: 43-53
31Guo K, Li L. Anal. Chem., 2010, 82(21): 8789-8793
32Kvitvang H F N, Andreassen T, Adam T, VillasBas S G, Bruheim P. Anal. Chem., 2011, 83(7): 2705-2711
33Huang X, Regnier F E. Anal. Chem., 2008, 80(1): 107-114
34Tumanov S, Zubenko Y, Obolonkin V, Greenwood D R, Shmanai V, VillasBas S G. Metabolomics, 2016, 12(4): 64
35Claeson A S, Ostin A, Sunesson A L. Anal. Bioanal. Chem., 2004, 378(4): 932-939
36Hooton K, Han W, Li L. Anal. Chem., 2016, 88(14): 7378-7386
37Guo K, Bamforth F, Li L. J. Am. Soc. Mass Spectrom., 2011, 22(2): 339-347
38Tao H, Wu Y, Tang C, Lin G, Li L. Anal. Chem., 2015, 87(19): 9838-9845
39Su X, Wang N, Chen D, Li Y, Lu Y, Huan T, Xu W, Li L, Li L. Anal. Chim. Acta, 2016, 903: 100-109
40Peng J, Guo K, Xia J, Zhou J, Yang J, Westaway D, Wishart D S, Li L. J. Proteome Res., 2014, 13(10): 4457-4469
41Zhou R, Guo K, Li L. Anal. Chem., 2013, 85(23): 11532-11539
42Takach E, O′Shea T, Liu H. J. Chromatogr. B, 2014, 964: 180-190
43Johnson D W. J. Chromatogr. B, 2011, 879(17-18): 1345-1352
44Zhou R, Huan T, Li L. Anal. Chim. Acta, 2015, 881: 107-116
45Wagner M, Ohlund L B, Shiao T C, Vézina A, Annabi B, Roy R, Sleno L. Rapid Commun. Mass Spectrom., 2015, 29(18): 1632-1640
46Mochizuki T, Takayama T, Todoroki K, Inoue K, Min J Z, Toyo′oka T. Anal. Chim. Acta, 2015, 875: 73-82
47Mochizuki T, Taniguchi S, Tsutsui H, Min J Z, Inoue K, Todoroki K, Toyo′oka T. Anal. Chim. Acta, 2013, 773: 76-82
48Nagao R, Tsutsui H, Mochizuki T, Takayama T, Kuwabara T, Min J Z, Inoue K, Todoroki K, Toyo′oka T. J. Chromatogr. A, 2013, 1296: 111-118
49Takayama T, Kuwabara T, Maeda T, Noge I, Kitagawa Y, Inoue K, Todoroki K, Min J Z, Toyo′oka T. Anal. Bioanal. Chem., 2015, 407(3): 1003-1014
50Ellis E M. Pharmacol. Ther., 2007, 115(1): 13-24
51Crick P J, William B T, Abdelkhalik J, Matthews I, Clayton P T, Morris A A, Bigger B W, Zerbinati C, Tritapepe L, Iuliano L. Clin. Chem., 2015, 61(2): 400-411
52Guo N, Liu P, Ding J, Zheng S J, Yuan B F, Feng Y Q. Anal. Chim. Acta, 2016, 905: 106-114
53Higashi T, Aiba N, Tanaka T, Yoshizawa K, Ogawa S. J. Pharm. Biomed. Anal., 2016, 117: 155-162
54Tie C, Hu T, Jia Z X, Zhang J L. Anal. Chem., 2016, 88(15): 7762-7768
55Yu L, Liu P, Wang Y L, Yu Q W, Yuan B F, Feng Y Q. Analyst, 2015, 140(15): 5276-5286
56Yamashita K, Kobayashi S, Tsukamoto S, Numazawa M. Steroids, 2007, 72(1): 50-59
57Eggink M, Wijtmans M, Ekkebus R, Lingeman H, Esch I J P D, Kool J, Niessen W M A, Irth H. Anal. Chem., 2008, 80(23): 9042-9051
58Biladeau S K, Richmond W N, Laulhe S, Nantz M H. Anal. Methods, 2016, 8(18): 3704-3710
59Laulhe S, Geers T E, Shi X, Zhang X, Nantz M H. Anal. Methods, 2013, 5(18): 4701-4706
60Huang Y Q, Ruan G D, Liu J Q, Gao Q, Feng Y Q. Anal. Biochem., 2011, 416(2): 159-166
61Liu P, Qi C B, Zhu Q F, Yuan B F, Feng Y Q. Sci. Rep., 2016, 6: 21433
62Zhao S, Luo X, Li L. Anal. Chem., 2016, 88(21): 10617-10623
63Li S, Jin Y, Tang Z, Lin S, Liu H, Jiang Y, Cai Z. Anal. Chim. Acta, 2015, 864: 30-38
64Chu J M, Qi C B, Huang Y Q, Jiang H P, Hao Y H, Yuan B F, Feng Y Q. Anal. Chem., 2015, 87(14): 7364-7372
65Li S, Jin Y, Wang J, Tang Z, Xu S, Wang T, Cai Z. Analyst, 2016, 141(3): 1144-1153

