苯炔与Mannich碱反应制备稠合四氢喹啉
李文娟,骆学松,郭亮,何林,代斌*,郭旭虹
(石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室/材料化工新疆维吾尔自治区重点实验室,新疆石河子832003)
苯炔与Mannich碱反应制备稠合四氢喹啉
李文娟,骆学松,郭亮,何林,代斌*,郭旭虹
(石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室/材料化工新疆维吾尔自治区重点实验室,新疆石河子832003)
苯炔是一种高活性反应中间体,在有机合成化学和天然产物的合成领域有着广泛的应用。本文采用活泼的苯炔前体与Mannich碱构建稠合的取代四氢喹啉环。实验结果表明:苯炔前体和Mannich碱比例为1∶1.5,KF为氟源,18-冠-6为添加剂,乙腈为溶剂,室温下反应2 h条件下可得到最优的产率;共制备15种稠合取代四氢喹啉,产率在23%-70%之间。其反应机理可能是:钾离子与 18-crown-6相络合,使氟离子游离,从而进攻苯炔前体中的三甲基硅基,进行 1,2消除反应,原位生成苯炔;Mannich碱中的氮原子进攻苯炔的三键进行亲电加成反应,同时苯炔三键的另一端对羰基碳原子进行亲核加成,从而得到稠合四氢喹啉产物。
苯炔;Mannich碱;插入环化反应;构建;稠合取代四氢喹啉
苯炔是一种具有高度反应活性的有机合成中间体,由于其结构的特殊性以及较高的反应活性一直备受化学家的关注,在有机合成化学和天然产物的合成领域有着广泛的应用。由于苯炔合成条件苛刻,苯炔化学发展受限。直到1983年Kobayashi发现在很温和的条件下高效释放苯炔的方法,苯炔反应才得到了长足进展[1-6]。苯炔的1,3-偶极环加成是构建苯并五元杂环的有效方法,目前关于Kobayashi前体生成的苯炔与杂原子中心的1,3-偶极化合物,如重氮甲烷[7]、氧化腈[8]、硝酮[9]、腈亚胺[10]、叠氮化合物[11]的环加成已见于相关报道。近年来苯炔与共轭双键的D-A反应也受到学者们的广泛关注[12-19]。通过苯炔前体发生插入环化反应可构建含氧含氮杂环结 构[20-24]。
四氢喹啉衍生物具有广泛的生物活性,在很多天然产物和药物分子中都含有四氧喹啉结构单元[25],它是一种含氮杂环,常见于天然产物的结构单元中,具有潜在的生物活性,已成为医药、农药和有机功能材料等的核心,多年来研究合成杂环的方法得到了很大发展[26-28]。因此,以高活性的苯炔作为主要反应物,开发含四氢喹啉环的化合物合成的新反应、新方法和新策略在生物、医药、农药等领域具有重要的意义。本课题组2013年以苯炔与 α-氨基酮及β-氨基酮在温和条件下发生串联插入-环化反应,制备多取代的 N-芳基吲哚类及N芳基四氢喹啉类化合物,且反应条件温和,产率很高[29-30]。
本研究在以苯炔发生插入-环化串联反应合成吲哚和四氢喹啉的基础上,以苯炔和环状mannich碱(5,6-diphenyl-6,6a,7,8,9,10-hexahydrophenanthridin-10a(5H)-ol)为模型反应,构建了稠合苯并杂环,并进行了反应条件优化和反应普适性研究,提出了可能的反应机理。
1 实验部分
1.1 实验仪器与试剂
1H NMR(400 MHz)以TMs为内标,采用Bruker-DMX400型核磁共振仪(CDC13)为溶剂;溶剂回流干燥处理;薄层色谱板为青岛海洋化工厂GF254硅胶板;柱层析硅胶为青岛海洋化工厂生产(200-300目);其它化学试剂均为分析纯或化学纯,均为阿拉丁化学试剂公司生产。
1.2 实验步骤和化合物的结构表征
1.2.1 Mannich碱的合成[31]
在搅拌通氮气下依次将苯胺(5mmol,460 μL)、苯甲醛 (5 mmol,510 μL) 及环己酮(15 mmol,1.75 mL)加入到反应瓶中,最后加入催化剂ZrOCl2·8H2O(0.75 mmol,240 mg)。在室温下搅拌至点板监测反应完全。反应结束后加入15 mL乙酸乙酯过滤,再将滤液先用15 mL饱和碳酸氢钠溶液分3次洗涤,再用饱和氯化钠15 mL分3次洗涤,分液后滤液用无水 Na2SO4干燥,柱层析(PE∶EA=25∶1)分离后得到白色固体。Mannich碱的合成反应方程式如下:
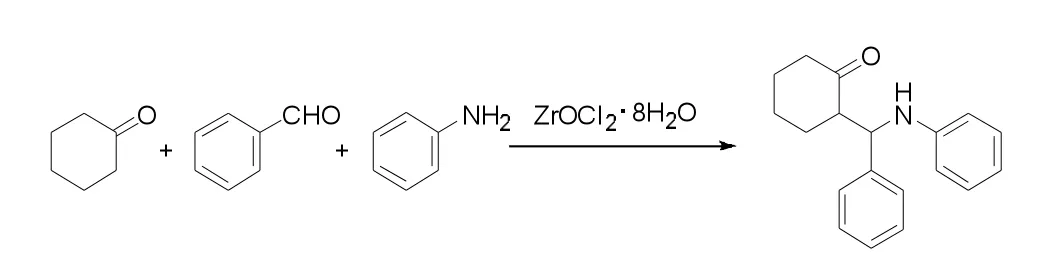
1.2.2 苯炔与 Mannich碱反应的一般过程
将一个15 mL的史莱克瓶在红外箱中加热约0.5 h,真空下冷却至室温,冲入氮气。加入Mannich碱 (0.2 mmol,56mg),KF (0.6mmol,35mg)和18-crown-6(0.6 mmol,159 mg),油泵抽真空十分钟,置换氮气,在氮气下加入溶剂乙腈(3 mL),搅拌约 5 min,最后在氮气保护下逐滴加入苯炔(0.45 mmol,108 μL)。室温下搅拌,TLC 点板监测反应。混合物经过硅胶柱层析分离得到纯净产物,洗脱剂为 PE/EA=100∶1。
1.2.3 目标化合物的结构表征






2 结果与分析
2.1 苯炔与Mannich碱发生插入-环化反应条件的优化
反应方程式如下:
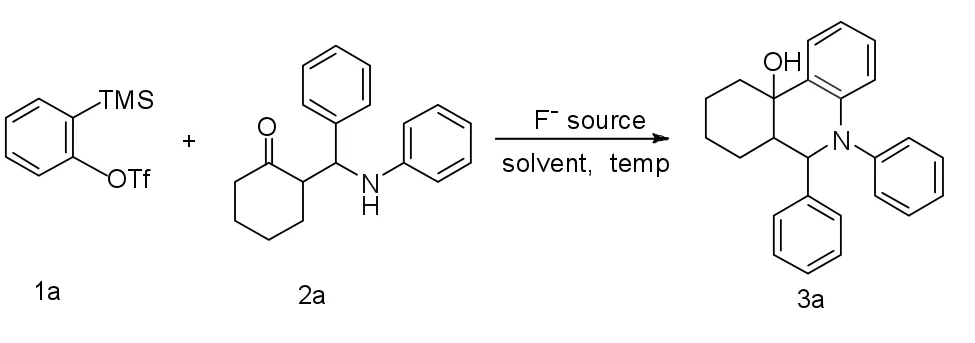
在前期工作的基础上,考察苯炔与Mannich碱的比例、氟源、溶剂、反应温度、反应时间对插入环化反应的影响,结果如下:
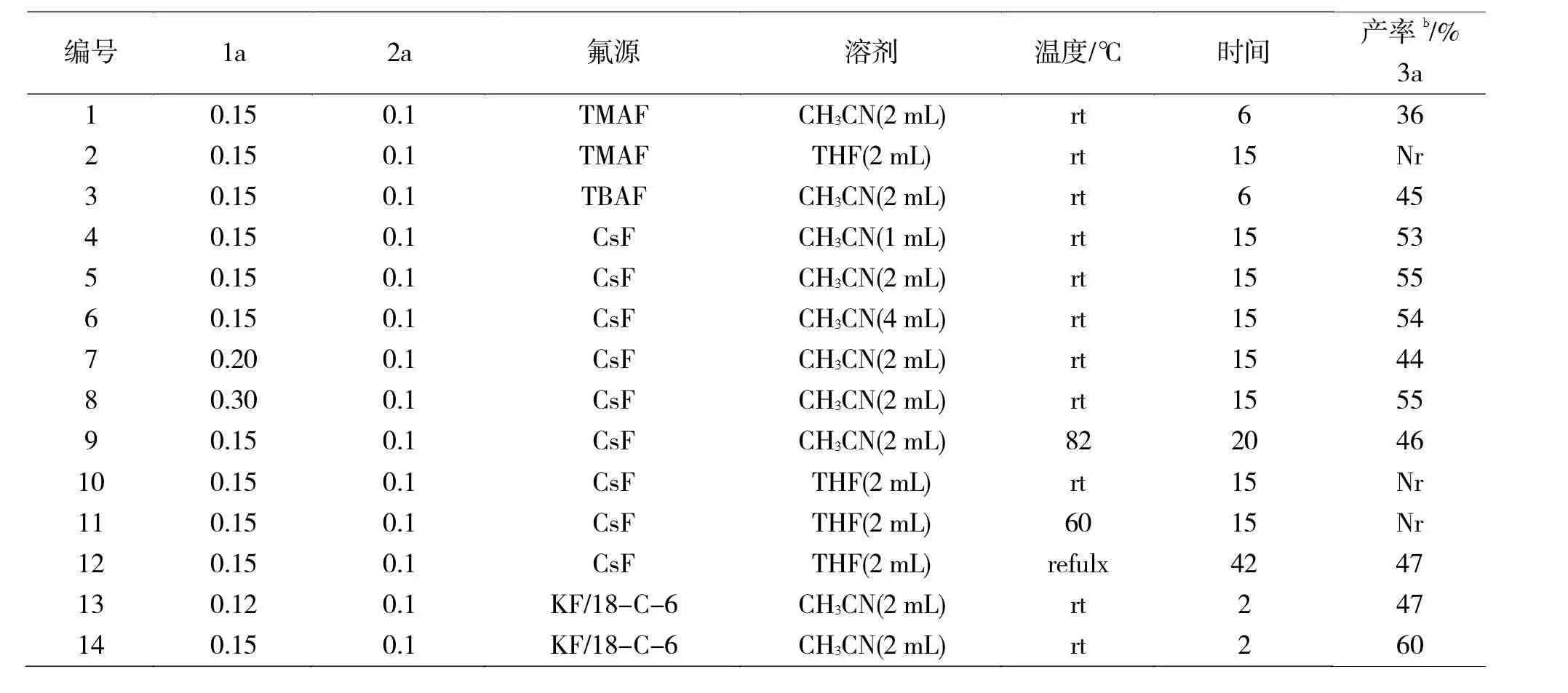
表1 原料比例、氟源、溶剂、反应温度及时间对插入环化反应的影响aTab.1 The effect of raw materials ratio ,fluorine source,solvent,reaction temperature and time on the insertion-cyclization reaction
由表1可知:
(1)苯炔前体和Mannich碱比例为1∶1.5,以四甲基氟化铵(TMAF)为氟源,以乙腈为溶剂,在室温下反应,换溶剂为四氢呋喃,室温下反应15 h仍然未发生反应。
(2)更换氟源为四丁基氟化铵(TBAF)时为溶剂,乙腈为溶剂,在室温下反应6 h产率为45%,提高9%。以CsF为氟源,乙腈为溶剂,当改变溶剂体积(1、2、4 mL)时,产率变化不大(53%-55%)。
(3)提高苯炔前体的用量,提高到2当量时,产率反而下降了10%,提高至3当量时,产率与1.5当量相当。
(4)当提高反应温度为82℃,产率为46%。当溶剂为THF时,室温下及60℃反应15 h为发生反应,回流状态下反应42 h产率47%。
(5)再次更换氟源为KF,并且以18-冠-6为添加剂时,反应2 h产率达60%,调整苯炔前体用量为1.2当量时产率也有所下降。
(6)通过上述反应条件优化可知,模型反应的最佳反应条件为:苯炔前体和Mannich碱比例为1∶1.5,KF/18-冠-6为氟源,乙腈为溶剂室温下反应2 h。
2.2 苯炔与Mannich碱的插入环化反应方程式:
在上述最佳反应条件下,考察不同取代Mannich碱与苯炔前体的插入环化反应,反应方程式如下,结果见表2。
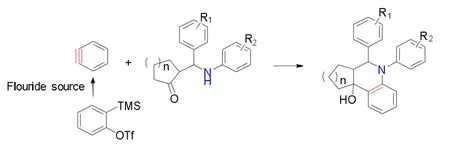
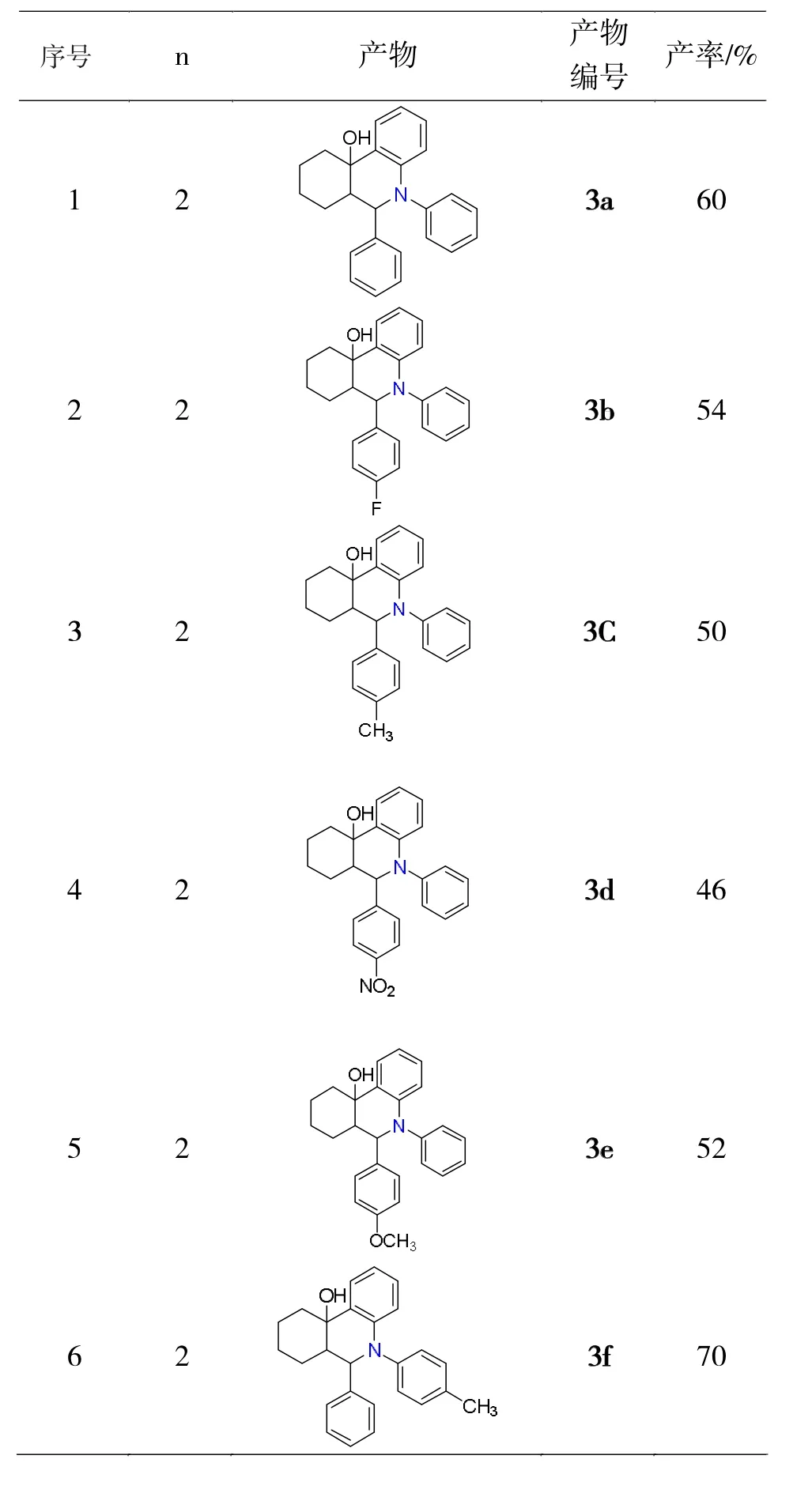
表2 苯炔前体与Mannich碱的插入环化反应Tab.2 Insertion-cyclization reaction of benzyne precursors and Mannich base
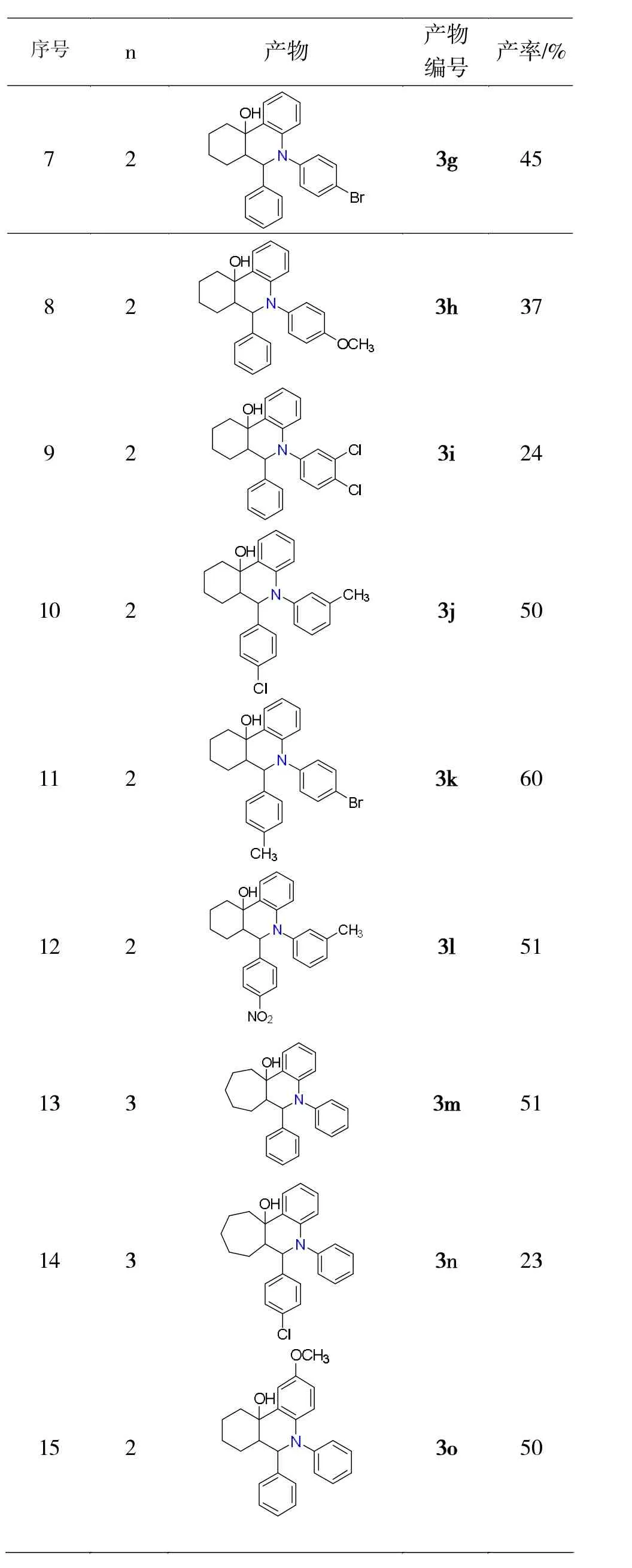
续表2
由表2可知:
(1)六元、七元环状Mannich碱都可以和苯炔发生插入环化反应,由于结构比较复杂,产率较低,在23%-70%之间。
(2)对于六元环状Mannich碱,芳香醛上有不同的取代基对产率影响不大,46%-60%,强吸电子的硝基产率最低(46%),芳香胺上不同取代基对产率影响较大,弱供电子效应的甲基产率最高达70%,强供电子效应(OCH3)产率下降至37%,有2个取代芳胺产率下降的更大。芳醛和芳胺上同时有取代基时产率在50%-60%之间。
(3)七元环状Mannich碱,没有取代时比有取代基产率高。
(4)取代苯炔也可与环状Mannich碱反应。
2.3 反应机理分析
在上述实验研究的基础上,提出以下可能的反应机理:钾离子与 18-crown-6相络合,使氟离子游离,从而进攻苯炔前体中的三甲基硅基基团,进行1,2消除,原位生成苯炔。Mannich碱中的氮原子上的孤对电子进攻苯炔三键,三键电子转移形成苯的碳负离子,碳负离子进攻Mannich碱中的羰基碳,发生亲核加成反应从而得到环状的目标产物。

2.4 插入环化反应的衍生化反应
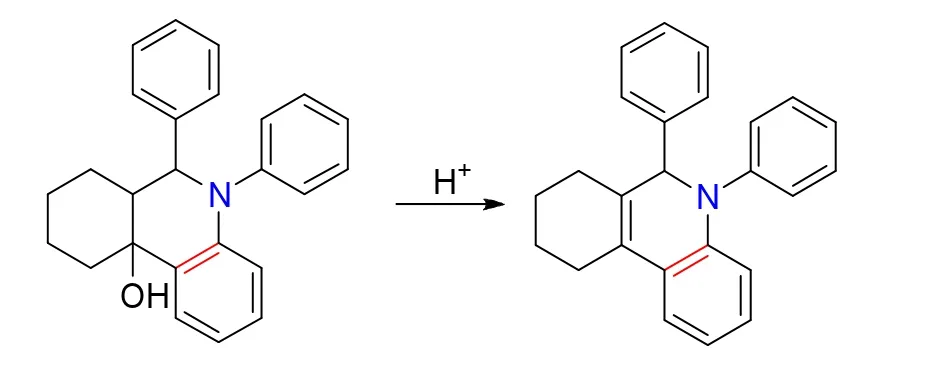
环状Mannich碱与苯炔反应后生成的稠合四氢喹啉环是个叔醇,在酸性条件下可脱水生成稠合二氢喹啉。

3 结论
(1)本文采用环状Mannich碱与苯炔前体反应,发展了一种制备构建稠合取代四氢喹啉的方法。
(2)通过摸索得到最佳的反应条件并制备了15种稠合取代四氢喹啉。对于六元环状Mannich碱为原料时,芳香醛上有不同的取代基对产率影响不大,其中强吸电子(硝基)会使产率下降;芳香胺上不同取代基对产率影响较大,弱供电子基团(甲基)产率高达70%,强供电子基团(OCH3)产率下降较多,可能由于甲氧基给电子能力强,使氮上的电子云密度增加,从而插入反应更容易,生成了叔胺;有2个取代基的芳胺由于空间位阻较大产率下降较多。
(3)七元环状Mannich碱,没有取代基时比有取代基产率高,说明空间位阻对反应有一定的影响。
[1]Dyke A M,Hester A J,Lloyd-Jones G C.Organometallic Generation and Capture of ortho-Arynes[J].synthesis,2006:4093-4112.
[2]Shu W,Zheng K,Ma J,et al.Transition-Metal-Free Coupling Annulation of Arynes with Ketones and Alkynoates:Assembly of Functionalized Naphthalenes[J].Org Lett,2016,18:3762-3765.
[3]Fine Nathel N,Morrill L,Mayr H,et al.Quantification of the Electrophilicity of Benzyne and Related Intermediates[J].J Am Chem Soc,2016,138:10402-10405.
[4]Peng X,Ma C,Tung C,et al.Cu-Catalyzed Three-Component Coupling of Aryne,Alkyne,and Benzenesulfonothioate:Modular Synthesis of o-Alkynyl Arylsulfides [J].Org Lett,2016,18(17):4154–4157.
[5]Shi J,Xu H,Qiu D,et al.Selective Aryne Formation via Grob Fragmentation from the [2+2]Cycloadducts of 3-Triflyloxyarynes[J].J Am Chem Soc,2017,139:623-626.
[6]Chen Q,Yan X,Wen C,et al.Copper-Catalyzed Addition of H–P(O)Bonds to Arynes[J].J Org Chem,2016,81(19):9476-9482.
[7]Jin T,Yamamoto Y.An Efficient,Facile,and General Synthesis of 1H-Indazoles by 1,3-Dipolar Cycloaddition of Arynes with Diazomethane Derivatives[J].Angew Chem(Int Ed),2007,46:3323-3325.
[8]Dubrovskiy A V,Laroek R C.Synthesis of Benzisoxazoles by the[3+2]Cycloaddition of in situ Generated Nitrile Oxides and Arynes[J].Org Let,2010,12:1180-1183.
[9]Kivrak A,Laroek R C.Synthesis of Dihydrobenzisoxazoles by the[3+2]Cycloaddition of Arynes and Oxaziridines[J].J Org Chem,2010,75:7381-7387.
[10]Spiteri C,Keeling S,Moses J E.New Synthesis of 1-Subs-tituted-1H-indazoles via 1,3-Dipolar Cycloaddition of in situ Generated Nitrile Imines and Benzyne[J].Org Lett,2010,12:3368-3371.
[11]Cheong P H Y,Paton R S,Bronner S M,et al.Indolyne and Aryne Distortions and Nucleophilic Regioselectivites[J].J Am Chem Soc,2010,132:1267-1269.
[12]Li Y Y,Qiu D,Gu R,et al.Aryne 1,2,3-Trifunctionalization with Aryl Allyl Sulfoxides[J].J Am Chem Soc,2016,138:10814-10817.
[13]Bhojgude S S,Bhunia A,Biju A T.Employing Arynes in Diels-Alder Reactions and Transition-Metal-Free Multicomponent Coupling and Arylation Reactions [J].Acc Chem Res,2016,49:1658-1670.
[14]Bhojgude S S,Roy T,Gonnade R G,et al.Substrate-Controlled Selectivity Switch in the Three-Component Coupling Involving Arynes,Aromatic Tertiary Amines,and CO2[J].Org Lett,2016,18:5424-5427.
[15]Rossini A,Muraca A,Casagrande G,et al.total Syntheses of Aporphine Alkaloids via Benzyne Chemistry:An Approach to the Formation of Aporphine Cores [J].J Org Chem,2015,80:10033-10040.
[16]Jian H,Liu K,Wang W H,et al.Construction of 9-functionalized xanthenes via Diels-Alder reaction of stable orthoquinone methides and arynes[J].Tetrahedron Letters,2017,58(12):1137-1141.
[17]Bhojgude S S,Kaicharla T,Bhunia A,et al.A Practical and General Diels Alder Reaction of Pentafulvenes with Arynes[J].Org Lett,2012,14:4098-4101.
[18]Kaicharla T,Bhojgude S,Biju A T.Efficient Diels Alder Reaction of 1,2-Benzoquinones with Arynes and Its Utility in One-Pot Reactions[J].Org Lett,2012,14:6238-6241.
[19]Thangaraj M,Bhojgude S S,Bisht R H,et al.Diels-Alder Reaction of Tropones with Arynes:Synthesis of Functionalized Benzobicyclo [3.2.2]nonatrienones.[J].J Org Chem,2014,79:4757-4762.
[20]Huang X,Zhang T.Cascade Nucleophilic Addition-Cyclic Michael Addition of Arynes and Phenols/Anilines Bearing Ortho r,β-Unsaturated Groups:Facile Synthesis of 9-Functionalized Xanthenes/Acridines [J].J Org Chem,2010,75:506-509.
[21]Zhao J,Larock R C.One-Pot Synthesis of Xanthones and Thioxanthones by the Tandem Coupling Cyclization of Arynes and Salicylate[J].Org Lett,2005,7:4273-4275.
[22]Zhao J,Larock R C.Synthesis of Xanthones,Thioxanthones,and Acridones by the Coupling of Arynes and Substituted Benzoates[J]J.Org Chem,2007,72:583-588.
[23]Rogness D C,Larock R C.Synthesis of Acridines by the[4+2]Annulation of Arynes and 2-Aminoaryl Ketones.[J]J Org Chem,2010,75:2289-2295.
[24]Wu C,Fang Y,Laroek R C,et al.Synthesis of 2H-Indazoles by the [3+2]Cycloaddition of Arynes and Sydnones[J].Org Lett,2010,12:2234-2237.
[25]Sridharan V,Suryavanshi P A,Menendez C.Advances in the chemistry of tetrahydroquinolines[J].Chem Rev,2011,111:7157-7259.
[26]Eihcer T,Hauptmnna S,Speieher A.The Chemistry of Heterocycles-Structure,Reaetions,Syntheses,andApplications[M].NewYork:John Wiley&Sons Inc,2003.
[27]李院珍,郭豪,王颖,等.氮杂环卡宾催化α-卤代烯醛的双硫化反应[J].石河子大学学报(自然科学版),2015,33(4):491-496.
Li Y Z,Guo H,Wang Y,et al.N-Heterocyclic Carbene-Ca talyzed Dithiolation Reaction of α-Haloenals [J]Journal of Shihezi University(Natural Science),2015,33(4):491-496.
[28]周忠强,余晓梦.无溶剂条件下丙酸乙醇铵催化合成2-氨基 -3- 氰基 -1,4,5,6- 四氢吡喃并[3,2-c]喹啉 -5- 酮衍生物[J].中南民族大学学报(自然科学版),2015,34(3):6-9.
Zhou Z Q,Yu X M.Synthesis of 2-Amino-3-cyano-1,4,5,6-tetrahydropyrano [3,2-c]-quinolin-5-oneDerivatives Catalyzed by 2-Hydroxy EthylammoniumPropionate under Solvent-free Conditions,Journal of South-Central University for Nationalities(Natural Science Edition),2015,34(3):6-9.
[29]He L,Pian J X,Shi J F,et al.Transition-metalfree synthesis of multisubstituted N-arylindoles via reaction of arynes and α-amino ketones[J].Tetrahedron,2014,70(14):2400-2405.
[30]Pian J X,He L,Du G F,Guo H,Dai B.Diastereoselective Synthesis of N-Aryl Tetrahydroquinolines and N-Aryl Indolines by the Tandem Reaction of Arynes[J].J Org Chem,2014,79:5820-5826.
[31]Eftekhari-Sis B,Abdollahifar A,Hashemi M M,Zirak M.Stereoselective Synthesis of β-Amino Ketones via Direct Mannich-Type Reactions,Catalyzed with ZrOCl2·8H2O under Solvent-Free Conditions [J].Eur.J Org Chem,2006,22:5152-5157.
Synthesis of fused tetrahydroquinoline via tandem reaction of benzyne and mannich base
LI Wenjuan,LUO Xuesong,GUO Liang,HE Lin,Dai Bin,GUO Xuhong
(School of Chemistry and Chemical Engineering,Shihezi University/Key Laboratory for Green Processing of Chemical Engineering of Xinjiang Bingtuan/Key Laboratory of Materials-Oriented Chemical Engineering of Xinjiang Uygur Autonomous Region,Shihezi,Xinjiang 832003,China)
Benzene is a highly reactive intermediate,which has a wide range of applications in the field of organic synthesis chemistry and synthesis of natural products.In this paper,we use benzyne precursors and Mannich bases to construct fused substituted tetrahydroquinoline rings.The experimental results show the optimal experiment condition that the ratio of benzyne and Mannich base is 1:1.5 and KF/18-crown-6 is fluorine source and acetonitrile is the solvent and time is 2 hours at room temperature.Fifteen kinds of fused-substituted quinones were obtained in a yield of 23%-70%.Possible reaction mechanism:18-crown-6 complexes with the potassium ion of KF and release the free fluoride ion,which subsequently attack the silica atom of o-trimethylsilylphenyl triflate to produce the active benzyne intermediate in situ.The nitrogen atom in the Mannich base attack the the tri-bond of benzyne through electrophilic addition reaction,and the nucleophilic addition of the carbonyl carbon atom at the other end of the benzyne the triple bond to obtain the cyclic target product.
benzyne; mannich base; insertion-cyclization reaction; construct; fused substituted quinoline
O626.323
A
10.13880/j.cnki.65-1174/n.2017.03.002
1007-7383(2017)03-0273-08
2017-03-16
国家自然科学基金项目(21462034),兵团高校优秀青年教师资助项目,石河子大学第5批“3152”人才支持计划(编号CZ0210)。
李文娟(1980-),女,博士研究生,专业方向为有机合成。
*通信作者:代斌(1969-),男,教授,从事绿色合成与转化、等离子体化学及多相催化和天然产物化学等领域的研究,e-mail:db_tea@shzu.edu.cn。

