评价中药早期心、肝、肾毒性的生物标志物的研究概况
李煦照 张帅男贵阳中医学院药学院,贵州 贵阳 550025
评价中药早期心、肝、肾毒性的生物标志物的研究概况
李煦照 张帅男*
贵阳中医学院药学院,贵州 贵阳 550025
笔者对一些中药早期心、肝、肾毒性的生物标志物及相关代谢途径进行综述,并将这些生物标志物进行分类。目前已知的生物标志物主要分为糖代谢类(2种)、脂类(10种)、磷脂类(5种)、氨基酸类(11种)、类固醇类(1种)、有机酸类(20种)、鞘脂类(1种)和其他类(11种)。这些代谢物可以用于靶标代谢组学对中药毒性进行评价。目前,应用代谢组学来评价中药毒性尚需完善具体的评价体系和评价标准、才能达到控制中药剂量降低中药毒性的目的。
中药;毒性;代谢组学;生物标志物
随着中药在世界上应用日渐广泛,其安全性也受到了国内外的普遍重视。因为中药复杂的成分既可以作用在治疗靶点上,也可以作用在毒性靶点上。因此,中药在治疗疾病的同时,也可能会产生潜在的毒性[1]。由于急性、亚急性、长期毒性实验主要集中于检测组织形态学改变和生化指标,但是并未从整体观点阐明中药对机体的生化过程所形成的内源性代谢物和外源性代谢物对毒性的影响和影响规律[2]。所以,寻找一种快速、准确、敏感的方法来评价外源性化合物对生物体的毒性作用,已成为当前中药安全性评价亟待解决的重要问题[3]。代谢组学是一门新发展的技术,主要研究生物体由病理生理刺激或遗传因素改变所致内源性代谢产物的变化[4]。代谢组学从研究生物体整体代谢变化出发,全面反映药物作用后生物体内各个组织器官代谢的变化,并可发现药物毒性及不良反应的情况。因此,代谢组学作为毒理学研究中一种重要的手段,开始应用于药物毒性早期评价及其机制研究等多项领域[3]。目前,基于代谢组学技术的中药肝毒性、肾毒性、心脏毒性等安全性评价研究已成为中药毒理学的研究热点。因此,中药毒性生物标志物是评价中药毒性的关键指标。笔者综述了中药毒性相关生物标志物研究进展,为利用靶标代谢组学评价中药毒性提供参考。
1 中药肾毒性相关生物标志物
肾脏不仅是排泄药物的主要器官,也是药物毒性作用的重要靶器官。王清秀等[5]利用NMR技术研究大黄素处理后大鼠尿液、血浆和肾脏组织萃取物中内源性代谢产物谱的变化,发现血浆中肌氨酸、异丁酸盐和 3-羟基丁氨酸升高,而乳酸、丙氨酸、酪氨酸、胆碱、磷酸卵磷酯、葡萄糖、VLDL/LDL(CH2)等明显下降;而尿液中肌酐、肌酸、TMAO、醋酸盐、乳酸、葡萄糖和各种氨基酸含量明显升高,柠檬酸盐、马尿酸、2-酮戊二酸、牛磺酸和甘氨酸含量水平下降。尿液中葡萄糖和氨基酸升高是肾小管损伤的典型标志;肾组织萃取物中醋酸盐、3-HB、肌酐、肌酸明显增加,而乳酸和胆碱、磷酸卵磷脂下降。由此推测大黄素可导致脂类成分的改变,破坏细胞膜性结构,最终导致肾小管上皮细胞受损而致重吸收障碍。但是损伤是轻微的,结束药物暴露后,损伤能够得到恢复。尿液中的氨基酸,葡萄糖,TMAO以及肌酐可以作为大黄素肾毒性的主要生物标志物研究。赵剑宇等[6]研究经关木通染毒后大鼠尿液的代谢表型改变及其与组织病理和尿液、血浆生化指标的相关性,结果尿样中氧化三甲胺、柠檬酸、牛磺酸、肌酐、甜菜碱等代谢物均有不同程度的下降,而醋酸、丙氨酸则明显上升。其中,醋酸、氧化三甲胺都是肾毒性的生物标志物[7-10]。常丽娟等[11]利用UFLC/MS-MS分析雷公藤乙醇提取物组致大鼠的血清中小分子代谢物的变化,发现血清中二甲基甘氨酸、赖氨酸、苯丙氨酸、溶血卵磷脂、磷脂酰胆碱、磷脂酰丝氨酸和甘油二酯等 9 种代谢物有统计学差异,鉴定其为雷公藤致肾毒性的生物标记物。研究表明[12]高浓度的二甲基甘氨酸可有效抑制 BHMT 活性,使高半胱氨酸升高,而高半胱氨酸会导致肾功能衰竭和高同型半胱氨酸血症的发生。西药的肾毒性生物标志物对研究中药肾毒性生物标志物也有参考价值。Zhao T等[13]运用代谢组学研究链脲霉素所导致的肾毒性,其通过超高效液相色谱-飞行时间质谱联用( UPLC-QTOF/MS) 和 PLS-DA分析发现马尿酸、硫酸吲哚酚、吡哆酸、山梨醇和 N-乙酰葡萄糖是其肾毒性的生物标志物。Ma等[14]发现尿液的分析结果显示牵牛子乙醇提取物改变了氨基酸、柠檬酸、肌酐、胆酸、5-甲基四氢叶酸在尿液的浓度。Gu L等[15]运用代谢组学研究马钱子的毒性,发现马钱子组大鼠血清肌酐、尿酸水平明显上升,同时胍基丁二酸、胍乙酸、3-羟基吲哚硫酸盐和吲哚乙酸的水平也高于空白组,这表明氨基酸的代谢异常。详见表1。
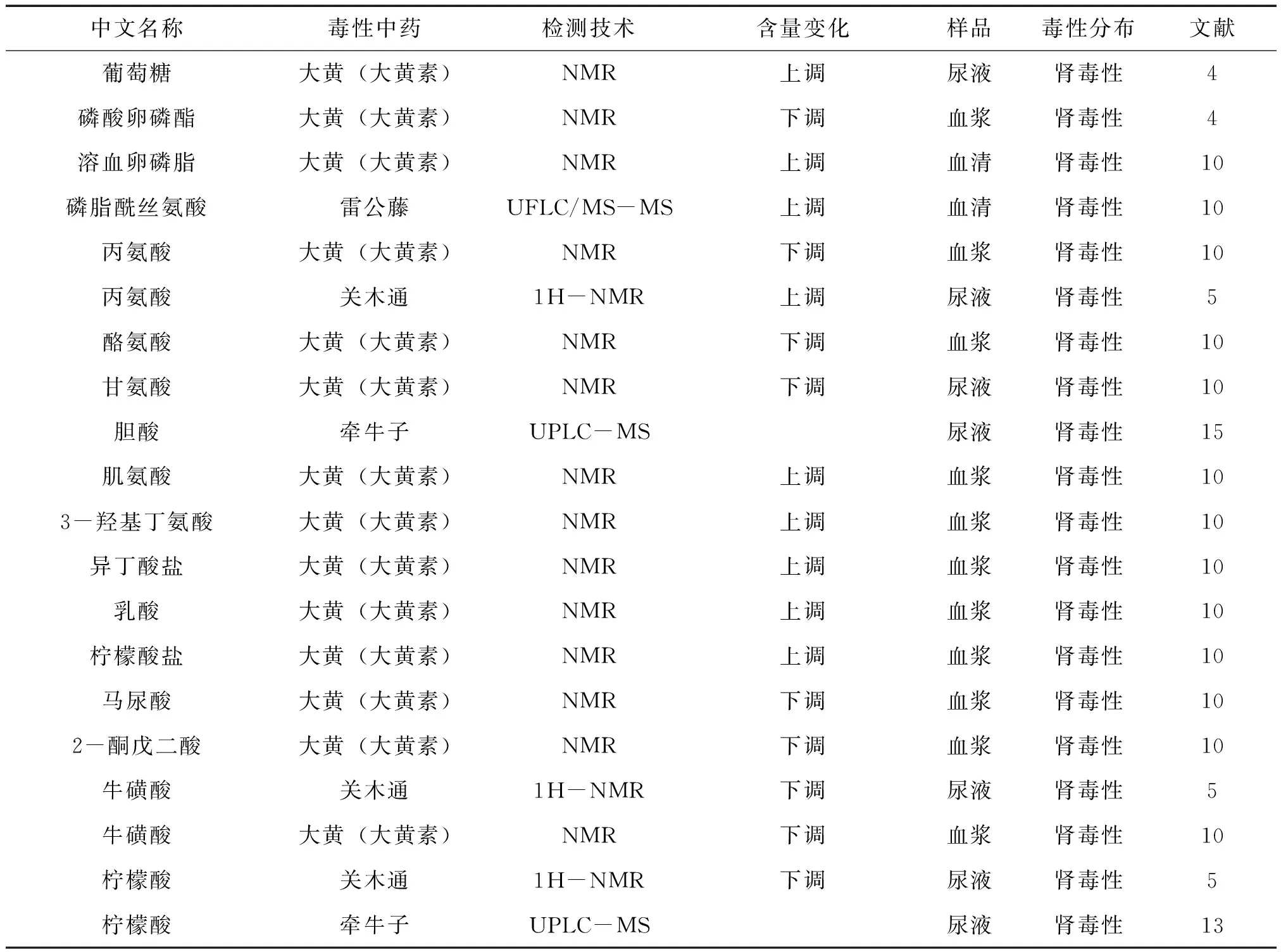
表1 中药肾毒性生物标志物
续表

表1 中药肾毒性生物标志物
2 中药肝毒性相关生物标志物
肝脏是人体的主要代谢器官,也是药物代谢的主要场所。因此,在药源性不良反应中,肝损伤是最常见不良反应之一。当前,药源性肝损害( Drug-induced Liver Injury,DILI) 已成为临床较常见的、易产生严重后果的药源性疾病[16]。在我国,因使用中药而产生的急慢性肝损害的临床报道呈逐年上升趋势,一些传统并不认为是毒剧药的中药如何首乌等甚至有中毒致死的报道[16]。代谢组学发现可能成为新的药源性肝损伤生物标志物主要有血清视晶酸(Ophthalmic Acid)、尿液中的8’-羟基-2’-脱氧鸟苷(8-OHdG)和辛酰肉碱(Octanoylcarnitine)以及血浆和尿液中的胆汁酸等[17]。药物通过代谢途径导致肝损伤的机制主要有影响肝代谢过程中的三羧酸循环,比如:乳酸、丙氨酸、肌酐的增加可预测肝毒性[18]。Shima等[19]利用 CE-MS/MS 结合 GC-TOF-MS 发现延胡索酸是甲基苯丙胺所致肝毒性的潜在生物标志物,甲基苯丙胺通过影响三羧酸循环过程干扰糖酵解、氧化磷酸化及脂肪酸的 β-氧化过程产生肝脏毒性。刘晓燕等[20]利用对乙酰氨基酚、四氯化碳、大黄素、雷公藤甲素和马兜铃酸构建不同类型的肝细胞损伤模型,利用超高效液相色谱-质谱联用技术(UPLC-MS)分别得到正常组和损伤组的细胞代谢轮廓谱(如图1a,1b),发现了14种潜在肝毒性生物标志物:包括植烷酸、13,14-二羟基-二十二烷酸、2-羟基-植烷酸、2-羟基-二十二烷酸、13-二十二烯酸、13-十八烯醇、3-羟基-二十四烷酸、4-羟基-6-二十二烷酮、烟酰胺腺嘌呤二核苷酸(NAD)、谷胱甘肽(GSH)、鞘氨醇、苯基甘氨酸和小肽。其中,植烷酸、13,14-二羟基-二十二烷酸、2-羟基-植烷酸、2-羟基-二十二烷酸、13-十八烯醇、3-羟基-二十四烷酸和 4-羟基-6-二十二烷酮均为脂类,其含量明显升高。脂类化合物的显著变化表明药物肝毒性扰乱了肝细胞内长链脂肪酸的正常代谢,尤其是脂肪酸的氧化过程。赵小梅等[21]筛查雷公藤多苷片所致的肝毒性损伤,分析鉴定了7 个代谢物,分别为 6-磷酸葡萄糖胺、溶血磷脂、色氨酸、胍基乙酸、3-吲哚丙酸、可的松和泛醌,其代谢水平的变化表明氨基酸代谢、糖代谢、磷脂代谢和激素代谢等途径发生紊乱,由此推测雷公藤多苷片致肝损伤可能与三羧酸循环中能量代谢和尿素循环中氨基酸代谢以及糖代谢异常有关(损伤机制如图2)。盛云华等[22]通过代谢组学检测发现黄药子组大鼠血清中α-葡萄糖、β-葡萄糖降低,三甲胺、谷氨酸、脂质(LDL/VLDL)、磷酸胆碱和甘油磷酸胆碱升高。黄药子组大鼠的尿液中m-羟基苯乙酸、苯乙酰甘氨酸、丙酮酸、丙二酸二甲酯和α-羟基丁酸、丙氨酸和乙酸、牛磺酸、乙酰乙酸、N-乙酰谷氨酸、N-甲基烟酰胺降低,马尿酸、α-羟基异戊酸、烟碱酸、p-羟基苯乙酸、三甲胺、二甲胺、丙二酸升高。这些代谢物异常表达反映出了糖脂代谢异常、脂类物质蓄积等肝损伤迹象。谢彤等[23]基于气质联用法对雷公藤组大鼠血浆进行代谢组学研究,发现雷公藤组中生糖氨基酸包括丙氨酸、谷氨酰胺、丝氨酸、脯氨酸等水平显著升高,支链氨基酸缬氨酸和异亮氨基酸水平下降,说明了雷公藤肝脏毒性的发生与氨基酸代谢,能量代谢等过程密切相关。马致洁等[24]采用液相色谱-质谱方法测定服用何首乌组大鼠的血清代谢指纹谱,共筛选得到6个潜在生物标志物: oleamide、lyso PC(16:0)、 leukotriene A4、trans-tetra-dec-2-enoic acid、dihydrocortisol 和 7a-hydroxydehydroepiandrosterone,这些标志物在何首乌致肝损伤动态过程中呈现一定的变化趋势。中药肝毒性生物标志物见表2。

图1 对乙酰氨基酚、四氯化碳、大黄素、雷公藤甲素和马兜铃酸干预后肝细胞代谢谱的PCA(1a)和PLS-DA(1b)分析结果[20]

图2 雷公藤致大鼠肝损伤后所影响的生化通路图[21]

表2 中药肝毒性生物标志物
续表

表2 中药肝毒性生物标志物
3 中药心脏毒性相关生物标志物
何家乐等[25]运用 UPLC-Q-TOF/MS 技术研究人参与附子配伍对大鼠血清中内源性标记物的影响,发现参附合并组中,谷胱甘肽、磷脂酰胆碱、柠檬酸含量下降,同时抗坏血酸、尿酸、D-半乳糖、色氨酸、L-苯丙氨酸的含量上升,说明参附合煎液中附子对心脏产生了毒性影响。有研究显示[26],当心血管系统受到损伤的时候,柠檬酸含量下降并且糖类和氨基酸水平升高。当心肌缺血,心肌能量供应不足的时候,ATP 降解产物次黄嘌呤、黄嘌呤增多,在代谢为最终产物尿酸的过程中,产生大量的 ROS(细胞内氧自由基)。因此尿酸水平的增加,预示着 ROS的大量产生以及心肌缺血的出现。有研究显示[27-29],心血管疾病进程中氧化应激损伤是一个很重要的机制,而抗氧化剂对此有抑制作用。采用斑马鱼作为模式动物,研究阿司咪唑对心脏毒性的生物标志物可以为研究中药的心脏毒性提供参考。韩利文[30]等采用阿司咪唑处理发育48hpf( Hours Post Fertilization) 斑马鱼幼鱼,代谢组学分析结果显示,斑马鱼体内葡萄糖、甘氨酸、乳酸肌肝、谷氨酰胺、N-乙酰-L-赖氨酸、L-脯氨酸、柠檬酸、L-酪氨酸、磷酸、胆固醇、棕榈酸等12 种代谢物发生了明显变化,说明心肌损伤可能与乳酸代谢障碍和氨基酸代谢紊乱、脂肪酸代谢异常有关。目前已发现附子、阿霉素(DOX)、异丙肾上腺素(ISO)作为毒性诱因的心脏毒性生物标志物共有五大类[31],分别是脂肪酸类、磷脂类、氨基酸及其衍生物、类固醇类和激素类衍生物、其他小分子代谢物,这些代谢物为研究中药心脏毒性提供了参考和依据。中药心脏毒性生物标志物见表3。
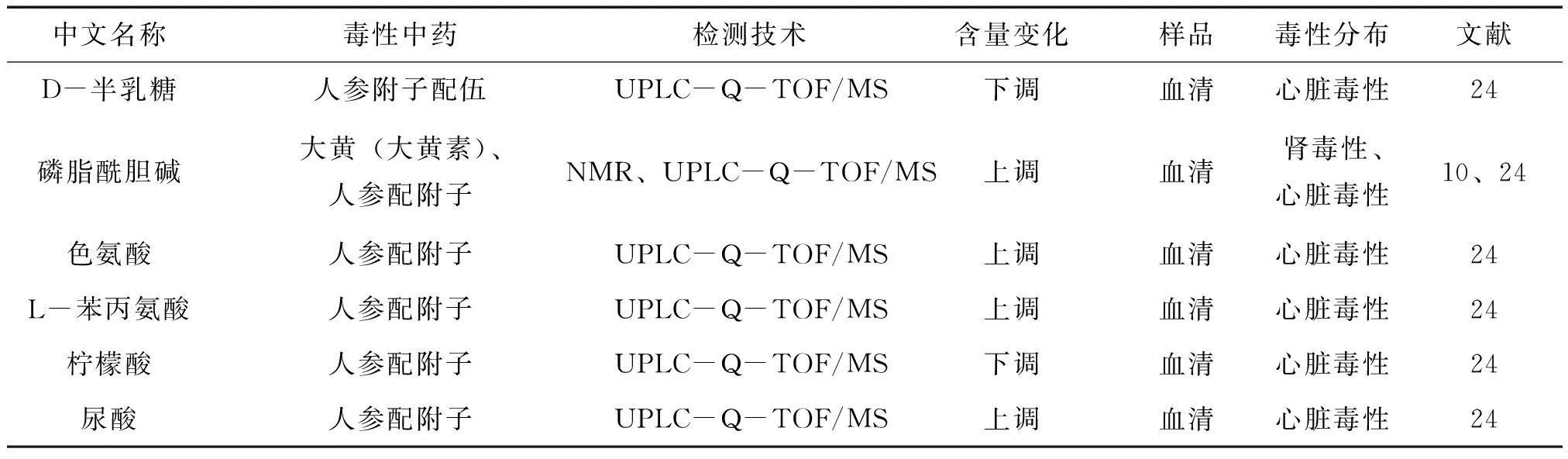
表3 中药心脏毒性生物标志物
4 小结与展望
近年来,代谢组学发展迅速,在中药毒理学应用中展现出明显优势。细胞代谢组学、血液代谢组学和尿液代谢组学的组合应用可以用于早期筛查中药的心、肝、肾毒性,以及为临床的心、肝、肾损伤提供较全面的诊断和治疗信息。文章总结了评价中药早期心、肝、肾毒性的生物标志物,并进行了归类和总结。但是代谢组学的应用仍有一定的局限性:目前已发现的生物标志物的活性尚未全部明晰,给中药毒性评价带来一定的障碍。代谢组学仍需要配合蛋白质组学、病理学等其他实验方法来验证其评价结果的准确性。代谢组学的研究目前欠缺系统性,在中药毒性的评价上仍需完善。在中药毒性评价研究中,可采用靶标代谢组学的研究方法,有目的地检测尿液、血液中各类生物标志物的表达量,具体评价中药的毒性程度。靶标代谢组学方法将会通过一系列检测方案并结合多种检测方法(比如蛋白质组学和基因组学)对中药的毒性进行快速、高效、准确的评价和筛查。
[1]Shuai-nan Zhang, Xu-zhao li, Yu wang, et al. Neuroprotection or neurotoxicity new insights into the effects of Acanthopanax senticosus harms on nervous system through cerebral metabolomics analysis[J]. Journal of Ethnopharmacology,2014(156):290-300.
[2] 刘树民,崔立然.代谢组学技术在中药毒性研究中的应用前景[J].毒理学杂志,2008,22(2):155-158.
[3]边育红,庄朋伟,王丽,等.药物潜在毒性发现技术及其在中药安全性评价中的应用展望[J].中草药,2011, 42(12):2379-2385.
[4] NICHOLSON J K, CONNELLY J, LINDON J C, et al. Metabonomics: A platform for studying drug toxicity and gene function[J]. Nat Rev Drug Discov, 2002(1):153-159.
[5] 王清秀,吴纯启,廖明阳. 大黄及其主要成分的毒性毒理研究[J].毒理学杂志,2007,21(4):301-302.
[6] 赵剑宇,颜贤忠,彭双清.关木通肾毒性的代谢组学研究[J]. 中草药,2006,37(5):725-730.
[7] Beckwith-Hall B M, Nicholson J K, Nicholls A W, et al. Nuclear magnetic resonance spectro scopic and principal components analysisinvestigations into biochemical effects of three model hepatotoxins[J].Chem Res Toxicol, 1998, 11(4): 260-272.
[8] 赵剑宇, 颜贤忠, 彭双清. 利用代谢组学技术研究中药关木通的肾毒性作用[J]. 世界科学技术-中医药现代化, 2007, 9(5) : 54-59.
[9] Nicholson J K, T imbrell JA, Sadler P J. Proton NMR spectra of urine as indicators of renal damage Mercury-induced nephrotoxicity in rats[J].Mol. Pharmacol, 1985, 27(6) : 644-651.
[10] Gart land K P R, Bonner FW, Nicholson J K. Investigations into the biochemical effects of region-specific nephrotixins[J]. Mol. Pharmacol, 1989(35):242-250.
[11]常立娟, 李佐静, 李清, 等. 雷公藤致大鼠肾毒性血清代谢组学分析[J]. 中国实验方剂学杂志. 2016, 22(12): 89-94.
[12] Taes YE, Delanghe JR, Rombaut R, et al. Creatine supplementation decreases homocysteine in an animal model of uremia[J]. Kidney Int, 2003, 64 (4) :1331-1337.
[13] Zhao T, Zhang HJ, Zhao TT, et al. Intrarenal metabolomics reveals the association of local organic toxins with the progression of diabetic kidney disease[J]. J Pharm Biomed Anal, 2012(60):32.
[14] Ma C, Bi K, Zhang M, et al. Metabonomic study of biochemical changes in the urine of Morning Glory Seed treated rat[J].J Pharm Biomed Anal, 2010, 539(3) : 559.
[15] Gu L, WANG XF, Zhang YY, et al.Determination of 12 potential nephrotoxicity biomarkers in rat serum and urine by liquid chromatography with mass spectrometry and its application to renal failure induced by Semen Strychni [J].J Sep Sci, 2014, 37(8/9) : 1058.
[16] Jung K A, Min H J, Yoo S S, et al. Drug-induced liver injury: twenty five cases of acute hepatitis following ingestion of Polygonum multiflorum Thunb [J]. Gut Liver, 2011(5):493.
[17] 马憬,汤纳平. 药源性肝损伤的新型生物标志物研究进展[J]. 中国药理学与毒理学杂志. 2013,27(增刊1):9.
[18] PAR VEEN A, RIZVI S H M, GUPTA A, et al.NMR-based metabonomics study of sub-acute hepatotoxicity induced by silica nanoparticles in rats after intranasal exposure[J].Cell Mol Biol, 2012, 58(1):196-203.
[19] SHIMA N, MIYAWAKI I, BANDO K, et al.Influences of meth-amphetamine-induced acute intoxication on urinary and plasma metabolic profiles in the rat [J].Toxicology, 2011, 287(1):29-37.
[20] 刘晓燕, 刘艳秋, 程孟春, 等. 超高效液相色谱-质谱联用技术在药物肝损伤代谢组学研究中的应用[J]. 色谱, 2015, 33(7): 683-690.
[21] 赵小梅, 刘歆颖, 续畅, 等. 基于 LC- MS 代谢组学的雷公藤多苷致肝毒性生物标志物的初步筛查[J]. 中国中药杂志, 2015,40(19):3851-3858.
[22] 盛云华, 乔靖怡, 金若敏,等. 基于1H-核磁共振代谢组学研究黄药子乙醇提取物致肝损伤的潜在生物标志物. 中国药理学与毒理学杂志. 2016, 30(4): 306-316.
[23] 谢彤, 周学平, 林丽丽, 等. 基于“异类相制”的雷公藤复方配伍减毒代谢组学研究[J].中国中药杂志,2016, 41(6):1124-1129.
[24] 马致洁, 李奇, 赵奎君, 等. 何首乌致肝损伤大鼠的动态血清代谢组学研究[J]. 中国中药杂志,2017, 42(1): 152-156.
[25] 何家乐, 赵佳伟, 马增春, 等. 基于代谢组学技术研究参附配伍对大鼠心脏毒性的影响[J].中国中药杂志,2015,40(14): 2743-2747.
[26] Militante J D,Lo mbardini J B. Taurine stimulation of calcium uptake in the retina: mechanism of action [J]. Adv Exp Med Biol, 2003(526):547.
[27] Saavedra W F, Paolocci N, St John M E, et al. Imbalance between xanthine oxidase and nitric oxide synthase signaling pathways underlies mechanoenergetic uncoupling in the failing heart[J]. Circ Res, 2002, 90 (3) : 297.
[28] Kyaw M, Yoshizumi M, Tsuchiya K, et al. Atheroprotective effects of antioxidants through inhibition of mitogen-activated protein kinases[J]. Acta Pharmacol Sin, 2004,25(8) : 977.
[29] 张健, 魏欣冰, 丁华, 等. 卡维地洛对过氧化氢致血管内皮细胞氧化应激损伤的保护作用[J].中国药理学通报,2006, 22(5):220.
[30] 韩利文, 赵亮, 楚杰,等. 采用 GC - MS代谢组学技术表征阿司咪唑诱导斑马鱼心脏毒性的内源性代谢物[J].中国药学杂志,2015,50(1):45-50.
[31] 局亮, 尹佳, 周浩楠, 等. 评价药物早期心脏毒性的生物标记物研究进展[J]. 药物评价研究, 38(5): 563-569.
The Research Survey of Evaluation Early Stage Toxicity Biomarkers of Heart,Liver and Kidney of Traditional Chinese Medicines
LI Xuzhao ZHANG Shuainan*
Pharmacy School,Guiyang University of Chinese Medicine,Guiyang 550025,China
This article reviewed a variety of biomarkers of heart, liver and kidney toxicity of some Traditional Chinese Medicines (TCM) and related metabolic pathways. And the biomarkers had been classified into 8 sorts. The known biomarkers had been mainly divided into glycometabolism (2 kinds), lipid (10 kinds), phospholipids (5 kinds), amino acid (11 kinds), steroid (1 kind), organic acid (20 kinds), sphingolipid (1 kind), other (11 kinds). The biomarkers could be applied in TCM toxicity evaluation by target metabolomics. So far, the specify evaluation system and standard will be needed in TCM toxicity evaluation by metabolomics to control the dosage of TCM and reduce the toxicity of TCM.
Traditional Chinese Medicine; Toxicity; Metabolomics;Biomarker
邱德文全国名老中医药专家传承工作室建设项目;贵阳中医学院博士启动金(2015,2016)。
李煦照(1986-),男,汉族,副教授,研究方向为系统药理学。E-mail:xuzhaoli86@yeah.net
张帅男(1987-),女,汉族,副教授,研究方向为系统毒理学。E-mail:laurahoney@163.com
R285.5
A
1007-8517(2017)12-0047-07
2017-04-12 编辑:陶希睿)

