水环境中的信息有机物与“水域生态讯息学”的提出
张 倩, 宋金明, 3, 李学刚, 3, 袁华茂, 3, 李 宁, 3, 段丽琴, 3, 曲宝晓, 3, 康绪明, 3
水环境中的信息有机物与“水域生态讯息学”的提出
张 倩1, 2, 宋金明1, 2, 3, 李学刚1, 2, 3, 袁华茂1, 2, 3, 李 宁1, 2, 3, 段丽琴1, 2, 3, 曲宝晓1, 2, 3, 康绪明1, 2, 3
(1. 中国科学院海洋生态与环境科学重点实验室(中国科学院海洋研究所), 山东青岛 266071; 2. 中国科学院大学, 北京 100049; 3. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室, 山东青岛266237)
信息有机物(或化感物质)系指存在于自然环境, 对生物物种或生物类群生存和生长有促进或抑制作用, 并能通过调控生物丰度与群落结构来影响生态系统和生态环境的微痕量有机物。目前已知的信息有机物大多是分子质量小于104Da的醇、酚、萜、酯、多肽等小分子物质, 它们随水体迁移扩散, 通过控制酶活性或光合系统等途径影响目标生物生存生长, 作用强度受微生物分解和营养水平等多种因素影响。水体中信息有机物一般是通过有机溶剂萃取或固相萃取富集后用色质联用鉴定结构并测定含量。本文系统总结了近年来水环境中信息有机物及其检测方法的主要研究进展, 归纳总结了高效灵敏的水体信息有机物检测方法, 阐述了水环境中信息有机物种类、结构、作用机制及其对水域生态学的意义, 在此基础上, 提出了“水域生态讯息学”的新概念, 诠释了“水域生态讯息学”的内涵, 这对于拓展生态学研究内容, 揭示水生生物学发生机制, 持续利用水生生物资源具有重要的科学意义和实际价值。
信息有机物; 检测方法; 水域生态讯息学; 水环境
信息有机物系指存在于自然环境中, 对生物物种或生物类群生存和生长有促进或抑制作用, 并能通过调控生物丰度与群落结构来影响生态系统和生态环境的微痕量有机物。这一概念包括两个层面: 生物释放的化感物质和人类活动产生的有机污染物。
化感现象的概念早在1937年就已经被提出, 最初指植物间通过分泌有机物影响其他植物生长的现象, 这些有机物就是化感物质[1], 随着研究的深入, 化感现象的范围逐渐拓展到微生物和动物等其他领域, 并得到越来越多的重视[2-3]。这些物质往往产生于生物在环境胁迫下的特定生理过程, 对生物的生存生长有显著影响, 与这些生物的种群分布和群落结构有对应关系, 它们在自然环境中的时空分布对生态系统结构有指示作用, 因此化感物质作为信息有机物在自然界中发挥讯息作用的概念与研究价值并不难以理解。而通过人类活动产生并进入自然环境中的有机污染物虽然也得到了充分重视, 相关研究也多有报道, 却很少有将其生态效应置于生态系统层面、与生物种群分布和群落结构相联系的系统研究。事实上, 这些有机污染物通常对生物生存生长有显著影响, 其种类、含量与分布均与生态系统有较大关联, 因此也可归为信息有机物。
与陆地生态系统不同, 水环境中的信息有机物可以随水体运动而扩散、迁移, 更容易与生物接触、作用, 常在藻华等生态现象中扮演关键角色, 对生态环境有重要影响。同时, 它们来源复杂, 影响因素多样, 人们对其认识尚不充分, 相关研究纷乱零散, 这使得系统了解信息有机物及其生态效应和开展后续研究困难重重。因此, 极有必要建立一个完整的研究框架, 将不同种类、不同来源的信息有机物化学结构、含量的检测和分布特征、生态学功能研究有机结合, 这对于理解生态系统结构、阐明生态现象机理有重要意义。本文在系统总结近年来水环境中信息有机物及其检测方法主要研究进展的基础上, 提出了“水域生态讯息学”的学科概念和研究体系, 这对于拓展生态学研究内容, 深入揭示水生生物学发生机制, 持续利用水生生物资源具有重要的科学意义和实际价值。
1 水环境信息有机物的类型
明确信息有机物的化学结构是进一步研究其含量、分布、作用途径与机理的前提与基础。目前陆地生态系统的讯息现象和信息有机物均已得到较充分的描述, 相对而言, 水环境中的讯息现象仍有待完善, 尤其是针对具体信息有机物化学组成和生态效应研究得非常不充分, 已有报道大多为分子质量小于104Da的小分子有机物, 按官能团分类[4], 主要有醇、酚、萜、酯、生物碱、氨基酸、羧酸等, 集中于生物次级代谢产物和人为产生的塑化剂、抗生素等(表1)。水环境中的有机物质容易随水体运动稀释、扩散, 在实验室条件下, 研究者可以提高培养密度或设置适宜条件从而获得较高浓度, 但自然环境中的信息有机物浓度极低, 难以分离出足以进行鉴定的量, 是造成这一现象的重要原因。

表1 水环境中可能含有的信息有机物及其讯息作用
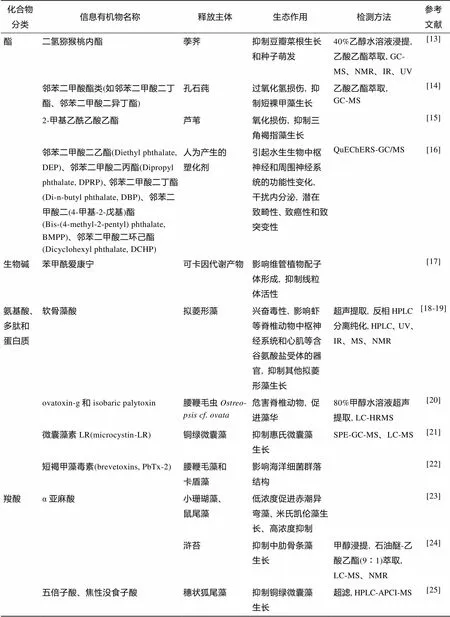
续表

续表
2 水环境信息有机物的作用机制
相对陆地生境而言, 水环境中的讯息作用认识相对缺乏, 一是因为水环境中的现象观测和研究开展都较陆地环境更为困难; 二是在水体稀释下, 信息有机物作用时间和强度通常达不到致使受体生物数量骤减甚至全部死亡的程度, 而是形成二者共存且生物量没有太大波动的平衡局面, 难以被人们察觉[2]; 三是水环境中的讯息作用过程受包括微生物活动、营养水平、环境条件等多种因素影响[31], 信息有机物的含量甚至存在与否都随生物生长时期和环境条件的不同而变化, 多种因素的干扰可能也是水环境中的讯息作用及其对水域生态学的意义在较长时间内未引起足够关注的原因, 但事实已证明水环境中讯息物质的存在和作用, 目前水环境中的信息有机物及其讯息作用已成为生态学研究的热点之一[2]。
2.1 讯息作用的形式
讯息作用在淡水和海洋环境中普遍存在, 目前文献报道的相关现象涉及物种极其广泛, 涵盖细菌、藻类、水生植物和无脊椎动物等。如硅藻释放的不饱和多元醛抑制纤毛虫和鞭毛虫等浮游动物生存生长[32]。秦皇岛褐潮现场海水抑制卤虫和轮虫摄食[33]。Zak等研究了6种南波罗的海地区常见藻类代谢产物对绿藻生长状况的影响, 发现甲藻的培养滤液能抑制绿藻生长, 而蓝细菌和的培养滤液则促进绿藻生长[34]。培养实验表明水生蕨类植物槐叶萍对酚类信息化合物2-氯酚和水杨醛很敏感, 在2.5 mg/L的低浓度下新叶生长、叶绿素产量和植株重量就会受到影响[35]。无脊椎动物如海绵等通过产生信息有机物阻止其他生物幼虫在其表面生长, 保持自身孔隙畅通, 从而获得最适摄食速率[37]。除自身直接释放外, 海绵还可以刺激自身携带的细菌释放信息有机物, 间接产生讯息作用[38]。
另外, 陆源信息有机物也能对水生生物产生影响, 常有关于落叶、秸秆或其他植物的抑藻作用见诸报道[39]。除生物代谢产物外, 许多人类活动产生的有机物也对生物群落丰度和种群分布产生影响, 属于信息有机物范畴, 尤其是小分子有机污染物因其对水体生态系统的潜在风险成为人们关注的重中之重。抗生素等药活性化合物是水体人为污染物中排放量最大的一类, 这些物质具有生物毒性, 且能在生物体内富集, 对生态环境乃至人类健康都有极大危害[40-41]。工业产品及其中间体和副产物也是近来逐渐引起人们重视的水体污染物之一, 以邻苯二甲酸酯类化合物 (Phthalic acid esters, PAEs) 为主的塑化剂就是其中的代表性物质, 它们能引起中枢神经和周围神经系统的功能性变化, 显示出较强的内分泌干扰性, 具有致畸、致癌和致突变风险, 有极大生态危害。抗生素也是陆源信息有机物的重要组成部分, 吴春辉等[42]研究发现浒苔原生质体再生苗对草丁膦极为敏感, 即使在较低浓度(12.5 μg/mL)下, 60 h后死亡率也超过75%。
生物产生的信息有机物常具有作用特异性, 如褐藻产生的3中不饱和多元醇lobophorenol A-C使与之接触的其他珊瑚白化, 却几乎不会危及其宿主珊瑚[5]。讯息作用的强度与多种因素有关[43], 通常在空间竞争激烈、营养盐较匮乏的条件下作用强烈, 而微生物活动旺盛的环境下信息有机物被迅速分解, 使得讯息作用相对较弱。信息有机物的浓度也是讯息作用的重要影响因素之一, 甚至可以造成完全相反的作用结果, 如邻苯二甲酸二丁酯浓度小于4 mg/L时促进铜绿微囊藻生长, 超过8 mg/L时表现出抑藻效果[41]。
对讯息作用现象的观察虽然存在陆地多于水环境、淡水环境多于海洋环境、实验室培养多于现场观测的问题, 但总体来说已经得到了较为充分的描述, 为研究信息有机物的作用途径与机理打下了坚实铺垫。
2.2 讯息作用的途径与机理
水环境中的信息有机物有两种作用途径。在底层水或沉积物中, 底栖藻类、沉水植物和固着无脊椎动物释放的信息有机物通过直接接触的方式作用于附生或相邻生物。而在上层水中, 浮游植物和蓝细菌释放的信息有机物或其他陆源有机物随水体扩散、迁移, 而后作用于目标。后者依赖于信息有机物有足够的亲水性, 可随水流迁移扩散, 并且产生和释放的量足够大, 经水体稀释后仍保持有效作用浓度, 但也不排除低水溶性信息有机物也可能通过第二种途径起作用的可能性, 因为亲脂性化合物可以结合在颗粒物上或形成胶束随水流迁移[31]。通过这种途径起作用的信息有机物影响范围广、种类繁多、性质多样, 是讯息作用研究中的重点, 但过于广泛的信息有机物化学类型与性质也使开展相关研究尤为困难。
信息有机物通常既不作为能被生命活动直接利用的能源物质, 又不作为构成生命体的结构物质, 却具有调节生物物种或类群生存和生长的讯息作用。人们对于其作用机理的探索由来已久, 但信息有机物化学结构与含量的缺失使这一领域仍缺乏系统连贯的研究成果。普遍认为生存竞争是生物间产生讯息作用的根本原因, 它们释放信息有机物从而在空间、营养、光照等资源竞争中获得优势, 或使自身免受微生物侵袭或天敌捕食[44-45], 影响氧化磷酸化过程和与蛋白质结合失活是最常见的信息有机物作用机制。
邻苯二甲酸酯类信息有机物还作用于线粒体电子传递, 使藻细胞内的活性氧自由基产生速率受到影响, 引起超氧化物歧化酶和过氧化氢酶等抗氧化酶活性的应激性变化, 对短裸甲藻细胞造成氧化损伤[14]。2-甲基乙酰乙酸乙酯导致的氧化损伤是造成三角褐指藻生长受到抑制的主要原因, 细胞抗氧化酶和非酶抗氧化剂的含量受氧化胁迫而增加[15]。脂肪酸类信息有机物阻碍细胞膜上的电子转移链和氧化磷酸化作用, 干扰三磷酸腺苷能量转化, 抑制烯酯酰载体蛋白还原酶等酶活性, 造成细胞溶解和超氧化、自氧化降解产物形成[45]。杂萜类信息有机物抑制活性氧自由基产生, 有抗氧化损伤和缓解紫外线辐射损伤的作用[11]。水生植物释放的毒性次级代谢产物N-苯基-2-萘胺通过影响电子转移而作用于蓝藻的光合系统Ⅱ[46]。水浮莲根系释放的信息有机物则通过影响藻青蛋白含量和藻青蛋白/别藻蓝素比影响光能合成, 同时破坏细胞膜, 增加O2*–含量, 造成铜绿微囊藻氧化损伤[47]。黄酮类信息有机物毛地黄黄酮显著降低铜绿微囊藻的最大量子产额、光合效率和最大电子传递速率, 破坏光合系统从而抑制蓝细菌生长[29]。
许多附生植物或浮游植物产生胞外酶, 以便在贫营养条件下获取额外的可用营养盐, 如碱性磷酸酶可在磷限制条件下将不能被植物利用的有机磷类化合物水解成可利用的无机磷, 但酚类信息有机物中的酚羟基和芳环结构与蛋白质中的氨基由于疏水作用和氢键结合造成胞外酶失活, 使植物无法获得足够的营养盐进而影响生长。Gross等研究了特里马素Ⅱ对念珠藻碱性磷酸酶活性的影响, 发现其特里马素Ⅱ施加量与碱性磷酸酶的抑制程度呈指数关系, 仅施加0.2 μmol/L特里马素Ⅱ就会致使酶活性降低10%, 这表示水环境中的信息有机物即使在较低浓度下也能有效抑制胞外酶的活性[48]。褐藻多酚类信息有机物类似于陆地环境中的单宁类化合物, 可以与蛋白质结合形成沉淀, 也有助于藻类躲避捕食[49]。
有些信息有机物具有基因毒性。细菌产生的一种酯类信息有机物与信号分子酰基高丝酸内酯形成竞争, 使其无法与活性位点结合, 影响特定基因的表达[45]。Eck-Varanka等通过贻贝微核测试证明千屈菜水提物中的单宁类物质具有不容忽视的诱变特性[50]。甲基磺酸乙酯对小新月菱形藻有诱变作用[51]。黄连素通过抑制光能合成关键基因的表达发挥讯息作用[52]。有些信息有机物作用于中枢神经系统, 具有神经毒性或使捕食者麻痹、食欲降低, 具有协助自身躲避捕食的作用, 它们随食物链传递, 也会对人类造成潜在危害[6, 18]。许多海洋生物会产生具有抗菌、抗病毒功能的褐藻多酚、脂肪酸、多肽、多糖、萜烯等信息有机物使自己免于海洋中普遍存在的致病细菌侵袭[45], 这些物质对于人类医学、药物学也具有重要意义。
3 水环境信息有机物的检测方法
常规的水环境信息有机物检测流程与天然产物分离鉴定过程类似, 包括样品采集、目标物质分离、化学结构鉴定和生物活性检测(图1)[3]。
在样品采集步骤, 大多数研究者采取直接从生物体中提取有机物质进行分离鉴定的方法, 这种方法虽然能发现大量具有生物学、生态学功能的活性物质, 但这些活性物质是否能进入水体并成为信息有机物还必须经过环境样品检测的验证, 如Rasher等[10]从绿藻和红藻中分离鉴定出4种被证明对珊瑚有讯息作用的物质, 它们在藻分泌液中的丰度为藻体内部丰度的0.43%~7%。此外还存在生物将产生的信息有机物全部释放进环境, 从而导致这些物质在生物体中含量极低, 无法检测的可能性。在实验室中收集生物释放进培养介质中的活性物质能有效弥补上一种采样方式的不足, 并且实验室培养可以人为调控生物密度从而获得较高浓度的样品[6-7], 但实验室模拟毕竟不能完全反映现实情况, 分离鉴定实际水体中的信息有机物仍十分必要。自然水环境中影响因素复杂多样, 且信息有机物的含量极低, 如东海海水中2-苯基乙胺含量约为0.68~46.93 nmol/L, 腐胺含量约为5.16~62.28 nmol/L, 亚精胺含量约为0~6.98 nmol/L, 精胺含量约为0.01~13.09 nmol/L[53-54], 如此低的含量使信息有机物的分离鉴定非常困难, 这也是目前自然水体中信息有机物含量报道极少的主要原因。正因如此, 如何从自然水体中分离、富集到足量有机物并进行结构鉴定和含量测定是该领域研究的一大焦点和难点。
3.1 水体中信息有机物的富集
富集对于信息有机物的进一步结构鉴定至关重要, 包括溶剂萃取法、色谱法、固相萃取法、树脂吸附法、分子印迹法、冻干法和透析等。
溶剂萃取是最常用的信息有机物富集方式, 通常根据萃取物的极性选用不同的萃取剂, 如酚类化合物通常用甲醇萃取, 己烷适于弱极性的脂肪酸和烃类化合物, 丙酮萃取物中通常含有单宁类物质等。由于信息有机物种类非常广泛, 通常用不同极性与比例的一系列溶剂萃取同一样品, 以实现更为全面的富集与检测。所得萃取液还需结合色谱法分离以便进一步鉴定, 具体分离方法有薄层色谱、硅胶柱色谱、Sephadex LH-20柱色谱、ODS柱色谱等[11]。Christophe等[5]成功用1︰1的二氯甲烷和甲醇混合溶剂从褐藻中萃取出醇类信息有机物, 经柱色谱和高效液相色谱等分离并鉴定其结构。溶剂萃取仅需要简单的实验装置, 但需消耗大量有机溶剂, 操作繁琐, 而且受限于溶剂的水溶性, 难以提取高度亲水的有机物。
固相萃取也常用于有机物富集, 这种方法仅消耗少量有机溶剂, 操作简单, 且回收率高。在信息有机物领域, 固相萃取应用不如溶剂萃取广泛, 但有多种基于这种技术的低浓度检测方法已被建立, 并在高效性和灵敏性方面表现出色。将固相萃取应用于信息有机物的分离富集中, 萃取铜绿微囊藻培养液中的微囊藻素[21]、穗状狐尾藻中的脂肪酸[26]和底栖生物膜中的紫罗兰酮[28]等信息有机物均有良好的效果。
Gros等[55]建立了一种快速、灵敏、可靠地检测环境水体中低浓度药活性化合物的方法, 并成功将其应用于西班牙加泰罗尼亚地区不同水体(处理前后的污水、河水、水库水、海水和自来水)中药活性化合物残余状况的分析。这种方法用自动离线固相萃取富集水体中的有机物, 随后用超高效液相色谱联用四级线性离子阱质谱分析, 用选择反应监测(selected reaction monitoring, SRM)模式进行定量分析, 进行相关数据采集实验验证检测结果(包括用同位素标记化合物作为内标), 具有需要样品量少(100 mL)、前处理简单且实现自动化、高灵敏度(检测限低至ng/L级别)、高选择性的优点。Osorio等[40]用这种方法首次定量分析了西班牙4个流域不同位点表层水和沉积物中药活性化合物, 并以藻类、水蚤和鱼为代表探讨了它们的环境毒性。叶欣[16]结合QuEChERS纯化和GC-MS鉴定检测地表水中邻苯二甲酸酯类塑化剂, 水样经QuEChERS(PSA+Mg2SO4)脱水除杂后, 用叔丁基甲醚-乙腈提取, GC-MS 测定, 外标法定量。5 种塑化剂在10~1000 μg/L范围内线性良好(>0.998), 最低检出限为0.10~0.18 mg/kg, 定量下限在0.3~ 0.7 mg/kg之间, 回收率为97.1%~107.4%, 相对标准偏差小于8%。该方法纯化效果好, 定量准确, 适用于地表水中多种邻苯二甲酸酯类塑化剂的快速检测。
大孔树脂吸附也可以归于固相萃取的一种, 以树脂装柱, 使水样中的有机物被吸附在树脂中, 在选择合适的溶剂洗脱, 包志成等成功用这种方法结合GC、HPLC和GC-MS对长江水中的有机物进行了鉴定和分析[56]。
分子印迹技术(Molecularly imprinting technique)是分析环境样品痕量物质的重要手段之一, 这种技术在材料聚合过程中添加模板分子, 使得除去模板分子后的高分子聚合物具有特异性识别模板分子的能力。基于分子印迹聚合物的分子印迹固相萃取能实现对目标分子的特异性吸附, 迅速消除杂质干扰, 达到快速分离、富集目标分子的效果, 在水体化合物痕量分析方面具有广阔的应用前景。王江涛等以萘乙酸为虚拟模板合成孔状萘分子印迹聚合物, 发现这种材料对萘和菲有较好的识别能力, 可望用于海水中2~3环多环芳烃的选择性吸附与富集[57]。以结晶紫和孔雀石绿为模板分子的印迹聚合物对三苯甲烷类杀菌剂表现出良好的选择吸附性能, 用这种填料进行固相萃取能有效富集目标分子, 去除天然海水中复杂基质的干扰, 结合高效液相色谱可以方便快捷地分离和检测天然海水样品中的三苯甲烷类杀菌剂[58]。
冻干法也是从水体中提取有机物的方法之一。Yamasaki等将绿胞藻的培养滤液冻干, 用三异丙基乙磺酰-HCl缓冲液溶解后经离子交换柱、凝胶柱层析和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳纯化, 进行胞外多糖蛋白的测定, 并成功应用于环境样品分析[59]。超滤或渗析等根据分离方法也可以实现对信息有机物的富集, Nakai等通过超滤富集得到穗状狐尾藻分泌物中分子量小于1 000的组分, 并成功鉴定其结构[25]。
3.2 信息有机物化学结构鉴定
常规的信息有机物的化学结构鉴定方法一般借鉴天然产物结构鉴定的方法, 将富集得到的样品经过多次分离, 纯化出单种物质, 再结合质谱、高效液相色谱、傅里叶变换红外光谱(fourier transform infrared spectrometry, FTIR)、紫外吸收光谱、核磁共振(nuclear magnetic resonance spectrometry, NMR)等一系列检测手段检测目标分子的官能团、共轭系统、分子量、化学键等性质, 结合标准品图谱比对, 最终确定物质结构[9]。这种检测方法步骤繁多, 周期漫长, 谱图解析非常复杂, 而且需要大量高浓度的样品才能分离出足以进行鉴定的纯物质, 对于实验室培养实验来说, 这种方法不失为一种可行的新物质鉴定方法, 但对于天然环境中的水体样品, 过高的样品量与纯度要求使得实际应用难以实现。
色谱-质谱联用技术(GC-MS或LC-MS)仍然是信息有机物鉴定中最有效的手段, 尤其是GC-MS配有可供检索的谱图库, 已广泛应用于定向(针对已知物质)或非定向(针对未知物质)有机物检测, 如图2所示。孔石莼化感物质的CG-MS分析图可以通过谱图库检索的方式, 确定峰1到峰10分别对应的物质, 如表2中所示, 再与标准品对比的方式确定具体物质。但这种技术只能检测易挥发、热稳定的非极性物质, 而LC-MS弥补了GC-MS的不足, 将检测范围拓宽至半极性和极性物质, 它们更易溶于水, 具有难降解和易迁移的特点, 与水体生态环境息息相关[60]。LC-MS还没有完善的谱图库, 只能通过大量文献来寻找已报道的谱图。

表2 孔石莼化感物质组成分析[61]
仅凭GC-MS或LC-MS结果尚无法完全确定样品中的具体成分, 还需依赖于标准品进行确认, 但信息有机物中有许多是新发现的物质和结构, 没有可供使用的高纯标准品, 这给信息有机物的鉴定造成极大困难。液相色谱联用高分辨质谱(high-resolution mass spectrometers, HRMS)在一定程度上改善了这一问题, 这种方法可以同时检测几百种物质, 在定量检测已知物质的同时, 还能系统评估未知物质, 为鉴定新发现的水体有机物提供了方法。在HRMS中, 四极杆飞行时间串联质谱(quadrupole time-of- flight tandem mass spectrometry, QTOF-MS/MS)和线性离子阱静电场轨道阱组合式串联质谱(ion trap orbitraptandem mass spectrometry, LTQ orbitrap MS/ MS)是两种能够快速、灵敏、可靠地在没有标准品条件下检测低分子量物质的技术, 在水环境信息有机物的检测领域有极大应用前景。HPLC分离与HRMS联用并配合NMR提供的构型、构象信息共同推断有机物结构已成功用于鉴定未知信息有机物, 如褐藻中的lobophorenol[5]、绿鼓藻中的isololiolide和丝状乳节藻中的内酯[10]等。
通过以上步骤分离鉴定出的有机物是否是信息有机物还需要通过生物活性测定来验证, 具体方法是观测添加一定剂量的待测有机物培养一段时间后受体生物的数量、生物量或光合作用强度等表征其活性的参数[3]。此外, 生物活性测定对于在有机物分离过程中筛选活性组分、简化分离步骤也很有帮助。
4 “水域生态讯息学”的提出
从最初对植物间相互作用的研究, 到后来不断发展的化感物质和水体有机污染物研究, 随着时间的推移和研究的深入, 信息有机物及其讯息作用逐渐受到重视, 相关研究研究范围也不断扩大, 已成为生态学研究的热点之一。根据以上总结可知, 围绕这一主题已经进行了较多的研究, 不仅证实了水环境中信息有机物的存在, 而且从不同方面探究了信息有机物在生物个体生长、发育以及生物类群丰度、分布和演替中的作用, 同时也建立了较为成熟的信息有机物分离、鉴定方法, 这为更深入地研究水环境中的信息有机物奠定了基础。
但从另一侧面也可以看出, 尽管水环境中信息有机物的研究已获得一些成果, 但其研究零散而不系统, 而且在研究中也存在一些问题, 如: 1)虽然已在实验室条件下分离鉴定出了多种信息有机物, 但直接从自然水体中分离鉴定出信息有机物并进行定量检测的研究成果很少, 更不用说对自然水体中信息有机物的生态效应研究了, 而弄清信息有机物在自然水体中的生态效应才是研究信息有机物的最终目的; 2)虽然已经明确信息有机物在生态系统中起着重要作用, 但目前大部分研究只是描述现象, 很少有深入到化合物层面进行分子鉴定及机理研究的报道; 3)对信息有机物的定义依然模糊, 有的研究从生物体内提取活性物质并测试其讯息效应, 却忽视了生物体中的物质不一定释放到水环境中, 不能视为信息有机物这一事实。鉴于水环境中信息有机物研究中存在的问题, 为形成水环境中信息有机物生态学系统科学的完整体系, 充分揭示水体信息有机物与水生生物群落的关系, 我们提出“水域生态讯息学”的新概念。
“水域生态讯息学”是研究水环境中信息有机物的检测、分布、迁移、转化机制及其与水生生物群落关系的一门科学, 是水环境化学、水域生态学、分子生物学和水生生物学等多学科交叉的产物。“水域生态讯息学”的主要研究内容包括以下几个方面: 1)水环境中信息有机物高效分离定量检测的方法以及信息有机物含量、种类及其分布特征; 2)信息有机物在水生生物体讯息作用中的通道、途径与机制; 3)水体信息有机物与水生生物群落的耦合与响应关系; 4)水体信息有机物在水生生物群落繁殖、演替中的作用与功能; 5)水环境中信息有机物在经济水生生物增养殖中的应用等等。“水域生态讯息学”概念和研究体系的提出对于拓展生态学研究领域, 系统揭示水生生物学发生机制, 持续利用水生生物资源具有重要的科学意义和实际价值, 相信通过这一领域专家的持续努力, “水域生态讯息学”一定会发展成为对水环境生态资源利用发挥巨大作用的新兴学科。
[1] Rice E L. Allelopathy: An Overview[C]//Cooper-Driver G A. Chemically Mediated Interactions Between Plants and Other Organisms. New York: Plenum Pub Corp, 1985: 81-105.
[2] Singh A, Thakur N L. Significance of investigating allelopathic interactions of marine organisms in the discovery and development of cytotoxic compounds[J]. Chemico-Biological Interactions, 2016, 243: 135-147.
[3] Hu H, Hong Y. Algal-bloom control by allelopathy of aquatic macrophytes——A review[J]. Frontiers of Environmental Science & Engineering in China, 2008, 2(4): 421-438.
[4] 邢其毅, 裴伟伟, 徐瑞秋, 等. 基础有机化学[M].北京: 高等教育出版社, 1994. Xing Qiyi, Pei Weiwei, Xu Ruiqiu, et al. Organic Chemistry[M]. Beijing: Senior Education Press, 1994.
[5] Christophe V, Thomas O P, Gérald C, et al. Allelopathic interactions between the brown algal genus(Dictyotales, Phaeophyceae) and scleractinian corals[J]. Scientific Reports, 2016, 6: 1-11.
[6] Shibata T, Miyasaki T, Miyake H, et al. The influence of phlorotannins and bromophenols on the feeding behavior of marine herbivorous gastropod[J]. American Journal of Plant Sciences, 2014, 5(3): 387-392.
[7] Shibata T, Hama Y, Miyasaki T, et al. Extracellular secretion of phenolic substances from living brown algae[J]. Journal of Applied Phycology, 2006, 18(6): 787-794.
[8] 冀晓青, 韩笑天, 杨佰娟, 等. 强壮前沟藻化感物质分析[J]. 生态学报, 2012, 32(6): 1745-1754.Ji Xiaoqing, Han Xiaotian, Yang Baijuan, et al. Analysis on allelochemicals in the sell-free filtrates ofActa Ecologica Sinica, 2012, 32(6): 1745- 1754.
[9] Sütfeld R, Petereit F, Nahrstedt A. Resorcinol in exudates of[J]. Journal of Chemical Ecology, 1996, 22(12): 2221-2231.
[10] Rasher D B, Stout E P, Engel S, et al. Macroalgal terpenes function as allelopathic agents against reef corals[J]. Proceedings of the National Academy of Sciences, 2011, 108(43): 17726-17731.
[11] Balboa E M, Li Y X, Ahn B N, et al. Photodamage attenuation effect by a tetraprenyltoluquinol chromane meroterpenoid isolated from[J]. Journal of Photochemistry & Photobiology B Biology, 2015, 148: 51-58.
[12] Tillmann U, Kremp A, Tahvanainen P, et al. Characterization of spirolide producing(Dinophyceae) from the western Arctic[J]. Harmful Algae, 2014, 39: 259-270.
[13] Stevens K L, Merrill G B. Growth inhibitors from spikerush[J]. Journal of Agricultural & Food Chemistry, 1980, 28(3): 644-646.
[14] 别聪聪. 邻苯二甲酸二丁酯对短裸甲藻的化感抑制机理研究[D]. 青岛: 中国海洋大学, 2011. Bie Congcong. Mechanism of the inhibitory action of allelochemical dibutyl phthalate on algea[D]. Qingdao: Ocean University of China, 2011.
[15] Yang C Y, Liu S J, Zhou S W, et al. Allelochemical ethyl 2-methyl acetoacetate (EMA) induces oxidative damage and antioxidant responses in[J]. Pesticide Biochemistry and Physiology, 2011, 100(1): 93-103.
[16] 叶欣. QuEChERS-GC/MS检测地表水中5种常见塑化剂[J]. 广东化工, 2014, 41(9): 207-208. Ye Xin. Determination of five common plasticizing agents in surface water by QuEChERS-GC/MS[J]. Guangdong Chemical Industry, 2014, 41(9): 207-208.
[17] Garcia-Cambero J P, Garcia-Cortes H, Valcarcel Y, et al. Environmental concentrations of the cocaine metabolite benzoylecgonine induced sublethal toxicity in the development of plants but not in a zebrafish embryo-larval model[J]. Journal of Hazardous Materials, 2015, 300: 866-872.
[18] Zabaglo K, Chrapusta E, Bober B, et al. Environmental roles and biological activity of domoic acid: A review[J]. Algal Research, 2016, 13: 94-101.
[19] Bates S S, Bird C J, De Freitas A S W, et al. Pennate diatom nitzschia pungens as the primary source of domoic acid, a toxin in shellfish from Eastern Prince Edward Island, Canada[J]. Canadian Journal of Fisheries & Aquatic Sciences, 1989, 46(7): 1203-1215.
[20] García-Altares M, Tartaglione L, Dell’aversano C, et al. The novel ovatoxin-g and isobaric palytoxin (so far referred to as putative palytoxin) from(NW Mediterranean Sea): structural insights by LC-high resolution MS(n.)[J]. Analytical & Bioanalytical Chemistry, 2015, 407(4): 1191-1204.
[21] Yang J, Deng X R, Xian Q M, et al. Allelopathic effect ofon: microcystin-LR as a potential allelochemical[J]. Hydrobiologia, 2014, 727(1): 65-73.
[22] Sipler R E, Mcguinness L R, Kirkpatrick G J, et al. Bacteriocidal effects of brevetoxin on natural microbial communities[J]. Harmful Algae, 2014, 38: 101-109.
[23] 王平平. 亚麻酸对赤潮异弯藻和米氏凯伦藻化感效应及细胞凋亡机制的研究[D]. 曲阜: 曲阜师范大学, 2015. Wang Pingping. The allelopathy and apoptotic mechanisms of iso-linolenic acid onand[D]. Qufu: Qufu Normal University, 2015.
[24] 崔峰. 浒苔对赤潮微藻的化感抑制作用以及化感物质的结构鉴定[D]. 上海: 上海海洋大学, 2014. Cui Feng. Studies on allelopathy effects ofon red tide microalgae and allelochemicals identification[D]. Shanghai: Shanghai Ocean University, 2014.
[25] Nakai S, Inoue Y, Hosomi M, et al.-released allelopathic polyphenols inhibiting growth of blue-green algae[J]. Water Research, 2000, 34(11): 3026-3032.
[26] Nakai S, Yamada S, Hosomi M. Anti-cyanobacterial fatty acids released from. Hydrobiology[J]. Hydrobiologia, 2005, 543(1): 71-78.
[27] 高云霓, 刘碧云, 王静, 等. 苦草()释放的酚酸类物质对铜绿微囊藻()的化感作用[J]. 湖泊科学, 2011, 23(5): 761-766. Gao Yunni, Liu Biyun, Wang Jing, et al. Allelopathic effects of phenolic compounds released byon[J]. Journal of Lake Sciences, 2011, 23(5): 761-766.
[28] Wu Y, Liu J, Yang L, et al. Allelopathic control of cyanobacterial blooms by periphyton biofilms[J]. Environmental Microbiology, 2011, 13(3): 604-615.
[29] Huang H M, Xiao X, Ghadouani A, et al. Effects of Natural Flavonoids on Photosynthetic Activity and Cell Integrity in[J]. Toxins, 2015, 7(1): 66-80.
[30] 左进城, 苗凤萍, 王爱云, 等. 大型海藻内共生真菌次生代谢产物中抑制水华蓝藻物质的分离与活性[J]. 植物科学学报, 2014, 32(5): 509-516. Zuo Jincheng, Miao Fengping, Wang Aiyun, et al. Identification of compounds with allelopathy on bloom microalgae from the secondary metabolites of endophytic fungi isolated from marine macroalgae and the algicidal activities[J]. Plant Science Journal, 2014, 32(5): 509-516.
[31] Gross E M. Allelopathy of aquatic autotrophs[J]. Critical Reviews in Plant Sciences, 2003, volume 22(3): 313-339.
[32] Lavrentyev P J, Franze G, Pierson J J, et al. The effect of dissolved polyunsaturated aldehydes on microzooplankton growth rates in the Chesapeake Bay and Atlantic Coastal Waters[J]. Marine Drugs, 2015, 13(5): 2834-2856.
[33] 公晗, 孔凡洲, 王云峰, 等. 秦皇岛海域“褐潮”海水对卤虫、轮虫存活和摄食的影响研究[J]. 海洋科学, 2015, 39(4): 30-36. Gong Han, Kong Fanzhou, Wang Yunfeng, et al. Effect of “Brown Tide” on survival and ingestion ofandin Qinhuangdao[J]. Marine Sciences, 2015, 39(4): 30-36.
[34] Zak A, Kosakowska A. The influence of extracellular compounds produced by selected Baltic cyanobacteria, diatoms and dinoflagellates on growth of green algae[J]. Estuarine Coastal and Shelf Science, 2015, 167: 113-118.
[35] Gallardo M T, Martin B B, Martin D F. Inhibition of water fernby cattail () extracts and by 2-chlorophenol and salicylaldehyde[J]. Journal of Chemical Ecology, 1998, 24(9): 1483-1490.
[36] Gette-Bouvarot M, Mermillod-Blondin F, Lemoine D, et al. The potential control of benthic biofilm growth by macrophytes-A mesocosm approach[J]. Ecological Engineering, 2015, 75: 178-186.
[37] Bell J J. The functional roles of marine sponges[J]. Estuarine, Coastal and Shelf Science, 2008, 79(3): 341-353.
[38] Thakur N. Antibacterial activity of the spongeand its primmorphs: Potential basis for epibacterial chemical defense[J]. Aquatic Microbial Ecology, 2003, 31(1): 77-83.
[39] Xiao X, Huang H M, Ge Z W, et al. A pair of chiral flavonolignans as novel anti-cyanobacterial allelochemicals derived from barley straw (): characterization and comparison of their anti-cyanobacterial activities[J]. Environmental Microbiology, 2014, 16(5): 1238-1251.
[40] Osorio V, Larrañaga A, Aceña J, et al. Concentration and risk of pharmaceuticals in freshwater systems are related to the population density and the livestock units in Iberian Rivers[J]. Science of the Total Environment, 2015.
[41] 刘春晓. DBP对铜绿微囊藻生长和抗氧化酶的影响[D]. 南京: 南京林业大学, 2013. Liu Chunxiao. Effects of dibutyl phthalate on growth and enzymatic antioxidants of[D]. Nanjing: Nanjing Forestry University, 2013.
[42] 吴春辉, 王峰, 赵瑾, 等. 浒苔原生质体再生苗对草丁膦与6种抗生素的敏感性[J]. 海洋科学, 2015, 39(8): 1-6. Wu Chunhui, Wang Feng, Zhao Jin, et al. Sensitivity of protoplast-regenerated seedling ofto phosphinothricin and six kinds of antibiotics[J[. Marine Sciences, 2015, 39(8): 1-6.
[43] Søndergaard M, Moss B. Impact of Submerged Macrophytes on Phytoplankton in Shallow Freshwater Lakes[M]. Springer New York, 1998.
[44] Maldonado A, Johnson A, Gochfeld D, et al. Hard coral (Porites lobata) extracts and homarine on cytochrome P450 expression in Hawaiian butterflyfishes with different feeding strategies[J]. Comparative biochemistry and physiology Toxicology & pharmacology : CBP, 2016, 179: 57-63.
[45] Shannon E, Abu-Ghannam N. Antibacterial derivatives of marine algae: An overview of pharmacological mechanisms and applications[J]. Marine Drugs, 2016, 14(4): 91-114.
[46] Liu R, Ran X F, Bai F, et al. Use of chlorophyll a fluorescence to elucidate the toxicity target of N-phenyl-2- naphthylamine on photosynthetic system of(Cyanobacteria)[J]. Phycologia, 2015, 54(1): 12-19.
[47] Wu X, Wu H, Ye J Y, et al. Study on the release routes of allelochemicals from., and its anti-cyanobacteria mechanisms on[J]. Environmental Science and Pollution Research, 2015, 22(23): 18994-19001.
[48] Gross E M, Meyer H, Schilling G. Release and ecological impact of algicidal hydrolysable polyphenols in[J]. Phytochemistry, 1996, 41(1): 133-138.
[49] Jormalainen V, Honkanen T, Koivikko R, et al. Induction of phlorotannin production in a brown alga: defense or resource dynamics?[J]. Oikos, 2003, 103(3): 640-650.
[50] Eck-Varanka B, Kovats N, Hubai K, et al. Genotoxic Effect ofExtract Determined by the Mussel Micronucleus Test[J]. Acta Biologica Hungarica, 2015, 66(4): 460-463.
[51] 杨茂纯, 赵耕毛, 王长海. 甲基磺酸乙酯对小新月菱形藻的生物学效应[J]. 海洋科学, 2015, 39(1): 8-12. Yang Maochun, Zhao Gengmao, Wang Changhai. The biological effect of the Ethyl Methanesulphonate on[J]. Marine Sciences, 2015, 39(1): 8-12.
[52] Bi X D, Zhang S L, Dai W, et al. Analysis of Effects of Berberine on the Photosynthesis ofat Gene Transcriptional Level[J]. Clean-Soil Air Water, 2015, 43(1): 44-50.
[53] 李彩艳, 赵卫红, 苗辉. 2010年中国东海夏季游离态2-苯基乙胺、腐胺、亚精胺和精胺的分布[J]. 海洋科学, 2012, 36(4): 68-74. Li Caiyan, Zhao Weihong, Miao Hui. Distributions of free 2-phenylethylamine, putrescine, spermidine, and spermine in the East China Sea in summer of 2010[J]. Marine Sciences, 2012, 36(4): 68-74.
[54] Kern S, Fenner K, Singer H P, et al. Identification of transformation products of organic contaminants in natural waters by computer-aided prediction and high- resolution mass spectrometry[J]. Environmental Science & Technology, 2009, 2(2): 362-377.
[55] Gros M, Rodríguez-Mozaz S, Barceló D. Fast and comprehensive multi-residue analysis of a broad range of human and veterinary pharmaceuticals and some of their metabolites in surface and treated waters by ultra-high-performance liquid chromatography coupled to quadrupole-linear ion trap tandem mass spectrometry[J]. Journal of Chromatography A, 2012, 1248: 104-121.
[56] 包志成, 张尊. 长江(江阴段)水体有机物鉴定与分析[J]. 环境化学, 2015, 9(4): 1-8. Bao Zhicheng, Zhang Zun. Identification and analysis of organics in Yangtze River (Jiangyin section)[J]. Environmental Chemistry, 2015, 9(4): 1-8.
[57] 王江涛, 宋兴良. 虚拟模板/硅胶表面分子印迹材料的制备及其在海水溶液中的吸附行为研究[J]. 分析化学, 2010, 38(8): 1121-1126. Wang Jiangtao, Song Xingliang. Synthesis, evaluation and adsorption behavior of naphthalene analog-imprinted polymer by immobilized template on modified silica gel in seawater[J]. Chinese Journal of Analytical Chemistry, 2010, 38(8): 1121-1126.
[58] 连子如, 黄振宇, 王江涛. 分子印迹固相萃取测定天然海水中的三苯甲烷类杀菌剂[J]. 海洋环境科学, 2014, 33(2): 304-310. Lian Ziru, Huang Zhenyu, Wang Jiangtao. Triphenylmethane dyes in natural seawater by high-performance liquid chromatograph using molecularly imprinted solid-phase extraction[J]. Marine Environmental Science, 2014, 33(2): 304-310.
[59] Yamasaki Y, Shikata T, Nukata A, et al. Extracellular polysaccharide-protein complexes of a harmful alga mediate the allelopathic control it exerts within the phytoplankton community[J]. Isme Journal, 2009, 3(7): 808-817.
[60] Ruff M, Mueller M S, Loos M, et al. Quantitative target and systematic non-target analysis of polar organic micro-pollutants along the river Rhine using high-resolution mass-spectrometry – Identification of unknown sources and compounds[J]. Water Research, 2015, 87: 145-154.
[61] 田志佳. 大型海藻化感物质对短裸甲藻的抑制作用[D]. 青岛: 中国海洋大学, 2009. Tian Zhijia. Inhibition effect of allelochemicals from large seaweeds on[D]. Qingdao: Ocean University of China, 2009.
(本文编辑: 康亦兼)
Informational organic matter in aquatic environments and new concept of “Aquatic Ecoinformatics”
ZHANG Qian1, 2, SONG Jin-ming1, 2, 3, LI Xue-gang1, 2, 3, YUAN Hua-mao1, 2, 3, LI Ning1, 2, 3, DUAN Li-qin1, 2, 3, QU Bao-xiao1, 2, 3, KANG Xu-ming1, 2, 3
(1. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Chinese Academy of Sciences, IOCAS, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Laboratoryof Marine Ecology and Environmental Sciences, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China)
Informational organic matter (or allelochemicals) is trace organic matter that exerts a biochemical informational effect (both stimulatory and inhibitory) on the life and growth of organism species or biological taxa and that affect the ecosystem and eco-environment by controlling and regulating biological abundance and community structure. In the aquatic environment, the informational effects of this organic matter are readily found. Pelagic algae and cyanobacteria may use informational active compounds to outcompete other species, to gain dominance over predecessors, or to influence the type of conspecifics and successors. In marine ecosystems, informational interactions may occur between phytoplankton species or in benthic areas where macroalgae, corals, and a few species of angiosperms are present. Informational interaction between planktonic algae has been described mainly when bloom-forming microalgae have been involved. Informational organic matter in aquatic environments may provide a competitive advantage to angiosperms, algae, or cyanobacteria via their interaction with other primary producers. Most informational organic matter known to date are low-weight molecules of less than 104Da. Their chemical classifications vary, including alcohol, phenol, terpene, acid, ester, and amide. Aquatic informational organic matter, in particular, must be sufficiently hydrophilic to reach their target organisms in effective concentrations despite considerable dilution. Informational organic matter exists in the natural environment. Some are produced by the metabolism of organisms. Others are generated by human activity. Aquatic informational organic matter often targets multiple physiological processes. By relocating and diffusing with the migration of water, these small molecules affect the growth and survival of target organisms by controlling their enzyme activities or influencing their photosystemic functions. The intensity of their informational effects is dependent on numerous factors, including the microbial decomposition of informational bioactive substances and the nutrient content and proportions in their living environment. Informational interactions seem to be enhanced under abiotic or biotic stress. Informational organic matter in the aquatic environment is usually enriched by solvent extraction or solid-phase extraction (SPE) and can be identified and quantified by chromatography coupled with mass spectrometry technology, including gas chromatography–mass spectrometry (GC-MS) and liquid chromatography–mass spectrometry (LC-MS). In this review, we systematically summarize recent research progress in informational organic matter as well as related determination methods. We discuss the importance to aquatic ecology of establishing an efficient and sensitive analysis method for identifying the chemical compositions and structures of informational organic matter in the aquatic environment and we investigate the mechanisms by which informational organic matter affects target organisms. In addition, we propose the concept of “aquatic ecoinformatics.” This topic has great scientific significance for expanding the scope of ecology research and for further revealing hydrobiology mechanisms. Also of crucial practical value is the relevance of aquatic ecoinformatics to the sustainable utilization of aquatic biological resources.
Informational organic matter; determination; aquatic ecoinformatics; aquatic environment
Jun. 20, 2016
[National Natural Science Foundation of China, No.41376092; AoShan Talents Program Supported by Qingdao National Laboratory for Marine Science and Technology(No.2015ASTP-OS13)]
P734
A
1000-3096(2017)03-0138-13
10.11759/hykx20160620002
2016-06-20;
2016-08-27
国家自然科学基金(No.41376092); 青岛海洋科学与技术国家实验室“鳌山人才”计划项目(No.2015ASTP-OS13)
张倩(1992-), 女, 山东日照人, 硕士研究生, 从事海洋化学研究, E-mail: zhangqian314@mails.ucas.ac.sn; 宋金明, 通信作者, 研究员, 电话: 0532-82898583, E-mail: jmsong@qdio.ac.cn

