不同尿白蛋白排泄率2型糖尿病患者血清HIF-1α、VEGF、vWf、IGF-1、25(OH)D3水平及其相互关系研究
邵 滢,吕 川,马小羽,王秋月
·论著·
不同尿白蛋白排泄率2型糖尿病患者血清HIF-1α、VEGF、vWf、IGF-1、25(OH)D3水平及其相互关系研究
邵 滢,吕 川,马小羽,王秋月*
目的 探讨不同尿白蛋白排泄率2型糖尿病(T2DM)患者的血清低氧诱导因子-1α(HIF-1α)、血管内皮生长因子(VEGF)、血管性血友病因子(vWf)、胰岛素样生长因子-1(IGF-1)、25-羟维生素D3〔25(OH)D3〕水平及其相互关系。方法 选取2012年6月—2014年11月在中国医科大学附属第一医院门诊及住院部就诊的T2DM患者423例作为病例组,根据尿白蛋白排泄率〔以尿微量白蛋白与尿肌酐比值(ACR)表示〕分为正常尿蛋白组(ACR<30 mg/g,n=163)、微量蛋白尿组(ACR 30~300 mg/g,n=145)、临床蛋白尿组(ACR>300 mg/g,n=115);另选取性别、年龄、BMI匹配的本院同期体检健康成年人165例作为对照组。采用ELISA法集中检测HIF-1α、VEGF、vWf、IGF-1,采用化学发光法检测25(OH)D3。结果 4组性别、平均年龄、BMI、高密度脂蛋白胆固醇(HDL-C)比较,差异无统计学意义(P>0.05);4组糖尿病病程、腰围、腰臀比(WHR)、空腹血糖(FPG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、血肌酐(SCr)、血尿素氮(BUN)、尿酸(UA)、纤维蛋白原(Fg)、空腹胰岛素(FINS)、胰岛素抵抗指数(HOMA-IR)、Ln(ACR)、HIF-1α、VEGF、vWf、IGF-1、25(OH)D3比较,差异有统计学意义(P<0.05)。Pearson相关分析结果显示,HIF-1α与VEGF、HIF-1α与vWf、HIF-1α与IGF-1、VEGF与vWf、VEGF与IGF-1、vWf与IGF-1均呈线性正相关(P<0.05),25(OH)D3与HIF-1α、VEGF、vWf、IGF-1均呈线性负相关(P<0.05)。Spearman秩相关分析结果显示,Ln(ACR)与糖尿病病程、腰围、WHR、HbA1c、TC、TG、LDL-C、SCr、BUN、UA、Fg、HOMA-IR、HIF-1α、VEGF、vWf、IGF-1呈正相关(P<0.05),与25(OH)D3呈负相关(P<0.05)。多元线性逐步主成分回归分析结果显示,糖尿病病程、TG、LDL-C、SCr、BUN、UA、HOMA-IR、HIF-1α、VEGF、vWf、IGF-1、25(OH)D3是Ln(ACR)的影响因素(P<0.05),回归方程为:Y[Ln(ACR)]=2.553+0.967×主成分+0.024×糖尿病病程+0.123×TG+0.147×LDL-C+0.018×SCr+0.195×BUN+0.003×UA+0.033×HOMA-IR-0.045×25(OH)D3,主成分=0.827×HIF-1α+0.846×VEGF+0.727×vWf+0.931×IGF-1。结论 尿白蛋白排泄率较高T2DM患者的血清HIF-1α、VEGF、vWf、IGF-1水平较高,血清25(OH)D3水平较低。血清HIF-1α、VEGF、vWf、IGF-1可能通过慢性炎性反应、促进血管生成、促内皮损伤及功能紊乱参与糖尿病肾病(DN)的发生发展,并相互作用、相互促进;25(OH)D3可能对DN有保护作用,且其至少有部分保护作用是通过抑制炎性反应和异常新生血管形成、抑制血管内皮功能紊乱实现的。 【关键词】 糖尿病肾病;低氧诱导因子-1α;血管内皮生长因子类;血管性血友病因子;胰岛素样生长因子Ⅰ;骨化二醇
邵滢,吕川,马小羽,等.不同尿白蛋白排泄率2型糖尿病患者血清HIF-1α、VEGF、vWf、IGF-1、25(OH)D3水平及其相互关系研究[J].中国全科医学,2017,20(16):1961-1967.[www.chinagp.net]
SHAO Y,LYU C,MA X Y,et al.Changes of serum HIF-1α,VEGF,vWf,IGF-1,25(OH)D3levels and their correlation in type 2 diabetes mellitus patients with different urinary albumin excretion rates[J].Chinese General Practice,2017,20(16):1961-1967.
糖尿病肾病(DN)是糖尿病较为常见的并发症之一,其特点为肾小球肥大、基底膜增厚及过量细胞外基质(extracellular matrix,ECM)沉积,并最终造成肾小球和肾间质纤维化,是由遗传和环境因素经过复杂的相互作用造成的代谢与血流动力学改变的病理生理过程。近年来,越来越多的报道支持慢性炎性反应[1]、新生血管形成[2]、血管内皮功能紊乱[3]参与了DN的发生发展。DN与一种慢性亚临床低度炎性状态相关,而该种炎性状态在糖尿病诊断前就已经存在,炎性反应通过氧化应激、转录因子、信号转导通路及细胞因子等途径在DN的发生发展中起重要作用。DN早期,新生的异常血管已经存在于肾小球附近,NAKAGAWA等[4]发现新生血管形成在DN的发病机制中起重要作用;同时WEN等[5]指出,部分抗血管新生类药物,如肿瘤抑素、内皮抑素、血管生成抑制因子、血管抑制蛋白-1等,已经被证实在DN的动物模型中具有治疗意义。在晚期糖基化产物、细胞因子、氧化应激等因素的作用下,内皮损伤和功能紊乱造成其不能维持肾小球滤过屏障的正常功能,故内皮损伤可以直接导致蛋白尿的发生,从而促进DN的发展[6]。
低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)是机体内高度敏感的氧含量监测与调节蛋白,既往在低氧条件下和肿瘤中的研究较多,然而除低氧外,生长因子、激素、应激状态、炎性状态等因素也均可提高HIF-1α的表达水平[7],且在高糖条件下HIF-1α是肾脏硬化的关键调节分子。血管内皮生长因子(vascular endothelial growth factor,VEGF)是内皮细胞的关键生长因子,尤其在肾脏细胞,是与肾脏疾病相关的最主要的血管生成因子[8]。血管性血友病因子(von willebrand factor,vWf)是由内皮细胞释放的多聚糖蛋白,是内皮细胞损伤和功能紊乱的生物学标志物[9]。胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)对肾脏发育,肾脏血流动力学,肾小管对水、钠、磷酸的重吸收起重要作用[10]。对肾小球系膜细胞而言,IGF-1是一个强有力的有丝分裂原,其可以诱导细胞迁移和刺激蛋白多糖、层粘连蛋白、纤维连接蛋白、IV型胶原蛋白生产,从而促进DN的发生发展[11]。MAO等[12]发现,维生素D可以通过抑制前列腺素的合成与活化降低炎性反应,通过抑制应激激活的蛋白激酶信号通路减缓DN进展。本研究选取这些具有代表性的炎性因子、促血管生成因子、促内皮损伤及功能紊乱因子,通过检测不同尿白蛋白排泄率〔以尿微量白蛋白与尿肌酐比值(ACR)表示〕2型糖尿病(T2DM)患者的相应因子水平及相互关系,明确DN的多种发病机制及其相互作用,从而为延缓和治疗DN提供新靶点。
1 对象与方法
1.1 研究对象 选取2012年6月—2014年11月在中国医科大学附属第一医院门诊及住院部就诊的T2DM患者423例,作为病例组。纳入标准:符合1999年WHO制定的T2DM诊断标准[13]。排除标准:(1)伴心、肝、肾疾病及各种感染性疾病;(2)近期发生过糖尿病酮症酸中毒、高渗性昏迷;(3)合并高血压;(4)近期使用过血管紧张素转化酶抑制剂(ACEI)/血管紧张素受体拮抗剂(ARB)。根据ACR,将病例组患者分为正常尿蛋白组(ACR<30 mg/g,n=163)、微量蛋白尿组(ACR 30~300 mg/g,n=145)、临床蛋白尿组(ACR>300 mg/g,n=115)。另选取性别、年龄、BMI匹配的本院同期体检健康成年人165例,作为对照组。本研究通过了中国医科大学伦理委员会的批准,纳入受试者均签署知情同意书。
1.2 研究方法
1.2.1 临床资料收集 通过查阅病历和体检报告的方法,收集受试者性别、年龄、糖尿病病程、BMI、腰围、腰臀比(WHR)等基本信息,以及空腹血糖(FPG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、血肌酐(SCr)、血尿素氮(BUN)、尿酸(UA)、纤维蛋白原(Fg)、空腹胰岛素(FINS)、胰岛素抵抗指数(HOMA-IR)、ACR、25-羟维生素D3〔25(OH)D3〕等指标的检测水平。上述指标的检测均由中国医科大学附属第一医院检验科完成,其中25(OH)D3的检测采用化学发光法。
1.2.2 实验室指标检测 采用ELISA法集中检测HIF-1α(KA1247,台湾Abnova)、VEGF(CSB-E11718h,武汉华美)、vWf(SBJ-H0100,南京森贝伽)、IGF-1(CSB-E04580h,武汉华美)水平。
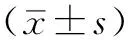
2 结果
2.1 4组临床资料比较 对照组中,男87例(52.7%),女78例(47.3%);正常尿蛋白组中,男82例(50.3%),女81例(49.7%);微量蛋白尿组中,男70例(48.3%),女75例(51.7%);临床蛋白尿组中,男59例(51.3%),女56例(48.7%)。4组性别比较,差异无统计学意义(χ2=0.245,P>0.05)。4组平均年龄、BMI、HDL-C比较,差异无统计学意义(P>0.05);4组糖尿病病程、腰围、WHR、FPG、HbA1c、TC、TG、LDL-C、SCr、BUN、UA、Fg、FINS、HOMA-IR、Ln(ACR)、HIF-1α、VEGF、vWf、IGF-1、25(OH)D3比较,差异有统计学意义(P<0.05,见表1)。
2.2 HIF-1α、VEGF、vWf、IGF-1、25(OH)D3的相关性分析 Pearson相关分析结果显示,HIF-1α与VEGF(r=0.508,P<0.05)、HIF-1α与vWf(r=0.522,P<0.05)、HIF-1α与IGF-1(r=0.727,P<0.05)、VEGF与vWf(r=0.461,P<0.05)、VEGF与IGF-1(r=0.820,P<0.05)、vWf与IGF-1(r=0.520,P<0.05)均呈线性正相关;25(OH)D3与HIF-1α(r=-0.185,P<0.05)、VEGF(r=-0.472,P<0.05)、vWf(r=-0.150,P<0.05)、IGF-1(r=-0.412,P<0.05)均呈线性负相关。2.3 Ln(ACR)与临床资料的相关性分析 Spearman秩相关分析结果显示,Ln(ACR)与糖尿病病程、腰围、WHR、HbA1c、TC、TG、LDL-C、SCr、BUN、UA、Fg、HOMA-IR、HIF-1α、VEGF、vWf、IGF-1呈正相关(P<0.05),与25(OH)D3呈负相关(P<0.05,见表2)。
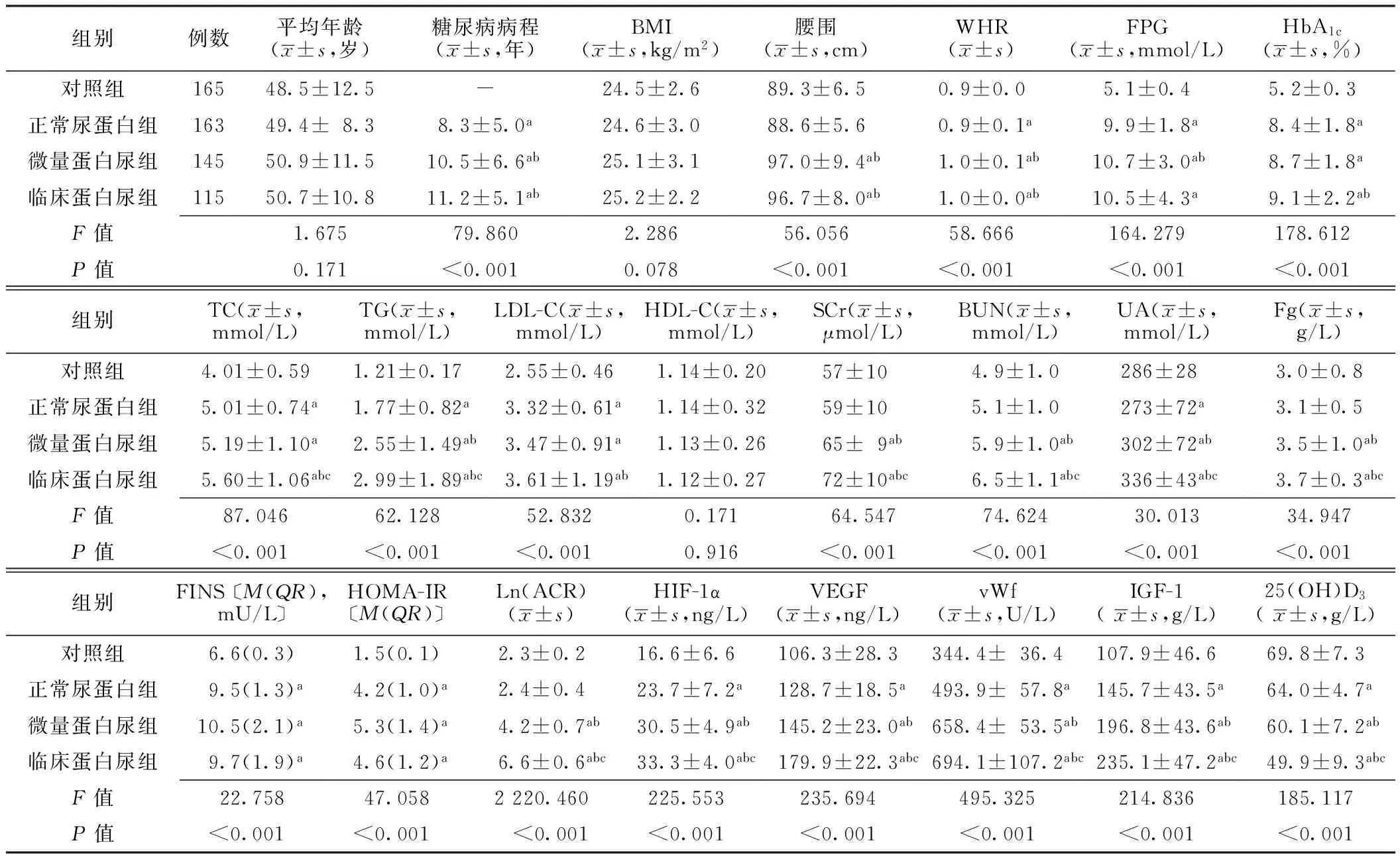
表1 4组临床资料比较
注:WHR=腰臀比,FPG=空腹血糖,HbA1c=糖化血红蛋白,TC=总胆固醇,TG=三酰甘油,LDL-C=低密度脂蛋白胆固醇,HDL-C =高密度脂蛋白胆固醇,SCr=血肌酐,BUN=血尿素氮,UA=尿酸,Fg=纤维蛋白原,FINS=空腹胰岛素,HOMA-IR=胰岛素抵抗指数,Ln(ACR)=尿微量白蛋白与尿肌酐比值的对数值;-代表无此数据;与对照组比较,aP<0.05;与正常尿蛋白组比较,bP<0.05;与微量蛋白尿组比较,cP<0.05
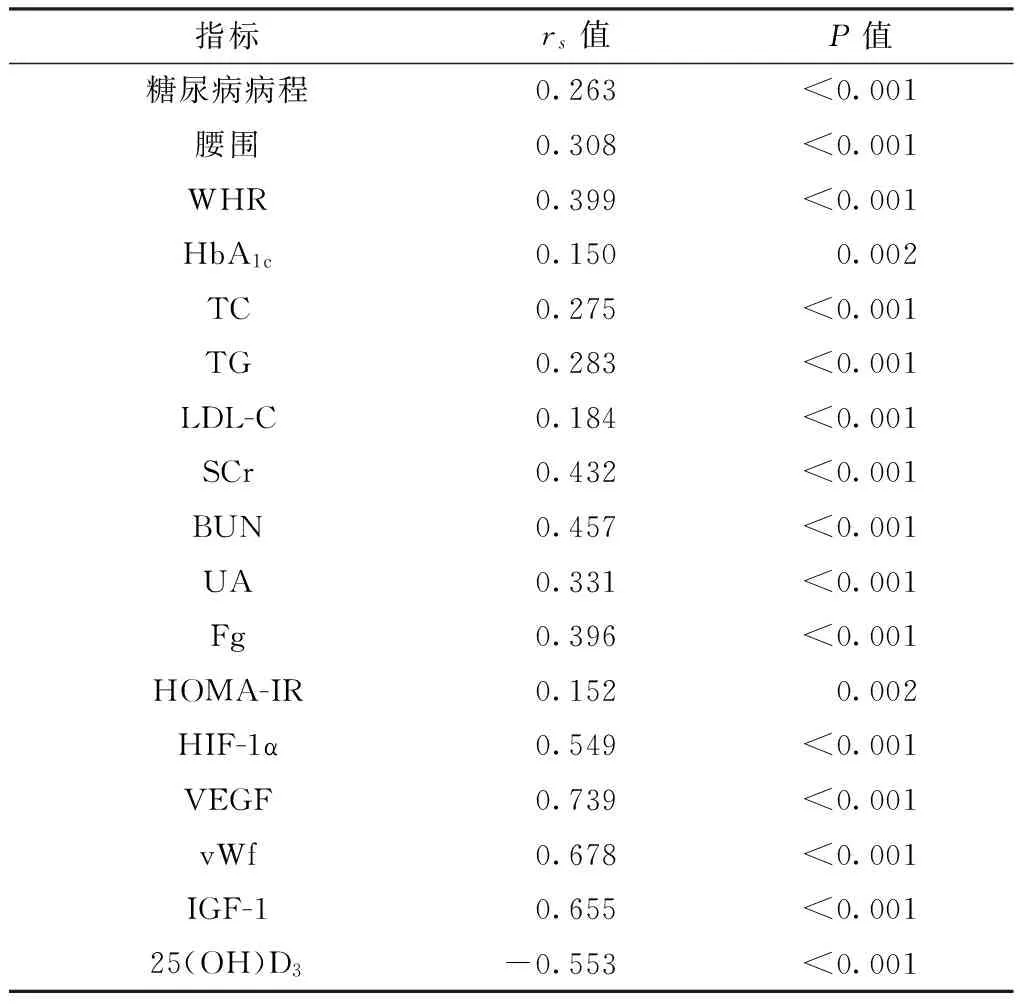
表2 Ln(ACR)与临床资料的相关性分析
本文要点:
近年来越来越多的报道指出,慢性炎性反应、新生血管形成、血管内皮功能紊乱参与了糖尿病肾病(DN)的发生发展。为明确DN的发病机制及其相互作用,本研究检测了不同尿白蛋白排泄率2型糖尿病(T2DM)患者的相关因子水平,包括氧诱导因子-1α(HIF-1α)、血管内皮生长因子(VEGF)、血管性血友病因子(vWf)、胰岛素样生长因子-1(IGF-1)、25-羟维生素D3〔25(OH)D3〕。通过分析发现:(1)HIF-1α、VEGF、vWf、IGF-1是促进DN的主要细胞因子,可以相互作用、互相促进,印证了慢性炎性反应、新生血管形成及内皮功能紊乱是DN发病机制中的3个重要部分;(2)维生素D对DN有保护作用,且其保护作用可能是通过抑制炎性反应、异常新生血管形成及血管内皮功能紊乱实现的。本研究结果可以为延缓和治疗DN提供新靶点,创新性和实用性较高。
2.4 Ln(ACR)影响因素的多元线性逐步主成分回归分析 以Ln(ACR)为因变量,以表2中与Ln(ACR)相关的指标为自变量,进行多元线性逐步主成分回归分析。结果显示,糖尿病病程、TG、LDL-C、SCr、BUN、UA、HOMA-IR、HIF-1α、VEGF、vWf、IGF-1、25(OH)D3是Ln(ACR)的影响因素(P<0.05)。回归方程为:Y[Ln(ACR)]=2.553+0.967×主成分+0.024×糖尿病病程+0.123×TG+0.147×LDL-C+0.018×SCr+0.195×BUN+0.003×UA+0.033×HOMA-IR-0.045×25(OH)D3,主成分=0.827×HIF-1α+0.846×VEGF+0.727×vWf +0.931×IGF-1(见表3)。
表3 Ln(ACR)影响因素的多元线性逐步主成分回归分析
Table 3 Multiple stepwise regression and principal component regression analysis of the correlation factors for Ln(ACR)
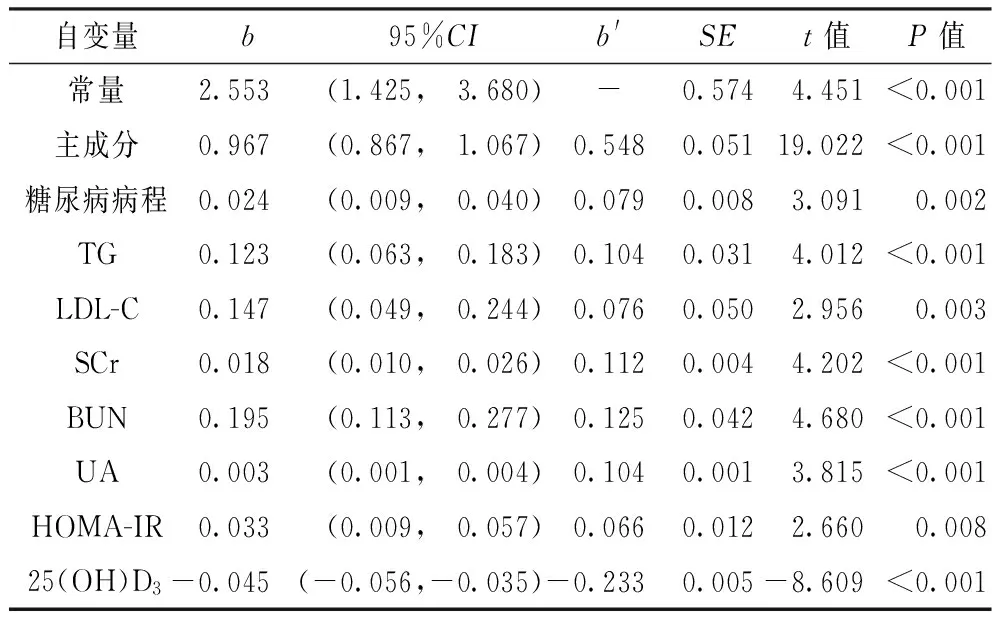
自变量b95%CIb'SEt值P值常量2.553 (1.425, 3.680)-0.5744.451<0.001主成分0.967(0.867, 1.067)0.5480.05119.022<0.001糖尿病病程0.024(0.009, 0.040)0.0790.0083.0910.002TG0.123(0.063, 0.183)0.1040.0314.012<0.001LDL-C0.147(0.049, 0.244)0.0760.0502.9560.003SCr0.018(0.010, 0.026)0.1120.0044.202<0.001BUN0.195(0.113, 0.277)0.1250.0424.680<0.001UA0.003(0.001, 0.004)0.1040.0013.815<0.001HOMA-IR0.033(0.009, 0.057)0.0660.0122.6600.00825(OH)D3-0.045(-0.056,-0.035)-0.2330.005-8.609<0.001
注:主成分=0.827×HIF-1α+0.846×VEGF+0.727×vWf +0.931×IGF-1
3 讨论
本研究结果显示,血清HIF-1α、VEGF、vWf水平在T2DM患者中均明显升高,且尿白蛋白排泄率较高的患者水平更高。相关性分析结果显示,HIF-1α、VEGF,vWf与Ln(ACR)呈正相关,主成分回归分析也指出上述细胞因子是导致Ln(ACR)升高的重要因素,与既往研究结果一致[14-15],进一步证实了慢性炎性反应、新生血管形成及血管内皮功能紊乱导致DN的学说。
HIF-1α在代谢紊乱和炎症的条件下,发挥重要作用。ISOE等[16]的研究结果证实,在正常供氧高糖培养的人和大鼠的肾小球系膜细胞中,HIF-1α的蛋白水平和mRNA水平明显升高。BONDEVA等[17]和PLUM等[18]发现,在肾脏细胞中,非低氧条件下,荧光素酶报告基因检测、迹和电泳迁移实验的结果说明晚期糖基化产物可以通过调节丝裂原活化蛋白激酶组织蛋白1(MAPKinase organizer protein1,Morg1)使HIF-1α的转录活性升高。HIF-1α可以通过激活促纤维化因子,如基质金属蛋白酶抑制剂(tissue inhibitor of metalloproteinase,TIMP)、纤溶酶原激活物抑制剂(plasminogen activator inhibitor,PAI)等刺激胶原聚集;同时,体内和体外实验均证实HIF-1α可以通过激活血管紧张素Ⅱ而促进肾间质纤维化[19]。
VEGF在DN患者肾脏和尿液中的表达均升高[2]。内皮一氧化氮合酶可以在肾脏调节VEGF的功能,在高糖、氧化应激、晚期糖基化产物等的作用下,肾脏内皮一氧化氮合酶表达下降,此条件下VEGF的表达对内皮细胞构成毒性作用。在DN中,VEGF的表达升高同时伴随内皮一氧化氮合酶表达下降,共同促进异常的血管生成[2]。VEGF家族及其受体是调节新生血管形成的重要细胞信号分子,VEGF表达增加活化磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信号通路,使内皮一氧化氮合酶磷酸化,从而引起新生血管形成,在内皮细胞中,VEGF可以引起PAI-1及金属蛋白酶间质胶原酶表达升高[14],从而促进DN的发生发展。在DN中异常新生血管形成多为不成熟的血管,可以导致肾脏纤维化并最终导致肾小球功能丧失,VEGF可以促进内皮细胞增殖、迁移和小管形成并诱导血管渗透性增加,而HIF-1α可以上调其下游VEGF、转化生长因子-β(transforming growth factor-β,TGF-β)、ECM的表达[20]。
本研究证实HIF-1α与VEGF存在明显相关关系。越来越多的证据显示,在糖尿病患者中,HIF-1α通过调节其下游靶基因,结缔组织生长因子(connective tissue growth factor,CTGF)、PAI-1、VEGF等的表达,促进肾脏硬化和肾间质纤维化[21]。同样的,既往研究证实在持续高糖作用下,核因子kB(NF-kB)活化,可以导致其下游的HIF-1α活化,进而使其下游的VEGF表达增加,后者通过旁分泌作用结合其在肾小球内皮细胞上的受体,导致单核细胞迁移进入肾小球、肾小球滤过率升高、蛋白尿、TGF-β表达升高、EMC蓄积并最终导致肾小球硬化和DN[22]。
DN患者血清vWf水平升高,VERROTTI等[23]证实,内皮功能紊乱与DN微量蛋白尿的发生和发展存在密切联系,内皮损伤是DN的一个特点,即使在该病的亚临床阶段。高血糖通过电子传递链产生许多过氧化物,组织内皮细胞一氧化氮合成酶活化,活化蛋白激酶C(PKC)和NF-kB,导致产生过量的活性氧,以及一氧化氮合成减少。转录因子,如NF-kB诱导炎性基因的表达,从而提高其表达,引起炎性细胞因子和黏附分子表达增加[24],CRUZ等[25]认为血糖升高通过多种信号转导通路引起炎性反应,造成内皮细胞损伤,从而使vWf水平升高,高凝状态形成,进而促进DN的发生发展。
本研究发现,IGF-1与HIF-1α、VEGF、vWf均呈线性正相关,故推测IGF-1可能通过调节HIF-1α、VEGF及vWf参与DN的发生发展。KAMENICKY 等[11]指出,生长激素(GH)/IGF-1轴的激活与肾性高血压、蛋白尿及肾小球硬化存在直接关系,对DN的早期病变起关键作用。研究认为,在肾小球增生肥大的过程中,GH的作用似乎多由IGF-1介导,但在肾小球硬化中IGF-1可独立发挥作用[11]。LEVIN-IAINA等[26]的研究证实,在糖尿病早期,致密斑神经源性一氧化氮合酶减少,导致肾小球滤过率升高,肾脏肥大、尿中一氧化氮排泄率下降,IGF-1可以通过TGF-β、VEGF、氧化应激、晚期糖基化产物及高凝状态等造成肾脏肥大和肾血流动力学异常,DN早期,明显升高的IGF-1和一氧化氮水平与肾脏肥大、肾小球滤过率升高存在密切关系。在高糖条件下,IGF-1参与促进基质蛋白、蛋白多糖及纤维粘连蛋白(fibronectin,FN)的合成,并直接引起系膜区域肾小球基底膜ECM的产生与蓄积,而且在DN中IGF-1水平的升高会伴随IV型胶原、层粘连蛋白水平的升高,共同促进DN的发生发展[27]。研究指出,IGF-1可以通过激活PI3K/Akt/哺乳动物西罗莫司靶蛋白(mTOR)信号通路刺激HIF-1α的表达,进而使VEGF表达增加。同样的,IGF-1通过在翻译水平上提高α亚基,从而实现对HIF-1α水平的上调,IGF-1可以使人骨髓间充质干细胞vWf蛋白表达增加[28]。
本研究发现,25(OH)D3与HIF-1α、VEGF及vWf呈线性负相关,提示维生素D减少蛋白尿、延缓DN进展的作用至少有部分是通过调节HIF-1α、VEGF及vWf实现的。PLUM等[18]认为,维生素D的缺乏可能是蛋白尿的独立危险因素,在动物实验中已经证实,维生素D及其类似物可以明显降低肾素的mRNA和蛋白表达,从而减少蛋白尿的产生,在给予足量维生素D治疗后,蛋白尿明显下降的同时,TGF-β和Smad3等纤维化指标也明显下降,所以维生素D治疗可以明显延缓DN进展。肾素-血管紧张素系统(RAS)在DN的进展中起重要的推动作用,而且血管紧张素Ⅱ可以通过多种途径造成肾脏损伤,包括:增加肾小球毛细血管压力,炎性因子、纤维化因子的释放,刺激肾脏细胞增生肥大,ECM蓄积以及足细胞损伤等。维生素D3通过抑制肾素,抑制RAS活化,减少上述损伤,从而保护肾脏[29]。DM患者血清维生素D水平与尿中炎性因子,如肿瘤坏死因子α(TNF-α)、白介素6(IL-6)、细胞间黏附分子-1(ICAM-1)呈明显正相关,而给予维生素D补充治疗后,上述炎性因子水平下降[12]。1,25(OH)2D3可以通过抑制低氧诱导因子-1(HIF-1)的转录活性从而在翻译水平抑制HIF-1蛋白的表达,同时降低其靶基因蛋白VEGF、内皮素-1(ET-1)等的表达;其还通过抑制细胞增殖而减少新生血管形成,从而延缓DN的发生发展。维生素D缺乏的DN患者与维生素D水平正常的DN患者相比,前者的微血管内皮功能明显下降[30],血管内皮损伤可以导致炎性因子的黏附与激活,可能使vWf表达升高,从而进一步促进DN发展。
综上所述,HIF-1α、VEGF、vWf、IGF-1是促进DN的主要细胞因子,其可以相互作用、互相促进,在DN的发生发展中起重要作用。同时,本研究也再次证实了慢性炎性反应、新生血管形成及内皮功能紊乱是DN发病机制中的3个重要部分。另外,本研究还发现,25(OH)D3在DN患者中的血清水平降低,尿白蛋白排泄率较高的患者水平更低,且其与HIF-1α、VEGF、vWf呈线性负相关。提示维生素D对DN有保护作用,且其保护作用可能是通过抑制炎性反应、异常新生血管形成及血管内皮功能紊乱实现的。
作者贡献:邵滢进行研究的实施与可行性分析、数据整理和统计学处理、结果的分析与解释,撰写论文并负责英文修订,参与文章的构思与设计、数据收集、论文的修订、文章的质量控制及审校,对文章整体负责,监督管理。吕川、马小羽参与数据收集;王秋月参与文章的构思与设计、论文的修订、文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
[1]SHAO Y,LYU C,WU C,et al.Mir-217 promotes inflammation and fibrosis in high glucose cultured rat glomerular mesangial cells via Sirt1/HIF-1α signaling pathway[J].Diabetes Metab Res Rev,2016,32(6):534-543.DOI:10.1002/dmrr.2788. [2]NAKAGAWA T,SATO W,KOSUGI T,et al.Uncoupling of VEGF with endothelial NO as a potential mechanism for abnormal angiogenesis in the diabetic nephropathy[J].J Diabetes Res,2013,2013(4):184539.DOI:10.1155/2013/184539. [3]CHENG H,HARRIS R C.Renal endothelial dysfunction in diabetic nephropathy[J].Cardiovasc Hematol Disord Drug Targets,2014,14(1):22-33.DOI:10.2174/1871529X14666140401110841. [4]NAKAGAWA T,KOSUGI T,HANEDA M,et al.Abnormal angiogenesis in diabetic nephropathy[J].Diabetes,2009,58(7):1471-1478.DOI:10.2337/db09-0119. [5]WEN D,HUANG X,ZHANG M,et al.Resveratrol attenuates diabetic nephropathy via modulating angiogenesis[J].PLoS One,2013,8(12):e82336.DOI:10.1371/journal.pone.0082336. [6]ADVANI A,GILBERT R E.The endothelium in diabetic nephropathy[J].Semin Nephrol,2012,32(2):199-207.DOI:10.1016/j.semnephrol.2012.02.006. [7]ORTEGA A,FERNNDEZ A,ARENAS M I,et al.Outcome of acute renal injury in diabetic mice with experimental endotoxemia:role of hypoxia-inducible factor-1 α[J].J Diabetes Res,2013,2013:254529.DOI:10.1155/2013/254529. [8]KHOURY C C,ZIYADEH F N.Angiogenic factors[J].Contrib Nephrol,2011,170:83-92.DOI:10.1159/000324950. [9]GOLDBERG R B.Cytokine and cytokine-like inflammation markers,endothelial dysfunction,and imbalanced coagulation in development of diabetes and its complications[J].J Clin Endocrinol Metab,2009,94(9):3171-3182.DOI:10.1210/jc.2008-2534. [10]KUMAR P A,BROSIUS F C,MENON R K.The glomerular podocyte as a target of growth hormone action:implications for the pathogenesis of diabetic nephropathy[J].Curr Diabetes Rev,2011,7(1):50-55. [11]KAMENICKY P,MAZZIOTTI G,LOMBS M,et al.Growth hormone,insulin-like growth factor-1,and the kidney:pathophysiological and clinical implications[J].Endocr Rev,2014,35(2):234-281.DOI:10.1210/er.2013-1071. [12]MAO L,JI F,LIU Y,et al.Calcitriol plays a protective role in diabetic nephropathy through anti-inflammatory effects[J].Int J Clin Exp Med,2014,7(12):5437-5444. [13]GABIR M M,HANSON R L,DABELEA D,et al.Plasma glucose and prediction of microvascular disease and mortality:evaluation of 1997 American Diabetes Association and 1999 World Health Organization criteria for diagnosis of diabetes[J].Diabetes Care,2000,23(8):1113-1118. [14]MAHDY R A,NADA W M,HADHOUD K M,et al.The role of vascular endothelial growth factor in the progression of diabetic vascular complications[J].Eye(Lond),2010,24(10):1576-1584.DOI:10.1038/eye.2010.86. [15]DOMINGUETI C P,DUSSE L M,MD C,et al.Hypercoagulability and cardiovascular disease in diabetic nephropathy[J].Clin Chim Acta,2013,415:279-285.DOI:10.1016/j.cca.2012.10.061. [16]ISOE T,MAKINO Y,MIZUMOTO K,et al.High glucose activates HIF-1-mediated signal transduction in glomerular mesangial cells through a carbohydrate response element binding protein[J].Kidney Int,2010,78(1):48-59.DOI:10.1038/ki.2010.99. [17]BONDEVA T,HEINZIG J,RUHE C,et al.Advanced glycated end-products affect HIF-transcriptional activity in renal cells[J].Mol Endocrinol,2013,27(11):1918-1933.DOI:10.1210/me.2013-1036. [18]PLUM L A,ZELLA J B.Vitamin D compounds and diabetic nephropathy[J].Arch Biochem Biophys,2012,523(1):87-94.DOI:10.1016/j.abb.2012.02.008. [19]TANG L,YI R,YANG B,et al.Valsartan inhibited HIF-1 alpha pathway and attenuated renal interstitial fibrosis in streptozotocin-diabetic rats[J].Diabetes Res Clin Pract,2012,97(1):125-131.DOI:10.1016/j.diabres.2012.01.037. [20]KANG M K,LIM S S,LEE J Y,et al.Anthocyanin-rich purple corn extract inhibit diabetes-associated glomerular angiogenesis[J].PLoS One,2013,8(11):e79823.DOI:10.1371/journal.pone.0079823. [21]MATOBA K,KAWANAMI D,OKADA R,et al.Rho-kinase inhibition prevents the progression of diabetic nephropathy by downregulating hypoxia-inducible factor 1α[J].Kidney Int,2013,84(3):545-554.DOI:10.1038/ki.2013.130. [22]XU X,CHEN P,ZHENG Q,et al.Effect of pioglitazone on diabetic nephropathy and expression of HIF-1α and VEGF in the renal tissues of type 2 diabetic rats[J].Diabetes Res Clin Pract,2011,93(1):63-69.DOI:10.1016/j.diabres.2011.03.019. [23]VERROTTI A,GRECO R,BASCIANI F,et al.von Willebrand factor and its propeptide in children with diabetes.Relation between endothelial dysfunction and microalbuminuria[J].Pediatr Res,2003,53(3):382-386.DOI:10.1203/01.PDR.0000049509.65496.BF. [24]YNGEN M,OSTENSON C G,HJEMDAHL P,et al.Meal-induced platelet activation in Type 2 diabetes mellitus:effects of treatment with repaglinide and glibenclamide[J].Diabet Med,2006,23(2):134-140.DOI:10.1111/j.1464-5491.2005.01765. [25]CRUZ N G,SOUSA L P,SOUSA M O,et al.The linkage between inflammation and Type 2 diabetes mellitus[J].Diabetes Res Clin Pract,2013,99(2):85-92.DOI:10.1016/j.diabres.2012.09.003. [26]LEVIN-IAINA N,IAINA A,RAZ I.The emerging role of NO and IGF-1 in early renal hypertrophy in STZ-induced diabetic rats[J].Diabetes Metab Res Rev,2011,27(3):235-243.DOI:10.1002/dmrr.1172. [27]JI L,YIN X X,WU Z M,et al.Ginkgo biloba extract prevents glucose-induced accumulation of ECM in rat mesangial cells[J].Phytother Res,2009,23(4):477-485.DOI:10.1002/ptr.2652. [28]JAZAYERI M,ALLAMEH A,SOLEIMANI M,et al.Molecular and ultrastructural characterization of endothelial cells differentiated from human bone marrow mesenchymal stem cells[J].Cell Biol Int,2008,32(10):1183-1192.DOI:10.1016/j.cellbi.2008.07.020. [29]LI Y C.Vitamin D and diabetic nephropathy[J].Curr Diab Rep,2008,8(6):464-469. [30]MUNISAMY S,KAMALIAH M D,Suhaidarwani A H,et al.Impaired microvascular endothelial function in vitamin D-deficient diabetic nephropathy patients[J].J Cardiovasc Med(Hagerstown),2013,14(6):466-471.DOI:10.2459/JCM.0b013e3283590d3d.
(本文编辑:王凤微)
Changes of Serum HIF-1α,VEGF,vWf,IGF-1,25(OH)D3Levels and Their Correlation in Type 2 Diabetes Mellitus Patients with Different Urinary Albumin Excretion Rates
SHAOYing,LYUChuan,MAXiao-yu,WANGQiu-yue*
DepartmentofEndocrinology,theFirstHospitalAffiliatedtoChinaMedicalUniversity,Shenyang110001,China*Correspondingauthor:WANGQiu-yue,Professor,Doctoralsupervisor;E-mail:wqycmu123@163.com
Objective To investigate the changes of serum hypoxia-inducible factor-1 alpha(HIF-1α),vascular endothelial growth factor(VEGF),von Willebrand factor(vWf),insulin-like growth factor-1(IGF-1),25-hydroxyvitamin D3〔25(OH)D3〕 levels and their correlation in type 2 diabetes mellitus(T2DM) patients at different stages of diabetic nephropathy(DN) determined by urinary albumin.Methods Four hundred and twenty-three outpatients and inpatients with T2DM(case group) admitted to the First Hospital Affiliated to China Medical University between June 2012 and November 2014 were included in this study.They were compared with 165 gender- and age- and BMI-matched healthy adults(control group) undergoing physical examination in the same hospital during the same period.For further and detailed study,in accordance with the level of urinary albumin excretion rate〔which is expressed with albumin/creatinine ratio(ACR)〕,we divided the case group into normoalbuminuric subgroup(ACR<30 mg/g,n=163),microalbuminuric subgroup(ACR ranges 30~300 mg/g,n=145),and macroalbuminuric subgroup(ACR>300 mg/g,n=115).The levels of serum HIF-1α,VEGF,vWf,and IGF-1 were determined by enzyme-linked immunosorbent assay(ELISA),and 25(OH)D3was measured by chemiluminescent immunoassay(CLIA) in all the subjects.Results Duration of T2DM,waist circumference,waist to hip ratio(WHR),fasting plasma glucose(FPG),glycosylated hemoglobin(HbA1c),total cholesterol(TC),triacylglycerol(TG),low-density lipoprotein cholesterol(LDL-C),serum creatinine(SCr),blood urea nitrogen(BUN),uric acid(UA),fibrinogen(Fg),fasting insulin(FINS),homeostasis model assessment- insulin resistance(HOMA-IR),Ln(ACR),HIF-1α,VEGF,vWf,IGF-1 and 25(OH)D3differed significantly between the control group,and normoalbuminuric,microalbuminuric and macroalbuminuric subgroups(P<0.05),while gender,average age,BMI,and high-density lipoprotein cholesterol(HDL-C) did not(P>0.05).Pearson correlation analysis found that,HIF-1α had linear positive correlation with VEGF,vWf as well as IGF-1(P<0.05);VEGF was linearly and positively correlated with vWf along with IGF-1(P<0.05);linear positive correlation was found between vWf and IGF-1(P<0.05);while 25(OH)D3showed linear negative correlation with HIF-1α,VEGF,vWf,and IGF-1(P<0.05).Results of Spearman′s rank correlation coefficient analysis demonstrated that,Ln(ACR)was positively associated with the duration of T2DM,waist circumference,WHR,HbA1c,TC,TG,LDL-C,SCr,BUN,UA,Fg,HOMA-IR,HIF-1α,VEGF,vWf and IGF-1(P<0.05),while it was negatively associated with 25(OH)D3(P<0.05).Multiple stepwise regression and principal component regression analysis revealed that the duration of T2DM,TG,LDL-C,SCr,BUN,UA,HOMA-IR,HIF-1α,VEGF,vWf,IGF-1,25(OH)D3were the correlation factors for Ln(ACR)(P<0.05),with a regression equation of Y[Ln(ACR)]=2.553+0.967×principal component +0.024×duration of T2DM +0.123×TG+0.147×LDL-C+0.018×SCr+0.195×BUN+0.003×UA+0.033×HOMA-IR-0.045×25(OH)D3,principal component =0.827×HIF-1α+0.846×VEGF+0.727×vWf +0.931×IGF-1.Conclusion In T2DM patients,with the increase of Ln(ACR),the levels of serum HIF-1α,VEGF,vWf and IGF-1 were gradually increased,while serum 25(OH)D3was gradually decreased.Serum levels of HIF-1α,VEGF,vWf,IGF-1 may be involved in the occurrence and progression of DN through chronic inflammation,promoting angiogenesis,endothelial injury and dysfunction.These pathogeneses interact with each other and promote each other;25(OH)D3may have protective effect on DN,and its protective effect is realized at least in part by inhibiting the inflammatory reaction,abnormal angiogenesis and inhibiting vascular endothelial dysfunction.
Diabetic nephropathy;Hypoxia-inducible factor Ⅰ alpha;Vascular endothelial growth factors;Von willebrand factor;Insulin-like growth factor Ⅰ;Calcifediol
辽宁省高等学校“高端人才队伍建设工程”项目(〔2014〕187)110001 辽宁省沈阳市,中国医科大学附属第一医院内分泌科
R 587.24
A
10.3969/j.issn.1007-9572.2017.16.012
2016-11-13;
2017-02-16)
*通信作者:王秋月,教授,博士生导师;E-mail:wqycmu123@163.com

