改性活性炭对水溶液中六价铬离子吸附效果的测定与分析
廖莹莹
(衡阳市环境监测站,湖南 衡阳 421001)
改性活性炭对水溶液中六价铬离子吸附效果的测定与分析
廖莹莹
(衡阳市环境监测站,湖南 衡阳 421001)
通过静态吸附实验,采用原子吸收分光光度计,测定并分析商业活性炭及其改性态对水溶液中六价铬的吸附去除能力。结果表明:六价铬的吸附性能取决于溶液的起始pH值、铬的浓度、活性炭的投加量、吸附时间和温度。活性炭及其改性态对六价铬的最大去除率分别达97.67%,99.87%,最大吸附量分别为4.75,5.95 mg/g。2种活性炭对六价铬的吸附是一个自发的吸热过程,Freundlich等温吸附与准一级吸附动力学模型能很好地拟合六价铬的吸附过程。
原子吸收分光光度法;改性活性炭;六价铬;吸附;分析
原子吸收分光光度法是测定水样中重金属离子的常用方法。铬(Cr)是重要的重金属污染物,其污染治理备受关注。Cr(VI)的生物毒性大,对环境安全和人类健康具有巨大的威胁[1]。发达国家通常将工业废水中的Cr(VI)还原为Cr(Ш),再将其沉淀后排放,以降低Cr的环境污染[2],但是这种方法的费用较高,且Cr(VI)不能彻底还原为Cr(Ш),Cr(Ш)沉淀物对Cr(VI)具有一定的表面吸附能力,能产生含Cr(VI)的毒性污泥,导致环境的二次污染[3]。因此,深入研究废水中Cr(VI)的去除方法很有必要。
吸附是去除废水中Cr(VI)的重要方法[4-7],商业活性炭吸附由于具有操作简单和技术可靠的特点,已广泛应用于世界范围内含Cr(VI)废水的处理[8]。但是,活性炭的官能团相对少,因此要提高活性炭对重金属的去除效果,其改性研究尤为重要。H2SO4是常用的化学活化剂,制备的生物基活性炭孔容较高,相对ZnCl2活化,其环境和生态毒性低;相对KOH活化,其活化温度低。
本实验采用原子吸收分光光度计,测定原生与硫酸改性活性炭吸附水溶液中Cr(VI)后滤液中Cr(VI)的含量,并对测定结果进行分析,旨在评价活性炭对水溶液中Cr(VI)的吸附能力与特性,为含Cr(VI)废水的活性炭吸附提供科学依据。
1 材料与方法
1.1 试验材料
1)吸附剂。
椰壳商业活性炭购于长沙天成试剂与设备有限公司,标记为AC0。
改性步骤如下:50 g AC0中加入250 mL、7 mol/L的H3PO4,混合物于90 ℃缓慢振荡12 h,105 ℃烘干,标记为AC1。
2)吸附质溶液。
称取2.828 7 g于120 ℃干燥2 h的重铬酸钾(K2Cr2O7),用超纯水溶解移入1 000 mL容量瓶中,再用超纯水稀释至标线,摇匀。得到浓度为1 000 mg/L的Cr(VI)储备液。实验用的Cr(VI)溶液根据浓度要求稀释配制。
1.2 试验方法
1)静态吸附试验。
在一系列250 mL锥形瓶中,先后加入50 mL不同浓度与pH值的含Cr(VI)溶液及一定剂量的活性炭,混合液于SKL-3F振荡仪上200 r/min、不同温度条件下振荡一定时间。再将混合液过滤,用分光光度计(Daojin, UV-1700)测定滤液中Cr(VI)含量。
Cr(VI)吸附量用公式(1)计算:
(1)
式(1)中,V为含Cr(VI)溶液体积(L);m为AC0和AC1剂量(g)。
Cr(VI)去除率R%用公式(2)计算:
(2)
实验重复3次,结果为3次实验的平均值±标准偏差。显著性差异用SPSS统计软件(SPSS, Chicago, IL, USA)分析,P<0.05为显著性水平。
2)影响吸附性能的单因素优化试验。
取100 mL、50 mg/L的Cr(VI)溶液放入大烧杯,用0.1 mol/L HCl或0.1 mol/L NaOH调节溶液的起始pH值。将0.5 g活性炭加入一系列内含50 mL、50 mg/L、不同pH值的Cr(VI)溶液锥形瓶中,于25 ℃、200 r/min的条件下振动120 min,测定滤液的Cr(VI)浓度,根据吸附效果,确定下一步实验的适宜pH值。
于一系列250 mL锥形瓶中,依次加入50 mL、pH值为4的一定浓度的Cr(VI)和0.5 g活性炭,200 r/min振荡一定时间,测定滤液的Cr(VI)浓度,根据吸附效果,确定下一步实验的吸附时间,同时分析吸附动力学过程。
在一系列250 mL锥形瓶中,分别加入0.5 g活性炭和50 mL、pH值为4的一定浓度的Cr(VI),200 r/min振荡60 min,测定滤液的Cr(VI)浓度,根据吸附效果,确定下一步实验的适宜Cr(VI)浓度。
在一系列250 mL锥形瓶中,分别加入不同剂量的活性炭和50 mL、25 mg/L、pH值为4的含Cr(VI)溶液,于200 r/min、25~40 ℃条件下振荡60 min,测定滤液的Cr(VI)浓度,以分析不同剂量活性炭和温度对吸附效果的影响,同时可供分析等温吸附的特性。
2 结果与讨论
2.1 溶液起始pH值对吸附的影响
溶液pH值是影响金属离子吸附的重要参数,研究pH值对吸附的影响有利于提高吸附效率。pH值对Cr(VI)去除率的影响如图1所示。由图1可见,随着pH值从2.0增加到8.0,Cr(VI)的去除率逐渐减少。pH值为2时Cr(VI)的去除率最大,且AC1对Cr(VI)的去除率高于AC0,但两者无显著差异。吸附后pH值由2,2.5,3.5,4~8分别降低至1.25,1.75,3.45,3.92~4.13。

实验结果与Khezami和Capart[9]的一致,这归因于不同的溶液pH值能改变吸附剂官能团的离子类型以及金属的化学性质。根据Cr(VI)的水解平衡常数,pH值为1.0~6.0时,溶液中的含铬离子主要为HCrO4-;pH值为6.0~8.0时,溶液中CrO42-为主导离子。2种离子的吸附机理可以由反应式(3)和(4)解释。 AC-OH2++HCrO4-⟺AC-OH2CrO4-+H+
(3) AC-OH2++CrO42-⟺AC-OHCrO42-+H+
(4) 溶液起始pH值从6.0降至1.0时,Cr(VI)去除率快速下降很可能是由于pH值下降,活性炭表面的H+增加,因而对HCrO4-的吸附能力增加。另外,酸性溶液中Cr(VI)可能还原为Cr(III)。溶液起始pH值大于6.0时,Cr(VI)去除率变化不大,可能是由于CrO42-与OH-竞争吸附点,但OH-占优势。吸附平衡时,溶液pH值相对起始pH值下降,表明活性炭表面吸附的H+由于HCrO4-或者CrO42-与AC-OH2+吸附而释放到溶液中,因此反应式(3)和(4)的吸附机理可以解释本实验吸附磷酸改性后,-COOH、-OH、-COOR含氧官能团增加,继续与H+反应形成带正电的水合氢离子,比如-COOH2+、-OH2+、=C=OH+,便于含铬阴离子的静电吸附。尽管溶液初始pH值为2.0时,Cr(VI)的吸附率最大,但为便于应用,以下实验采用4.0作为最佳吸附pH值。
2.2 吸附时间与六价铬初始浓度对吸附的影响
吸附时间与铬初始浓度对吸附的影响如图2所示。由图2可知,AC0和AC1首先快速吸附Cr(VI),在60 min时吸附趋于稳定,因此选择60 min作为后续吸附平衡时间。Cr(VI)初始浓度从10 mg/L增加到150 mg/L,其去除率由99.87%减少到22.76%。AC1比AC0对Cr(VI)的吸附效果更好,可能是由于AC1空隙多,孔容大,以及磷酸氧化过程中使得活性炭比较面积增大所致。

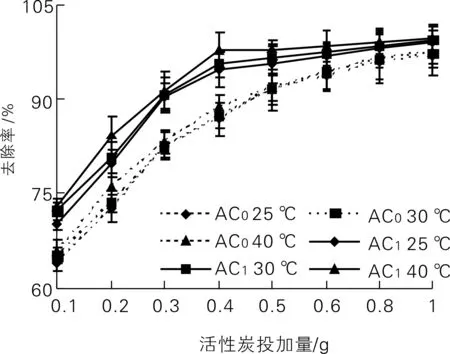
2.3 活性炭剂量与温度对吸附的影响
活性炭投加量与温度对吸附的影响如图3所示。由图3可知,当活性炭剂量为0.1~1.0 g、吸附时间为60 min时,AC0与AC1对Cr(VI)的去除率对应为64.17%~96.47%和70.27%~98.97%。这是因为吸附剂量增加,供吸附的表面积增大、吸附位点增加以及吸附的孔容也增加。
AC0与AC1对Cr(VI)的吸附去除率随吸附温度的增加而增加(见图3),表明吸附反应是吸热过程,活性炭与Cr(VI)发生了化学吸附,产生了更多的吸附位点;或者是因温度较高,Cr(VI)在吸附剂颗粒内部扩散速率增加所致。
标准的吉布斯自由能变△G0(kJ/mol)可用方程(5)计算:
△G0=-RTlnKc
(5)
式(5)中R为气体常数8.314 J·mol-1·K-1,T为绝对温度(K)。不同温度的平衡常数Kc值可由方程(6)计算得出:
(6)
式(6)中,CAC与Ce是Cr(VI)在吸附剂与溶液中的平衡浓度(mg/L)。
标准焓变△H0(kJ/mol)和熵变△S0(J·mol-1·K-1)可由范德霍夫方程(7)获得:
(7)
吸附热力学参数见表1。表1列出了Kc、△G0、△S0与△H0参数值以及不同吸附剂对应的热力学参数值。△G0为负值,表明2种活性炭对Cr(VI)的吸附过程都是自发的,而且自发程度随着温度的上升而增加。△S0值为正,表明固液界面的吸附随机性增加。△H0为正,证实吸附是吸热过程,温度增加有利于吸附发生。
活性炭投加量/gT/KlnKc△G0/(kJ/mol)△H0/(kJ/mol)△S0/(J·mol-1·K-1)AC00.52983033131.581.591.63-3.92-3.99-4.232.4321.27AC10.52983033132.362.593.07-5.84-6.52-7.9937.15144.19AC00.62983033131.912.022.04-4.74-5.10-5.305.7135.32AC10.62983033132.612.813.31-6.46-7.08-8.6136.54144.17
2.4 等温吸附特性
等温吸附模型能描述吸附剂如何与吸附质发生反应,是优化吸附剂用量的关键。本研究采用Langmuir和Freundlich吸附等温模型拟合实验数据。Langmuir 吸附等温线的2种线性表达方式见方程(8)和(9):
(8)
(9)
式(8)~(9)中,Ce是吸附平衡时溶液中吸附质浓度(mg/L);qe为单位吸附剂吸附的吸附质(mg/g);Qm是单层完全吸附的吸附量(mg/g);Ka为吸附平衡常数(L/mg)。
等温吸附参数如表2所示。pH值为4.0时,AC0与AC1对Cr(VI)的最大吸附量分别为3.55~4.75 mg/g、4.07~5.95 mg/g。Demirbas 的研究表明,当溶液2.0≤pH≤3.0时,活性炭对Cr(VI)的吸附量为3.5~180.3 mg/g[9]。吸附量差异可能是因活性炭制备的原料、理化性质、活性炭剂量、Cr(VI)起始浓度、溶液pH值以及吸附温度等实验条件的不同所引起。
Freundlich吸附等温线模型的线性形式如方程(10):
(10)
方程(10)中,KF(mg/g)与1/n分别是相对吸附能力常数和吸附强度。
1/n<1表明吸附的可行性大;1/n>1则表示存在协同吸附,包括吸附质分子之间的强烈反应。由表2可知,AC0与AC1的1/n介于0.37~0.44之间,表明吸附容易发生。由Freundlich模型得到的R2较Langmuir的高,说明AC0与AC1对Cr(VI)的平衡吸附可以更好的用Freundlich模型拟合。

表2 等温吸附参数
2.5 吸附动力学分析
吸附动力学模型能描述溶液吸附速率。本研究利用准一级和二级吸附动力学模型来分析吸附过程。
准一级吸附动力学的线性方程(11):
ln(qe-qt)=lnqe+k1t
(11)
方程(11)中,qe(mg/g)、qt(mg/g)分别为吸附平衡以及任意时间t(min)的吸附量;k1(1/min)为吸附速率常数。
准二级吸附动力学的线性方程(12):
(12)
方程(12)中,k2(g/mg·min)为吸附速率常数。
吸附动力学参数见表3。由表3可知,尽管AC0与AC1对Cr(VI)吸附与准一级吸附动力学模型的R2分别为0.89~0.96,0.89~1.00,但是准一级动力学模型得出的qe值远大于AC0与AC1对Cr(VI)吸附的qe值,表明准一级动力学方程可以描述该吸附过程,但不适合整个吸附过程以及qe的预测。而准二级吸附动力学模拟的qe值与吸附实验qe值一致性很好,表明准二级吸附动力学模型可以描述AC0与AC1对Cr(VI)的整个吸附过程。
表3 吸附动力学参数
3 结论
原生以及硫酸改性活性炭能有效去除水溶液中的Cr(VI)。Cr(VI)的吸附主要依赖于溶液起始pH值、Cr(VI)起始浓度、活性炭用量,而时间与温度对吸附的影响相对较小。Cr(VI)最高去除率对应的pH值为2,吸附时间约120 min。原生与改性活性炭对Cr(VI)的最大去除率分别为92%,98%。吸附为放热以及自发过程,Freundlich与准二级动力学模型可以很好地拟合平衡吸附与吸附动力学过程。今后,应对实际废水进行吸附研究,对吸附材料做一定的表征分析,以更好地揭示吸附机理并为实际废水吸附处理提供科学依据。
[2] Krishnani KK,Parimala V,Meng XG.Detoxification of chromium(VI) in coastal water using lignocellulosic agricultural waste[J].Water S A,2004,30(4):541-545.
[3] Xu WH,Liu YG,Zeng GM,et al.Enhancing effect of iron on chromate reduction by cellulomonas flavigena[J].Journal of Hazardous Materials,2005,126(1-3):17-22.
[4] 曹玉娟,张扬,夏军,等.ε-聚赖氨酸生产废菌体对六价铬吸附影响的研究[J].环境科学,2012,33(2):499-504.
[5] 黄玉梅.改性沸石制备及对其铬吸附特性的研究[J].硅酸盐通报,2017,36(1):205-209.
[6] Han Y,Cao X,Ouyang X,et al.Adsorption kinetics of magnetic biochar derived from peanut hull on removal of Cr(VI) from aqueous solution:effects of production conditions and particle size[J].Chemosphere.2015,145:336-341.
[7] Zhao D,Gao X,Wu C,et al.Facile preparation of amino functionalized graphene oxide decorated with Fe3O4nanoparticles for the adsorption of Cr(VI)[J].Applied Surface Science,2016,384:1-9.
[8] Khezami L,Capart R.Removal of chromium(VI) from aqueous solution by activated carbons: kinetic and equilibrium studies[J].Journal of Hazardous Materials,2005,123(1-3):223-231.
[9] Demirbas E,KobyaM,Senturk E,et al.Adsorption kinetics for the removal of chromium(VI) from aqueous solutions on the activated carbons prepared from agricultural wastes[J].Water S A,2004,30(4):533-539.
(责任编辑 高 嵩)
Determination and Analysis on Absorption Effect of Modified Activated Carbon on Hexavalent Chromium in Aqueous Solution
LiaoYingying
(Environmental Monitoring Station of Hengyang,Hengyang Hunan 421001)
Atom Absorption Spectrometry was used to analyze the concentrations of Cr(VI) after the adsorption by raw and modified activated carbon in solutions by batch experiment.The Cr(VI) sorption was dependent on pH,contact time,initial concentration of Cr(VI),adsorbent dose,and temperature.The maximum removal efficiency of Cr(VI) was 97.67% and 99.87%,and the maximum adsorption capacity was found to be 4.75 and 5.95 mg/g for raw and modified activate carbons, respectively.Thermodynamic parameters indicated that the adsorption process was endothermic and spontaneous in nature.The Freundlich adsorption isotherm and pseudo second-order kinetics models could describe the adsorption process well.
atom adsorption spectrometry;modified activated carbon;Cr(VI);adsorption;analysis
2017-04-06
廖莹莹,工程师,本科。
10.3969/j.issn.2095-4565.2017.03.009
O65
A
2095-4565(2017)03-0038-05

