Fe3O4@VC磁性纳米粒子对Cr(Ⅵ)的吸附性能
阳 晶 李忠海 -
(中南林业科技大学食品科学与工程学院,湖南 长沙 410004)
Fe3O4@VC磁性纳米粒子对Cr(Ⅵ)的吸附性能
阳 晶YANGJing李忠海LIZhong-hai
(中南林业科技大学食品科学与工程学院,湖南 长沙 410004)
通过水热法合成Fe3O4@VC磁性纳米粒子,采用透射电镜、红外光谱和X射线衍射等表征手段对合成的粒子结构进行表征。探讨了pH值、吸附时间、吸附剂用量、溶液初始浓度等因素对六价铬Cr(VI)吸附的影响,并对Cr(VI)的吸附热力学和动力学进行了研究。结果表明,在pH为1.50,25 ℃条件下,磁性纳米粒子对Cr(VI)的饱和吸附量可达39.12 mg/g,吸附率为85%以上。吸附性能试验表明,磁性纳米粒子对Cr(VI)的吸附符合Langmuir热力学模型和HO准二级动力学吸附模型。
Fe3O4@VC磁性纳米粒子;吸附;Cr(VI)
据调查[1]发现:铬是目前世界上最主要的重金属污染之一,其对人体健康和生态环境造成了严重威胁,其中Cr(VI)是罪魁祸首。Cr(VI)毒性很大,几乎是三价铬Cr(III)的500倍[2]。Cr(VI)是国际公认的致癌物,是33种高度危险的毒性物质之一[3-4]。铬的污染问题在国内外引起了相当高的重视。吸附法是目前处理Cr(VI)的主要方法,常用的吸附剂主要包括活性炭、硅藻土、膨润土、沸石以及腐殖质树脂等。这些吸附剂只能一次使用,再生性能低而使其应用受到限制。因此,为了有效清除Cr(VI)污染,迫切需要开发一种可循环使用的吸附材料来处理Cr(VI)。磁性纳米材料是将磁效应与物质的纳米效应相结合而形成的材料[5]。不仅拥有纳米材料的优势如小尺寸效应、表面效应、量子尺寸效应、宏观量子隧道效应以及介电限域效应等,而且具有特殊的磁性能,能够借助外加磁场轻易地从溶液中分离出来,是一种潜在的可循环使用的吸附剂。VC修饰的磁性纳米材料Fe3O4@VC属于磁性纳米材料的一种,通过一步合成法使VC与Fe3O4纳米粒子相结合,形成具有高比表面积的材料,提高了材料本身的稳定性和对Cr(VI)的吸附活性[6-7]。
本试验通过水热法合成Fe3O4@VC磁性纳米粒子,系统地研究pH值、吸附时间、吸附剂用量、溶液初始浓度等因素对Cr(VI)吸附的影响,并对Cr(VI)的吸附热力学和动力学进行研究。Fe3O4@VC能较好地吸附Cr(VI),成本低且可以重复使用,具有重要的理论研究意义和实际应用价值。
1 材料与方法
1.1 试剂与仪器
1.1.1 主要试剂
无水乙醇:分析纯,天津市恒兴化学试剂制造有限公司;
六水合三氯化铁:分析纯,台山市化工厂有限公司;
水合肼80%:分析纯,上海山浦化工有限公司;
抗坏血酸:分析纯,国药集团化学试剂有限公司;
重铬酸钾:分析纯,天津市风船化学试剂科技有限公司。
1.1.2 主要仪器设备
透射电镜:HT7700型,日立高新技术公司;
比表面积及孔径分析仪:F-Sorb3400型,北京金埃谱科技公司;
傅里叶红外光谱仪:IRTracer-100型,岛津企业管理有限公司;
X射线衍射仪:D/MAX2500型,日本株式会社理学公司;
紫外分光光度计:UV-1800型,北京莱贝赛威科技有限公司;
气浴恒温恒速振荡器:ZD-85A型,常州国宇仪器制造有限公司;
超声波清洗机:KQ-DB300型,昆山市超声仪器有限公司;
电子天平:FA1104型,上海舜宇恒平科学仪器有限公司;
磁力加热搅拌器:CJJ79-1型,金坛市环保仪器厂;
酸度计:PHS-3C型,上海仪器股份有限公司;
聚四氟乙烯高压反应釜:KH-100型,上海隆拓仪器设备有限公司;
超纯水机:Z1303008型,湖南中沃水务环保科技有限公司;
真空干燥箱:DZF-6050型,上海博迅实业有限公司。
1.2 方法
1.2.1 Fe3O4粒子的制备 根据改进的共沉淀法来制备Fe3O4[8],分别称取4.86 g(0.018 mol)六水合三氯化铁和1.79 g(0.009 mol)四水合氯化亚铁,放入烧杯中,加入80 mL超纯水,用玻璃棒搅拌使其溶解,再边搅拌边加入10 mL氨水,有沉淀产生时,将烧杯放入80 ℃水浴锅中,并加入0.15 g(0.000 4 mol)十六烷基三甲基溴化铵,陈化反应90 min,反应结束后,把烧杯放于磁铁上加速沉降,用超纯水洗涤至中性,把沉淀放入真空冷冻干燥机中干燥18 h,研磨即可得到Fe3O4磁纳米粒子。
1.2.2 Fe3O4@VC磁性纳米材料的制备 根据薛君[9]的方法。称取1.080 g(0.004 mol)六水合三氯化铁加入到180 mL超纯水中,磁力搅拌形成澄清溶液,再依次加入2.112 g(0.012 mol)VC和20 mL水合肼(50 mL/100 mL),磁力搅拌1 h,然后将混合均匀的溶液在聚四氟乙烯高压反应釜中,于180 ℃下恒温反应8 h。反应结束后,将灰色产物研成粉末,用超纯水和乙醇反复洗涤数次。洗涤后,放入真空干燥箱中,在60 ℃下烘干,标记保存。
1.2.3 Cr(VI)浓度分析 按GB 7467—87的二苯碳酰二肼分光光度法执行。
1.2.4 吸附性能测试 取30 mL一定浓度的Cr(VI)标准溶液于100 mL的锥形瓶中,调节pH,加入一定量Fe3O4@VC磁性纳米粒子,超声分散后,在25 ℃下恒温振荡一定时间,取出过滤,用紫外分光光度计测定滤液中Cr(VI)的浓度,按式(1)、(2)计算吸附量和吸附率。

(1)
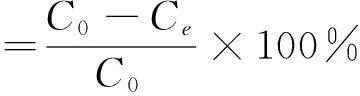
(2)
式中:
q——吸附量,mg/g;
C0——吸附前Cr(VI)浓度,mg/L;
Ce——吸附后Cr(VI)浓度,mg/L;
W——吸附剂质量,g;
V——所加标准溶液的体积,L;
η吸——吸附率,%。
2 结果与讨论
2.1 磁性纳米粒子的表征
2.1.1 透射电镜(TEM)分析 Fe3O4和Fe3O4@VC的透射电镜图见图1。经比表面积和孔径分析仪测定Fe3O4和Fe3O4@VC的比表面积分别为27.21,212.42 m2/g,与Fe3O4相比,Fe3O4@VC的比表面积增大,有利于吸附。

图1 Fe3O4和Fe3O4@VC的TEM图Figure 1 TEM images of Fe3O4 (a)and Fe3O4@VC (b、c)
2.1.2 红外光谱(FTIR)分析 为了检测磁性纳米粒子的化学基团,分别对制备的Fe3O4和Fe3O4@Vc进行了傅立叶变换红外光谱分析,结果见图2。由图2可知,在585.56 cm-1附近的吸收峰为Fe3O4特有的Fe—O吸收峰,1 081.78 cm-1附近的特征峰为C—O—C的伸缩振动峰,1 557.78 cm-1附近的特征峰为纳米粒子表面N—H的弯曲振动特征峰,3 220.67 cm-1附近较宽的峰可能是N—H与O—H伸缩振动的叠加,样品中的O—H可能是由洗涤过程中表面残留的乙醇造成的。
2.1.3 X射线衍射(XRD)分析 采用XRD考察了Fe3O4和Fe3O4@VC磁性纳米粒子的晶体结构,结果见图3。由图3可知,Fe3O4纳米粒子分别在30.30°,35.73°,43.45°,53.56°,57.13°,62.92°处有明显的特征峰,分别对应于Fe3O4晶体的(220)、(311)、(400)、(422)、(511)和(440)晶面,其位置与Fe3O4的标准图谱相一致[10],说明所制备的纳米粒子为具有尖晶石结构的纯Fe3O4纳米粒子。Fe3O4@VC纳米粒子的尖锐衍射峰与Fe3O4纳米粒子的峰位重合。与图3(a)相比,图3(b)的衍射峰强度有所降低,表明合成过程中Fe3O4纳米粒子有所损失。

a. Fe3O4 b. Fe3O4@VC图2 Fe3O4和Fe3O4@VC的红外光谱图Figure 2 FTIR spectra of Fe3O4 and Fe3O4@VC

a. Fe3O4 b. Fe3O4@VC图3 Fe3O4和Fe3O4@VC的XRD图Figure 3 XRD images of Fe3O4 and Fe3O4@VC
2.2 不同因素对吸附性能的影响

图4 pH对吸附量的影响Figure 4 Effect of pH on the adsorption
2.2.2 时间对吸附性能的影响 取7份pH为1.53浓度为50 mg/L的Cr(VI)溶液各30 mL,Fe3O4@VC为0.05 g ,超声分散3 min,于25 ℃下恒温振荡一定时间,过滤,取滤液,测溶液的吸光度,结果见图5。由图5可知,吸附量随时间的延长而增加,在前80 min内,随时间延长,吸附量逐渐升高,当到达80 min时,基本达到吸附平衡(吸附量为28.44 mg/g),随时间的继续延长,吸附量基本不变,所以选择80 min作为最佳吸附时间。

图5 时间对吸附量的影响Figure 5 Effect of time on the adsorption
2.2.3 质量对吸附性能的影响 取8份pH为1.55浓度为50 mg/L的Cr(VI)溶液各30 mL,Fe3O4@Vc加入量为0.01~0.08 g,超声分散3 min,于25 ℃下恒温振荡80 min,过滤,取滤液,测溶液的吸光度,结果见图6。由图6可知,随着吸附剂用量的增大,吸附量逐渐减小,吸附率逐渐增大,当吸附剂用量大于0.06 g时,吸附率增加较小,趋于平缓,所以为了保证一定的吸附量和吸附率,因此选择最佳投加量为0.06 g,此时吸附量达到了22.44 mg/g。
2.2.4 初始浓度对吸附性能的影响 取9份不同初始浓度的Cr(VI)溶液各30 mL,调节pH为1.50,Fe3O4@VC加入量为0.06 g,超声分散3 min,于25 ℃下恒温振荡80 min,过滤,取滤液,测溶液的吸光度,结果见图7。由图7可知,随着Cr(VI)初始浓度的增大,吸附量逐渐增加,当Cr(VI)离子浓度增加到150 mg/L后,随着浓度的继续增加,吸附量增加较小,趋于平缓,所以选定初始浓度为150 mg/L,此条件下的吸附量为39.12 mg/g。
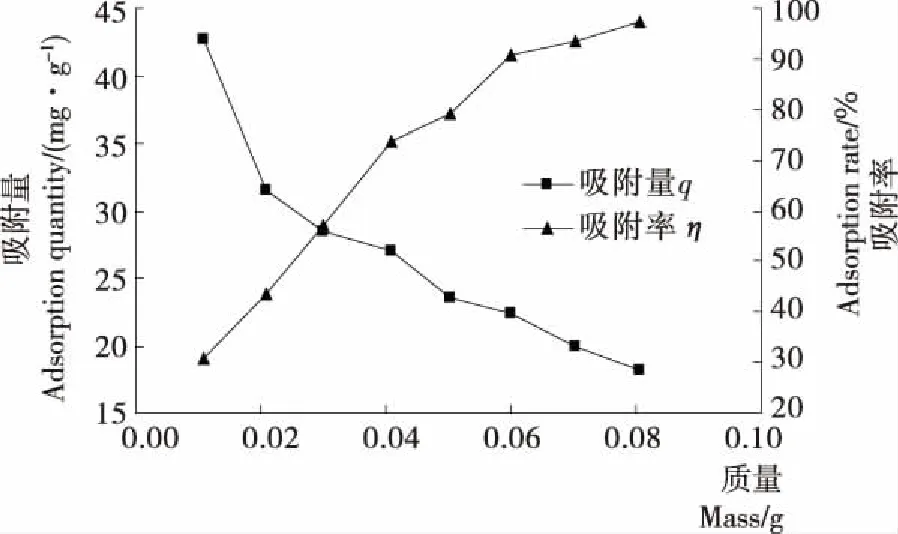
图6 质量对吸附量的影响Figure 6 Effect of dosages on the adsorption

图7 初始浓度对吸附量的影响Figure 7 Effect of initial concentration on the adsorption
2.3 再生性能研究
取30 mL浓度为150 mg/L的Cr(VI)溶液于100 mL的锥形瓶中,调节pH值为1.50,加入0.06 g Fe3O4@VC,超声分散3 min,25 ℃下振荡80 min,取出静置于磁铁上,去除上清液,将吸附了Cr(VI)的Fe3O4@VC用超纯水清洗2次,加入10 mL溶液为0.25 mol/L的盐酸解析30 min,测吸光值,进行吸附剂的多次吸附-解析重复试验,结果见图8。由图8可知,重复操作6次后,Fe3O4@VC磁性纳米粒子对Cr(VI)的回收率仍在85%以上,表明Fe3O4@VC磁性纳米粒子具有良好的再生使用能力。

图8 Fe3O4@VC的循环利用Figure 8 Cyclicutilization of Fe3O4@VC
2.4 吸附热力学分析
配制浓度为30,60,90,120,150 mg/L的Cr(VI)溶液各100 mL,调节pH为1.50,均取30 mL的各浓度的溶液于100 mL的锥形瓶中,向盛有溶液的锥形瓶中均加入0.06 g的Fe3O4@Vc磁性纳米材料,在298,308,318 K下恒温振荡80 min,过滤取滤液,测定吸附平衡后溶液浓度Ce,由C0和Ce计算出平衡吸附量qe。以qe对Ce作图,见图9。由图9可知,随着温度的升高,Fe3O4@VC对Cr(VI)的吸附量逐渐升高。
为了进一步研究吸附热力学,分别使用Langmuir模型和Frendlich模型对其进行拟合。Langmuir模型[11]:
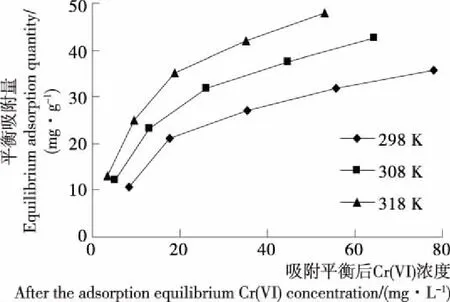
图9 不同温度下Fe3O4@VC对 Cr(VI)的吸附等温线Figure 9 Adsorption isotherms of Cr(VI) on Fe3O4@VCat different temperatures
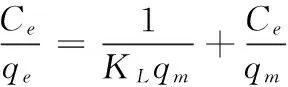
(3)
式中:
Ce——平衡浓度,mg/L;
qm——最大的单层吸附容量,mg/g;
qe——平衡浓度下单位重量的吸附剂对吸附质的吸附量,mg/g;
KL——Langmuir常数。
Frendlich模型[12]:
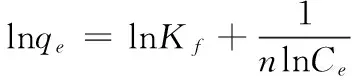
(4)
式中:
Kf——Frendlich常数;
n——Frendlich系数;
其他参数与Langmuir模型相同。
采取两种模型所得的拟合曲线分别见图10、11。
由图10、11可得相应的拟合曲线方程,根据拟合曲线方程可以得到模型的相关参数,见表1。由表1可知,Langmuir等温方程的拟合程度优于Freundlich等温方程,在不同的试验温度条件下,Langmuir等温方程的相关系数均比Freundlich等温方程的相关系数大。

图10 不同温度下Fe3O4@VC对Cr(VI)的Langmuir 拟合曲线
Figure 10 Langmuir isotherms fitted to the adsorption data of Cr(VI) on Fe3O4@VCat different temperatures

图11 不同温度下Fe3O4@VC对Cr(VI)的Frendlich拟合曲线Figure 11 Frendlich isotherms fitted to the adsorption data of Cr(VI) on Fe3O4@VC at different temperatures表1 Fe3O4@VC吸附Cr(VI)的不同模型的等温方程参数Table 1 Parameters for Cr(VI) adsorption by Fe3O4@VCacccording to different equilibrium

T/KLangmuir等温吸附模型qm/(mg·g-1)KLR2Freundlich等温吸附模型KfnR229846.950.03950.99284.12971.95200.942630853.480.05770.99836.01172.05380.970631858.480.08010.99898.10432.14060.9727
2.5 吸附动力学分析
分别取初始浓度为150 mg/L且pH为1.55的Cr(VI)溶液各30 mL于6个100 mL的锥形瓶中,向锥形瓶中分别加入0.06 g Fe3O4@VC磁性纳米材料,在298,308,318 K下恒温振荡30~80 min,过滤,测定滤液中吸附后的Cr(VI)浓度Ce。计算单位吸附量qt绘制Fe3O4@VC对Cr(VI)的吸附动力学曲线,见图12。由图12可知,在相同的吸附时间内,Fe3O4@VC对Cr(VI)的吸附量随温度的升高而增大。
为了进一步研究Fe3O4@VC对Cr(VI)的吸附动力学,分别采用准一级和准二级动力学模型对其进行模拟。准一级动力学模型[13]:
ln(qe-qt)=lnqe-K1t,
(5)
式中:
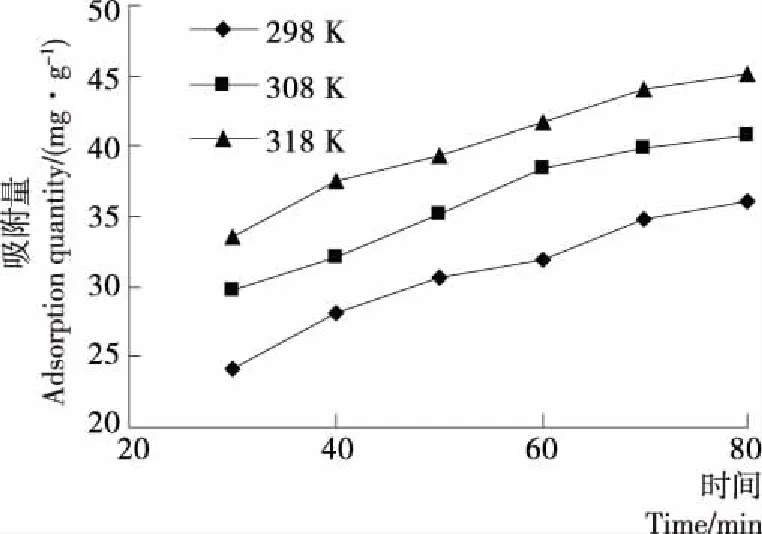
图12 Fe3O4@VC吸附Cr(VI)的动力学曲线Figure 12 Effect of contact time on the uptake of Cr(VI) by Fe3O4@VC
qe——磁性纳米粒子对Cr(VI)的平衡吸附量,mg/g;
qt——t时刻磁性纳米粒子对Cr(VI)的吸附量,mg/g;
K1——准一级动力学模型的一级速率常数。
准二级动力学方程[14]:
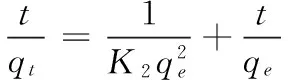
(6)
式中:
K2——准二级动力学模型的二级速率常数;
其它参数与准一级动力学模型相同。
两种模型所得的拟合曲线分别见图13、14。

图13 Fe3O4@VC吸附Cr(VI)的Lagergren 准一级动力学方程曲线Figure 13 Lagergren first-order kinetic plot for the sorption of Cr(VI) ions on Fe3O4@VC
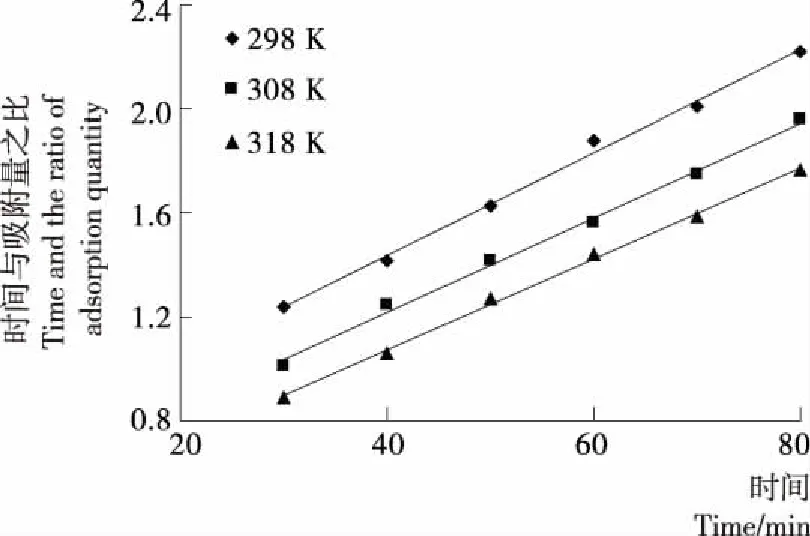
图14 Fe3O4@VC吸附Cr(VI)的HO准二级 动力学方程曲线Figure 14 Second-order kinetic plots for the sorption of Cr(VI) ions on Fe3O4@VC
由图13、14可得相应的拟合曲线方程,根据拟合曲线方程可以得到模型的相关参数,见表2。由表2可知,Fe3O4@VC对Cr(VI)吸附回归结果更符合HO准二级动力学模型(R2>0.99)。这表明Fe3O4@VC对Cr(VI)的吸附由化学吸附控制,而非扩散控制。
2.6 Fe3O4@VC吸附能力与其它吸附剂比较
由于试验条件不同,Fe3O4@VC直接与其他吸附剂相比比较困难。表3将Fe3O4@VC对Cr(VI)的吸附量与其他吸附剂进行了简单的比较。可以看出Fe3O4@VC对Cr (VI)具有较好的吸附能力。

表2 Fe3O4@VC吸附Cr(VI)的动力学参数Table 2 Kinetic parameters for the adsorption of Cr(VI) onto the Fe3O4@VC

表3 各种吸附剂对Cr(VI)吸附能力的比较Table 3 The adsorptive capacities of various adsorbents for Cr(VI)
3 结论
通过水热法合成了Fe3O4@VC磁性纳米粒子,用于探索其对水中Cr(VI)的吸附性能,结果表明:在pH为1.50,振荡时间为80 min,吸附剂质量为0.06 g,溶液初始浓度为150 mg/L的条件下,磁性纳米粒子对Cr(VI)的饱和吸附量可达39.12 mg/g,吸附率为85%以上。可循环次数为6,说明Fe3O4@VC磁性纳米粒子具有较强的循环使用能力。吸附性能试验表明,磁性纳米粒子对Cr(VI)的吸附符合Langmuir热力学模型和HO准二级动力学吸附模型。
[1] ZHANG Run-hu, WANG Bo, MA Hong-zhu. Studies on chromium (VI) adsorption on sulfonated lignite[J]. Desalination, 2010, 255(1): 61-66.
[2] SARIN V, PANT K K. Removal of chromium from industrial waste by using eucalyptus bark[J]. Bioresource Technology, 2006, 97(1): 15-20.
[3] 黄丹丹, 孟超, 单宏权, 等. 铬(VI)离子印迹聚合物的研究进展[J]. 天津化工, 2015, 29(5): 5-8.
[4] 张润虎. 磺化褐煤、硫酸掺杂聚苯胺纤维、紫茎泽兰活性炭对六价铬离子的吸附性能研究[D]. 西安: 陕西师范大学, 2012: 3-5.
[5] 单小璇. 磁性纳米材料的化学法制备及性能研究[D]. 广州: 华南理工大学, 2011: 1-4.
[6] 孙海平. 磁性纳米粒子的表面修饰及功能化[D]. 扬州: 扬州大学, 2008: 7-20.
[7] NIU Hong-yun, ZHANG Di, ZHANG Sheng-xiao, et al. Humic acid caoted Fe3O4magnetic nanoparticles as highly efficient Fenton-like catalyst for complete mineralization of sulfathiazole[J]. Journal of Hazardous Materials, 2011, 190(1/2/3): 559-565.
[8] SHEN Xing-can, FANG Xiu-zhong, ZHOU Ying-hua, et al. Synthesis and Characterization of 3-Aminopropyltriethoxysilane-Modified Superparmagnetic Magnetite Nanopariticles[J]. Chemistry Letters, 2004(11): 1 468-1 469.
[9] 薛君. 功能化磁性纳米材料的制备及其在废水污染物治理中的应用研究[D]. 沈阳: 沈阳理工大学, 2014: 57-58.
[10] MONTAGNE F, MONDAIN-MONVAL O, PICHOT C, et al. Preparation and characterization of narrow sized (o/w) magnetic emulsion[J]. Journal of Magnetism and Magnetic Materials, 2002, 250: 302-312.
[11] LANGMUIR I. The constitution and fundamental properties of solids and liquids. Part II.—Liquids[J]. Journal of the American Chemical Society, 1916, 38(5): 102-105.
[12] 保佳媛, 李俊峰, 张钱丽. 活性炭纤维对亚甲基蓝的吸附动力学和热力学研究[J]. 苏州科技学院学报, 2015, 32(3): 30-35.
[13] AZIZIAN S. Comment on “kinetics of solute adsorption at solid/solution interfaces: a theoretical development of the empirical pseudo-first and pseudo-second order kinetic rate equations, based on applying the statistical rate theory of interfacial transport”[J]. Journal of Physical Chemistry B, 2006, 110(33): 514-525.
[14] AZIZIAN S. Kinetic models of sorption: a theoretical analysis[J]. J Colloid Interface Sci, 2004, 276(1): 47-52.
[15] JOSHI M V. Removal of Cr(VI) and Hg(II) from Aqueous Solutions Using Fly Ash and Impregnated Fly Ash[J]. Separation Science and Technology, 2005, 39(7): 1 611-1 629.
[17] LIU S X, CHEN X, CHEN X Y, et al. Activated carbon with excellent chromium(VI) adsorption performance prepared by acid-base surface modification[J]. Journal of Hazardous Materials, 2007, 141(1): 315-319.
[18] YUAN Peng, FAN Ming-de, YANG Dan, et al. Montmorillonite-supported magnetite nanoparticles for the removal of hexavalent chromium [Cr(VI)] from aqueous solutions[J]. J. Hazard. Mater., 2009, 166(2/3): 821-829.
[19] HU Jing, CHEN Guohua, LO IMC. Removal and recovery of Cr(VI) from wastewater by maghemite nanoparticles[J]. Water Research, 2005, 39(18): 4 528-4 536.
[20] 赵永纲, 沈昊宇, 李勍, 等. 氨基功能化纳米Fe3O4磁性高分子吸附剂对废水中Cr(VI)的吸附研究[J]. 化学学报, 2009, 67(13): 1 509-1 514.
The Study of Adsorption of Cr(Ⅵ) Ions Using Magnetic Ascorbic Acid-coated Fe3O4Nanoparticles
(CollegeofFoodScienceandEngineering,CentralSouthUniversityofForestryandTechnology,Changsha,Hunan410001,China)
Magnetic Ascorbic Acid-coated Fe3O4Nanoparticles were successfully synthesized via a hydrothermal route. The resulting products were characterized by Transmission electron microscope, Fourier transform infrared spectra and X-ray diffraction. Various factors affecting the uptake behavior were discussed, including the pH, adsorption time, adsorbent dosage and initial concentration on the absorption of Cr (VI). Moreover, the thermodynamics and dynamics of the hexavalent chromium ion adsorption were also studied. The results showed that a maximum adsorption capacity was 39.12 mg/g for Cr (VI) at pH 1.50 and the absorption can be up to 85%. The adsorption performance of magnetic nanoparticles in line with both the Langmuir adsorption of Cr (VI) thermodynamic model and HO secondary dynamic adsorption one.
Magnetic Ascorbic Acid-coated Fe3O4Nanoparticles; adsorption; Cr (VI)
10.13652/j.issn.1003-5788.2017.04.015
云南省科技计划面上项目(编号:2014FB141)
钟汝能,男,云南师范大学副教授,在读博士。
郑勤红(1962—),男,云南师范大学教授,博士生导师。 E-mail:zheng_qh62@aliyun.com
2017—01—02

