赤霉素处理对马铃薯块茎低温糖化的效果
巩慧玲,徐 进,孙梦遥,冯再平,袁惠君
(兰州理工大学生命科学与工程学院,甘肃 兰州 730050)
栽培生理
赤霉素处理对马铃薯块茎低温糖化的效果
巩慧玲*,徐 进,孙梦遥,冯再平,袁惠君
(兰州理工大学生命科学与工程学院,甘肃 兰州 730050)
马铃薯块茎低温糖化现象除了直接受到淀粉和糖代谢相关酶如淀粉酶、酸性转化酶的活性影响外,也可能间接受到赤霉素和脱落酸等植物激素的调控。以马铃薯品种‘大西洋’块茎为试验材料,采用50 mmoL GA3处理12 h后置于低温((4±0.5)℃)和室温((22±1)℃)条件下贮藏10 d,测定薯块的炸片色泽、还原糖含量、淀粉酶和酸性转化酶活性,研究赤霉素对马铃薯块茎低温糖化的影响。结果表明,GA3处理使马铃薯块茎的炸片色泽加深,还原糖含量增加121.1%;同时,GA3处理提高了淀粉酶的活性,而对酸性转化酶的活性没有影响。由此表明,GA3可能通过提高马铃薯块茎淀粉酶的活性而使还原糖积累,从而导致炸片色泽加深即增强了低温糖化现象。
马铃薯;赤霉素;低温糖化;淀粉酶;酸性转化酶
马铃薯(Solanum tuberosum L.)块茎在低温贮藏(10℃以下)时淀粉降解,导致还原糖(葡萄糖和果糖)含量急剧升高,这种现象被称为低温糖化[1,2]。马铃薯在油炸加工过程中,还原糖与α-氨基酸发生美拉德反应,生成“类黑蛋白素”,使薯片颜色加深,口感苦涩,严重影响加工品质[3]。目前,对马铃薯低温糖化机制的研究已有较多报道[4-6],普遍认为,马铃薯低温糖化是由淀粉降解与随之的蔗糖代谢速率不平衡引起的[7,8],其中淀粉和糖代谢途径中的淀粉酶和酸性转化酶被认为与低温糖化紧密相关[9-11]。
赤霉素(Gibberellin,GA)参与调控植物发育和各种生理过程,包括茎的伸长、根的生长、叶片伸展、种子萌发、花和果实的发育以及表皮毛发育等。在马铃薯中,GA常用来打破块茎的休眠,促进芽的生成。在谷物种子中,GA作为信号分子可诱导α-淀粉酶基因的表达,引起α-淀粉酶生物合成而催化淀粉水解为糖[12];同时也发现,低温也可诱导GA的合成[13]。由此推测,GA也可能调节马铃薯块茎淀粉的代谢而影响还原糖的含量,从而对马铃薯低温糖化现象具有一定的调节作用。本研究通过用外源赤霉素处理马铃薯块茎,探讨赤霉素是否对马铃薯低温糖化有一定的调节作用及其调节机制。该研究有助于马铃薯低温糖化分子调控机理的阐明,将为耐(抗)低温糖化马铃薯品种的选育和马铃薯低温贮藏方法的改进提供新途径。
1 材料与方法
1.1试验材料与方法
试验材料:马铃薯品种‘大西洋’块茎。种薯种植于甘肃省渭源县会川镇,2015年4月28日种植,9月16日收获,收获后于实验室常温黑暗贮藏3周后,进行赤霉素处理试验。利用50 mmoL GA3浸泡处理马铃薯块茎12 h,对照用蒸馏水处理,每个处理10个薯块,分成2组,分别置于低温((4±0.5)℃)和室温((22±1)℃)条件下贮藏10 d,然后将薯块清洗去皮后沿纵轴切成两半,一半用来直接炸片,一半立即切成小块,取样、称量后用液氮速冻,贮藏于-80℃以备测定可溶性糖、葡萄糖和蔗糖含量、淀粉酶活性和酸性转化酶活性。
1.2马铃薯炸片加工和色泽的测定
将去皮后的马铃薯块茎切成厚1.5 mm的薄片,在((145±2)℃)食用植物油(菜籽油)中炸至炸片表面无气泡冒出为止(约5 min),沥干表面油,冷却后,用X-rite sp60型色差计测定炸片色泽L值。炸片色泽L值越小,表示炸片色泽越深,加工品质越差;L值越大,表示色泽越浅,加工品质越好。
1.3还原糖、可溶性总糖和蔗糖含量的测定
还原糖、可溶性总糖和蔗糖含量的测定参考韩雅珊[14]的方法。
1.4淀粉酶和酸性转化酶活性的测定
淀粉酶活性的测定参考李雯等[15]的方法,酸性转化酶活性的测定参考Wu等[10]的方法。
1.5数据处理与分析
所有数据都是3次重复的平均值,数据用平均值±标准误表示,采用Microsoft Office Excel 2007软件对试验数据进行处理,用SPSS 20.0统计软件进行方差分析,采用新复极差法(Duncan)进行差异性检验。
2 结果与分析
2.1GA3对马铃薯块茎炸片色泽的影响
马铃薯炸片色泽的深浅是其低温糖化结果的直观现象。由图1A、1B比较可知,马铃薯品种‘大西洋’块茎经低温贮藏后,炸片色泽较未经低温处理的炸片明显加深,即发生了低温糖化现象。马铃薯块茎经50 mmoL GA3处理后,无论置于低温还是室温条件下贮藏,其炸片色泽均较未经GA3处理的炸片加深。
用色差仪测定马铃薯炸片的L值可知(图2),马铃薯品种‘大西洋’经GA3处理后,无论是低温(4℃)贮藏还是室温(22℃)贮藏,炸片的L值均降低,即色泽加深。
综上,用色差计测得的结果与用肉眼观察到的薯片色泽变化结论一致,即GA3处理引起马铃薯炸片色泽加深。
2.2GA3对马铃薯还原糖、蔗糖和可溶性总糖含量的影响
由图3可知,马铃薯品种‘大西洋’块茎经低温处理后,还原糖、可溶性总糖和蔗糖含量均显著增加,分别增加了384.4%、35.3%和20.8%,其中还原糖含量增加的幅度最大,这也是导致发生马铃薯低温糖化的原因。与未经GA3处理相比,GA3处理后马铃薯块茎无论在低温条件还是在室温条件下贮藏,还原糖含量均显著增加,分别增加了121.1%(低温)和94.9%(室温);与未经GA3处理相比,GA3处理后可溶性总糖含量在低温贮藏下显著增加,增加了37.1%,而在室温贮藏条件下,可溶性总糖含量并未发生显著变化;经GA3处理后,蔗糖含量无论在低温还是室温贮藏条件下差异均不显著。

图1 GA3处理对马铃薯炸片色泽的影响Figure 1 Effect of GA3treatment on color of potato chips

图2 GA3处理对马铃薯炸片色泽L值的影响Figure 2 Effect of GA3treatment on L value of potato chips
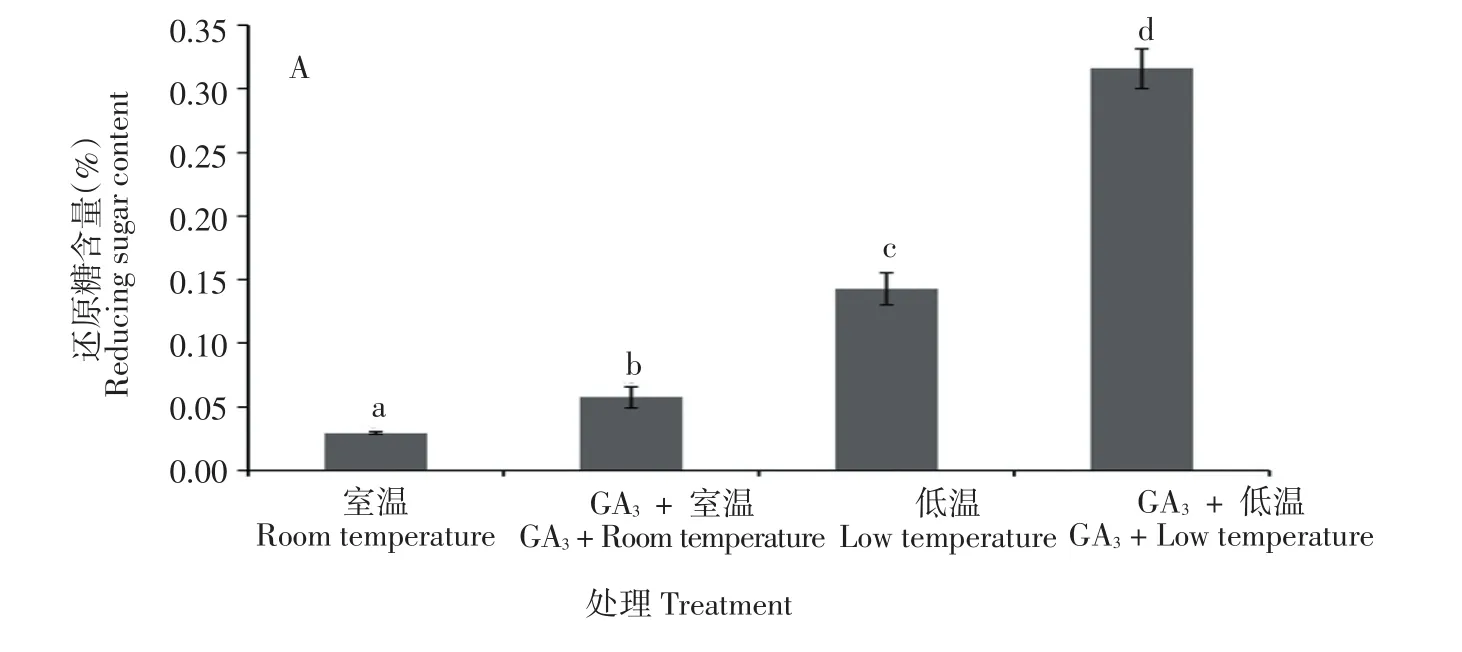
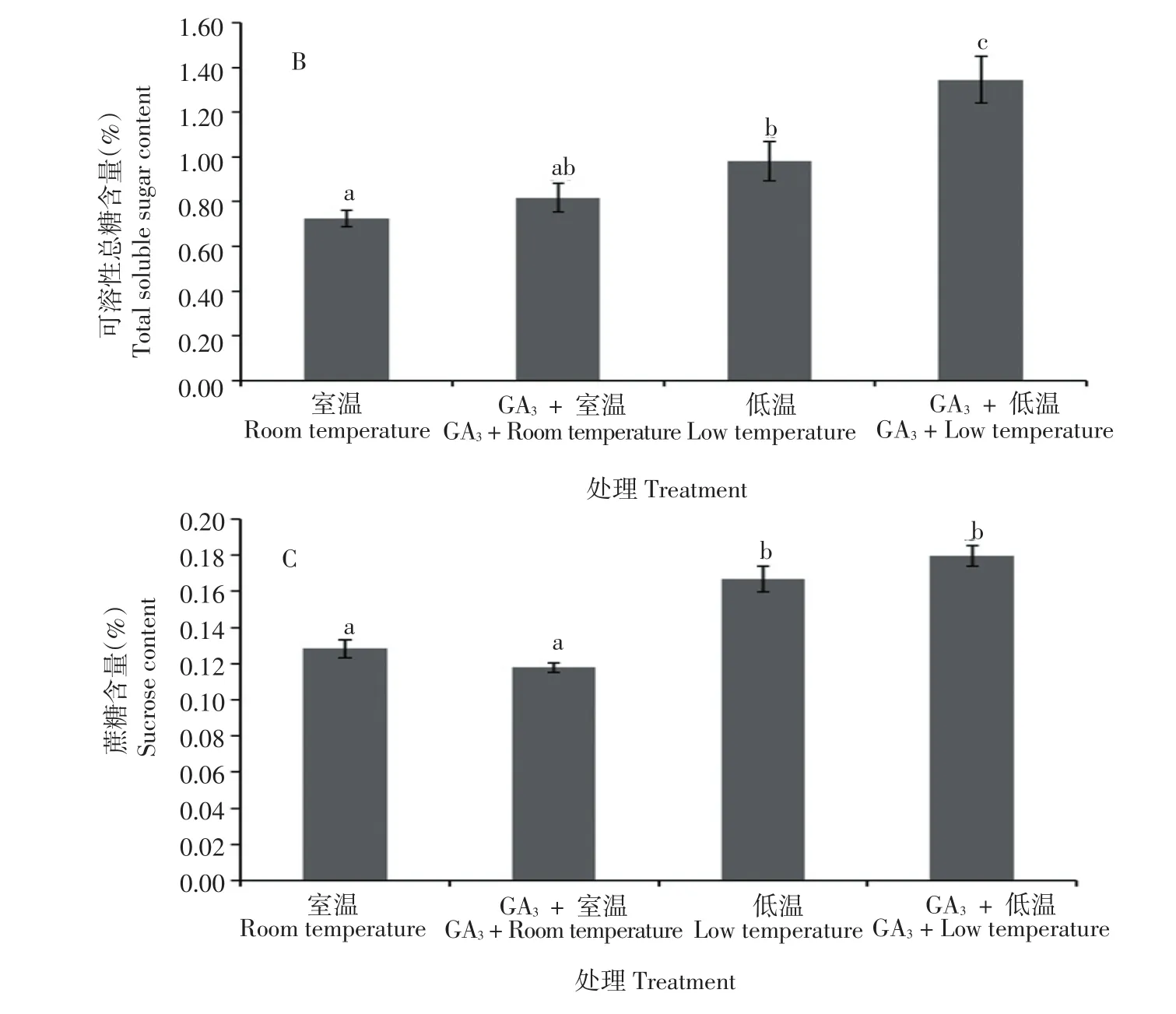
图3 GA3处理对马铃薯还原糖(A)、可溶性总糖(B)和蔗糖(C)含量的影响Figure 3 Effects of GA3treatment on content of reducing sugar(A),totalsoluble sugar(B)and sucrose(C)of potato tuber
2.3GA3对马铃薯淀粉酶活性的影响
如图4所示,与室温处理相比,低温处理后马铃薯品种‘大西洋’块茎的淀粉酶活性显著提高,升高了159%,表明淀粉酶参与了马铃薯低温糖化现象。经GA3处理后,无论贮于室温还是低温条件下,淀粉酶活性均显著上升,在低温和室温贮藏条件下淀粉酶活性分别增加了57.0%和46.7%。由此表明,GA3可能通过诱导马铃薯淀粉酶的活性而增加还原糖的含量及其炸片色泽的加深,从而调控低温糖化现象。

图4 GA3处理对马铃薯淀粉酶活性的影响Figure 4 Effect of GA3treatment on amylase activity of potato tuber
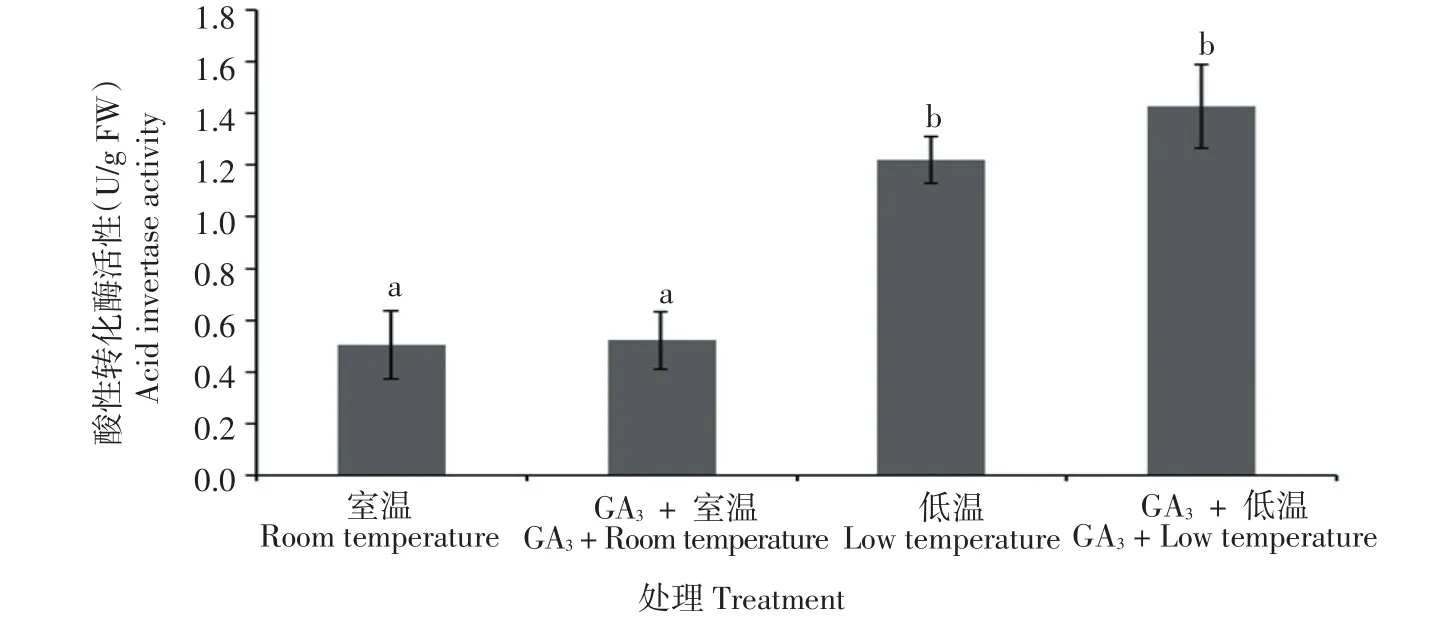
图5 GA3处理对马铃薯酸性转化酶活性的影响Figure 5 Effect of GA3treatment on acid invertase activity of potato tuber
2.4GA3对马铃薯酸性转化酶活性的影响
如图5所示,与室温处理相比,低温处理后马铃薯品种‘大西洋’块茎的酸性转化酶活性提高了141.6%,表明酸性转化酶参与了马铃薯低温糖化现象。经GA3处理后,‘大西洋’品种无论贮于室温还是低温条件下,酸性转化酶活性均未发生显著变化,即GA3并未影响酸性转化酶的活性。由此表明,酸性转化酶可能并不参与GA3对马铃薯低温糖化的调控。
3 讨论
马铃薯块茎在低温贮藏条件下会发生低温糖化现象,由此导致炸片色泽加深,而较多研究表明,影响低温糖化现象的酶主要为酸性转化酶和淀粉酶等[11,16]。本研究中,马铃薯品种‘大西洋’块茎经4℃低温贮藏10 d,与室温贮藏条件下相比,还原糖含量明显增加,并由此导致炸片色泽加深,此外,酸性转化酶和淀粉酶活性也显著增加。由此表明,马铃薯品种‘大西洋’块茎在4℃低温贮藏10 d后发生了低温糖化现象,酸性转化酶和淀粉酶参与了还原糖的积累。
马铃薯低温糖化现象除了受糖代谢的直接调控外,可能也会受植物激素的间接调控[17]。本研究中,马铃薯品种‘大西洋’块茎经GA3处理后,贮于低温条件下,还原糖的含量均高于未经GA3处理的对照,炸片色泽也较对照深,而GA3处理对可溶性糖和蔗糖含量的影响较小。结果表明,GA3处理通过诱导马铃薯块茎还原糖的积累而加深了炸片色泽,即促进了马铃薯低温糖化现象,但这种现象并不依赖于贮藏条件,GA3处理后在室温条件下贮藏,同样使还原糖含量升高和炸片色泽加深。Skriver等[18]研究表明,谷物种子中α-淀粉酶基因启动子序列中存在赤霉素应答元件即GARE元件,Gubler等[12]研究表明,GA作为信号分子可诱导大麦糊粉层细胞α-淀粉酶基因的表达,引起α-淀粉酶生物合成而催化淀粉水解为糖。本研究中,马铃薯块茎经GA3处理后,无论经低温还是室温贮藏,淀粉酶的活性均显著升高,由此推测,GA3处理可能通过诱导马铃薯块茎α-淀粉酶基因表达而增加了淀粉酶的活性,从而导致还原糖的积累。
赖广洵[19]研究表明,GA3处理显著增加了马铃薯芽眼部位酸性转化酶的活性,而对薯心部位的酶活性影响不大。本研究中GA3处理并未影响酸性转化酶活性,可能因为试验中的测定样品均是去掉马铃薯薯皮的,芽眼部位已被去除,但本研究发现GA3处理导致整个炸片色泽加深,并不局限于芽眼部位(图1)。由此表明,酸性转化酶可能并不参与GA3对还原糖积累的影响和低温糖化现象。Ou等[20]研究表明,GA3可以诱导马铃薯液泡酸性转化酶基因(stvacINV1)启动子的表达,且在该启动子序列中发现了8个赤霉素应答元件(GARE)。但同时发现,虽然stvacINV1的活性在低温下显著提高,但是该基因启动子的活性在低温下反而降低,从而推测该基因可能存在转录后水平的调控。因此,GA3处理虽然可以诱导stvacINV1基因的表达,但该基因的酶活性却不一定会随之增加。综上,本研究表明,GA3导致马铃薯块茎还原糖含量升高和炸片色泽加深的主要原因可能是GA3诱导了淀粉酶基因的表达和随之的活性升高,而酸性转化酶可能并不参与这一过程。
外源赤霉素处理马铃薯块茎研究其对低温糖化的影响,结果表明,GA3处理使还原糖含量升高,加深了马铃薯炸片色泽即导致低温糖化现象增强,通过测定相关酶的活性发现这种影响可能是GA3处理增强了淀粉酶的活性而引发的。这一研究结果可为运用植物激素或其合成抑制剂调控马铃薯低温糖化现象提供理论依据。
[1] van Vliet W F,Schriemer W H,Buitenweg H.Sugar accumulation in potatoes at low temperature,studied in crosses between Western European (Dutch)varieties and South American varieties of Solanum tuberosum[J].European Potato Journal,1961,4(1): 87-92.
[2] Burton W G.The sugar balance in some British potato varieties during storage.II.The effects of tuber age,previous storage temperature,and intermittent refrigeration upon low-temperature sweetening[J].Potato Research,1969,12(2):81-95.
[3] Blenkinsop R W,Copp L J,Yada R Y,et al.Changes in compositional parameters of tubers of potato(Solanum tuberosum) during low-temperature storage and their relationship to chip processing quality[J].Journalof Agriculturaland Food Chemistry, 2002,50(16):4545-4553.
[4] Duplessis P M,Marangoni A G,Yada R Y.A mechanism for low temperature induced sugar accumulation in stored potato tubers[J].American Potato Journal,1996,73(10):483-494.
[5]陈芳,胡小松.马铃薯块茎“低温糖化”机理的研究及进展[J].马铃薯杂志,1998,12(1):52-55.
[6] 成善汉,谢从华,吴艳阁.马铃薯贮藏块茎低温糖化研究进展[J].中国马铃薯,2006,20(6):352-355.
[7] Isherwood F A.Starch-sugar interconversion in Solanum tuberosum[J]. Phytochemistry,1973,12(11):2579-2591.
[8] Sowokinos J R.Biochemicaland molecularcontrolofcold-induced sweetening in potatoes[J].American Journal of Potato Research, 2011,78(3):221-236.
[9] Gupta S K,Sowokinos J R,Hahn I S.Regulation of UDP-glucose pyrophosphorylase isozyme UGP5 associated with cold-sweetening resistance in potatoes[J].Journal of Plant Physiology,2008,165 (7):679-690.
[10] Wu L,Bhaskar P B,Busse,J S,et al.Developing cold-chipping potato varieties by silencing the vacuolar invertase gene[J].Crop Science,2011,51(3):981-990.
[11] Zhang H,Liu X,Liu J,et al.A novel RING finger gene,SbRFP1, increases resistance to cold-induced sweetening of potato tubers[J].Febs Letters,2013,587(6):749-755.
[12] Gubler F,Kalla R,Roberts J K,etal.Gibberellin-regulated barley aleurone cells:evidence for Myb transactivation of a high-pIalphaamylase gene promoter[J].Plant Cell,1995,7(11):1879-1891.
[13]YamauchiY,Ogawa M,Kuwahara A,etal.Activation ofgibberellin biosynthesis and response pathways by low temperature during imbibition of Arabidopsisthaliana seeds[J].PlantCell,2004,16(2): 367-378.
[14] 韩雅珊.食品化学实验指导[M].北京:中国农业大学出版社, 1992.
[15] 李雯,邵志远,陈维信.淀粉酶测定方法的改进[J].植物生理学通讯,2005,41(5):655-656.
[16] Zrenner R,Schüler K,Sonnewald U.Soluble acid invertase determines the hexose-to-sucrose ratio in cold-stored potato tubers[J].Planta,1996,198(2):246-252.
[17]Doucette M S,Pritchard M K.ABA involvement in low temperature sweetening ofpotatoes[J].Acta Hort(ISHS),1993,343:293-294.
[18] Skriver K,Olsen F L,Rogers J C,etal.Cis-acting DNA elements responsive to gibberellin and its antogonist abscisic acid[J]. Proceedings of the National Academy of the United States of America,1991,88(16):7266-7270.
[19] 赖广洵.赤霉素对马铃薯等地下繁殖器官萌发过程中转化酶活性及糖类含量变化的影响[J].植物生理学通讯,1982(2): 26-29.
[20] Ou Y,Song B,Liu X,et al.Promoter regions of potato vacuolar invertase gene in response to sugars and hormones[J].Plant Physiology and Biochemistry,2013,69(8):9-16.
Effectof Gibberellin on Cold-induced Sweetening of Potato Tuber
GONG Huiling*,XU Jin,SUN Mengyao,FENG Zaiping,YUAN Huijun
(College of Life Science and Engineering,Lanzhou University of Technology,Lanzhou,Gansu 730050,China)
ract:Cold-induced sweetening in potato tuber is directly controlled by amylase and acid invertase which are starch-sugar metabolism-related enzymes,but it might be indirectly regulated by plant hormone,such as gibberellins and abscisic acid.Tubers of potato cultivar'Atlantic'were treated with 50 mmoL GA3for 12 h,stored at low temperature ((4±0.5)℃)and room temperature((22±1)℃)for 10 d,and then the chip color ofpotato tuber,the contentofreducing sugar,and the activity of amylase and acid invertase were analyzed,in order to study the effect of gibberellin on cold-induced sweetening ofpotato tuber.The results showed that GA3treatmentmade the chip color browner,increased the content of reducing content and the activity of amylase in potato tuber,while the activity of acid invertase was not affected.The results demonstrated that GA3treatment enhanced the cold-induced sweetening and the color of chip in potato tuber by increasing the activity ofamylase and the contentofreducing sugar.
ords:potato;gibberellin;cold-induced sweetening;amylase;acid invertase
S532
A
1672-3635(2017)03-0138-06
2016-06-01
甘肃省自然科学基金(1308RJZA209);国家自然科学基金(31360296)。
巩慧玲(1973-),女,博士,副教授,主要从事马铃薯、百合采后生理学研究。
巩慧玲,E-mail:gonghl@lut.cn。

