锦鲤疱疹病毒潜伏感染实时荧光定量 PCR检测方法的建立
陈俊杰,李媛媛,阳瑞雪,古晶晶,汪开毓,耿毅,欧阳萍
锦鲤疱疹病毒潜伏感染实时荧光定量 PCR检测方法的建立
陈俊杰,李媛媛,阳瑞雪,古晶晶,汪开毓,耿毅,欧阳萍*
(四川农业大学动物医学院,四川成都611130)
为建立一种特异和敏感的检测锦鲤疱疹病毒(koi herpesvirus,KHV)潜伏感染的方法,以KHV基因为靶序列设计特异性引物,通过条件优化建立Real–Time PCR检测方法,并且对该方法进行特异性和敏感性评估及临床样品应用研究。结果显示:建立的方法与鲤痘疱疹病毒、金鱼造血器官坏死病病毒和鳗鲡疱疹病毒均无交叉反应,特异性强;最低检出率为42拷贝/μL,灵敏度高。用本方法对63份临床样品进行检测,有锦鲤疱疹病毒病(KHVD)病史的18份样品的检测结果全为阳性,阳性率为100%;从有临床症状的鱼中得到的15份样品的检测结果全为阳性,阳性率为100%;30份无任何临床症状鱼中的6份被检测为阳性,阳性率为20%。本试验中建立的水生动物疱疹病毒潜伏感染快速检测方法,可为潜伏感染KHV的临床检测提供一种快速、敏感和特异的检测手段,可为KHVD的分子流行病学调查和预防提供参考。
锦鲤疱疹病毒(KHV);潜伏感染;实时荧光定量PCR (Real–Time PCR)
锦鲤疱疹病毒病(koi herpesvirus disease,KHVD)是由锦鲤疱疹病毒(koi herpesvirus,KHV)感染引起的一种高致病性、高传染性和高死亡率的疾病。该病特异性高,主要感染鲤鱼和锦鲤,引起的主要病理变化为鳃坏死和间质性肾炎。该病发病率高,流行范围广,致死率高达80%~100%[1–4]。世界动物卫生组织(OIE)和中国都将KHVD列为必须申报的疾病,中国农业部将其列为Ⅱ类动物疫病[5]。KHVD已经在世界多个国家和地区流行,给鲤鱼养殖业造成了重大的经济损失。
目前已经建立的锦鲤疱疹病毒病的检测方法已达10多种,如细胞培养分离技术、分子生物学检测技术、环介导等温扩增技术、免疫学检测技术、电镜观察和原位杂交技术[6]等。临床检测试验已证明这些检测技术适用于处于急性感染状态的鱼,对于临床症状不明显的处于KHV潜伏感染状态下的鱼,相关的检测方法还有待完善。
疱疹病毒有100多种,能够感染多种动物和人类。疱疹病毒感染的表现形式可以分为急性感染和潜伏感染。目前感染哺乳动物的所有疱疹病毒都已被证实存在潜伏感染。潜伏感染时,病毒以非整合状态的基因组形态游离在宿主细胞核内,一定条件下病毒可被重新激活,引起宿主临床症状并导致死亡。潜伏感染的机制目前尚不清楚[7]。2011年,Kathleen等[8]发现KHV存在潜伏感染,病毒主要潜伏于外周血白细胞中。2013年,Reed等[9]发现KHV主要潜伏于B淋巴细胞中。
在潜伏感染时,只有部分基因发生表达,并且表达量会出现下调,因此,常规的检查方法很难检测到病毒存在。目前,用于锦鲤疱疹病毒潜伏感染检测的方法只有重组酶聚合酶扩增(recombinase polymerase amplification,RPA)检测方法[10]。当前用于KHVD急性感染期的检测方法还不能确切检出处于潜伏感染状态的宿主,容易出现假阴性。在一定条件下,潜伏感染可以转变为急性感染,造成宿主死亡和疾病暴发[11–14]。为了实现对KHV潜伏感染的检测,笔者以KHV基因为靶序列设计特异性引物建立了Real–Time PCR检测方法。现将结果报道如下。
1 材料与方法
1.1材料
1.1.1样品和菌株及质粒载体
锦鲤疱疹病毒(KHV)、鳗鲡疱疹病毒(AngHV)、鲤疱疹Ⅰ型病毒(CyHV–1)和鲤疱疹Ⅱ型病毒(CyHV–2)的DNA样品、大肠杆菌DH5α感受态细胞均由四川农业大学动物医学院鱼病研究中心实验室提供。pMD19-T克隆载体购自Invitrogen公司。锦鲤和鲤鱼共63条,10条体质量(55±3) g的存在潜伏感染的鲤鱼(A组)来自于暴发KHVD 4个月后的池塘。8条体质量(40±3) g存在潜伏感染的锦鲤(B组)为KHV感染试验后存活下来的锦鲤。15条体质量(100±20)g的鲤鱼(C组)来自于带有KHVD临床症状的经PCR检测为正暴发KHVD的池塘。30条体质量(100±20)g的鲤鱼(D组)为四川地区3个鲤鱼养殖场随机采集的样品。
1.1.2主要试剂
组织DNA提取试剂盒、小剂量质粒抽提试剂盒、T4DNA连接酶、胶回收试剂盒和SYBR® Premix EX荧光定量PCR试剂盒均购自TaKaRa公司。
1.1.3引物设计与合成
根据GenBank公布的KHV美国株(KHV–U,ID为DQ657948.1)、以色列株(KHV–I,ID为DQ177346.1)和欧洲株(KHV–GZ11,ID为KJ627438.1)基因编码区(ORF54)的共有序列,采用Primer 5.0和Oligo 6.0设计特异性引物,上游引物编号为F1,下游引物编号为R1,预期片段大小为235 bp。临床样品检测中以普通PCR(OIE推荐TK引物)[6]为对照,上游引物编号为F2,下游引物编号为R2,预期片段大小为409 bp。引物序列见表1。所有引物均由擎科生物(成都)有限公司合成。
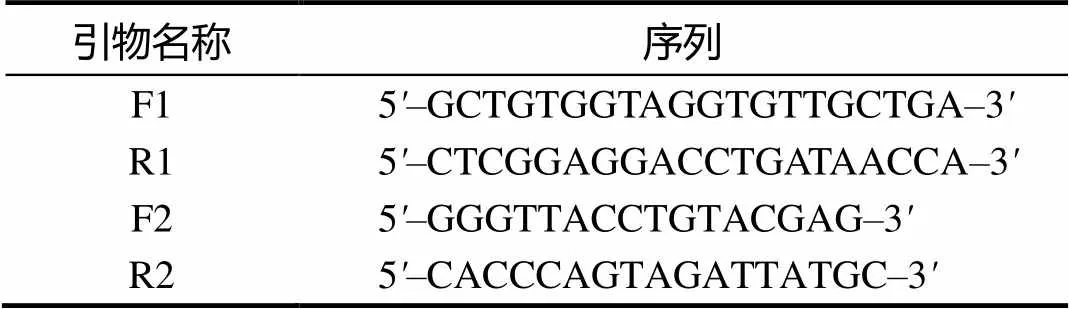
表1 引物序列
1.2外周淋巴细胞的分离和标准阳性模板的制备
1.2.1外周淋巴细胞的分离与总DNA提取
将鱼浸入含有MS222麻醉剂(100 mg/L)的水中,约5 min后完成麻醉。用含有肝素的1 mL注射器以尾静脉穿刺法抽血:将已经麻醉处理的鱼置于解剖盘上,在臀鳍后缘与鱼体脊柱垂直的部位进针,直接刺到2个椎体之间凹处的静脉,采取0.3~0.5 mL鱼全血,轻轻倒置摇匀3~5 次,置于4 ℃冰箱保存,备用。
采用红细胞裂解法分离外周全血淋巴细胞。将抗凝的鱼血和红细胞裂解液按体积比1∶4(0.3 mL新鲜抗凝血与1.2 mL红细胞裂解液混合)加入到1.5 mL EP管中,轻轻倒置摇匀3~5次。室温静置2 min,1 000 r/min离心3~5 min,弃掉上层红色液体,收集沉淀部分。使用红细胞裂解液重复裂解3次,然后用生理盐水洗涤2~3次。将得到的细胞沉淀用200 μL生理盐水重悬,置于4 ℃冰箱保存,备用。取适量的外周淋巴细胞悬液,用DNA提取试剂盒提取总DNA(具体操作按说明书进行),将提取的总DNA于-20 ℃保存,备用。
1.2.2标准品的制备
将KHV接种到KF细胞(koi fin ,KF)中培养,收集病变超过75%的KF细胞反复冻融3次,离心后吸取上清液,用DNA试剂盒提取KHV基因组作为PCR扩增模板。PCR扩增体系:2×PCR Master Mix 12.5 μL,10 μmol/L的上下游引物(F1、R1)各1 μL,模板DNA 1 μL,用ddH2O补充到25 μL。反应程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸45 s,共35个循环;72 ℃延伸5 min。用1%琼脂糖凝胶电泳检测扩增结果。将凝胶回收试剂盒回收目的基因片段克隆到pMD19–T载体上,转化到DH5α感受态细胞中,并将PCR和序列测序鉴定为含有目的基因的重组质粒按文献[11]的方法命名(pMD19–T–Sph)。
1.3条件的优化与标准曲线的绘制
1.3.1实时荧光定量PCR反应条件的优化
实时荧光定量PCR扩增体系20 μL:2×Real Master Mix/20×SYBR Solution 10 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 1 μL,用ddH2O补至20 μL。在ABI7500型荧光PCR仪上进行扩增,反应条件:95 ℃预变性10 min;94 ℃变性3 s,57 ℃退火30 s,68 ℃延伸60 s,40个循环。对系统自动生成的数据进行统计学分析。在其他变量相同的条件下,于56~61 ℃对退火温度进行优化,以确定最适反应条件。
1.3.2标准曲线的绘制
将pMD19–T–Sph标准质粒稀释到1×109拷贝/μL后再进行10倍系列稀释,获得1×102,1×103,1×104,…,1×106拷贝/μL共 5个浓度,制作标准曲线。每个浓度3个重复。以ddH2O为空白对照进行SYBR实时荧光定量扩增。用StepOne Plus荧光定量PCR仪(ABI)自带的Step One Software v2.1软件进行分析,用Excel 2013绘出标准曲线(横坐标为模板质粒DNA起始浓度的对数值,纵坐标为相应的值)。
1.4敏感性和特异性试验
1.4.1敏感性试验
将pMD19–T–Sph标准质粒进行10倍系列稀释(4.2×100,4.2×101,4.2×102,…,4.2×109拷贝/μL)。每个浓度取1 μL作为模板。以ddH2O为阴性对照。以优化的最佳反应条件进行荧光定量PCR试验,分别确定所建立方法能检测出的pMD19–T–Sph标准质粒最低拷贝数。
1.4.2特异性试验
用建立的SYBR GreenⅠ实时荧光定量PCR对CyHV–3以及与该病毒基因组亲缘关系相近的AngHV、CyHV–2和CyHV–1进行扩增,以ddH2O和正常锦鲤基因组DNA为阴性对照,检测建立方法的特异性。
1.5临床样品的检测
对所采集的临床样品进行抽血、外周淋巴细胞分离与总DNA提取,用建立的实时荧光定量PCR方法以及普通PCR方法进行检测。
2 结果与分析
2.1实时荧光定量PCR反应条件的优化结果
通过退火温度为56~61 ℃的筛选试验,最终确定出实时荧光定量PCR的扩增条件:在20 μL反应体系中,SYBR Green Premix ExⅡ10 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 1 μL,用ddH2O补至20 μL。反应参数:95 ℃预变性10 min;94 ℃变性3 s,57 ℃退火30 s,68 ℃延伸60 s,40个循环。对系统自动生成的数据进行处理。
2.2标准曲线
以10倍稀释的pMD19–T–Sph为模板,以2.1项中的优化条件进行RT–PCR扩增。以模板质粒DNA起始浓度的对数值()为横坐标,以值()为纵坐标得到标准曲线=–3.33+35.83,相关系数(2)为0.998,标准曲线的线性关系良好。
2.3敏感性和特异性试验结果
2.3.1敏感性试验结果
将构建好的重组质粒通过ddH2O进行10倍系列稀释,使用优化好的实时荧光定量PCR进行灵敏度检测。检测结果显示:实时荧光定量PCR的灵敏度为42 拷贝/μL(图1)。阳性以35个循环出现条带为准,后面出现的条带可能与形成的引物二聚体有关。
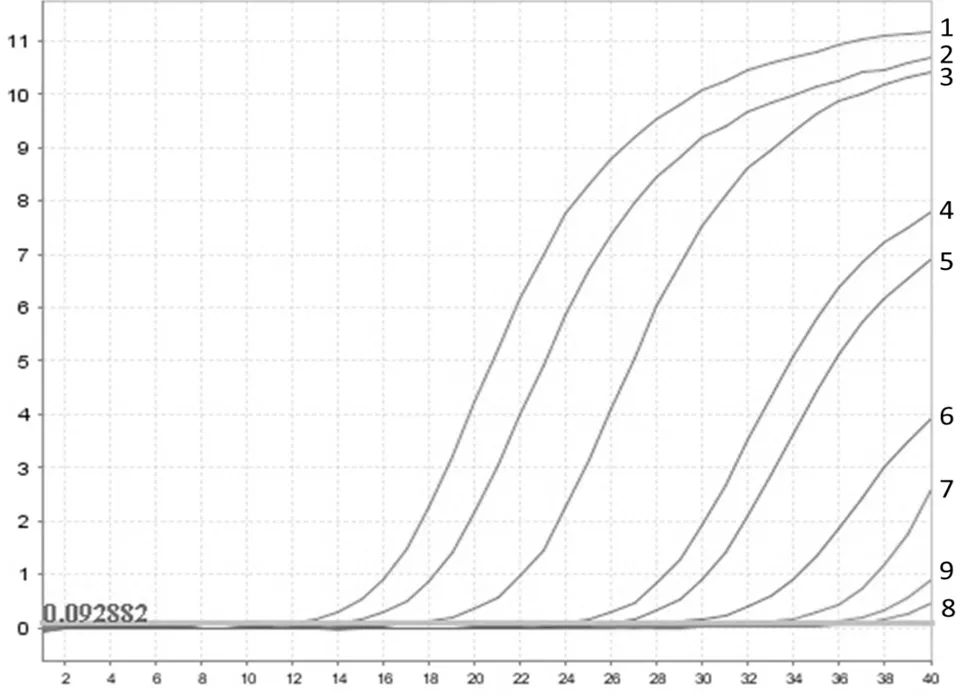
曲线1,曲线2,曲线3,…,曲线7,曲线8分别为标准质粒拷贝数4.2×107,4.2×106,4.2×105,…,4.2×101,4.2×100拷贝/μL;曲线9 阴性对照(ddH2O)。
2.3.2特异性试验结果
应用建立的实时荧光定量PCR方法对CyHV–3以及与该病毒亲缘关系相近的AngHV、CyHV–2、CyHV–1进行扩增,并以ddH2O和健康锦鲤基因组DNA为阴性对照,结果显示只有CyHV–3有目的条带(图2),说明本研究中建立的方法与KHV亲缘关系较近的病毒无交叉反应,具有良好的特异性。
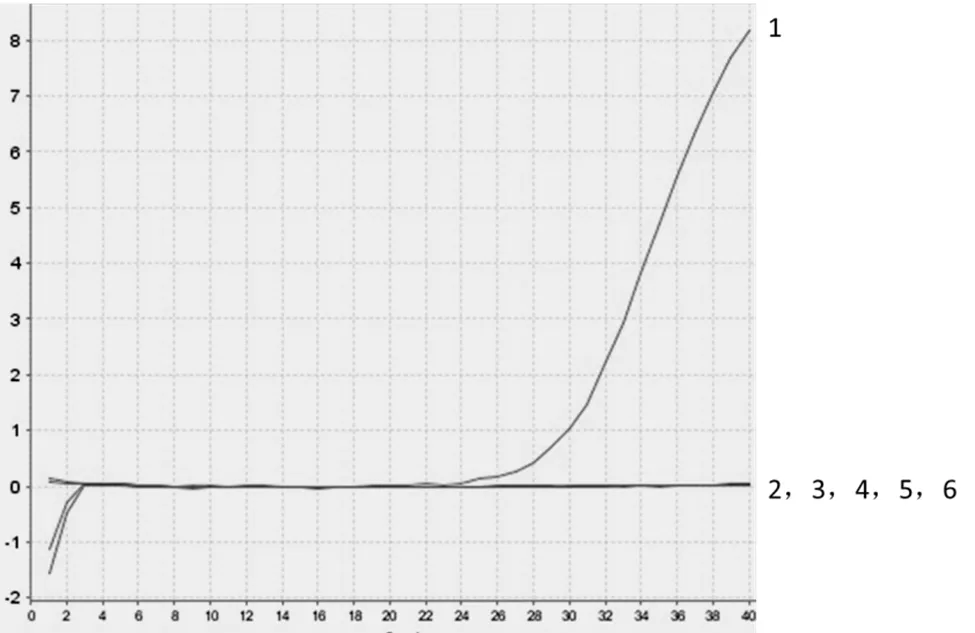
曲线1 CyHV–3;曲线2 CyHV–1;曲线3 CyHV–2;曲线4 AngHV;曲线5 阴性对照;曲线6 阴性对照。
2.4Real–Time PCR重复性试验结果
对同一样品的3个不同浓度4.2×107、4.2×106和4.2×105拷贝/μL分别进行3个重复试验。4.2×107、4.2×106、4.2×105拷贝/μL试验组的组内变异系数分别为1.06%、1.79%和1.36%,组间变异系数分别为1.3%、1.55%和1.5%。组内和组间重复性试验的变异系数都小于2%,表明所建立的方法具有较好的重复性。
2.5临床样品的检测结果
采用1.2.1中的方法分离外周血淋巴细胞并提取总DNA,使用实时荧光定量PCR和普通PCR检测方法对63份样品的检测结果显示:有过KHV病史的鱼(A组)的普通PCR检测阳性率为0,实时荧光定量PCR阳性率为100%;有烂鳃、腹部出血等临床症状的鱼(C组)的普通PCR检测KHV阳性率为80%,荧光定量PCR检测阳性率为100%;表面健康的鱼(D组)的普通PCR阳性检出率为0,荧光定量PCR检出率为20%(表2)。
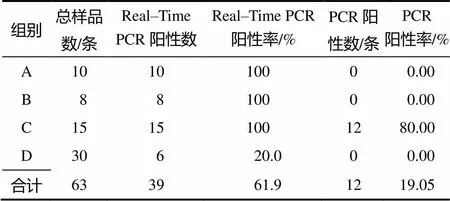
表2 临床样品检测结果
3 结论与讨论
锦鲤疱疹病毒(KHV)从发现至今只有短短十几年时间。除了南美洲,世界各地都有KHVD爆发引起大面积鲤鱼死亡的报道[12]。KHV的快速传播与其存在潜伏感染有很大关系,病毒的潜伏期可以长达十几年甚至为宿主终生历经的时间[8,13]。本研究中针对KHV基因保守区设计特异性引物,通过优化反应条件建立的检测KHV潜伏感染的Real– Time PCR方法只对KHV进行扩增,不与AngHV、CyHV–2、CyHV–1和锦鲤组织DNA发生交叉反应,具有良好的特异性。使用荧光定量PCR对pMD19–T–Sph标准阳性质粒进行定量检测,在1×102~1×106拷贝/μL具有良好的线性关系,最低检出率为42拷贝/μL,组内和组间变异系数均小于2%。该方法具有很好的敏感性和重复性。
临床样品检测结果显示,有KHVD病史鱼的样品(A、B组)的普通PCR检测为阴性,但实时荧光定量PCR检测为阳性,表明KHV潜伏状态下普通PCR检测方法难以检测到该病毒,只有高灵敏度检测方法适用于对该病毒进行检测,否则容易出现假阴性。烂鳃、腹部出血等临床症状池塘中的鱼的普通PCR检测阳性率达80%,荧光定量PCR检测阳性率为100%,表明该池塘中的鱼正暴发KHVD。表面健康的鱼的PCR检测结果全为阴性,但Real–Time PCR阳性率为20%,说明这些样品中的部分鱼存在潜伏感染,其所在鱼塘具有暴发KHVD的可能。
[1] BOUTIER M,RONSMANS M,RAKUS K,et al. Cyprinid herpesvirus 3:an archetype of fish alloherpesviruses[J]. Adv Virus Res,2015,93: 161–256. DOI:10.1016/bs.aivir. 2015.03.001.
[2] 王旭,谈自强,黄玲利,等. 兽用喹噁啉类遗传毒性研究进展[J]. 中国兽药杂志,2013,47(5): 62–65.
[3] ZHANG L,MA J,FAN Y,et al. Immune response and protection in gibel carp,,after vaccination with β–propiolactone inactivated cyprinid herpesvirus 2[J]. Fish Shellfish Immunol,2016,49: 344–350. DOI:10.1016/j.fsi.2016.01.003.
[4] 陈俊杰,汪开毓,周立新,等. 锦鲤疱疹病毒环介导等温扩增检测方法的建立[J]. 中国预防兽医学报,2016,38(5): 390–393. DOI:10.3969/j.issn.1008–0589.2016.05.11.
[5] MA Y P,LIU Z X,HAO L,et al. Analysing codon usage bias of cyprinid herpesvirus 3 and adaptation of this virus to the hosts[J]. J Fish Dis,2015,38(7): 665–673. DOI:10.1111/jfd.12316.
[6] 郑树城,王庆,李莹莹,等. 鲤疱疹病毒3型研究进展[J]. 病毒学报,2016,32(1): 108–120.
[7] ROIZMAN B,PELLETT P E.The family Herpesviridae:a brief introduction[J].Fields Virology,2001,2(11):2381– 2397.
[8] EIDE K E,MILLER–MORGAN T,HEIDEL J R,et al. Investigation of koi herpesvirus latency in koi[J]. J Virol,2011,85(10): 4954–4962. DOI:10.1128/JVI.01384–10.
[9] REED AN,IZUME S,DOLAN B P,et al. Identification of B cells as a major site for cyprinid herpesvirus 3 latency[J]. J Virol,2014,88(16):9297–9309. DOI:10.1128/JVI.00990–14.
[10] PRESCOTT M A,REED A N,JIN L,et al. Rapid detection of cyprinid herpesvirus 3 in latently infected koi by recombinase polymerase amplification[J]. J Aquat Anim Health,2016,28(3):173–180. DOI:10.1080/08997 659.2016.1185048.
[11] 陈红英,李新生,崔保安,等. 基于TaqMan探针的猪细小病毒实时荧光定量PCR方法的建立[J]. 湖南农业大学学报(自然科学版),2008,34(6):686–689.
[12] RAKUS K,OUYANG P,BOUTIER M,et al. Cyprinid herpesvirus 3:an interesting virus for applied and fundamental research[J]. Vet Res,2013,44:85. DOI:10.1186/1297–9716–44–85.
[13] FABIAN M,BAUMER A,ADAMEK M,et al. Transmission of cyprinid herpesvirus 3 by wild fish species–results from infection experiments[J]. J Fish Dis,2016,39(5): 625–628. DOI:10.1111/jfd.12399.
[14] PIAČKOVÁ V,FLAJŠHANS M,POKOROVÁ D,et al. Sensitivity of common carp,L.,strains and crossbreeds reared in the Czech Republic to infection by cyprinid herpesvirus 3 (CyHV–3; KHV)[J]. Journal of Fish Diseases,2012,36(1):75–80. DOI:10.1111/jfd. 12007.
责任编辑:王赛群
英文编辑:王库
Method of Real–Time PCR for the detecting latent infection of koi herpesvirus
CHEN Junjie, LI Yuanyuan, YANG Ruixue, GU Jingjing, WANG Kaiyu, GENG Yi, OUYANG Ping*
(College of Veterinary Medicine, Sichuan Agricultural University, Chengdu 611130, China)
To establish a rapid, sensitive and specific approach for detecting the latent infection of koi Herpesvirus (KHV), a Real-Time PCR test was designed through specific primers designed to target KHVgene. Under the optimized reaction conditions, the results showed that this method was specific for latent detection of KHV without cross reaction to other fish pathogenic viruses, including carp pox herpes virus (CyHV–1), goldfish herpes virus (CyHV–2) and eel herpes virus (AngHV–1). The lowest limitation of detection concentration by Real–Time PCR was 42 copies per 1 μL. A total of 63 clinical samples were detected by Real–Time PCR. The result showed that 18 samples out of which had koi herpesvirus disease (KHVD) history, all samples were positive; 15 samples out of which had in clinical signs and the positive rate was 100%; 30 samples out of which had no any clinical symptoms, and 6 out of the 30 samples were positive, the positive rate was 20%. In conclusion, the approach provides a rapid, sensitive and reliable molecular tool for detecting latent infection of koi Herpesvirus.
koi herpesvirus (KHV); latent infection; Real–Time PCR (RT–PCR)
10.13331/j.cnki.jhau.2017.03.016
S941.41
A
1007-1032(2017)03-0310-05
2016–10–09
2017–01–13
中国博士后科学基金(2015M582563);教育部留学回国人员科研启动基金(教外司留[2015]311号)
陈俊杰(1990—),男,山东临沂人,硕士研究生,主要从事兽医病原微生物及病理学研究;
,欧阳萍,讲师,博士,主要从事家畜病理学研究,ouyang.ping@live.cn
投稿网址:http://xb.hunau.edu.cn

