同步放化疗与序贯放化疗对宫颈癌中晚期患者血液毒性以及肿瘤标志物的影响
杨江华 张丹丹 高 琴 白 矾
同步放化疗与序贯放化疗对宫颈癌中晚期患者血液毒性以及肿瘤标志物的影响
杨江华 张丹丹 高 琴 白 矾
目的 研究同步放化疗与序贯放化疗对宫颈癌中晚期患者血液毒性以及肿瘤标志物的影响。方法 选取宫颈癌中晚期患者100例作为研究对象,根据放化疗方式,设同步放化疗为观察组,序贯放化疗为对照组,每组各50例。观察两组患者放化疗前血液毒性相关指标及放化疗后2、4周变化情况,观察两组患者放化疗前及放化疗后2、4周肿瘤标志物的变化。结果 两组患者放疗前血液中血红蛋白、白细胞、粒细胞及血小板水平比较均无显著差异(P>0.05),观察组患者放疗后2、4周血液中血红蛋白、白细胞、粒细胞及血小板水平均显著高于对照组(P<0.05);两组患者放疗前SCC-AG、CEA、CA50、CA724水平比较无显著差异(P>0.05),放疗后2、4周观察组SCC-AG、CEA、CA50、CA724水平均显著低于对照组(P<0.05)。 结论 同步放化疗较序贯放化疗能够较大程度提高对宫颈癌中晚期患者的治疗效果,降低治疗过程中的不良反应,具有较大的临床应用价值。
同步放化疗;序贯放化疗;宫颈癌;血液毒性;肿瘤标志物
(ThePracticalJournalofCancer,2017,32:1082~1084)
在全球女性中,宫颈癌作为患病率仅次于乳腺癌的1种恶性肿瘤,其危害性较为严重,尤其在发展中国家。相关资料表明,宫颈癌生存率较低,其中Ⅱ期5年生存率约为58%,Ⅲ期则为43%。过去早期宫颈癌的治疗方法为手术,中晚期则为放射治疗[1]。国内相关报道表明,同步放化疗对宫颈癌中晚期治疗优于单纯的序贯放化疗。但也有国内外文献表明其对血液毒性及血液肿瘤标志物有负面影响[2]。因此我们设计此实验,进一步探究同步放化疗与序贯放化疗在血液毒性及肿瘤标志物方面的优劣,现报告如下。
1 材料与方法
1.1 一般资料
选取2012年4月至2014年2月我院收治的宫颈癌患者作为研究对象。纳入标准: ①经病理检查确诊的宫颈癌中晚期(Ⅰb2~Ⅲb);②已行同步放化疗治疗或序贯放化疗;③每位患者治疗过程中只能采用一种化疗方案,每周1次,连续4~5次;④具有完整的入院后记录;⑤具有完整的辅助检查记录。排除标准:①同步放化疗或序贯放化疗前接受过其他放疗或化疗;②治疗中两次放化疗时间间隔>1月;④合并其他严重的恶性肿瘤。符合以上标准的患者为100例,根据放化疗方式,设同步放化疗为观察组,序贯放化疗为对照组,每组各50例。观察组年龄45~68岁,平均年龄(54.3±3.7)岁;体重44~ 70 kg,平均( 52.4±6.9) kg ;FIGO分期,Ⅰb2期6例,Ⅱa期8例,Ⅱb期18例,Ⅲa期6例,Ⅲb期12例,;对照组年龄52~80岁,平均年龄(60.4±3.2)岁;体重43~69 kg,平均( 51.4±7.5) kg ;FIGO分期,Ⅰb2期7例,Ⅱa期7例,Ⅱb期16例,Ⅲa期10例,Ⅲb期10例,。两组患者在年龄、体重、FIGO分期中无显著差异(P>0.05),具有良好的可比性。
1.2 方法
对照组给予序贯放化疗治疗,采用盆腔前后野分割照射治疗,放化疗强度为2 Gy/次,频率为5次/周,总剂量为40~45 Gy,放疗完成后给予以顺铂50 mg/m2为主的化学药物的治疗,并于首次放射治疗完成后3周再给予化学药物治疗。观察组采用同步放化疗治疗,放疗方案同对照组,并在放疗的同时应用顺铂50 mg/m2对患者进行化疗,放疗第一天同时加以氟尿嘧啶4 000 mg,应用时间为4 d,应用周期为4周,治疗疗程为3个周期。
所有患者均在放化疗前后于清晨空腹状态下抽取5ml静脉血进行检测,离心分离血清,-20 ℃保存待测。血液毒性指标参考CTC 3.0不良反应评估标准,患者均在放疗前后检测血红蛋白、白细胞、粒细胞和血小板等血常规检测。
肿瘤标志物检测采用化学发光免疫法(chemiluminescence immunoassay,CLIA)法测定。应用罗氏E411全自动电化学发光分析仪及配套试剂盒(购自瑞士罗氏公司)进行检测。采用盲法、复孔测定。
1.3 观察指标
观察两组患者放化疗前血液毒性相关指标水平及放化疗后2、4周变化情况,观察两组患者放化疗前及放化疗后2、4周肿瘤标志物水平变化。
1.4 统计学方法

2 结果
2.1 两组患者放化疗前血液毒性相关指标水平比较
两组患者放疗前血液中血红蛋白、白细胞、粒细胞及血小板水平比较均无显著差异(P>0.05),见表1。

表1 两组患者放化疗前血液毒性相关指标对比
2.2 两组放疗后2、4周血液毒性相关指标水平比较
观察组患者放疗后2、4周血液中血红蛋白、白细胞、粒细胞及血小板水平均显著高于对照组(P<0.05),见表2。
2.3 两组患者放疗前后肿瘤标志物水平比较
两组患者放疗前SCC-AG、CEA、CA50、CA724水平比较无显著差异(P>0.05),放疗后2、4周观察组SCC-AG、CEA、CA50、CA724水平均显著低于对照组(P<0.05),见表3。
3 讨论
宫颈癌目前作为我国女性群体中患病率较高的1种恶性肿瘤,随着近几年宫颈癌的筛查方法的逐渐普及,早期诊断宫颈癌的效果得到不断提升,但仍有许多患者由于诸多原因未能及时诊断,进而发展为中晚期宫颈癌,因此医学界仍重点研究中晚期宫颈癌的治疗方法[3-4]。过去一般认为,中晚期宫颈癌最有效的治疗方法为放射治疗,手术治疗效果未能优于放射治疗方式[5]。近几年因化疗药物和方法的不断发展和改进,化疗对中晚期宫颈癌的治疗效果也逐渐显现,具体方法有辅助化疗、同步放化疗、新辅助化疗、序贯化疗等[6-7]。同步放化疗是指在放疗的当天同时进行化疗,可通过放疗和化疗两种治疗效果的叠加,最大化提高治疗的有效率和控制率,能够有效控制癌症的微小转移灶,减少放化疗长程治疗后导致的肿瘤后增殖现象。但也有相关研究表明,同步放化疗也可能在增加远处转移病灶的同时增加了对人体的毒副反应[8]。序贯放化疗是指在全部疗程中以放疗和化疗连续进行的治疗方式[9]。放疗方法可控制癌症的肿瘤病变,化疗可进一步缩小肿瘤大小,降低放疗的照射面积,能够较好的避免放化疗同时进行的毒副作用的叠加效果,降低治疗过程中对人体的毒副作用,但其治疗强度相对较弱,肿瘤清除效果较低,具体表现为患者体内肿瘤标志物水平未能降至较低水平,也可导致化疗耐受细胞的出现。以上两种方法对人体的毒副作用主要表现在对患者血液产生毒害作用,进而产生放化疗后血液行相关并发症[10-11]。
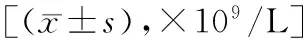
表2 两组患者放疗后2、4周血液毒性相关指标水平比较

表3 两组患者放疗前后肿瘤标志物水平对比
注:与对照组比较,b为P>0.05,a为P<0.05。
本次研究结果表明,两组患者放疗前血液中血红蛋白、白细胞、粒细胞及血小板均无显著差异(P>0.05),两组患者放疗后2、4周血液中血红蛋白、白细胞、粒细胞及血小板水平均显著高于对照组(P<0.05),两组患者放疗前SCC-AG、CEA、CA50、CA724水平无显著差异(P>0.05),放疗后2、4周观察组SCC-AG、CEA、CA50、CA724水平均显著低于对照组水平(P<0.05),说明了同步放化疗及序贯放化疗都可对中晚期宫颈癌的治疗产生较好的效果。同步放化疗对患者放化疗后血液毒性的危害程度低于序贯放化疗,说明同步放化疗可在长程放化疗后最大程度的减少患者血液方面的并发症,改善患者治疗总体效果,对促进患者预后恢复有着重要的作用。同步放化疗也能够更加有效的降低患者肿瘤标志物的水平,较大范围地杀死患者体内宫颈癌细胞,降低患者宫颈癌再次复发的概率,增加其5年生存率。
当然实验中也存在些许问题,如实验中两组采集的样本都过少。因为实验中两组样本均为50例,在统计分析结果肿瘤标志物及血液指标时,两组例数差别即使很小也有可能很大程度上影响统计学计算,导致P值不能准确反应两者对宫颈癌治疗效果的对比,故若能增加两组实验样本中的例数则可很大程度上增加结果的可靠性。
[1] 杨镇休,宋向群.局部晚期宫颈癌80例放化疗分析〔J〕.实用医学杂志,2012,28(18):3059-3061.
[2] 田 欣,吴 荣,张振勇,等.局部晚期食管癌同步放化疗和序贯放化疗的临床分析〔J〕.山东医药,2012,52(4):60-61.
[3] 贾玉玲,张保祯.中晚期宫颈癌同步放化疗与序贯化放疗的临床研究〔J〕.中华放射医学与防护杂志,2013,33(1):64-65.
[4] 邰宵辉,赵 达,关泉林,等.同步放化疗与序贯放化疗治疗食管癌的Meta分析〔J〕.实用肿瘤杂志,2013,28(6):605-611.
[5] 张紫萱,刘慧慧,胡 克,等.局部晚期NSCLC同步放化疗与序贯放化疗的比较〔J〕.国际呼吸杂志,2014,34(10):749-752.
[6] 祝沈冬,段宏燕,于清蕊,等.同步放化疗与序贯放化疗治疗Ⅲ期非小细胞肺癌的临床疗效比较〔J〕.临床肺科杂志,2013,18(3):415-416.
[7] 陈光烈.同步放化疗与序贯放化疗对直肠癌术后患者局部控制率和生存率的影响〔J〕.当代医学,2012,18(2):47-48.
[8] 李德刚.同步放化疗与序贯放化疗治疗食管癌疗效对比观察〔J〕.中国现代药物应用,2013,7(2):24-25.
[9] 廖妮虹.术前序贯放化疗治疗局部巨块型宫颈癌的近期疗效〔J〕.国际医药卫生导报,2014,20(9):1261-1263.
[10] 李真斌,陈 轩,汤晓梅,等.同步放化疗治疗非小细胞肺癌的临床分析〔J〕.中国当代医药,2014,21(13):23-25.
[11] 陆 颖,黄海欣,李桂生,等.局部晚期乳腺癌术后后程同步放化疗及序贯治疗的临床对比研究〔J〕.中华肿瘤防治杂志,2014,21(11):854-857.
(编辑:吴小红)
Influences of Concurrent Chemoradiotherapy and Sequential Chemoradiotherapy on Hematological Toxicity and Tumor Markers of Patients with Advanced Cervical Cancer
YANGJianghua,ZHANGDandan,GAOQin,etal.TheAffiliatedHospitalofWuhanUniversityofScienceandTechnology,WuhanPurenHospital,Wuhan,430081
Objective To study the influences of concurrent chemoradiotherapy and sequential chemoradiotherapy on hematological toxicity and tumor markers of patients with advanced cervical cancer.Methods According to chemoradiotherapy methods,100 cases of cervical cancer were selected and divided into 2 groups,concurrent chemoradiotherapy as the observation group and sequential chemoradiotherapy as the control group,50 cases in each group. The changes of blood toxicity related indicators and tumor markers before and 2 and 4 weeks after chemotherapy were observed.Results There were no significantly difference in blood hemoglobin,leukocytes,platelets and granulocytes between the 2 groups before radiotherapy (P>0.05),2 and 4 weeks after radiotherapy,blood hemoglobin,leukocytes,platelets and granulocytes levels of the observation group were significantly higher than the control group (P<0.05),SCC-AG,CEA,CA50,CA724 levels of the 2 groups before radiotherapy had no significant difference (P>0.05),2 and 4 weeks after radiotherapy,SCC-AG,CEA,CA50,CA724 level of the observation group were significantly lower than the control group (P<0.05).Conclusion Compared with sequential chemoradiotherapy,concurrent chemoradiotherapy can improve efficacy of advanced cervical cancer and reduce the incidence of toxicity,and it has great clinical value.
Concurrent chemoradiotherapy;Sequential chemotherapy;Cervical cancer;Hematological toxicity;Tumor markers
430081 武汉科技大学附属医院,武汉市普仁医院
10.3969/j.issn.1001-5930.2017.07.012
R737.33
A
1001-5930(2017)07-1082-03
2016-08-05
2017-04-10)

