乙酸可通过增强脂肪酸β氧化治疗小鼠肥胖
范秀琴,路媛媛,樊超男,李 苹,齐可民
(首都医科大学附属北京儿童医院/北京市儿科研究所营养研究室,北京100045)
乙酸可通过增强脂肪酸β氧化治疗小鼠肥胖
范秀琴,路媛媛,樊超男,李 苹,齐可民
(首都医科大学附属北京儿童医院/北京市儿科研究所营养研究室,北京100045)
目的:探讨乙酸对高脂饮食诱导的肥胖小鼠体重及脂肪酸β氧化的影响。方法:3~4w龄C57BL/6J雄性小鼠分别给予正常饲料和高脂饲料喂养4个月以诱导肥胖,然后对肥胖小鼠实施乙酸治疗5w。喂养过程结束后,心脏采血,取结肠、肝脏和性腺周围脂肪。检测血浆葡萄糖、甘油三酯(TG)、总胆固醇(TCH)和胰岛素浓度,同时检测结肠G蛋白偶联受体(GPR43、GPR41)、酪酪肽(PYY)、胰高血糖素样肽1(GLP-1)以及肝脏和脂肪肉碱脂酰转移酶(cpt)基因mRNA表达水平。结果:高脂诱导的肥胖小鼠给予乙酸治疗5w后,体重显著性下降,但日均进食量和能量摄入却显著增加(P<0.05)。肥胖小鼠的血浆葡萄糖、TG和TCH较正常小鼠,均显著升高(P<0.05),给予乙酸治疗后,血浆TG和TCH水平均显著降低(P<0.05)。与正常小鼠相比,肥胖小鼠结肠中GPR43、GPR41、PYY和GLP1的mRNA表达量均显著性升高(P<0.05),脂肪和肝脏中cpt1a、cpt1c、cpt2的mRNA表达显著性降低(P<0.05);肥胖小鼠给予乙酸治疗后,结肠中上述基因mRNA表达量均显著性降低(P<0.05),脂肪中cpt基因mRNA表达均显著性升高(P<0.05)。结论:乙酸对小鼠肥胖有较好的治疗效果,其作用机制可能是通过特异性促进脂肪组织中脂肪酸β氧化。
乙酸;肥胖;小鼠;脂肪酸β氧化
近几年来,肥胖发病率逐渐升高,肥胖及其并发症,已成为全球性威胁人类健康的主要问题[1]。早期研究发现,增加膳食纤维的摄入可以抑制人的食欲并降低体重[2],膳食纤维在结肠中的厌氧菌发酵作用下主要产生短链脂肪酸,我们近期研究结果显示,高脂饲料中添加短链脂肪酸尤其是乙酸,可显著预防肥胖的发生[3]。本研究拟以高脂饲料诱导的肥胖小鼠为对象,观察乙酸对肥胖小鼠体重的影响及其作用机制。
1 材料和方法
1.1 实验动物与分组
SPF级3~4w龄C57BL/6J雄性小鼠30只,随机分成正常组(10只)和高脂组(20只),2组初始体重为18.86±0.76g和18.89±0.53g,无显著性差异。然后分别给予正常饲料(脂肪含量为4.3%、供能比为10%)和高脂饲料(脂肪含量为34.9%、供能比为60%)喂养4个月以诱导肥胖。继而将高脂组肥胖小鼠随机分为肥胖组(10只)和乙酸—肥胖组(10只),并分别给予高脂饲料和乙酸高脂饲料(乙酸钠含量为5%),正常组继续给予正常饲料,均喂养5w。小鼠饲料,由北京华阜康生物科技股份有限公司制作,其组成成分见表1。喂养周期结束后,禁食12h,麻醉状态下心脏取血,离心(3 000r/min,15min)分离血浆,于-20℃冰箱保存待测。颈椎脱臼法处死小鼠,取肝脏、结肠和性腺周围脂肪组织,立即放入液氮中保存备用。小鼠,购买于斯贝福(北京)生物技术有限公司,饲养于中国人民解放军军事医学科学院实验动物中心SPF级环境中。实验过程经该院实验动物伦理委员会批准。
1.2 方法
1.2.1 小鼠进食量和能量摄入测定 在乙酸干预治疗的第3w,每天同一时间测定小鼠进食量,连续测定7d。正常饲料能量为3.733 kcal/g、高脂饲料能量为5.225 kcal/g、添加乙酸钠的高脂饲料能量为5.675 kcal/g,根据小鼠进食量计算小鼠能量摄入。
1.2.2 血浆指标的检测 血浆胰岛素检测采用放射免疫法,试剂盒由北方生物科技研究所提供;血浆葡萄糖检测采用葡萄糖氧化酶法,试剂盒由北京中生北控公司提供;血浆甘油三酯(TG)和总胆固醇(TCH)检测采用酶法,试剂盒由日本积水医疗公司提供。
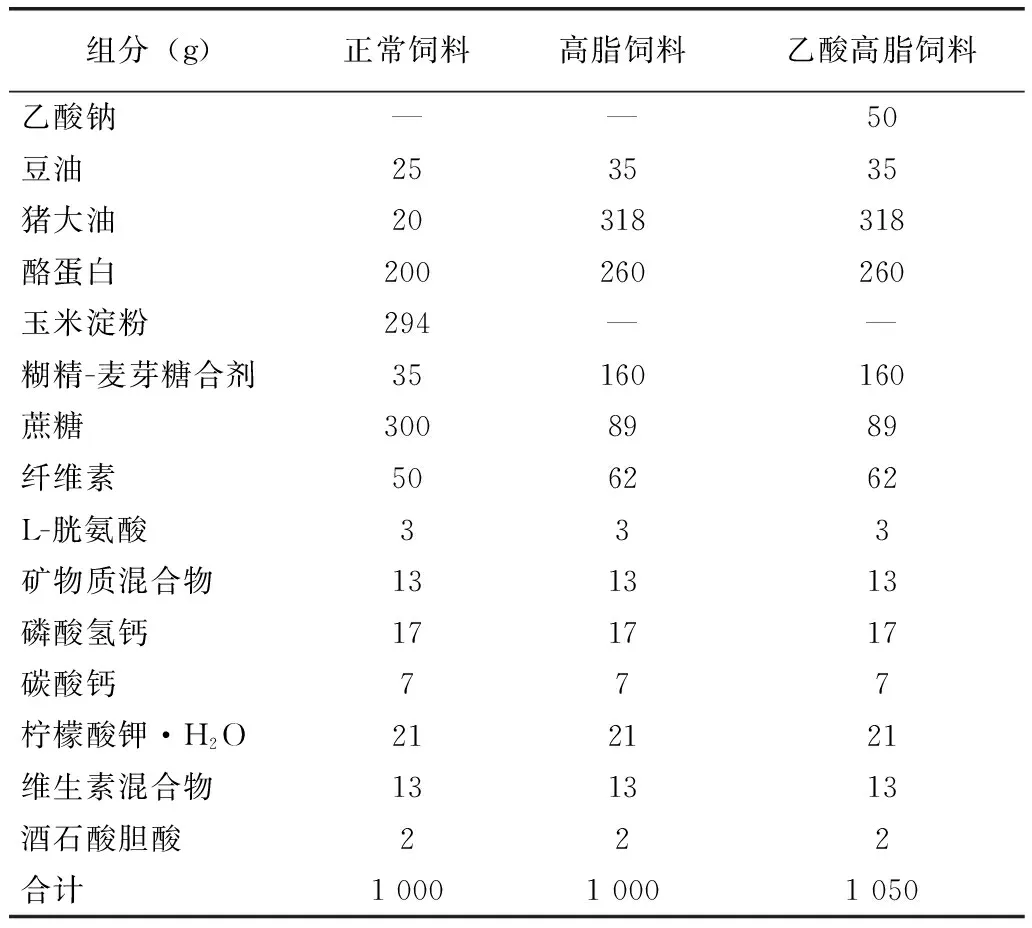
表1 小鼠饲料组成成分
1.2.3 基因mRNA表达测定 采用TRIzol® RNA(美国 Invitrogen 货号:10296-010)提取结肠、肝脏以及脂肪组织的总mRNA,然后用Quant cDNA第一链合成试剂盒(天根生化科技有限公司货号:KR103-04)逆转为cDNA,最后用实时荧光定量PCR法检测结肠组织中G蛋白偶联受体(GPR43、GPR41)、食欲抑制因子酪酪肽(PYY)与胰高血糖素样肽-1(GLP-1)、肝脏和脂肪组织中脂肪酸氧化过程中的关键酶肉碱脂酰转移酶(cpt1a、cpt1c、cpt2)的mRNA表达水平。目的基因mRNA表达量以其相对于内参基因β-actin的mRNA含量表示,PCR扩增引物见表2。
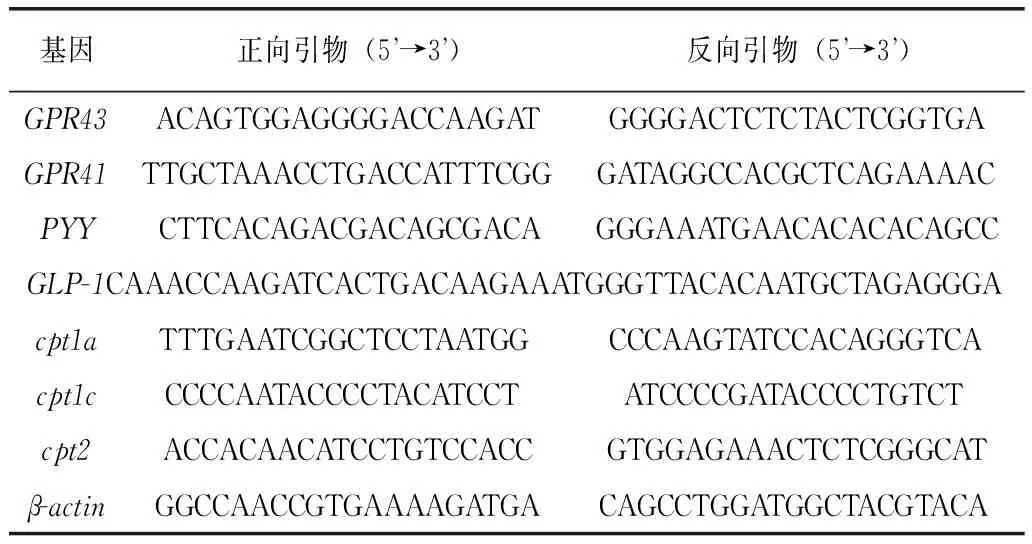
表2 实时荧光定量PCR引物
1.3 统计学方法

2 结果与分析
2.1 乙酸对肥胖小鼠体重的影响
小鼠经高脂饲料喂养4个月后,体重48.03±2.89g显著高于正常饲料喂养组小鼠31.80±1.88g(P<0.05),肥胖诱导成功。肥胖小鼠给予乙酸干预治疗5w后,体重显著性下降,幅度达21.5%,而未治疗的肥胖小鼠体重增加了9.7%(表3)。
表3 乙酸对肥胖小鼠体重的影响
注:*与正常组相比,P<0.05;Δ与肥胖组相比,P<0.05。
2.2 乙酸对肥胖小鼠进食量和能量摄入的影响
虽然肥胖小鼠日均进食量低于正常小鼠(P<0.05),但日均能量摄入却显著高于正常小鼠(P<0.05)。肥胖小鼠给予乙酸治疗后,日均进食量和能量摄入均有显著升高(P<0.05)(表4)。
表4 乙酸对肥胖小鼠进食量和能量摄入的影响
注:*与正常组相比,P<0.05;Δ与肥胖组相比,P<0.05。
2.3 乙酸对肥胖小鼠血浆指标的影响
肥胖小鼠的血浆葡萄糖、TG和TCH水平与正常小鼠相比,均显著升高(P<0.05),而血浆胰岛素水平无明显变化。肥胖小鼠给予乙酸治疗后,血浆TG和TCH水平均显著降低(P<0.05),而血浆葡萄糖和胰岛素水平均无明显变化(表5)。

表5 乙酸对肥胖小鼠血浆生化指标的影响
注:*与正常组相比,P<0.05;Δ与肥胖组相比,P<0.05。
2.4 乙酸对肥胖小鼠食欲及脂肪酸β-氧化的影响
与正常小鼠相比,肥胖小鼠结肠中GPR43、GPR41、PYY和GLP1基因mRNA表达量均显著性升高(P<0.05),脂肪组织和肝脏中cpt1a、cpt1c、cpt2的mRNA表达显著性降低(P<0.05)。肥胖小鼠给予乙酸治疗后,结肠中GPR43、GPR41、PYY和GLP1基因mRNA表达量均显著性降低(P<0.05),脂肪组织中cpt1a、cpt1c、cpt2基因mRNA表达均显著性升高(P<0.05),肝脏组织中cpt1a、cpt1c、cpt2基因mRNA表达无变化(P>0.05)(表6)。
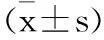
表6 乙酸对肥胖小鼠食欲因子表达及脂肪酸β-氧化的影响
注:a为此组数据乘以10-3;*与正常组相比,P<0.05;Δ与肥胖组相比,P<0.05。
3 讨论
3.1 乙酸在体重调控中的作用
流行病学和实验研究均显示膳食纤维可提升饱腹感和满足感,膳食纤维的摄入和体重的增加呈负相关[4-6],然而,膳食纤维摄入过多可产生腹胀、腹痛等不适表现。近年来的研究显示,膳食纤维可通过小肠到达结肠而不被消化酶消化,在结肠中的厌氧菌发酵作用下产生短链脂肪酸,主要包括乙酸、丙酸和丁酸等,其含量比例为60∶20∶20[7]。膳食来源的短链脂肪酸分布较为局限,仅存在于奶制品当中。近来的研究表明,饮食中添加短链脂肪酸可抑制高脂饲料诱导的啮齿类动物体重的增加,有助于预防肥胖的发生[3,8,9]。本研究结果显示,肥胖发生后给小鼠进行乙酸治疗5w,使得其体重有明显的下降。临床试验研究发现,肥胖者饮用醋可起到减肥的作用[10]。可见,短链脂肪酸在肥胖预防和治疗中起着积极的作用。
3.2 乙酸对食欲的调控作用
正常情况下,能量摄入会导致肠道内分泌细胞分泌PYY和GLP-1等食欲抑制因子,进而抑制食欲,减缓肠道蠕动,延长胃排空时间,提升饱腹感,防止过多能量的摄入[11]。本研究结果显示,高脂诱导肥胖小鼠较正常小鼠结肠组织中食欲抑制因子PYY和GLP1的mRNA表达量显著性升高,日均进食量显著性降低,这与Sung等[12]的研究结果一致,但能量摄入是显著增加的。而给肥胖小鼠予以乙酸治疗后,小鼠的日均进食量没有减少,反而增加,这可能与其结肠组织中GPR43和GPR41的表达量以及相关食欲抑制因子PYY和GLP1的表达量降低有关。对正常生理状态下的研究发现,乙酸等短链脂肪酸与GPR41和GPR43结合可促进PYY、GLP-1等食欲抑制因子的合成与分泌[13]。此外,乙酸也可透过血脑屏障直接作用于下丘脑食欲调控中枢来调控食欲[14]。尽管如此,关于短链脂肪酸对食欲的影响与机制仍需深入研究。
3.3 乙酸对脂肪氧化的影响
脂肪合成代谢的关键酶是乙酰辅酶A 羧化酶(ACC),乙酸等短链脂肪酸的添加可抑制此酶的活性,进而抑制脂肪的合成[15],而cpt则是脂肪分解代谢过程中脂肪酸β氧化的限速酶,分为cpt1和cpt2两类[16],其表达水平与活性升高可促进脂肪酸的β氧化分解,降低体内脂肪的含量[17-18]。本研究显示,肥胖小鼠给予乙酸治疗5w后,肝脏中cpt1a,cpt1c和cpt2的mRNA表达无明显变化,而脂肪组织中cpt1a、cpt1c和cpt2的mRNA表达水平显著性升高,加速了脂肪酸的转运和β氧化过程,更多地燃烧脂肪,进而导致小鼠体重下降。提示,特异性促进脂肪组织中脂肪酸的β氧化为乙酸发挥作用的另一机制。
综上所述,乙酸对小鼠肥胖有较好的治疗效果,其机制之一为特异性促进脂肪组织中脂肪酸的β氧化,这提示我们未来可以考虑将乙酸等短链脂肪酸用于肥胖的干预治疗。然而,关于短链脂肪酸的研究大多数都来自动物模型,收集人群的相关数据并进一步开展临床研究是有必要的。◇
[1]Franks PW,Hanson RL,Knowler WC,et al.Childhood obesity,other cardiovascular risk factors,and premature death[J]. N Engl J Med,2010,362(6):485-493.
[2]Wanders AJ,van den Borne JJ,de Graaf C,et al.Effects of dietary fibre on subjective appetite,energy intake and bodyweight:asystematic review of randomized controlled trials[J]. Obes Rev,2011,12(9):724-739.
[3]Lu Y,Fan C,Li P,et al.Short Chain Fatty Acids Prevent High-fat-diet-induced Obesity in Mice by Regulating G Protein-coupled Receptors and Gut Microbiota[J]. Sci Rep,2016,28(6):37589.
[4]Ludwig DS,Pereira MA,Kroenke CH,et al.Dietaryfiber,weight gain,and cardiovascular disease risk factors inyoung adults[J]. JAMA,1999,282(16):1539-1546.
[5]Maskarinec G,et al. Trends anddietary determinants of overweight and obesity in a multiethnicpopulation[J]. Obesity (Silver Spring),2006,14(4):717-726.
[6]Du H,et al.Dietaryfiber and subsequent changes in bodyweight and waist circumferencein European men and women[J]. Am J Clin Nutr,2010,91(2):329-336.
[7]Cummings JH,Pomare EW,Branch WJ,et al.Shortchain fatty acids in human large intestine,portal,hepaticand venous blood[J]. Gut,1987,28(10):1221-1227.
[8]Lin HV,Frassetto A,Kowalik EJ Jr,et al.Butyrate and propionate protect against diet-induced obesity and regulate guthormones via free fatty acid receptor 3-independent mechanisms[J]. PLoS One,2010,7(4):e35240.
[9]Chambers ES,Viardot A,Psichas A,et al.Effects of targeted delivery of propionate to the human colon on appetiteregulation,body weight maintenance and adiposity in overweight adults[J]. Gut,2015,64(11):1744-1754.
[10]Kondo T,Kishi M,Fushimi T,et al. Vinegar intake reduces body weight,body fat mass,and serum serum triglyceride levels in obese Japanese subjects[J]. Biosci Biotechnol Biochem,2009,73(8):1837-1843.
[11]Psichas A,Sleeth ML,Murphy KG,et al.The short chain fatty acid propionate stimulates GLP-1 and PYY secretion viafree fatty acid receptor 2 in rodents[J]. Int J Obes (Lond),2015,39(3):424-429.
[12]Sung YY,Yoon T,Yang WK, et al.Antiobesity effects of Actinidia polygama extract in mice with highfat dietinduced obesity[J]. Mol Med Rep,2013,7(2):396-400.
[13]Chambers ES,et al.Control of appetite and energy intake by SCFA:what are the potential underlying mechanisms[J]. Proc Nutr Soc,2015,74(3):328-336.
[14]Frost G,Sleeth ML,Sahuri-Arisoylu M,et al. Theshort-chain fatty acid acetate reduces appetite via a central homeostaticmechanism[J]. Nat Commun,2014,5:3611.
[15]Yonezawa T,Yonekura S,Sanosaka M, et al.Octanoate stimulates cytosolic triacylglycerol accumulation and CD36 mRNA expression but inhibits acetyl coenzyme A carboxylase activity in primary cultured bovine mammary epithelial cells[J]. Dairy Res,2004,71(4):398-404.
[16]Bonnefont JP,et al.Carnitine palmitoyltransferase deficiencies[J].Mol Genet Metab,1999,68(4):424-440.
[17]Foster DW.The role of the carnitine system in human metabolism[J]. Ann N Y Acad Sci,2004(1033):1-16.
[18]Qu Q,Zeng F,Liu X,et al. Fatty acid oxidation and carnitine palmitoyltransferase I:emerging therapeutic targets in cancer[J]. Cell Death Dis,2016,7:e2226.
(责任编辑 李婷婷)
Acetate Can Treat Obesity by Enhancing Fatty Acid β-oxidation in Mice
FAN Xiu-qin,LU Yuan-yuan,FAN Chao-nan,LI Ping,QI Ke-min
(Beijing Children’s Hospital,Capital Medical University/Pediatric Nurtition Center,Beijing Pediatric Research Institute,Beijing 100045,China)

acetate;obese;mice;fatty acid β-oxidation
北京市科委行业定额经费自主项目(项目编号:2015-bjsekyjs-Qi)。
范秀琴(1988— ),女,博士,研究实习员,研究方向:儿童营养。
齐可民(1967— ),男,博士,研究员,研究方向:儿童营养。

