凤丹牡丹花瓣化学成分研究
闫慧娇,王志伟,陈燕平,姜姣姣,崔莉,耿岩玲,王晓*
(1.山东省中药质量控制重点实验室,山东省分析测试中心,山东 济南 250014;2.烟台出入境检验检疫局,山东 烟台 264000 3.山东中医药大学药学院,山东 济南 250014)
【中药与天然活性产物】
凤丹牡丹花瓣化学成分研究
闫慧娇1,王志伟1,陈燕平2,姜姣姣3,崔莉1,耿岩玲1,王晓1*
(1.山东省中药质量控制重点实验室,山东省分析测试中心,山东 济南 250014;2.烟台出入境检验检疫局,山东 烟台 264000 3.山东中医药大学药学院,山东 济南 250014)
对凤丹牡丹花瓣化学成分进行深入研究,运用高效液相色谱方法进行分离纯化,运用1H NMR、13C NMR和MS波谱学数据鉴定其结构。结果得到2个没食子酸鞣质类化合物,分别为1-O-galloyl-β-D-glucose(1)和1,2,3,4,6-Trigalloyl-β-D-glucose(2),以及一个黄酮类化合物kaempferol-3,7-di-O-β-D-glucopyranoside(3)。化合物1~3均首次从凤丹牡丹花中分离得到,化合物1~2也是首次从凤丹牡丹花中分离得到鞣质类化合物。
牡丹;花瓣;鞣质;黄酮
牡丹(PaeoniasuffruticosaAndr.)属毛茛科芍药属灌木,为传统名贵观赏花卉,又有富贵花和“花中之王”的美称。其根皮,又称牡丹皮、丹皮,为传统中药,《神农本草经》列为中品,具有清热凉血、活血化瘀之功效[1]。牡丹花作为特色的天然生物资源,在我国有悠久的药用和食用历史,《四川中药志》载牡丹花性平、苦、淡,具有调经活血的功能[2]。牡丹花是较好的天然营养保健资源,凤丹牡丹(PaeoniasuffruticosaAndr. cv. Fengdan) 花2013年被国家卫计委批准为新食品原料[3]。前期研究中,我们对凤丹牡丹花的化学成分进行了系统的分离,并从中得到7个单萜糖苷类化合物、9个黄酮类化合物和2个没食子酸类化合物[4-5]。
鞣质(tannins)又称单宁,是存在于植物体内一类结构比较复杂的多元酚类化合物。鞣质广泛存在于植物界,其多元酚类结构赋予它一系列独特的化学性质,并具有很强的生物和药理活性,固涩收敛滑脱、遏制气血津液耗散的药物都含有丰富的鞣质成分。现代研究表明,鞣质具有抗氧化[6]、抗肿瘤[7-8]、抑菌[9]、抗病毒[10]以及免疫调节[11-12]的药理活性。我们在前期研究的基础上,采用高效液相色谱制备的方法,大大减少了鞣质的损失。结果得到2个没食子酸鞣质类化合物,分别为1-O-galloyl-β-D-glucose(1)和1, 2, 3, 4, 6-trigalloyl-β-D-glucose(2)。同时得到1个黄酮类化合物kaempferol-3,7-di-O-β-D-glucopyranoside(3)。化合物1~3(结构式见图1)均为首次从凤丹牡丹花中分离得到,也是首次从凤丹牡丹花中分离得到鞣质类化合物。
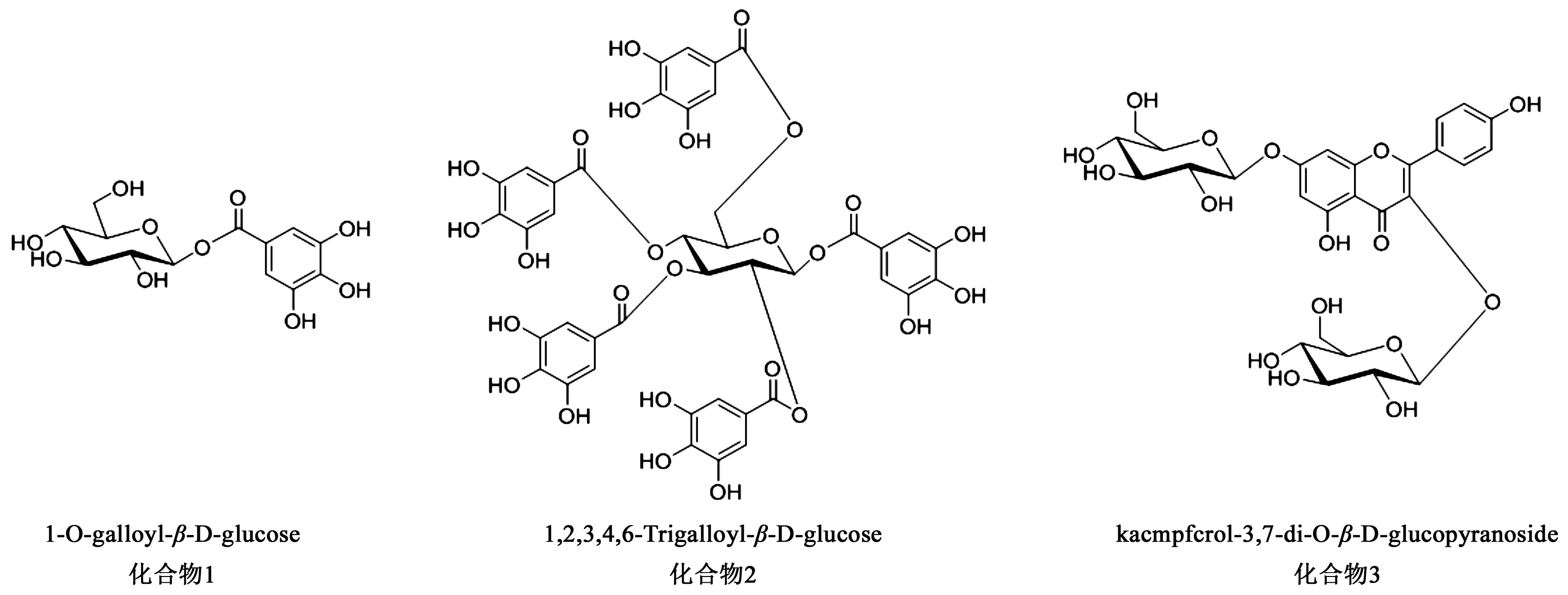
图1 化合物1~3结构式Fig.1 Structures of compounds 1~3
1 仪器与材料
Varian INOVA-600型核磁共振波谱仪(美国Varian公司,以TMS为内标);Varian INOVA-400型核磁共振波谱仪(美国Varian公司,以TMS为内标);Agilent 1120 型高效液相色谱仪(配有DAD检测器,自动进样器,美国Agilent 公司);R201 型旋转蒸发仪(上海申生科技有限公司);RIGOL L-3140型高效液相色谱仪(北京普源精电科技有限公司,色谱柱为YMC-PACK ODS-A column,250 mm×10 mm);Agilent 5973型质谱仪(美国Agilent公司);FA1104 型电子天平(上海精天电子仪器厂)。
乙醇(分析纯,德州恒业化工有限公司);甲醇、石油醚,分析纯(天津市化学试剂厂);甲酸、乙腈(色谱纯,山东禹王试剂有限公司)。
牡丹花采自山东菏泽,经山东省分析测试中心刘伟副研究员鉴定为芍药属植物凤丹牡丹的花。
2 提取与分离
取干燥后的凤丹牡丹花瓣10 g,粉碎后于65%乙醇中60 ℃温浸3次,每次4 h,合并提取液,减压浓缩至无醇味。浸膏0.3 g分散于甲醇中(20 mL)成悬浊液,用石油醚萃取3次(3 ×20 mL),甲醇部分蒸干复溶后直接采用高效液相色谱制备,得化合物1(1.2 mg)、2(2.0 mg)和3(5.0 mg)。
2.1 制备条件
采用RIGOL L-3140型高效液相色谱仪,色谱柱为YMC-PACK ODS-A(250 mm×10 mm,5 μm),以乙腈-0.1%甲酸水溶液为流动相,梯度洗脱:0~5 min,5%乙腈;5~8 min,5%~12%乙腈;8~23 min,12%乙腈;23~24 min,12%~15%乙腈;24~30 min,15%乙腈;30~31 min,15%~21%乙腈;31~48 min,21%乙腈;48~53 min,21%~34%乙腈;53~63 min,34%乙腈;63~64 min,34%~100%乙腈;64~69 min,100%乙腈;体积流量3.0 mL/min;进样量60 μL,检测波长270 nm。色谱图见图2。
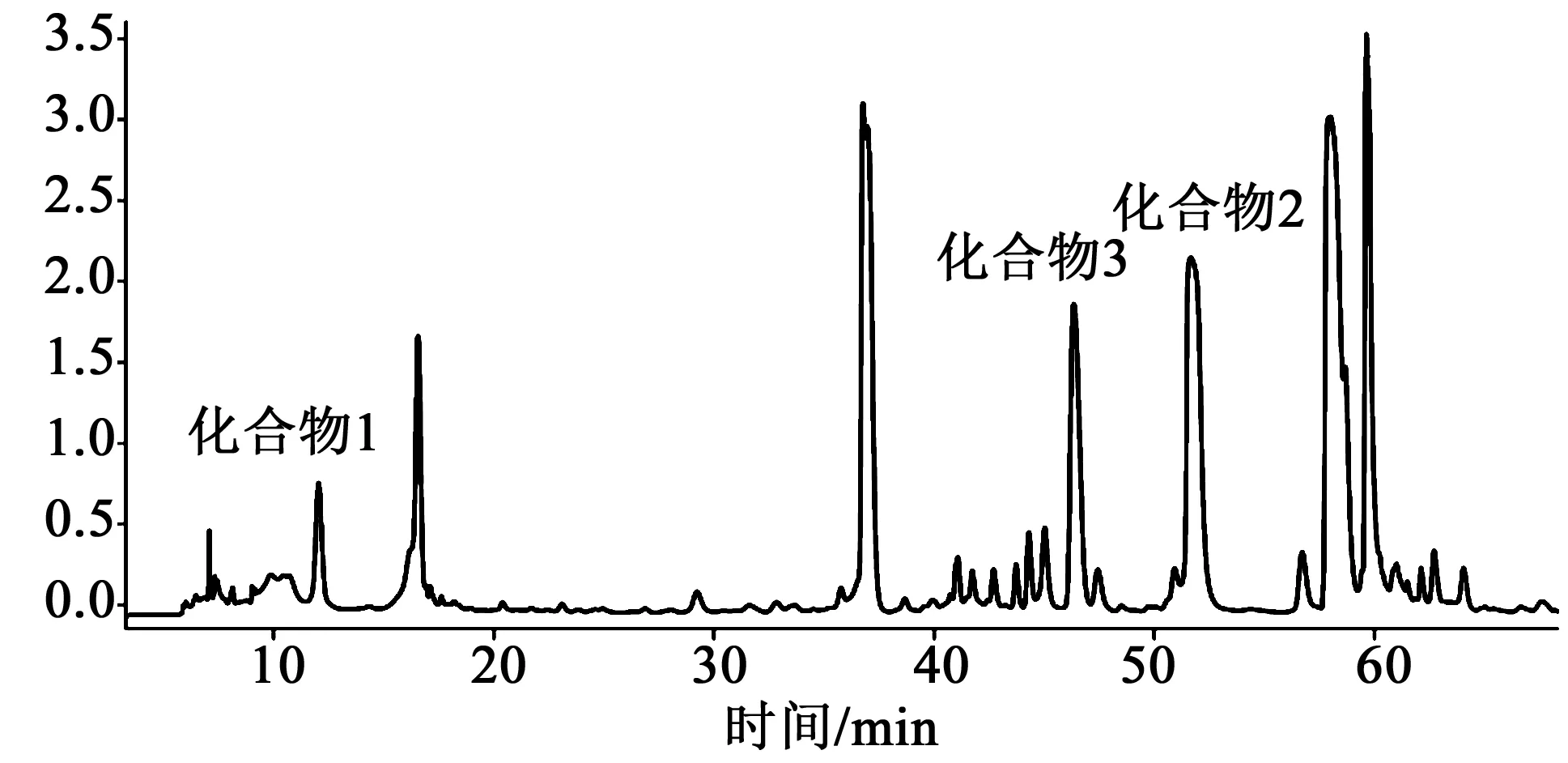
图2 样品制备高效液相色谱图Fig.2 Chromatogram of the crude methanol extract by HPLC
2.2 化合物纯度检测
纯度检测梯度条件同上,采用Agilent 1120 型高效液相色谱仪,色谱柱为纳微Nano-Micro C18柱(250 mm×4.6 mm,5 μm),体积流量1.0 mL/min;进样量10 μL,检测波长270 nm,化合物纯度均大于95%。色谱图见图3。

图3 单体化合物高效液相色谱图Fig.3 HPLC chromatograms of compound 1~3
3 结构鉴定
化合物1:无色粉末。ESI-MSm/z: 333 [M + H]+。1H NMR (DMSO, 600 MHz): δH7.00 (2H, s, H-2, 6), 5.50 (1H, d,J= 8.0 Hz, Glc-1′), 3.14~3.67 (6H, m, Glc-2′-6′);13C NMR (DMSO, 150 MHz):δC119.18 (C-1), 109.47 (C-2, 6), 146.09 (C-3, 5), 139.48 (C-4), 94.89 (Glc-1), 73.04 (Glc-2), 78.29 (Glc-3), 69.96 (Glc-4), 77.03(Glc-5), 61.02(Glc-6)。以上数据与文献[13]报道对照基本一致,故鉴定化合物为1-O-galloyl-β-D-glucose。
化合物2:无色粉末。ESI-MSm/z: 941 [M + H]+。1H NMR (DMSO, 400 MHz):δH6.37 (1H, d,J= 8.2 Hz, Glc-1), 5.95 (1H, t,J= 9.6 Hz, Glc-3), 5.46 (2H, m,Glc-1-2,4), 4.59 (1H, d,J= 9.6 Hz, Glc-5), 4.32 (2H, brs, Glc-6);13C NMR (DMSO, 150MHz): δC92.16 (Glc-1), 71.01 (Glc-2), 72.38 (Glc-3), 68.17 (Glc-4), 72.57 (Glc-5),61.86 (Glc-6), 117.73(G1-1),109.51 (G1-2, 6),146.18 (G1-3, 5),140.25 (G1-4),164.44 (G1-7), 118.52(G3-1),109.19(G3-2, 6), 145.88 (G3-3, 5),139.45 (G3-4), 165.93 (G3-7),118.35(G2-1), 109.37(G2-2, 6), 145.96 (G2-3, 5),139.69 (G2-4), 165.29 (G2-7), 118.50(G4-1),109.27(G4-2, 6),146.00 (G4-3, 5), 139.66 (G4-4),165.07 (G4-7),119.33(G6-1),109.24(G6-2, 6), 146.06 (G6-3, 5), 139.31 (G6-4), 164.94 (G6-7)。以上数据与文献[14]报道对照基本一致,故鉴定化合物为1,2,3,4,6-Trigalloyl-β-D-glucose。
化合物3:白色粉末。ESI-MSm/z: 611 [M + H]+。1H NMR (DMSO, 400 MHz):δH6.45 (1H, d,J= 1.8 Hz, H-6), 6.80 (1H, d,J= 1.8 Hz, H-8), 8.07 (2H, d,J= 9.0 Hz, H-2′, 6′), 7.33 (2H, d,J=9.0 Hz, H-3′, 5′), 5.49 (1H, d,J= 7.3 Hz, Glc-1),5.08 (1H, d,J= 7.3 Hz, Glc-1′), 3.08-3.55 (14H, m, Glc-2-6, Glc′-2-6);13C NMR (DMSO, 100MHz):δC157.30 (C-2), 133.95 (C-3), 178.11 (C-4), 161.33 (C-5), 100.22 (C-6), 163.30 (C-7), 94.94 (C-8), 160.62 (C-9), 106.14 (C-10), 121.23 (C-1′), 131.46 (C-2′, 6′), 115.63 (C-3′, 5′), 156.49 (C-4′), 101.20 (Glc-1), 74.69 (Glc-2), 76.91 (Glc-3), 70.39(Glc-4), 78.01(Glc-5), 61.31(Glc-6), 99.83 (C-1‴), 73.56 (C-2‴), 76.91 (C-3‴), 70.07(C-4‴), 77.64(C-5‴), 61.11(C-6‴)。以上数据与文献[15]报道对照基本一致,故鉴定化合物为kaempferol-3,7-di-O-β-D-glucopyranoside。
4 结果与讨论
为了全面了解凤丹牡丹花化学成分,前期我们对其进行了系统的成分分离,采用方法为硅胶、聚酰胺等进行粗分,再以Sephadex LH-20、中压制备、高效液相色谱等分离得到单体化合物的常规方法[3-4],但是在分离中并未得到鞣质类化合物。说明由于鞣质在硅胶和聚酰胺等分离材料中不易洗脱,损失极大,常规分离方法不适合于鞣质的分离。在前期研究的基础上,我们采用直接高效液相色谱制备的方法,有针对性地对鞣质类成分进行了分离,大大减少了鞣质的损失,并首次从凤丹牡丹花中分离得到鞣质类化合物。
[1]任崇勇, 程德海. 菏泽牡丹资源开发利用现状及发展对策 [J]. 现代农业科技, 2013, (22): 316.
[2] 江苏新医学院. 中药大辞典(上册) [M].上海:上海科学技术出版社, 1985:1130.
[3]国家卫生计生委.关于批准祼藻等8种新食品原料的公告(2013年第10号)[EB/OL].[2016-04-03].http://www.moh.gov.cn/sps/s/s7890/201311/533ed 8492dd04ff3aa63c7e7dd40c256.shtml.
[4] 闫慧娇, 赵伟, 耿岩玲, 等.牡丹花化学成分研究 [J].天然产物研究与开发,2015,27 (12): 2056-2059.
[5] 赵伟, 耿岩玲, 崔莉, 等.牡丹花黄酮类化学成分研究 [J].中国现代中药,2016,18 (3): 303-306.
[6] 薛梅, 王立梅, 吴建芳, 等. 天山堇菜鞣质的提取及抗氧化活性研究 [J].时珍国医国药, 2011, 22(2), 371-372.
[7] 金哲雄, 齐典. 刺玫果鞣质预防肿瘤作用研究 [J].中华中医药学刊, 2007, 25(4): 647-648.
[8]武晓丹. 仙鹤草红外光谱分析及其鞣质抗肿瘤作用研究 [D].哈尔滨: 东北林业大学,2010.
[9]王伟, 杨晓玲, 樊海燕, 等. 微波辅助提取和田石榴皮籽中鞣质的工艺及其抑菌作用研究 [J]. 食品工业, 2012, 33(9): 40-43。
[10]张军峰, 谭健, 蒲蔷, 等. 青蒿鞣质抗病毒活性研究 [J]. 天然产物研究与开发,2004,16(4): 307-311。
[11]阎巧娟, 韩鲁佳, 江正强, 等. 老鹳草鞣质的提取工艺及免疫作用的试验研究 [J].中国农业大学学报, 2002, 7(6): 16-19.
[12]吕晓东, 杨胜, 齐春会, 等. 山茱萸鞣质活性部位对佐剂性关节炎人鼠免疫功能的影响 [J].中草药, 2004, 35(9): 1023-1026.
[13] 白秀秀, 夏广萍, 赵娜夏, 等. 张家界产莓茶中的酚性化学成分 [J].中药材, 2013, 36 (1): 65-67.
[14] LAVOIE S, OUELLET M,FLEURY P Y, et al. Complete1H and13C NMR assignments of a series of pergalloylated tannins [J].Magnetic resonance in chemistry,2016, 54(2): 168-174.
[15] 刘锐, 庾石山, 裴月湖. 楹树叶的化学成分 [J].中国中药杂志, 2009, 34 (16): 2063-2066.
Research on tannins and flavonoid from the flower petals ofPaeoniasuffruticosaAndr. cv. Fengdan
YAN Hui-jiao1, WANG Zhi-wei1, CHEN Yan-ping2,JIANG Jiao-Jiao3, CUI Li1, GENG Yan-ling1, WANG Xiao1*
(1.Shandong Analysis and Test Center,Shandong Key Laboratory Breeding Base of TCM Quality Control Technology,Jinan 250014,China; 2.School of Pharmaceutical Sciences, 3.Yantai Entry-Exit Inspection and Quarantine Bureau,Yantai 264000,China;Shandong University of Traditional Chinese Medicine,Jinan 250014,China)
∶In this paper, the chemical constituents from the flower petals ofPaeoniasuffruticosaAndr. cv. Fengdan were thoroughly studied, which were isolated and purified by HPLC, and identified by1H NMR、13C NMR and MS. Two gallotannins both 1-O-galloyl- β-D-glucose (1) and 1, 2, 3, 4, 6-Trigalloyl- β-D-glucose (2), as well as a flavonoid kaempferol-3,7-di-O- β-D-glucopyranoside (3) were isolated from the flower petals ofPaeoniasuffruticosaAndr. cv. Fengdan by HPLC methods. Compounds 1~3 were all obtained from the flowers ofPaeoniasuffruticosaAndr. cv. Fengdan for the first time, and Compounds 1~2 were also the tannins obtained from this genus for the first time.
∶PaeoniasuffruticosaAndr. cv. Fengdan; flower petals; gallotannins; flavonoid
10.3976/j.issn.1002-4026.2017.03.003
2016-08-01
山东省科学院青年基金(青基合字2015第2号);山东省自然科学基金三院联合基金(ZR2015YL012)
闫慧娇(1984-),博士,助理研究员,研究方向为天然产物分离纯化及活性。E-mail: yanhuijiao01@163.com
*通信作者,王晓,研究员,博士生导师,研究方向为天然产物化学及中药资源。E-mail: wangx@sdas.org
R284.1
A
1002-4026(2017)03-0012-05

