不同植物生长调节剂对栓皮栎嫩枝扦插的影响1)
杨庆春 李国雷
(省部共建森林培育与保护教育部重点实验室(北京林业大学),北京,100083)
不同植物生长调节剂对栓皮栎嫩枝扦插的影响1)
杨庆春 李国雷
(省部共建森林培育与保护教育部重点实验室(北京林业大学),北京,100083)
以栓皮栎7年生优势苗木半木质化枝条为材料,采用3种植物生长调节剂(吲哚丁酸(IBA)、萘乙酸(NAA)和生根粉1号(ABT1)),设置0.5、1.0、1.5 g·L-13个质量浓度,并用清水对照,调查插穗的不定根发生特征、根系发育效果、不同生根时期营养物质质量分数的动态变化。结果表明:不同植物生长调节剂对栓皮栎插穗不定根的发生和根系发育的影响差异显著。IBA处理插穗生根效果整体优于 ABT1和NAA;0.5 g·L-1处理对插穗生根影响较小,1.0、1.5 g·L-1处理不仅显著提高了插穗不定根发生和发育效果,还使插穗提前7~15 d生根;所有处理组合中,IBA质量浓度1.0 g·L-1处理插穗,不定根发生和根系发育效果最佳,不定根发生率、生根数、生根指数等生根指标最大,根系生物量、根系总长度、根系总表面积、根系总体积等根系发育指标也最高。IBA可以通过调控不同时期插穗基部可溶性糖质量分数、m(C)∶m(N)变化,影响不定根的形成。初步筛选IBA质量浓度1.0 g·L-1为当前栓皮栎嫩枝扦插繁殖最佳植物生长调节剂处理;根据营养动态变化,分析了插穗生根机理。
栓皮栎;嫩枝扦插;植物生长调节剂;不定根发生
栎属(Quercus)天然地理分布广泛,是温带和亚热带地区主要建群树种,在我国乃至世界范围的森林生态建设中发挥着重要作用[1]。传统栎属树种培育多以播种繁殖为主,然而栎类种子产量不稳定,水分和淀粉含量过高不耐贮藏且易发生虫蛀[2];种子中抑制物质,导致种子萌发延迟和出苗不整齐[3]。无性繁殖技术,不仅可以有效克服有性繁殖中基因重组产生的性状分离,快速、高效的固定母本优良性状,获得较高的遗传增益;还能在较短时间内实现良种快速繁育[1,4]。栎类无性繁殖,可以通过扦插、组织培养和体细胞胚胎发生予以实现[5-7]。组织培养和体胚发生培养过程较复杂,受母本基因型、外植体种类、培养条件等多因素影响,培养条件要求严格,尚不能大规模应用于生产[8-9];而扦插繁殖,操作相对简单、培养条件易控制、成活无性系表现出更快的生长速率,因此在生产中具有较广应用前景[4,10]。
插穗生根,与采穗母树年龄、穗条着生部位、促根剂的使用和扦插环境气候条件等多种因素有关[10-11]。栎类树种中多数种类属于难生根类型,常规措施下不定根发生困难,使用一定质量浓度的植物生长调节剂处理可以提高插穗内某些酶活性,调节内源激素的含量,加快细胞代谢,从而促进插穗生根[12]。同时,种间对促根剂的响应又存在显著差异[13],如何针对具体树种筛选出最佳的生长调节剂处理尤为重要。
栓皮栎(Quercusvariabilis)是栎类中典型的代表,在生态恢复、生物质能源开发、木材生产、城乡绿化等领域发挥着重要作用[14]。近年来,随着乡土树种在园林绿化中的大力开发,栓皮栎作为独特的彩叶树种也受到关注[15]。栓皮栎成年植株无性繁殖系数极低,关于栓皮栎扦插繁殖报道也较少。虽然胡婉怡等[16]以1年生苗木为材料进行扦插试验,但仅使用了生根粉处理,对生根机理尚未开展研究。本研究以栓皮栎早期选择的7年生优势苗木为母树材料,使用不同质量浓度的多种植物生长调节剂进行处理,在调查插穗生根的基础上分析了生长调节剂对插穗基部营养物质含量的影响,旨在探究栓皮栎插穗营养物质变化与根系形态建成之间的关系。
1 材料与方法
1.1 试验材料及处理
试验于2015年7月—2016年10月,在北京市昌平区大东流苗圃全光自动喷雾扦插温室进行。以7年生优势苗木为对象,采集当年生长势良好、无病虫害枝条修剪成长10~12 cm的插穗,每个插穗预留2~3片叶,每片叶剪去2/3,预留3个以上腋芽,上切口在距上端芽1 cm处平切,下切口距下端芽0.5 cm处斜切。
1.2 试验设计
扦插试验(2015年):采用完全随机区组设计。选用IBA、NAA(上海伯奥生物科技有限公司)和ABT1(中国林业科学研究院ABT研发中心1号生根粉)3种植物生长调节剂,设置0.5 g·L-1、1.0 g·L-1、1.5 g·L-13个质量浓度,以清水为对照(CK),每个区组10个处理,每处理50株插穗,3次重复。
营养物质质量分数测定(2016年):采用完全随机区组设计。设置对照和已知最佳生根组合(IBA质量浓度1.0 g·L-1)2个处理,每个处理插穗200株,3次重复。
1.3 扦插与管理
将制备好的插穗,先用质量浓度为0.5 g·L-1的多菌灵溶液消毒5 min,再用蒸馏水洗净,将插穗基部在配制好的植物生长调节剂中处理10 s,待下切口溶液自然风干后立刻插入(V(珍珠岩)∶V(蛭石)=1∶1)混合基质中,株行距5 cm×5 cm;扦插完成后,开启全自动间歇喷雾系统喷水增加湿度,遮阳网调节光照强度,每周喷施1次多菌灵溶液对基质和周围环境进行消毒。
1.4 生根指标和营养物质测定
生根指标测定:扦插后,每7 d观察1次插穗生长情况,记录生根进程。9月下旬对各处理插穗进行不定根发生率、最长根长、不定根数、平均根长、生根指数等生根指标进行调查。生根指数的计算方法参照牟洪香[17]的方法,生根指数=生根率×不定根数×平均根长,平均根长指单株扦插苗的平均总根长。
根系发育指标测定:11月下旬,每种处理各取6株成活苗木,剪去地上部分,去离子水冲洗干净后,采用Epson数字化扫描仪(Expression10000XL1.0,Japan 110)快速进行扫描;然后用WinRHIZO根系图像分析软件(加拿大RegentInstruments公司)对扫描图像进行定量分析;扫描后,根放入烘箱65 ℃烘干至恒质量(48 h),测定生物量干质量(精确至0.01 mg)。
营养物质测定:生根过程中,每7 d从各处理随机选取20株成活插穗,用清水冲洗掉根系周围基质,将插穗基部2 cm韧皮部剥下,混合均匀,用恩酮比色法[18]进行可溶性糖测定、凯氏定氮法[19]测定总氮质量分数。
1.5 数据处理
2 结果与分析
2.1 不同植物生长调节剂对栓皮栎插穗不定根形成的影响
2.1.1 栓皮栎扦插不定根形成特性
插穗形态观察发现:各处理扦插7 d均出现少量愈伤组织,随后愈伤组织不断出现、生长。NAA质量浓度为1.5 g·L-1的处理在28 d首先出现不定根(见图1g),其它中、高质量浓度处理在35 d相继产生不定根(见图1c、图1d、图1f、图1i、图1j);对照和低质量浓度处理,在42 d少量插穗出现白色芽状不定根(见图1a、图1b、图1e、图1h),未生根插穗愈伤组织逐渐褐化。生根统计发现:对照和0.5 g·L-1质量浓度的植物生长调节剂处理插穗较难生根,生根所需时间较长,根系结构较简单;插穗不定根发生,多集中于基部切口1.0 cm范围内;从不定根发生部位看,栓皮栎有愈伤诱导(见图1e)和皮部发生(见图1c)2种生根方式,且以皮部生根为主。
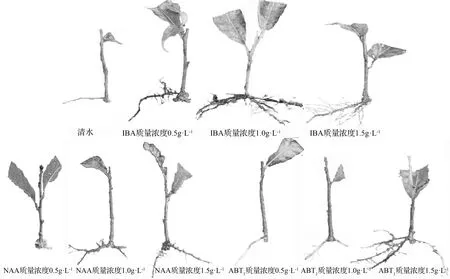
图1 不同植物生长调节剂处理的栓皮栎不定根发生效果
2.1.2 不同植物生长调节剂对栓皮栎插穗不定根发生率的影响
植物生长调节剂处理,对插穗不定根发生率具有极显著影响(P<0.001)。由表1可见:ABT1与NAA处理的插穗,不定根发生率随处理质量浓度的增加而提高,IBA处理的不定根发生率先升高后下降;相同质量浓度处理,不同植物生长调节剂不定根发生率变化一致,即从小到大依次为ABT1、NAA、IBA,除ABT1、NAA质量浓度为0.5 g·L-1外,其余各处理不定根发生率均显著高于对照。各处理组合中,IBA质量浓度为1.0 g·L-1处理,插穗不定根发生率最高(34.07%),比对照组提高了5.2倍。
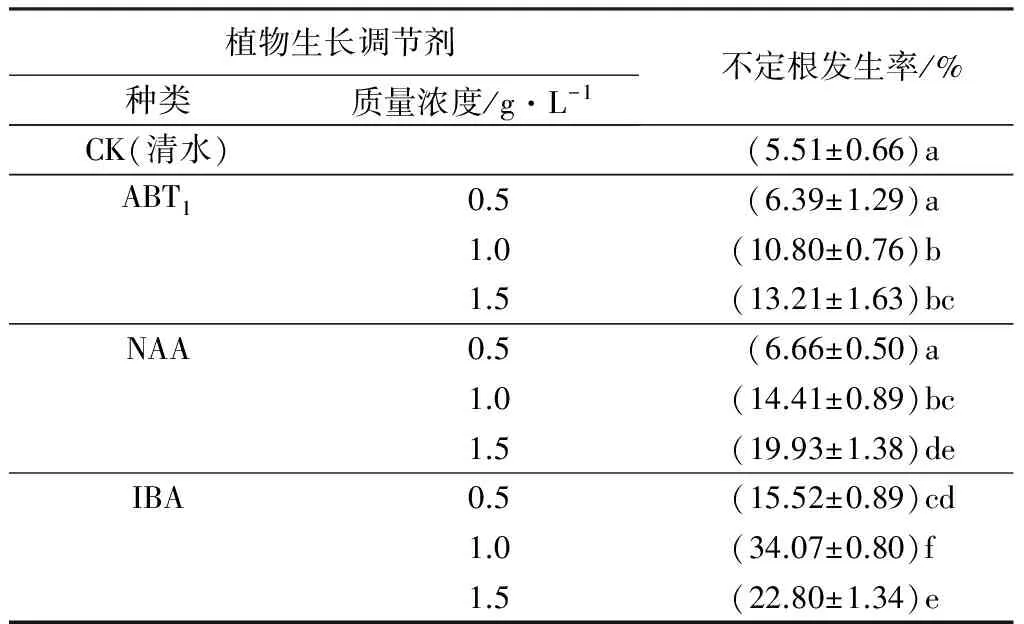
表1 不同植物生长调节剂处理的栓皮栎扦插不定根发生率
注:不定根发生率数据为平均值±标准差,同列不同字母表示差异显著(P<0.05)。
2.1.3 不同植物生长调节剂对栓皮栎插穗生根的影响
植物生长调节剂处理插穗的最长不定根长、平均根长、不定根数、生根指数,差异极显著(P<0.001)。从生长调节剂种类或质量浓度看,ABT1、NAA处理插穗,最长不定根长、平均根长、不定根数、生根指数随植物生长调节剂质量浓度的增加不断增大,其中,NAA处理插穗的最长不定根长、平均根长,高于IBA、ABT1处理;IBA处理,各指标参数值先增加后减小,不定根数和生根指数优于ABT1、NAA处理(见表2)。从处理组合看,IBA质量浓度为1.0 g·L-1处理插穗,不定根数和生根指数达到最大值,分别为5.31条/穗、10.06,综合生根效果最佳;NAA质量浓度为1.5 g·L-1处理插穗,最长不定根长、平均根长最大,分别为12.08、8.73 cm,但根数较少,生根指数较低。
2.1.4 不同植物生长调节剂对栓皮栎插穗根系发育的影响
不同植物生长调节剂对插穗根系生物量、根系总长、根系总表面积、根系总体积的影响,差异极显著(P<0.001)。从生长调节剂种类或质量浓度看,ABT1、NAA处理苗木,根生物量、根系总长、根总表面积、根总体积等根系生长参数,随植物生长调节剂质量浓度的增加而持续增大;IBA处理各参数值先增加后减小,IBA处理插穗根系发育情况,明显优于其它处理,低质量浓度处理对插穗根系发育影响相对较小(见表3)。从处理组合看,IBA质量浓度为1.0 g·L-1处理的插穗,根生物量、根系总长、根系总表面积、根系总体积,显著高于其它各处理。
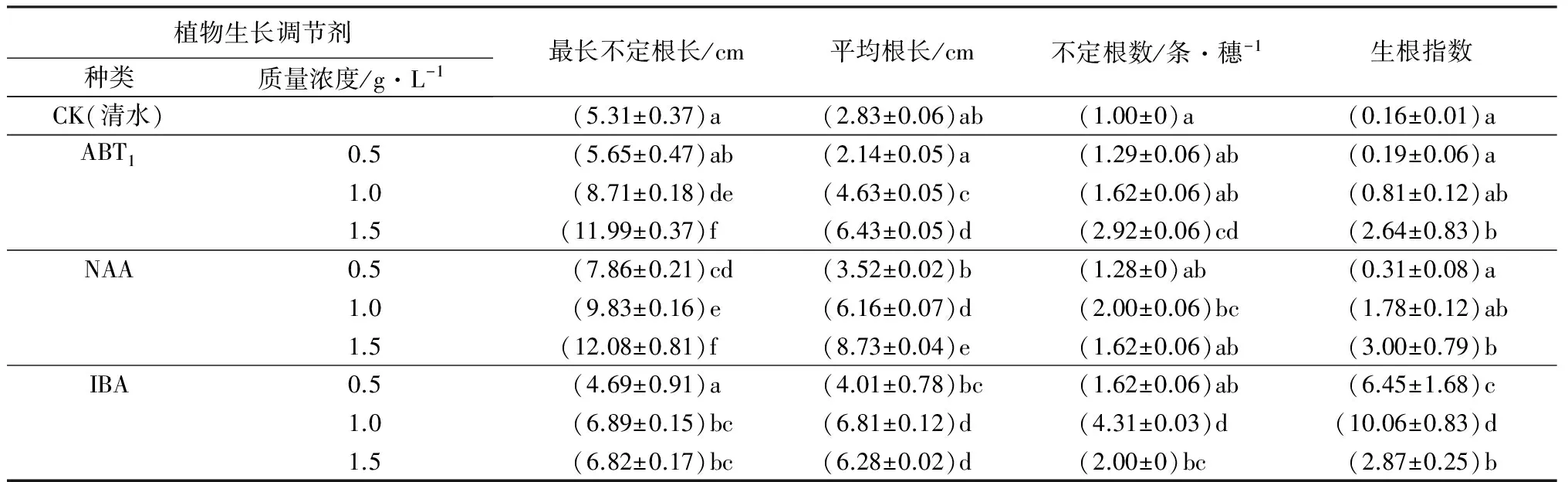
表2 不同生长调节剂对栓皮栎插穗生根质量影响的多重比较
注:表中数据为平均值±标准差,同列不同字母表示差异显著(P<0.05)。
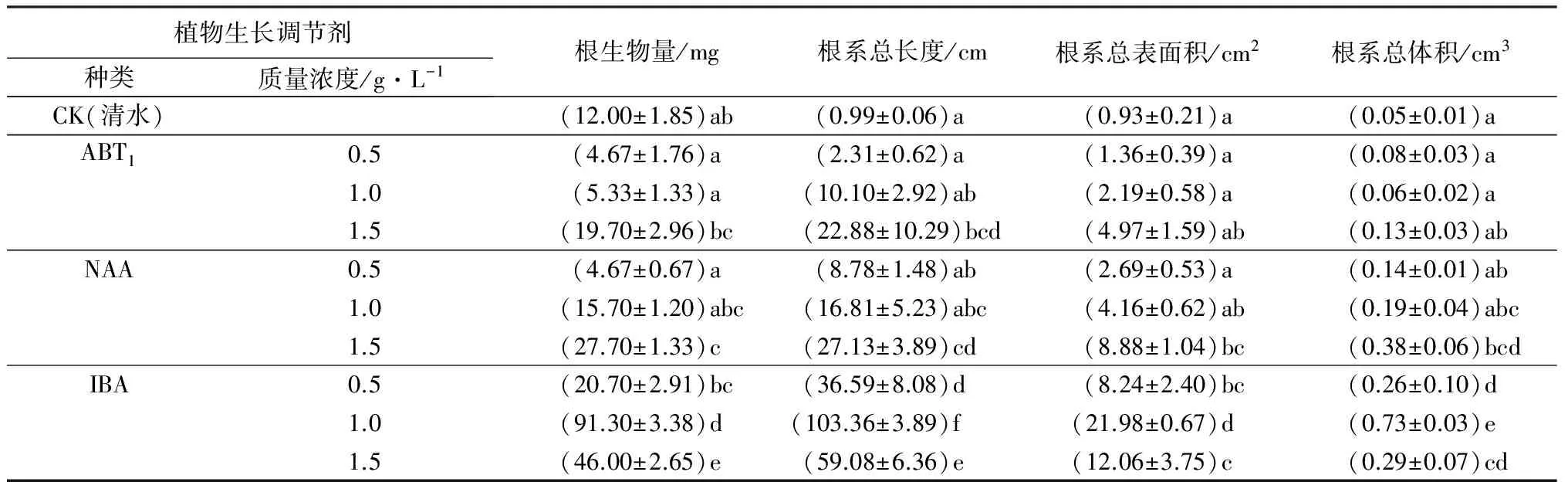
表3 不同植物生长调节剂处理的栓皮栎插穗根系发育情况
注:表中数据为平均值±标准差,同列不同字母表示差异显著(P<0.05)。
2.2 栓皮栎插穗生根过程中营养物质的变化
生根过程可溶性糖测定结果表明:生根过程,IBA处理可显著提高插穗可溶性糖质量分数。愈伤组织形成期(0~7 d),插穗可溶性糖质量分数变化无明显差异;愈伤组织膨大和不定根诱导期(7~35 d),插穗可溶性糖质量分数持续增加,IBA处理在35 d达到最大值,之后随着不定根伸长生长开始下降,对照的插穗可溶性糖质量分数仍在缓慢增加(见表4)。
氮素化合物主要反映插穗生根过程中酶和激素含量的变化。由表4可见:生根过程中插穗全氮质量分数波动较小,在愈伤形成和膨大期逐渐升高,不定根诱导期开始下降。IBA处理对全氮质量分数影响不明显,两处理,插穗全氮质量分数整体都有所减少,IBA、CK处理,插穗全氮质量分数分别下降了13.1%、14.9%。
插穗m(C)∶m(N)在前7 d的愈伤组织形成初期,无明显变化;在7~35 d的愈伤膨大和不定根诱导期,IBA处理m(C)∶m(N)持续增大,根形成后下降,基本与可溶性糖的变化同步;对照处理,m(C)∶m(N)先下降后上升。在不定根诱导和生长过程中,IBA处理m(C)∶m(N)比显著高于对照(见表4)。
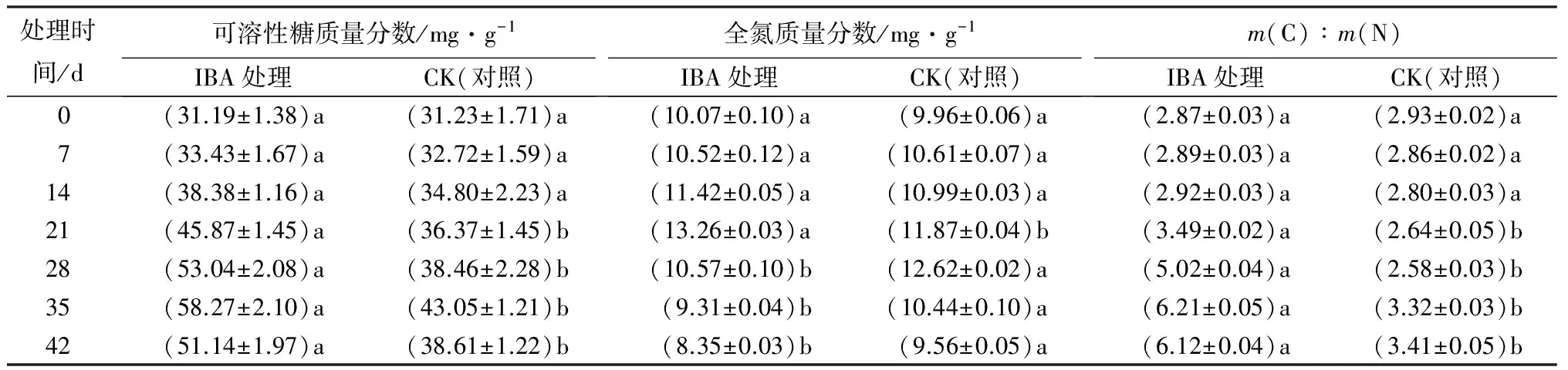
表4 IBA处理栓皮栎插穗生根过程中营养物质的变化
注:表中数据为平均值±标准差,同一营养物质中同行不同字母表示差异显著(P<0.05)。
3 讨论
植物扦插繁殖的关键在于不定根的形成,它受插条内外多种因素影响[10]。植物生长调节剂是当前调控难生根树种生根最常用的技术手段[12,20],它可以通过调节插穗细胞新陈代谢、增加组织再生能力、提高酶活性诱导根原基的发生[21]。但植物调节剂类型对木本植物扦插生根效果的影响存在差异,例如,NAA在大果沙棘扦插中,扦插生根效果显著好于IBA和ABT 2号生根粉[22];ABT 1号生根粉在麻栎和北美红栎的扦插中,促生根效果优于NAA、IBA和NAA+IBA组合[23-24]。本研究发现,IBA处理栓皮栎插穗,不仅在生根率、根数、生根指数等生根效果方面,优于NAA、ABT 1号生根粉,而且在根系生物量、总长度、总表面积、总体积等根系发育指标也持续占优势。此外,植物生长调节剂质量浓度,是影响不定根形成的另一关键因素。蒙古栎扦插过程发现,0.5 g·L-1处理有利于插穗生根,而质量浓度达到1.0 g·L-1则会抑制生根[25];在云锦杜鹃中,质量浓度为0.2、0.4 g·L-1处理插穗生根效果较好,当质量浓度为0.8 g·L-1时插穗生根率显著降低[27]。本研究中,0.5 g·L-1处理对插穗各生根指标影响较小,当用质量浓度为1.0、1.5 g·L-1处理可以显著提高插穗不定根发生效果,这与插穗不定根发生方式有关。清水和质量浓度0.5 g·L-1处理有利于插穗愈伤组织的诱导,但栓皮栎愈伤组织诱导不定根发生过程缓慢,生根效果不理想;质量浓度为1.0、1.5 g·L-1处理可以直接诱导不定根的发生,与栓皮栎插穗主要生根方式吻合,生根效果较好。目前,植物扦插繁殖的研究多集于调查插穗生根率、生根数、根长等不定根形成指标[21-26],对后续根系发育效果关注较少。本研究发现,IBA质量浓度为1.0 g·L-1处理插穗,不仅生根率、不定根数、生根指数等生根效果最佳,同时,根系生物量、根系总长度、根系总体积、根系总表面积等根系发育指标也优势明显,并形成了较为均匀的健壮根系。
插穗不定根形成过程需要消耗大量的营养物质,碳水化合物和含氮化合物是插条中营养物质的主要存在形式[27-28],两者的含量及其比值与不定根发生率存在明显的相关关系[29],营养物质含量的变化可以反映插穗营养消耗情况。本研究发现,IBA对插穗营养物质含量调配作用显著,主要通过调控插穗可溶性糖质量分数和m(C)∶m(N)变化,影响不定根的形成,与氮素含量关系不明显。同时发现,不同不定根形成阶段,营养物质消耗量不同。在愈伤形成期、不定根诱导期营养物质消耗较少,可溶性糖质量分数、m(C)∶m(N)净含量增加,此时愈伤组织细胞代谢活动旺盛,加速了插穗内淀粉向可溶性糖水解的速率[30]。不定根形成后,养分消耗增加,营养物质含量、m(C)∶m(N)下降,这主要受根系伸长生长过程营养物质需求量增加影响。
栓皮栎种内遗传变异丰富,早期子代家系间在树高、叶形等指标差异显著,大部分性状间存在相关关系[31],通过其表现型进行优良家系早期选择,为加快栓皮栎遗传改良进程提供了可能。本研究以7年生生长量和干形早期表现优良家系苗木为研究材料,初步筛选出IBA 1.0 g·L-1为栓皮栎扦插繁殖最佳植物生长调节剂组合,生根率可达34.07%,但仍有一定的提升空间,同时,对生根机理还需做进一步深入研究。
[1] 冯健.我国栎类遗传育种研究进展[J].辽宁林业科技,2015(1):43-47.
[2] 刘艳.几种北方落叶栎种子发育的形态生理及萌发特性研究[D].北京:北京林业大学,2013.
[3] 李庆梅,刘艳,刘广全,等.栎属7种植物种子的发芽抑制物质研究[J].生态学报,2013,33(7):2104-2112.
[4] 施季森,何祯祥.林木无性繁殖及其在遗传改良中的地位[J].世界林业研究,1994(1):25-30.
[5] CHALUPA V. Vegetative propagation of oak (QuercusroburandQ.petraea) by cutting and tissue culture[J]. Annales des Sciences Forestières,1993,50(Supplement):295-307.
[6] AMISSAH J N, PAOLILLO D, BASSUK N. Adventitious root formation in stem cuttings ofQuercusbicolorandQuercusmacrocarpaand its relationship to stem anatomy[J]. Journal of the American Society for Horticultural Science,2008,133(4):479-486.
[7] HERNANDEZ I, CELESTINO C, ALEGRE J, et al. Vegetative propagation ofQuercussuberL. by somatic embryogenesis. II. Plant regeneration from selected cork oak trees[J]. Plant Cell Reports,2003,21(8):765-770.
[8] CORREDOIRA E, SAN-JOSÉ M C, VIEITEZ A M. Induction of somatic embryogenesis from different explants of shoot cultures derived from young Quercus alba trees[J]. Trees,2012,26(3):881-891.
[9] 张存旭,张焕玲,贾小明,等.栓皮栎体胚的增殖、成熟和萌发[J].林业科学,2008,44(6):39-44.
[10] ROSIER C L, FRAMPTON J, GOLDFARB B, et al. Growth stage, auxin type, and concentration influence rooting of virginia pine stem cuttings[J]. Hort Science,2004,39(6):1392-1396.
[11] COPES D L, MANDEL N L. Effects of IBA and NAA treatments on rooting Douglas-fir stem cuttings[J]. New Forests,2000,20(3):249-257.
[12] HENRIQUE A, CAMPINHOS E N, ONO E O, et al. Effect of plant growth regulation in the rooting of pinus cuttings[J]. Brazilian Archives of Biology and Technology,2006,49(2):189-196.
[13] DREW J, DIRR M. Propagation ofQuercusL. species by cuttings[J]. Journal of Environmental Horticulture,1989,7(3):115-117.
[14] 周建云,林军,何景峰,等.栓皮栎研究进展与未来展望[J].西北林学院学报,2010,25(3):43-49.
[15] 李振卿,陈建业,李红伟,等.彩叶树种栽培与应用[M].北京:中国农业大学出版社,2011.
[16] 胡婉仪,涂炳冲.栓皮栎、麻栎、小叶栎、苦槠、石栎扦插繁殖简报[J].湖北林业科技,1992(2):35-36.
[17] 牟洪香.三倍体毛白杨优良无性系微体快速繁殖技术研究[D].泰安:山东农业大学,2003.
[18] 张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2003:127-130.
[19] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,2005:42-49.
[20] SWAMY S L, PURI S, SINGH A K. Effect of auxins (IBA and NAA) and season on rooting of juvenile and mature hardwood cuttings of Robinia pseudoacacia and Grewia optiva[J]. New Forests,2002,23(2):143-157.
[21] HUSEN A, PAl M. Metabolic changes during adventitious root primordium development in Tectona grandis Linn f(teak) cuttings as affected by age of donor plants and auxin (IBA and NAA) treatment[J]. New Forests,2007,33(3):309-323.
[22] 杨立学,王海南,范晶.母株年龄和生长调节剂对俄罗斯大果沙棘嫩枝扦插生根的影响[J].北京林业大学学报,2011,33(6):107-111.
[23] 唐罗忠,赵丹,田野,等.不同处理下的麻栎扦插成活率和内含物含量[J].福建林学院学报,2012,32(2):113-119.
[24] 丁彤,黄成林.北美红栎扦插繁殖技术的研究[J].安徽农业大学学报,2012,39(4):507-513.
[25] 黄秦军,李文文,丁昌俊.蒙古栎嫩枝扦插繁殖技术研究[J].西南林业大学学报,2013,33(1):27-33.
[26] 王书胜,单文,张乐华,等.基质和IBA浓度对云锦杜鹃扦插生根的影响[J].林业科学,2015,51(9):165-172.
[27] 赵晓敏,霍常富,沈海龙.影响林木插条生根的内部及环境因子研究综述[J].世界林业研究,2007,20(5):12-16.
[28] 王小玲,赵忠,高柱.四倍体刺槐插条不定根发生的营养物质变化[J].江西农业大学学报,2012,34(4):724-729.
[29] LIAO W B, XIAO H L, ZHANG M L. Effect of nitric oxide and hydrogen peroxide on adventitious root development from cuttings of groundcover chrysanthemum and associated biochemical changes[J]. Journal of Plant Growth Regulation,2010,29(3):338-348.
[30] HAMBRICK C E, DAVIES F T, PEMBERTON H B. Seasonal changes in carbohydrate/nitrogen levels during field rooting ofRosamultiflora‘Brooks 56’ hardwood cuttings[J]. Scientia Horticulturae,1991,46(1/2):137-146.
[31] 董海芳,张存旭.栓皮栎优树自由授粉子代遗传变异研究[J].西北林学院学报,2011,26(3):102-106.
Effects of Plant Growth Regulators on the Rooting of Softwood Cutting ofQuercusvariabilis//
Yang Qingchun, Li Guolei
(Key Laboratory for Silviculture and Conservation, Ministry of Education, Beijing Forestry University, Beijing 100083, P. R. China)//Journal of Northeast Forestry University,2017,45(6):12-16,46.
Quercusvariabilis; Softwood cutting; Plant growth regulator; Adventitious root development
1)“十二五”农村领域国家科技计划课题(2015BAD15B01),北京园林绿化落叶乔木优良品种选育及栽培技术(CEG-2015-01),北京市共建项目专项资助。
杨庆春,男,1990年11月生,省部共建森林培育与保护教育部重点实验室(北京林业大学),硕士研究生。E-mail:yangqc1127@163.com。
李国雷,省部共建森林培育与保护教育部重点实验室(北京林业大学),副教授,E-mail:glli226@163.com。
2017年2月23日。
S723.1+32;S482.8
责任编辑:张 玉。
Semi lignified branches of 7 a superior seedlings ofQuercusvariabiliswere subjected to three kinds of plant growth regulators (Indole butyric acid, naphthalene acetic acid, ABT No.1 rooting powder) with three contents of 0.5, 1.0 and 1.5 g·L-1, as well as to water as control. Adventitious root characteristics, root development and the dynamics of nutrient content in the varied rooting periods were explored. The plant growth regulator types significantly affected adventitious root initiation and development ofQ.variabilis. IBA yielded the most ideal effect for the rooting of cuttings. The 0.5 g·L-1treatment conferred minor effect on the rooting of cuttings. The 1.0 and 1.5 g·L-1treatments not only benefited adventitious root formation and development, but also hastened rooting fro 7-15 d. The combination of IBA with 1.0 g·L-1had the most advantageous to adventitious root formation and root development of cuttings. Cuttings treated with the combination had the greatest rooting rate, adventitious root number and root effective index. Also, it had the greatest root biomass, total root length, total root surface area and total root volume. The mechanisim of IBA promoting the formation of adventitious roots was that IBA effectively regulated the soluble sugar content and the mass ratio of C to N in various rooting stages. The current study trial provided IBA1.0 g·L-1as the the optimal plant growth regulator and concentration for the rooting ofQ.variabilis, and preliminarily revealed the rooting mechanism.

