基于SH片段的中国腮腺炎病毒疫苗株与野毒株鉴别方法的建立
肖芳,施勇,李健雄,龚甜,刘师文,熊英
(江西省疾病预防控制中心,江西南昌330029)
·论著·
基于SH片段的中国腮腺炎病毒疫苗株与野毒株鉴别方法的建立
肖芳,施勇,李健雄,龚甜,刘师文,熊英
(江西省疾病预防控制中心,江西南昌330029)
目的研究建立一种简便快速的鉴别中国腮腺炎病毒疫苗株与野毒株方法。方法在已扩增出的小疏水蛋白基因(small hydrophobic gene)(SH基因)上,寻找能将中国腮腺炎病毒疫苗株区别于野毒株的限制性内切酶酶切位点,并对逆转录-聚合酶链反应(Reverse Transcription-Polymerase Chain Reaction,RT-PCR)的方法进行特异性实验证明。结果非腮腺病毒RT-PCR结果均未见阳性条带,说明RT-PCR方法特异。PCR产物经BclI酶切作用后,腮腺炎野毒株将会被酶切为170bp和340bp两个片段,而疫苗株则被酶切为270bp和240bp两个片段。结论新建立的RT-PCR-RFLP是一种快速、简便的鉴别中国腮腺炎病毒疫苗株与野毒株的方法。
腮腺炎病毒;疫苗株;野毒株;逆转录聚合酶链反应;限制性片段长度多态性分析
腮腺炎病毒是一种不分节段、单负链的RNA病毒,它属于副粘病毒科腮腺炎病毒属。腮腺炎病毒基因组结构为:3’N-P-M-F-SH-HN-L-5’,分别编码以下蛋白:核壳蛋白(N),磷酸化蛋白(P),膜蛋白(M),融合蛋白(F),小疏水蛋白(SH),血凝素神经氨酸酶蛋白(HN)及大蛋白(L)。其中SH基因是整个腮腺炎病毒基因组中变异最大的部分,它常常被用作腮腺炎毒株型别及毒株间同源性分析[1]。2008年,我国将腮腺炎减毒活疫苗纳入国家免疫规划,18~24月龄接种1剂麻疹-腮腺炎-风疹联合减毒活疫苗或麻疹-腮腺炎联合减毒活疫苗。2009年江西省将腮腺炎纳入扩大免疫规划项目[2]。现阶段,中国使用的腮腺炎疫苗均为减毒活疫苗,且为A基因型,主要是S79株和Jeryl-lynn株[3]。目前,全球发现的腮腺炎病毒有12个基因型,但只有一个血清型[4]。通过血清学检测无法鉴定腮腺炎病毒的基因型别,也无法区分是疫苗株还是野毒株感染。江西省目前腮腺炎病毒流行株的基因型为F基因型[5],这与中国目前的优势基因型是一致的[6~9]。大多数国家都是依靠测序后序列分析的方法来鉴定腮腺炎病毒的基因型别及区分疫苗株还是野毒株[10]。但序列分析的方法受条件限制很难广泛开展,因此建立一种快速简便易操作的鉴别腮腺炎疫苗株与野毒株的方法非常必要。逆转录-聚合酶链反应-限制性片段长度多态性分析(Reverse Transcription-Polymerase Chain Reaction-Restriction FragmentLength Polymorphism,RT-PCRRFLP)技术具有简便、可操作性强、容易推广的优势。
1 材料与方法
1.1 材料实验所使用的流行性腮腺炎(腮腺炎)病毒、麻疹病毒、风疹病毒、流感病毒、水痘病毒均分离于江西省疾病预防控制中心病毒实验室,麻疹-腮腺炎-风疹联合减毒活疫苗(Measles,Mumps,Rubella Combined Attenuated Live Vaccine;MMR)(上海生物制品有限公司)为现在江西省预防接种所使用。
1.2 试剂QIAGEN RNeasy Mini Kit(生产批号:151042932);QIAGEN One Step RT-PCR Kit试剂盒(生产批号:151046825);BclI限制性内切酶(New England Biolabs公司,生产批号:6121305)。
1.3 方法
1.3.1 腮腺炎毒株的分离将抗生素处理过的腮腺炎病人咽拭子标本接种于已长成单层的Vero-Slam细胞上,每天观察细胞病变(CPE),连续观察7d,当>75%的细胞出现CPE时,冻融后-80℃冰箱保存。未产生CPE的细胞培养物反复冻融,如前培养盲传3代。
1.3.2 病毒核酸的提取提取所获得的出现CPE的细胞培养物核酸。取病毒细胞培养液200μl,采用德国QIAGEN公司的RNeasy Mini Kit提取,具体步骤参考产品说明书。
1.3.3 腮腺炎SH基因序列的扩增与测定
1.3.3.1 RT-PCR扩增SH基因及序列测定采用QIAGEN One Step RT-PCR Kit试剂盒对提取的培养物核酸进行MuV SH基因RT-PCR扩增。所用引物序列为[11]:SH 5-1 AATATCAAGTAGTGTCGATGA,SH 5-2 AGGTGCAAAGGTGGCATTGTC。反应条件为:60℃1min,42℃10min,50℃30mim,95℃15min,逆转录;94℃变性45s,55℃退火40s,72℃延伸1min,35个循环后,72℃延伸10min[12]。扩增后的PCR产物(约长500bp),经1.5%琼脂糖凝胶电泳鉴定后,PCR产物送至生工生物工程(上海)股份有限公司测定。
1.3.3.2 序列整理及分子生物学信息分析已测序的序列用DNAStar 5.0的Seqman进行序列的拼接,从GenBank基因数据库下载MuV各基因型的参考序列进行序列比对分析。采用Mega 4.0软件进行核苷酸和氨基酸同源性分析、系统进化树的构建及遗传距离的分析。
1.3.4 腮腺炎病毒野毒株与疫苗株鉴别RT-PCRRFLP方法
1.3.4.1 酶切反应的条件取上述PCR产物3μl、BclI限制性内切酶(New England Biolabs公司)0.45 μl、10×NEB缓冲液1μl、H2O 5.55μl。对照管为10μl PCR产物。将酶切管与对照管同时置于50℃水浴2h,腮腺炎野毒株将会被酶切为170bp和340bp两个片段,而疫苗株则被酶切为270bp和240bp两个片段。见图1。

图1 酶切图谱分析
1.3.4.2 电泳One-step RT-PCR扩增产物及RFLP酶切产物用2%的琼脂糖凝胶进行电泳检测后观察结果。
2 结果
2.1 病毒分离与鉴定咽拭子标本接种到Vero-Slam细胞上经盲传3代后,90%细胞出现融合病变,经RT-PCR方法鉴定为腮腺炎病毒,分离的腮腺炎毒株在约500bp处有一条清晰的条带,见图2。
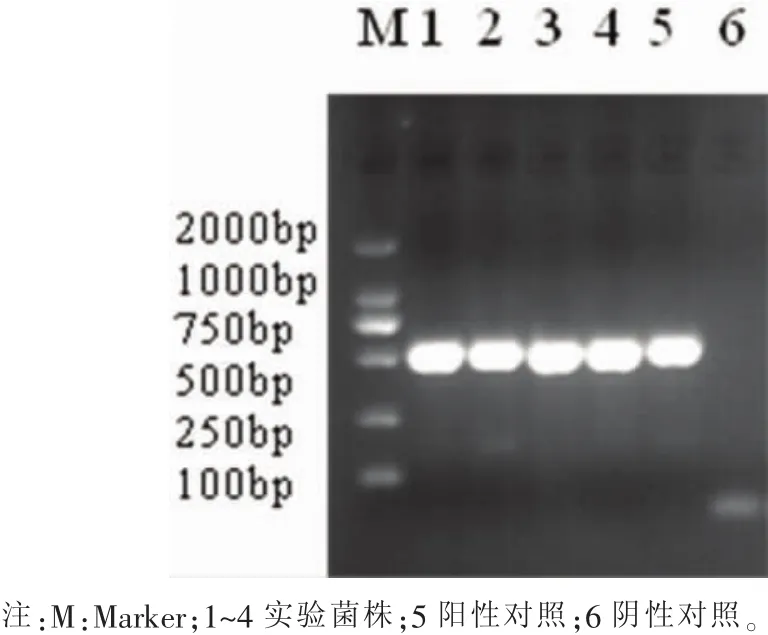
图2 RT-PCR结果
2.2 SH基因片段的序列测定结果将所获得的腮腺炎毒株SH基因的316个核苷酸片段与WHO提供的12个基因型的17株参考株相对应的核苷酸片段构建系统进化树,结果显示所分离的腮腺炎毒株与WHO提供的MuV F基因型参考株Z77160-WSH1-CNA96-F、Z77158-WLZ1-CNA95-F最为接近,并形成独立的分支,故分离株为F基因型。见图3。
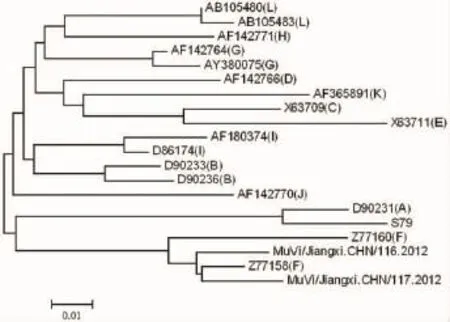
图3 系统进化树分析
2.3 腮腺炎病毒特异性检验对腮腺炎病毒、麻疹病毒、风疹病毒、流感病毒、水痘病毒进行RNA或DNA提取,经RT-PCR或PCR扩增,腮腺炎病毒核酸扩增为阳性,在500bp处呈现阳性电泳条带;非腮腺炎病毒的病毒核酸扩增为阴性,与之前预期的结果一致。见图4。

图4 腮腺炎病毒特异性检验结果
2.4 RFLP方法鉴别腮腺炎野毒株与疫苗株的结果经BclI限制性内切酶酶切后,分离到的腮腺炎病毒野毒株能被该酶切成170bp和340bp两个片段,而疫苗株则被酶切为270bp和240bp两个片段,由此来提示该毒株为腮腺炎野毒株。见图5。
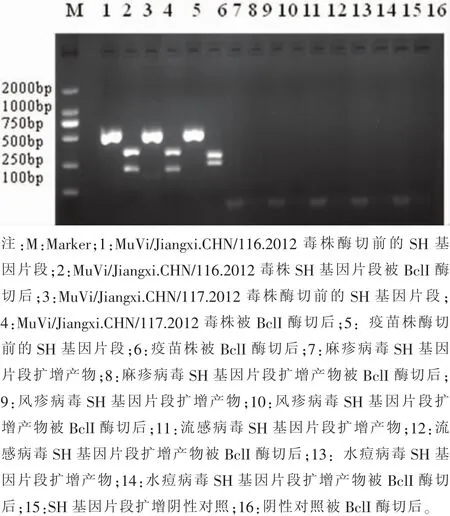
图5 BclI酶切前后的电泳图
3 讨论
儿童腮腺炎疫苗常规免疫在2008年以麻风腮三联苗的形式引入中国。如今使用的麻风腮疫苗中的腮腺炎疫苗株为S79株和Jeryl-lynn株。腮腺炎疫苗的使用大大降低了我国腮腺炎病毒的发病率,但也有研究显示,Jeryl-lynn疫苗株可引起与腮腺炎野毒株类似的中枢神经系统反应[13]。目前中国对MuV未形成系统的监测体系,国内还没有文献报道由于接种腮腺炎疫苗导致的脑膜炎,但在国外已有相关的报道[14,15]。因此,在接种腮腺炎疫苗后证明腮腺炎感染是疫苗株还是野毒株导致尤为重要。本研究中,根据我国现有腮腺炎野病毒基因型分布情况,建立了适用于我国的对腮腺炎病毒野毒株与疫苗株RT-PCR-RFLP快速鉴别方法。
小疏水蛋白SH基因在整个腮腺炎病毒的基因组蛋白中变异最大,全长316bp,编码57个氨基酸,功能尚不清楚,对病毒的复制是一种非必须蛋白,是腮腺炎病毒分型的依据[16]。有一项最新的研究认为SH蛋白可以作为一种信号途径特异性的阻断由肿瘤坏死因子-(TNF-)介导的细胞凋亡,是一种涉及逃逸宿主抗病毒反应的膜内蛋白[17]。目前,除了辽宁、福建、陕西在2011年发现了G基因型的腮腺炎病毒外,其余有文献报道的省份腮腺炎病毒的优势基因型仍是F基因型[18,19]。所以我们要区别腮腺炎野毒株和疫苗株主要是要区别F基因型与A基因型。许多作者都报道过Urabe株或Jeryl Lynn株的P、F、SH和HN基因处的核苷酸序列与野毒株不同[20-23]。我们在SH基因片段处用RFLP,一种简单、灵敏的方法从野毒株中区分疫苗株。腮腺炎病毒SH基因的核苷酸变异比较大,为316bp,本研究所利用的一步法RT-PCR具有较好特异性。利用所建立的RFLP方法对分离的MuV株与腮腺炎疫苗株SH片段PCR产物进行BclI酶切作用后,分离到的MuV毒株能被该酶切成170bp和340bp两个片段,而疫苗株则被酶切为270bp和240bp两个片段。腮腺炎病毒疫苗株与野毒株鉴别方法的建立,对腮腺炎疫苗纳入免疫规划后腮腺炎样病例的监测具有实际意义,对科学区分由接种MuV疫苗引起的相关病例和MuV野病毒感染引起的腮腺炎病例具有指导意义。本研究所建立的RT-PCR-RFLP方法是一种快速、简便,又经济实用的鉴别MuV株与腮腺炎野病毒株的方法,容易推广和普及。
[1]Jin L,Beard S,Brown DWG.Genetic heterogeneity of mumps virus in the United Kingdom:identification of two new genotypes[J].J Infect Dis,1999,180(3):829-833.
[2]毛向群,涂秋凤.2008-2012年江西省流行性腮腺炎监测疫情分析[J].首都公共卫生,2013,7(6):251-253.
[3]崔爱利,金俐,许文波.F基因型腮腺炎病毒全基因组基因特征分析[J].病毒学报,2013,29(6):602-607.
[4]崔爱利.流行性腮腺炎病毒的分子流行病学研究[J].中国计划免疫,2006,12(6):521-526.
[5]肖芳,施勇,龚甜,等.江西省流行性腮腺炎病毒基因特征分析[J].中国卫生检验杂志,2016,26(16):2288-2290.
[6]邓秀英,马福宝,陆培善,等.江苏省流行性腮腺炎病毒的基因特征分析[J].中国卫生检验杂志,2015,25(2):229-232.
[7]李平,李月玲,高建中,等.陕西省流行性腮腺炎病毒基因及抗体水平分析[J].中国公共卫生,2010,26(10):1300-1301.
[8]司源,马钰,李平,等.2011年陕西省流行性腮腺炎病毒株基因型别分析[J].中华疾病控制杂志,2014,18(2):176-177.
[9]王艳,马艳,韩悦,等.辽宁省2008~2011年流行性腮腺炎野病毒SH蛋白基因特征分析[J].病毒学报,2012,28(5):506-510.
[10]Forsey T,Mawn JA,Yates PJ,et al.Differentiation of vaccine and wild mumps viruses using the polymerase chain reaction and dideoxynucleotide sequencing[J].J Gen Virol,1990,71(Pt 4):987-990.
[11]崔爱利,朱贞,王常银,等.中国2006~2008年流行性腮腺炎病毒的基因特征分析[J].中国疫苗和免疫,2009,15(1):8-13.
[12]肖芳,李健雄,周珺,等.2013年-2014年江西省乙型流感病毒HA1基因特性分析[J].中国卫生检验杂志,2015,25(17):2943-2946.
[13]Nalin DR.Mumps,measles,and rubella vaccination and encephalitis[J].BMJ,1989,299(6709):1219.
[14]Gray JA,Burns SM.Mumps meningitis following measles,mumps,and rubella immunisation[J].Lancet,1989,2(8654):98.
[15]Murray MW,Lewis MJ.Mumps meningitis after measles,mumps,and rubella vaccination[J].Lancet,1989,2(8664):677.
[16]Jin L,Rima B,Brown D,et al.Proposal for genetic characterisation of wild-type mumps strains:preliminary standardisation of the nomenclature[J].Arch Virol,2005,150(9):1903-1909.
[17]Wilson RL,Fuentes SM,Wang P,et al.Function of small hydrophobic proteins of paramyxovirus[J].J Virol,2006,80(4):1700-1709.
[18]杨秀惠,管辉日,严延生,等.福建省一起流行性腮腺炎爆发的病毒分离及基因特征分析[J].中国疫苗及免疫,2013,19(1):43-46.
[19]王艳,马艳,郝爽,等.辽宁省2008~2014年流行腮腺炎病毒SH和HN基因特征分析[J].病毒学报,2016,32(2):179-184.
[20]Brown EG,Furesz J,Dimock K,et al.Nucleotide sequence analysis of Urabe mumps vaccine strain that caused meningitis in vaccine recipients[J].Vaccine,1991,9(11):840-842.
[21]Forsey T,Mawn JA,Yates PJ,et al.Differentiation of vaccine and wild mumps viruses using the polymerase chain reaction and dideoxynucleotide sequencing[J].J Gen Virol,1990,71(Pt 4):987-990.
[22]Katayama K,Oya A,TanabayashiK,etal.Differentiationof mumps vaccine strains from wild viruses by single-strand conformation polymorphism of the P gene[J].Vaccine,1993,11(6):621-623.
[23]Sugiura A,Yamada A.Aseptic meningitis as a complication of mumps vaccination[J].Pediatr Infect Dis J,1991,10(3):209-213.
The establishment of method for identifying China vaccine strains and wild strains of Mumps virus based on the SH fragment
XIAO Fang,SHI Yong,LI Jianxiong,GONG Tian,LIU Shiwen,XIONG Ying.
Jiangxi Provincial Center for Disease Control and Prevention,Nanchang 330029,China.
Objective To establish a simple and quick method for identifying China vaccine strains and wild strains of Mumps Virus.Methods To search the enzyme site in Small Hydrophobic gene of mumps virus for different domestic vaccine strains and wild strains of mumps virus and then to confirm the specificity of the RT-PCR method,and then to identify the RT-PCR product by RFLP.Results No positive bands can be found in the non-mumps virus strains,it means that the RT-PCR method has good specificity,the PCR products of China mumps vaccine strains of S79 and Jeryl-lynn were all cut into two fragments(270bp and 240bp)by BclI,but mumps wild virus strains were all cut into two fragments(170bp and 340bp)by BclI.Conclusion The RTPCR-RFLP method we established is a rapid and simple method for identifying China vaccine strain and wild strain of mumps virus.
∶Mumps virus;Mumps vaccine virus strain;Mumps wild virus strain;Reverse transcription-polymerase chain reaction;Restriction fragment length polymorphism
R373.1+6,R446.62
A
1674-1129(2017)03-0297-04
2016-10-31;
2017-04-20)
10.3969/j.issn.1674-1129.2017.03.002
江西省卫生厅科技计划(20111522)
肖芳,女,1984年生,硕士研究生,主管技师,从事病毒检验工作,E-mail:181272013@qq.com。
熊英,女,1968年生,硕士研究生,主任技师,研究方向为分子病毒检测,E-mail:18079125868@163.com。

