菲律宾蛤仔对三价和五价无机砷的富集转化规律
陈丽竹,王丹,曹瑞文,王清,赵建民,祝艳霞,吴惠丰
(1.中国科学院烟台海岸带研究所中国科学院海岸带环境过程与生态修复重点实验室,山东烟台264003;2.中国科学院大学,北京100049;3.宁波大学,浙江宁波315211)
菲律宾蛤仔对三价和五价无机砷的富集转化规律
陈丽竹1,2,王丹3,曹瑞文1,2,王清1,赵建民1,祝艳霞3,吴惠丰1
(1.中国科学院烟台海岸带研究所中国科学院海岸带环境过程与生态修复重点实验室,山东烟台264003;2.中国科学院大学,北京100049;3.宁波大学,浙江宁波315211)
砷是具有类金属特性的污染物,不同赋存形态的砷毒性差异极大,海洋贝类由于其生活习性易于富集高浓度的砷,本研究以菲律宾蛤仔(Ruditapes philippinarum)为对象,探讨其在亚砷酸盐(arsenite,AsⅢ)和砷酸盐(arsenate,AsⅤ)暴露14天后的生物富集和转化规律。结果表明,菲律宾蛤仔对砷的积累量随海水中无机砷浓度的升高而逐渐增加。但菲律宾蛤仔鳃组织对砷的生物利用度很低,10 μg/L暴露组菲律宾蛤仔鳃组织对砷的积累量与对照组相比无显著差异。菲律宾蛤仔对三价砷的生物利用度高于五价砷,且砷更易于在菲律宾蛤仔肝胰腺中积累。菲律宾蛤仔组织中无机砷转化过程主要包括As(Ⅲ)氧化,As(Ⅴ)还原和甲基转化。在对照组和各暴露组有机砷砷甜菜碱(AsB)和二甲基胂酸(dimethylarsinic acid,DMA)是主要赋存形态,一甲基胂酸(monomethylarsonic acid,MMA)在100 μg/LAs(Ⅴ)暴露处理后含量显著下降,表明在无机砷的限速转化反应中MMA可以较快地代谢或转化为其他赋存形态。无机砷在菲律宾蛤仔鳃组织中主要转化为DMA,肝胰腺中主要转化为AsB。以上研究结果为阐明菲律宾蛤仔的生物富集和转化机制提供了重要依据,同时也可为贝类安全养殖和食用提供一定理论依据。
菲律宾蛤仔;砷;富集;甲基转化
砷(As)及其化合物在自然界中广泛存在,作为一种有毒类金属,能够导致人类皮肤癌等多种癌症疾病,对人类健康产生严重威胁(Akter et al,2005;Jomova et al,2011)。近年来,随着矿石开采、含砷农药的使用以及工业“三废”的排放,我国近海砷污染现状严重,近海生物体砷含量超标现象时有发生。据报道,福建近海鲈鱼和真鲷体内无机砷最高含量达到2.8~4.5 μg/g(干重),已经超过我国食品卫生标准(1 μg/g)(Onsanit et al,2010;唐健等,2006)。近年来,渤海海水和软体动物体内砷最高含量分别达到3.44 μg/L和19.01 μg/g(湿重)(Gao et al,2014)。海洋砷污染还可以通过海洋生物的富集作用进入食物链,从而对人类健康产生威胁(Neff,1997)。
砷在自然界中具有多种赋存形态,不同形态砷化合物的毒性不同。一般研究表明,无机砷形式的亚砷酸盐和砷酸盐与有机砷形式相比具有高毒性和致癌性。然而,近年来研究表明甲基亚砷酸的毒性甚至高于亚砷酸盐(Akter et al,2005;Ventura-Lima et al,2011),因而阐明无机砷的富集转化规律对于揭示砷的毒性和健康风险具有重要意义。砷在海水和沉积物中主要以无机砷形式存在,而在海洋生物体内主要以砷甜菜碱(arsenobetaine,AsB)、砷胆碱(arsenocholine,AsC)、砷糖(arsenosugars,AsS)等有机砷形式存在(Fattorini et al,2004)。目前,已在微生物和哺乳动物中对无机砷转化规律开展了较为系统的研究(Qin et al,2006;Thomas et al,2007),发现无机砷在生物体内主要的转化过程是甲基化过程,包括砷酸盐的还原和亚砷酸盐的甲基化两个阶段(Aposhian et al,2004)。而在海洋软体动物中,有关不同组织中砷积累及形态转化的研究较少。目前研究表明,贻贝(Mytilus edulis)在100 μg/L无机砷暴露后对无机砷富集能力较弱(Gailer et al,1995),牡蛎(Saccostrea cucullata)对无机砷有较强的富集和转化能力(Zhang et al,2015)。菲律宾蛤仔(Ruditapes philippinarum)是我国沿海居民食用的主要海产品之一,而且是我国“贻贝监测计划”的主要指示生物之一,主要栖息在污染相对严重的滩涂或河口地区,已被大量用于海洋生态毒理学研究。本文主要研究不同浓度的亚砷酸盐和砷酸盐在菲律宾蛤仔肝胰腺与鳃组织中的积累与转化情况。本研究不仅对于阐明海洋软体动物对于不同价态无机砷的积累和转化规律具有重要意义,同时也可为贝类安全养殖和食用提供理论依据。
1 材料与方法
1.1 样品的采集
菲律宾蛤仔(壳长3~4 cm)购于烟台当地水产市场,实验室驯养10天后开始暴露实验。我国部分海域潮间带海水砷含量达到0.01 mg/L以上(张才学等,2011),模拟海洋环境最高砷浓度,并参考相关研究文献,4个暴露组分别采用10 μg/L、100 μg/L的As(Ⅲ)和As(Ⅴ)暴露菲律宾蛤仔14天,对照组使用干净过滤海水(定期取干净过滤海水检测海水中砷含量,海水中砷的本底值为1.150 ±0.226 μg/L,n=8),不添加无机砷,暴露结束后,采集对照组和暴露组菲律宾蛤仔的肝胰腺和鳃组织,并保存于-80℃超低温冰箱备用。
暂养和正式实验期间,实验动物养殖于曝气过滤海水中(13℃,31‰,pH 7.9),定时投食小球藻,滤食2 h后换水,每24 h完全换水一次。
1.2 总砷分析
将组织样品从超低温冰箱中取出,电热恒温鼓风干燥箱内烘干至恒重,称重。每个样品中加入1mL二次纯化的浓HNO3,80℃水浴加热至消解完全,冷却至室温,超纯水定容到10 mL,采用ICP-MS(PerkinElmer,Elan DRCⅡ,仪器型号,USA)测定分析重金属离子含量。每组采集6个平行样本,组织内重金属含量以μg/g干重表示。
1.3 不同赋存形态砷含量分析
不同形态砷含量检测方法参照Zhang等(2015)。即,称取菲律宾蛤仔冻干组织约0.05 g,加入5 mL 50%甲醇溶液(甲醇∶水=1∶1),组织匀浆机匀浆15 min后,10 000 rpm离心10 min取上清,重复以上步骤两次。提取的上清液50℃加热浓缩至1 mL后,加超纯水稀释至5 mL,0.45 μm过滤,使用HPLC-UV-HG-AFS(AF-610D2,Beifenruili Analytical Instument Corp,北京)进行砷形态分析。检测条件如下:阴离子交换柱:Hamilton PRP-X100(10 μm,250 mm×4.1 mm);流动相:20 mmol/L NH4HCO3,10 mmol/L KCl,pH 10.3;载流:10%(V/V)HCl;还原剂:2%的KBH4溶于0.2%(w/V)的KOH;氧化剂:2%(m/V)K2S2O8溶于0.5%(w/V)的KOH;屏蔽气:800 mL/min;载气:500 mL/min;光电倍增管电压:325 V;灯电流:100 mA。
1.4 数据统计分析
采用SPSS 16.0统计分析软件进行单因子方差分析(One-way ANOVA)和相关性分析(Pearson correlation),并采用Orign 8.0作图。
2 结果
2.1 组织中无机砷的富集
如图1和图2所示,在菲律宾蛤仔受无机砷暴露后,鳃和肝胰腺中砷的积累随着暴露浓度的升高均有增加,并且肝胰腺中总砷含量明显低于鳃组织。对鳃组织而言,仅100 μg/L As(Ⅲ)暴露组总砷含量与对照组相比显著升高(P<0.05,图1)。而在肝胰腺中,100 μg/L As(Ⅲ),10 μg/L和100 μg/L As(Ⅴ)暴露组总砷含量与对照组相比都显著增加(P<0.05,图2),由此可见,与鳃组织相比,砷更易于肝胰腺中累积。
如图3所示,肝胰腺中总砷含量与暴露浓度之间呈现显著的线性相关关系(P<0.05),总砷含量随暴露浓度升高逐渐增加。而在鳃组织中,仅As(Ⅲ)暴露组总砷含量与暴露浓度之间呈现显著的线性相关关系。且随着暴露浓度升高,As(Ⅴ)暴露组肝胰腺和鳃组织中总砷含量增加趋势相对As(Ⅲ)暴露组更为平缓,表明菲律宾蛤仔对三价砷的生物利用度高于五价砷。
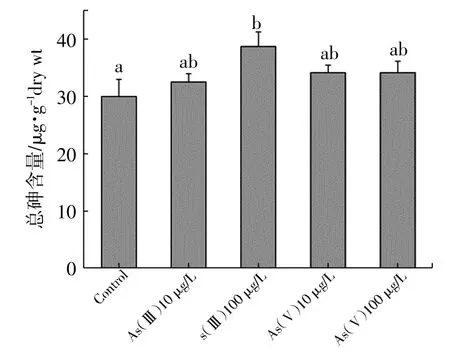
图1 菲律宾蛤仔暴露14天后鳃组织中总砷含量
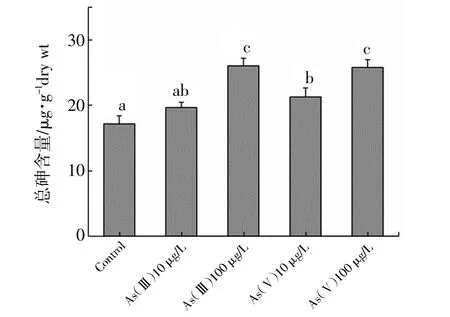
图2 菲律宾蛤仔暴露14天后肝胰腺中总砷含量
2.2 组织中无机砷的转化
表1和表2显示了无机砷暴露后菲律宾蛤仔组织中5种不同赋存形态砷含量。受无机砷暴露14天后,与对照组相比,100 μg/L As(Ⅴ)暴露组肝胰腺中As(Ⅴ)的含量显著升高(P<0.05),表明As(Ⅴ)进入组织后,尚未转化为有机砷的部分主要以As(Ⅴ)形式存在,仅有小部分还原成为As(Ⅲ)。100 μg/L As(Ⅴ)暴露组肝胰腺中一甲基胂酸(monomethylarsonic acid,MMA)含量也出现显著下降,表明MMA快速地代谢或转化为其他赋存形态。100 μg/L As(Ⅲ)和As(Ⅴ)暴露组鳃组织中二甲基胂酸(dimethylarsinic acid,DMA)和AsB含量显著增加(P<0.05),表明菲律宾蛤仔鳃组织可将无机砷经过一系列还原甲基化过程转化为毒性较小的DMA和AsB。
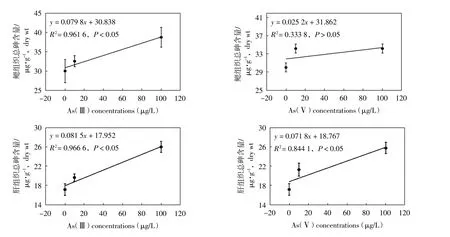
图3 菲律宾蛤仔暴露14天后组织中总砷含量(/μg·g-1,干重)与暴露浓度相关性分析

表1 无机砷暴露14天后菲律宾蛤仔鳃组织不同形态砷含量(/μg·g-1,干重)

表2 无机砷暴露14天后菲律宾蛤仔肝胰腺不同形态砷含量(/μg·g-1,干重)
图4显示了菲律宾蛤仔组织中五种砷形态占总砷百分比,其中AsB是最主要的赋存形态,其次为DMA。无机砷形态As(Ⅲ)和As(Ⅴ)占总砷比例均比较小,其中As(Ⅲ)占总砷百分比不超过2.02%,As(Ⅴ)占总砷百分比不超过5.70%。而且与对照组相比,各暴露组As(Ⅲ)和As(Ⅴ)占总砷比例没有显著变化,表明菲律宾蛤仔可以有效地将无机砷转化为有机砷。MMA占总砷比例不超过6%,与对照组相比,100 μg/L As(Ⅴ)暴露组鳃组织以及100 μg/L As(Ⅲ)和As(Ⅴ)暴露组肝胰腺中MMA所占比例均出现显著下降(P<0.05),再次表明菲律宾蛤仔对无机砷进行甲基转化,MMA可以快速地代谢或转化为其他赋存形态。
在对照组和各处理组鳃组织中AsB占总砷比例为50.42%~58.09%,DMA为33.05%~41.81%。100 μg/L As(Ⅴ)暴露组鳃组织中MMA显著下降(P<0.05),DMA含量上升,AsB含量也表现出一定的下降趋势。由此可见,在菲律宾蛤仔鳃组织中,无机砷主要转化为DMA。而在肝胰腺中,AsB占总砷百分比可达73.96%~79.52%,DMA仅为9.75%~15.23%。100 μg/L As(Ⅴ)处理组MMA含量显著下降,DMA也呈下降趋势,AsB含量显著增加(P<0.05),表明在肝胰腺中无机砷主要转化为AsB。以上结果表明,菲律宾蛤仔不同组织对无机砷的转化效率或策略不同。
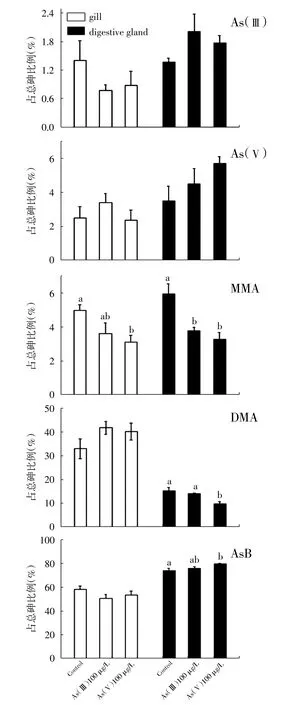
图4 无机砷暴露14天后菲律宾蛤仔鳃和肝胰腺组织中不同形态砷含量变化(%)
3 讨论
以浮游植物和大型藻类为食的海洋动物(比如软体动物,甲壳类,食草腹足类等)组织中通常都含有高浓度的砷(Neff,1997),例如,珠母贝Pinctada fucata(Katano et al,2003),螃蟹(Ruttens et al,2012),卡帕克斯马贻贝Modiolus capax(Gutiérrez-Galindo et al,1994)和美洲牡蛎Crassostrea virginica(Wilson et al,1992)。本研究也发现未经暴露菲律宾蛤仔组织中也含有高浓度的砷,鳃组织总砷达到30.01 μg/g(干重),肝组织总砷达到17.16 μg/g(干重)。但多数海洋动物对海水中无机砷生物利用度较低。Gailer等(1995)研究报道,与对照组贻贝Mytilus edulis组织中总砷含量(4.2~5.1 mg/kg(湿重))相比,在100 μg/L As(Ⅲ)和As(Ⅴ)暴露10天后贻贝组织中总砷含量分别为5.8和3.9 mg/kg(湿重),没有显著变化。Hunter等(1998)研究发现虾Crangon crangon在100 μg/L As(Ⅴ)暴露24天后组织中总砷含量与对照组相比没有变化。Zhang等(2012)研究发现,与对照组相比,花身鯻Terapon jarbua幼鱼在100 μg/L As(Ⅲ)和As(Ⅴ)暴露10天后体内积累的亦较少。同样,本研究也发现菲律宾蛤仔鳃组织在100 μg/L As(Ⅴ)暴露14天后总砷积累与对照组相比没有显著差异(图1),且肝胰腺和鳃组织中总砷含量增加趋势缓慢(图3)。以上研究表明无机砷的低生物利用度。此外,本研究发现菲律宾蛤仔对三价砷的生物利用度高于五价砷,这与Zhang等(2015)在僧帽牡蛎Saccostrea cucullata中的研究结果类似,表明三价砷可能比五价砷更易于代谢转化。
本研究表明,对照组和暴露组鳃组织中总砷含量皆高于肝胰腺,但总砷在肝胰腺中的积累比鳃组织更显著。其他研究人员也发现了类似的研究结果,Andersen等(1994)研究报道,As污染严重地区的青蟹Carcinus maenas鳃和外骨骼中总砷含量更高,蜗牛Hemifusus ternatanus(Neff,1997)鳃组织总砷含量亦高于其他组织。鳃组织直接与海水中As接触,可能主要以吸附而不是吸收的方式积累高浓度的砷,且易于排出或转运至其他组织。Langston(1984)发现将双壳贝类Serobicularia plana从As污染较重的地区转移至低污染区域,鳃组织中总砷浓度迅速下降,鳃组织中总砷的浓度会随周围环境砷浓度的变化而改变,而肝胰腺中总砷的浓度仍保持相对较高的水平,表明As与肝组织结合紧密,不易移除,能够在肝组织中不断积累。因此,与鳃组织相比,总砷更容易在菲律宾蛤仔肝胰腺中积累和富集。
已有研究表明,僧帽牡蛎(Zhangetal,2015)、日本青鳉Oryzias latips(Ohki et al,2002)和罗非鱼Tilapia mossambica(Ohki et al,2002)组织中总砷的积累随水体中砷暴露浓度的升高成比例增加。本研究发现,除As(Ⅴ)暴露组鳃组织中总砷的积累与水体中砷暴露浓度不成比例外,菲律宾蛤仔组织中总砷的积累与水体中砷暴露浓度呈现显著的线性相关关系。但也有研究报道沙蚕Arenicola marina(Geiszinger et al,2002)组织中总砷积累与海水中砷暴露浓度存在剂量效应,但不是以线性的方式增加。紫贻贝Mytilus galloprovincialis(Ünlü et al,1979)组织中总砷的积累与海水中砷浓度亦不成比例,在高浓度暴露时受到部分抑制。
在一些水生生物体内,无机砷的甲基化过程主要包括砷酸盐的还原和亚砷酸的甲基化两个阶段(Vahter,2002)。本研究发现,在菲律宾蛤仔体内不仅存在无机砷的还原甲基化过程,而且还存在As(Ⅲ)氧化为As(Ⅴ)的情况。在100 μg/L As(Ⅲ)暴露处理14天后,鳃组织中As(Ⅴ)含量与对照组相比增加了2倍(表1)。Zhang等发现僧帽牡蛎在1 mg/L As(Ⅲ)暴露30天后,组织中As(Ⅴ)含量增加20倍(Zhangetal,2015)。As(Ⅲ)氧化为As(Ⅴ)的情况在真核藻类Cyanidioschyzon sp.(Qin et al,2009)和淡水绿藻Chlamydomonas reinhardtii(Wang et al,2013)也有报道。而在As(Ⅴ)暴露处理后,鳃和肝胰腺组织中无机砷主要以As(Ⅴ)形式存在(表1,表2),仅有小部分以As(Ⅲ)形式存在。上述现象可能是菲律宾蛤仔的一种解毒方式,由于进入组织的无机砷超过了转化与排出的速率,而且As(Ⅲ)毒性高于As(Ⅴ)。因此,过多的无机砷以毒性较低的As(Ⅴ)贮存或隔离,再进行后续的还原甲基转化。
MMA是无机砷甲基转化的中间产物,在菲律宾蛤仔肝胰腺和鳃组织中所占比例低于6%。受砷暴露处理后,组织中MMA含量显著下降,表明在砷的限速转化反应中,MMA可以较快的转化为其他赋存形态。已有研究表明,僧帽牡蛎(Zhang et al,2015)、沙蚕Arenicola marina(Geiszinger et al,2002)、两种微生物Apiotrichum humicola和Scopulariopsis brevicaulis(Cullen et al,1994)中MMA代谢快于其他砷转化形态。AsB是大多数海洋动物组织中主要的赋存形态(Hanaoka et al,1988;Zhang et al,2013),也是无机砷转化代谢的主要终产物(Francesconi et al,1987;Francesconi et al,1994)。菲律宾蛤仔鳃和肝胰腺组织转化无机砷的效率存在差异,在鳃组织中无机砷主要转化为DMA,而在肝胰腺中主要转化为AsB,可见肝胰腺是砷甲基转化的重要场所(Vahter,2002)。这可能与参与无机砷转化相关的蛋白在肝组织中表达量更高有关,目前关于不同组织无机砷转化效率方面的研究报道尚少,需要进一步实验验证。
4 结论
菲律宾蛤仔受到高浓度无机砷暴露后,肝胰腺中砷含量显著增加,随暴露浓度成比例增加,且菲律宾蛤仔组织对As(Ⅲ)的生物利用率高于As(Ⅴ)。菲律宾蛤仔组织内无机砷转化主要包括As(Ⅲ)氧化,As(Ⅴ)还原和甲基转化。有机砷是菲律宾蛤仔组织中主要的赋存形态,MMA在暴露处理后含量显著下降,表明在无机砷的限速转化反应中MMA可以较快地代谢或转化为其他赋存形态。菲律宾蛤仔鳃和肝胰腺转化无机砷的效率存在差异,仍需要进一步验证。
Akter K F,Owens G,Davey D E,et al,2005.Arsenic speciation and toxicity in biological systems.Reviews of environmental contamination and toxicology,184:97-149.
Andersen J,Depledge M,1994.Arsenic accumulation in the shore crab Carcinus maenas:the influence of nutritional state,sex and exposure concentration.Marine Biology,118(2):285-292.
Aposhian H V,Zakharyan R A,Avram M D,et al,2004.A review of the enzymology of arsenic metabolism and a new potential role of hydrogen peroxide in the detoxication of the trivalent arsenic species. Toxicology and applied pharmacology,198(3):327-335.
Cullen W R,Li H,Hewitt G,et al,1994.Identification of extracellular arsenical metabolites in the growth medium of the microorganisms Apiotrichum humicola and Scopulariopsis brevicaulis.Applied organometallic chemistry,8(4):303-311.
Fattorini D,Alonso-Hernandez C M,Diaz-Asencio M,et al,2004.Chemical speciation of arsenic in different marine organisms:Importance in monitoring studies.Marine Environmental Research,58(2-5):845-850.
Francesconi K A,Edmonds J S,1987.Accumulation of arsenobetaine from seawater by the mussel(Mytilus edulis).Heavy metals in the environment,2:71-73.
Francesconi K A,Edmonds J S,Morita M,1994.Biotransformation of arsenic in the marine environment.ADVANCES IN ENVIRONMENTAL SCIENCE AND TECHNOLOGY-NEW YORK-,26:221-221.
Gailer J,Lrgolic K,Francesconi K A,et al,1995.Metabolism of arsenic compounds by the blue mussel Mytilus edulis after accumulation from seawater spiked with arsenic compounds.Applied organometallic chemistry,9(4):341-355.
Gao X,Zhou F,Chen C-T A,2014.Pollution status of the Bohai Sea:An overview of the environmental quality assessment related trace metals.Environment international,62:12-30.
Geiszinger A E,Goessler W,Francesconi K A,2002.The marine polychaete Arenicola marina:its unusual arsenic compound pattern and its uptake of arsenate from seawater.Marine environmental research, 53(1):37-50.
Gutiérrez-Galindo E,Muñoz G F,Celaya J V,et al,1994.Spatial and temporal variations of arsenic and selenium in a biomonitor(Modiolus capax)from the Gulf of California,Mexico.Marine pollution bulletin,28(5):330-333.
Hanaoka K I,Yamamoto H,Kawashima K,et al,1988.Ubiquity of arsenobetaine in marine animals and degradation of arsenobetaine by sedimentary micro‐organisms.Applied Organometallic Chem-istry,2 (4):371-376.
Hunter D,Goessler W,Francesconi K,1998.Uptake of arsenate,trimethylarsine oxide,and arsenobetaine by the shrimp Crangon crangon. Marine Biology,131(3):543-552.
Jomova K,Jenisova Z,Feszterova M,et al,2011.Arsenic:toxicity,oxidative stress and human disease.Journal of applied toxicology:JAT, 31(2):95-107.
Katano S,Matsuo Y,Hanaoka K i,2003.Arsenic compounds accumulated in pearl oyster Pinctada fucata.Chemosphere,53(3):245-251.
Langston W,1984.Availability of arsenic to estuarine and marine organisms:a field and laboratory evaluation.Marine biology,80(2):143-154.
Neff J M,1997.Ecotoxicology of arsenic in the marine environment.Environmental Toxicology and Chemistry,16(5):917-927.
Ohki A,Nakajima T,Maeda S,2002.Studies on the accumulation and transformation of arsenic in freshwater organisms I.Accumulation, transformation and toxicity of arsenic compounds on the Japanese Medaka,Oryzias latipes.Chemosphere,46(2):319-324.
Ohki A,Nakajima T,Maeda S,2002.Studies on the accumulation and transformation of arsenic in freshwater organisms II.Accumulation and transformation of arsenic compounds by Tilapia mossambica. Chemosphere,46(2):325-331.
Onsanit S,Ke C,Wang X,et al,2010.Trace elements in two marine fish cultured in fish cages in Fujian province,China.Environmental pollution,158(5):1334-1342.
Qin J,Lehr C R,Yuan C,et al,2009.Biotransformation of arsenic by a Yellowstone thermoacidophilic eukaryotic alga.Proceedings of the National Academy of Sciences of the United States of America,106 (13):5213-5217.
Qin J,Rosen B P,Zhang Y,et al,2006.Arsenic detoxification and evolution of trimethylarsine gas by a microbial arsenite S-adenosylmethionine methyltransferase.Proceedings of the National Academy of Sciences of the United States of America,103(7):2075-2080.
Ruttens A,Blanpain A C,De Temmerman L,et al,2012.Arsenic speciation in food in Belgium.Journal of Geochemical Exploration,121: 55-61.
Thomas D J,Li J,Waters S B,et al,2007.Arsenic(+3 oxidation state) methyltransferase and the methylation of arsenicals.Experimental biology and medicine,232(1):3-13.
Ünlü M,Fowler S,1979.Factors affecting the flux of arsenic through the mussel Mytilus galloprovincialis.Marine Biology,51(3):209-219.
Vahter M,2002.Mechanisms of arsenic biotransformation.Toxicology, 181:211-217.
Ventura-Lima J,Bogo M R,Monserrat J M,2011.Arsenic toxicity in mammals and aquatic animals:a comparative biochemical approach. Ecotoxicology and environmental safety,74(3):211-218.
Wang N-X,Li Y,Deng X-H,et al,2013.Toxicity and bioaccumulation kinetics of arsenate in two freshwater green algae under different phosphate regimes.Water research,47(7):2497-2506.
Wilson E,Powell E,Wade T,et al,1992.Spatial and temporal distributions of contaminant body burden and disease in Gulf of Mexico oyster populations:The role of local and large-scale climatic controls.Helgoländer Meeresuntersuchungen,46(2):201-235.
Zhang W,Guo Z,Zhou Y,et al,2015.Biotransformation and detoxification of inorganic arsenic in Bombay oyster Saccostrea cucullata. Aquatic toxicology,158:33-40.
Zhang W,Huang L,Wang W X,2012.Biotransformation and detoxification of inorganic arsenic in a marine juvenile fish Terapon jarbua after waterborne and dietborne exposure.Journal of hazardous materials,221-222:162-169.
Zhang W,Wang W X,Zhang L,2013.Arsenic speciation and spatial and interspecies differences of metal concentrations in mollusks and crustaceans from a South China estuary.Ecotoxicology,22(4):671-682.
唐健,李士敏,2006.浙江省沿海地区四种贝类中砷的形态及含量分布.环境化学,25(2):236-237.
张才学,孙省利,陈春亮,2011.湛江港附近海域潮间带海水,沉积物和贝类体内的重金属.广东海洋大学学报,31(1):67-72.
(本文编辑:袁泽轶)
Bioaccumulation and biotransformation of inorganic arsenic in Ruditapes philippinarum
CHEN Li-zhu1,2,WANG Dan3,CAO Rui-wen1,2,WANG Qing1,ZHAO Jian-min1, ZHU Yan-xia3,WU Hui-feng1
(1.Key Laboratory of Coastal Zone Environmental Processes and Ecological Remediation,Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences,Yantai 264003,China;2.University of Chinese Academy of Sciences,Beijing 100049,China; 3.Ningbo University,Ningbo315211,China)
Arsenic(As)is a ubiquitous toxic metalloid,and its toxicity depends greatly on its chemical speciation.Marine mollusks are apt to bioaccumulation of high arsenic contents because of their living habits.In this study,the bioaccumulation and biotransformation of the clam Ruditapes philippinarum were investigated after waterborne exposure to arsenite(As (Ⅲ))or arsenate(As(Ⅴ))for 14 days.The results showed that arsenic uptake increased with increasing arsenic concentration in the seawater,while gills of R.philippinarum showed the limited ability to bioaccumulate inorganic arsenic from seawater,with no significant difference compared with control group following waterbone 10μg/L As(Ⅲ)and As (Ⅴ)exposure for 14 days.The bioavailability of As(Ⅲ)was slightly higher than that of As(Ⅴ)to R.philippinarum,andarsenic was easier to be accumulated in digestive glands.The results demonstrated the As biotransformation in the clams included As(Ⅴ)reduction,As(Ⅲ)oxidation,and methylation.Arsenobetaine(AsB)and dimethylarsinic acid (DMA)was the major arsenic speciation in all treatments,while monomethylarsonic acid(MMA)contents decreased significantly after exposure,indicating that MMA can be quickly metabolized or converted into other arsenic speciation in the rate-limiting conversion reaction of inorganic arsenic.Inorganic arsenic in gills was mainly converted to DMA,but AsB in digestive glands,indicating the different transformation efficiency in different tissues.In summary,the results provided an important basis for elucidating the arsenic bioaccumulation and biotransformation mechanism in R.philippinarum and provided theoretical basis for shellfish breeding and food safety.
Ruditapes philippinarum;arsenic;bioaccumulation;biotransformation
Q179
A
1001-6932(2017)03-0326-08
10.11840/j.issn.1001-6392.2017.03.011
2016-03-15;
2016-04-07
国家自然科学基金(41206105);山东省自然科学杰出青年基金(JQ201310);中国科学院海洋生态与环境科学重点实验室开放基金(KLMEES201301)。
陈丽竹(1990-),硕士研究生,主要从事海洋生态毒理学研究。电子邮箱:lzchen@yic.ac.cn。
王清,副研究员。电子邮箱:qingwang@yic.ac.cn;吴惠丰,研究员。电子邮箱:hfwu@yic.ac.cn。
--先进无机材料论坛例记(Ⅰ)

