氟维司群联合依西美坦治疗绝经后激素受体阳性、非甾体类芳香化酶抑制剂耐药的复发转移性乳腺癌
郭运杰,井小会
(平顶山市第一人民医院肿瘤科,河南 平顶山 467000)
乳腺癌为女性最常见的恶性肿瘤,其中约2/3为激素受体(ER/PR)阳性,此类患者可能从内分泌治疗受益[1]。对于绝经后患者,90%以上的雌激素由雄烯二酮经芳香化酶的转化而来,此过程可以被芳香化酶抑制剂(AIs)阻断[2]。内分泌治疗耐药是此类患者治疗失败的主要原因,如何提高内分泌治疗的有效性及逆转内分泌治疗耐药是研究方向[3]。近年来的研究,包括内分泌治疗联合抗HER2治疗、抗血管生成治疗、哺乳动物雷帕霉素靶(mTOR)抑制剂、细胞周期依赖性激酶4/6(cyclin-dependent kinase CDK4/6)抑制剂等,一批新药应用于此类晚期乳腺癌[4-5]。对于非甾体类芳香化酶抑制剂(NSAIs)治疗后进展的患者目前没有最佳方案,可选择的药物有氟维司群、依维莫司、依西美坦等[5]。氟维司群作为一种抗雌激素药物,能够下调雌激素受体,理论上可以增强芳香化酶抑制剂的效果,国外关于AIs联合氟维司群的临床研究存在相互矛盾的结论[6-7]。本研究探讨依西美坦联合氟维司群作为二、三线治疗,在非甾体类芳香化酶抑制剂治疗后进展的绝经后激素受体阳性乳腺癌中的疗效。
1 资料与方法
1.1 一般资料
入组标准:绝经后经组织学证实的复发转移性乳腺癌患者,激素受体阳性(ER/PR至少一个阳性),单纯骨转移或无症状的内脏转移,NSAIs治疗后进展。既往接受NSAIs作为术后辅助治疗者需持续给药12个月以上,晚期患者NSAIs作为一线治疗者需连续用药6个月以上,KPS评分≥60分。排除标准:既往接受过依西美坦或氟维司群治疗,有症状的内脏转移,肿瘤进展速度快,肝肾功能不全。所有患者签署知情同意书。两组患者的基线特征相当:研究组和对照组的中位年龄为56.8岁和59.5岁,KPS评分≥80分的占35.8%和29.6%,确诊到首次复发/转移的中位时间为33.5个月和36.5个月,既往接受NSAIs作为辅助治疗的为15.6%和18.8%,HER2阳性者和16.8%及18.2%。
1.2 研究设计
选择于2014-10-10—2016-10-20间在我院收治的符合以上入组及排除标准的乳腺癌患者47例,采用随机数字表法随机分组。研究组(24例):d0、d14、d28分别予以氟维司群500 mg肌肉注射给药,此后每28 d为1周期,联合依西美坦2.5 mg/d;对照组(23例):依西美坦单药2.5 mg/d,直到病情进展或副反应不可耐受。所有患者均接受最佳支持治疗。如出现3级及以上不良事件需停药,直到恢复至≤1级。
1.3 疗效评价及不良反应评价标准
每6周复查影像学进行疗效评价。评价标准采用实体瘤疗效评价标准(RECIST 1.1),分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。客观缓解率(ORR)为CR+PR所占的比例。疾病控制率(DCR)为CR+PR+SD所占的比例。不良事件的分级采用美国国家癌症研究所常见毒性分级标准(NCI CTCAE v4.0)进行评价。主要终点为无进展生存(PFS),定义为从入组到疾病进展或死亡;次要终点为客观缓解率、疾病控制率及安全性。
1.4 统计学方法

2 结果
2.1 两组患者近期疗效比较
两组均无患者达到完全缓解,研究组和对照组的客观缓解率分别为16.7%和8.7%,差异无统计学意义(P=0.35)。疾病控制率分别为54.2%和21.7%,差异有统计学意义(χ2=5.23,P=0.02)。见表1。

表1 研究组和对照组的近期疗效
2.2 两组的不良事件及安全性分析
研究组和对照组的总体耐受性良好,均未见3级及以上不良事件。研究组有4例患者至少1次延迟氟维司群给药超过2周。研究组常见的1~2级不良事件分别为潮热(45.8%),关节疼痛(41.7%),嗜睡(37.5%),食欲下降(33.3%),腹泻(33.3%),便秘(29.2%),贫血(29.2);对照组常见的不良事件为嗜睡(43.5),潮热(39.1),关节疼痛(34.8),乏力(30.4%),食欲下降(26.1%),贫血(21.7%)。两组的不良事件差异无统计学意义。
2.3 随访及无进展生存
中位随访时间8.6个月(1.5个月~21.5个月),研究组的中位治疗时间6.2月,对照组中位治疗时间3.5个月。两组患者进展后根据耐受情况接受后续内分泌治疗或化疗。研究组中位PFS 6.5个月(95%CI=3.86~9.14),对照组3.0个月(95%CI=2.37~3.63),差异有统计学意义(χ2=4.07,P=0.044)。见图1。
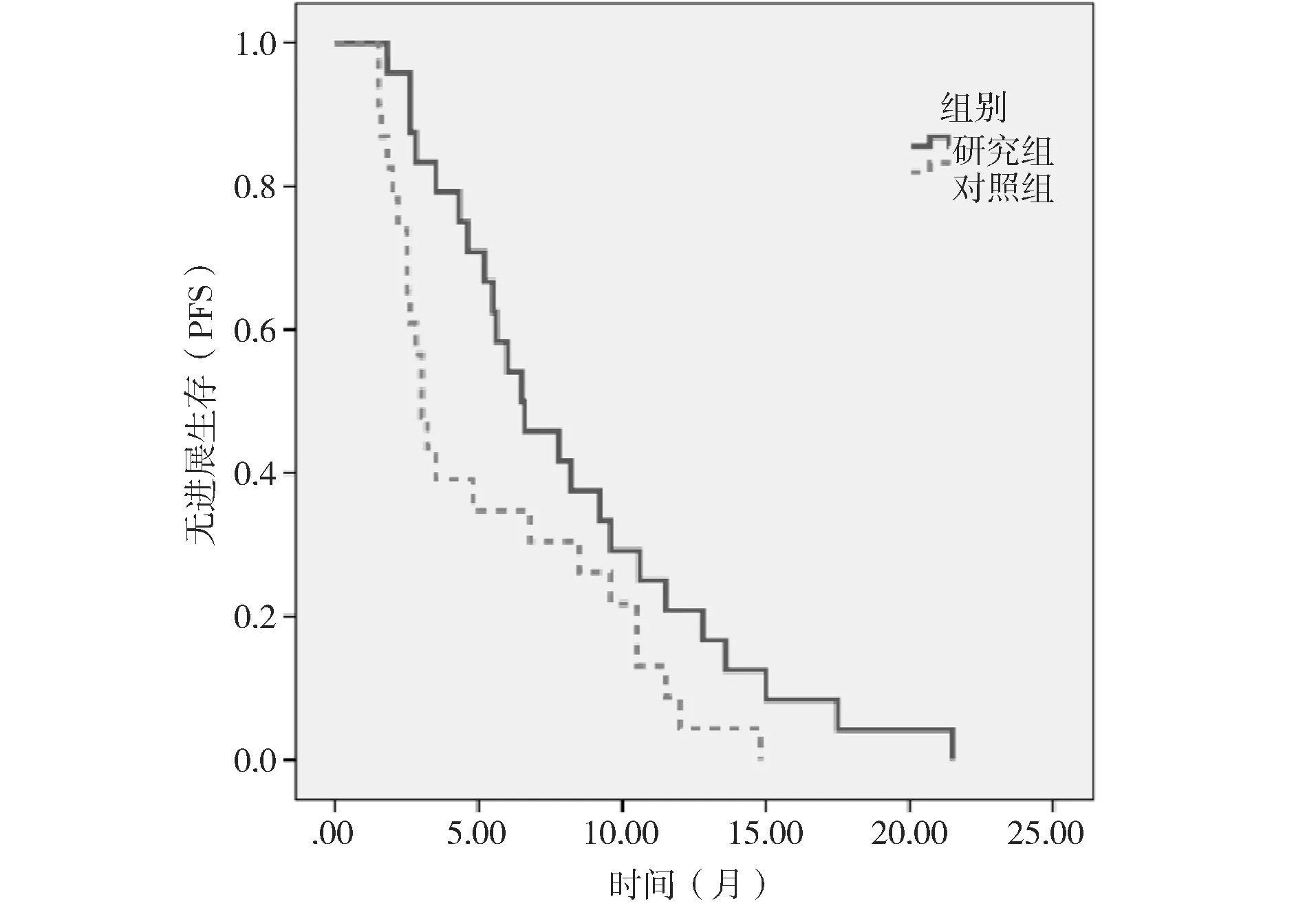
图1 两组患者的无进展生存(PFS)
3 讨论
有研究表明,对于非甾体类芳香化酶抑制剂(NSAIs)治疗后进展的患者,依维莫司联合依西美坦优于依西美坦单药,能显著提高无进展生存,而两种内分泌治疗药物联合是否优于单个无完全交叉耐药的内分泌药物尚不清楚[8-9]。临床前研究显示,低雌激素环境可增强氟维司群的疗效,在转染了芳香化酶的MCF-7细胞系中,氟维司群联合芳香化酶抑制剂比单药氟维司群或芳香化酶抑制剂效果更好[7]。
此次研究中,氟维司群联合依西美坦可延长中位PFS 3个月,差异有统计学意义,研究组的疾病控制率亦明显提高,表明氟维司群联合依西美坦可提高NSAIs治疗失败的晚期乳腺癌的疗效。在S0226研究中,氟维司群联合阿那曲唑作为激素受体阳性晚期乳腺癌的一线治疗,相对于安阿那曲唑单药可显著延长PFS(15Vs13.5月),表明氟维司群联合AI可进一步提高疗效[6]。SoFEA研究为一多中心的Ⅲ期临床研究,该研究中723例绝经后激素受体阳性、NSAIs进展的晚期乳腺癌患者随机接受氟维司群+阿那曲唑、氟维司群+安慰剂及依西美坦单药治疗,中位随访37.9个月,3组的中位PFS分别为4.4个月、4.8个月及3.4个月,差异无统计学意义[7]。我们注意到,该研究中氟维司群剂量为每月250 mg,而CONFIRM研究表明,氟维司群每月500 mg优于250 mg[10]。这可能是SoFEA研究得出阴性结果的原因之一。
我们在研究中发现,氟维司群联合依西美坦的耐受性良好,常见的不良事件如潮热、关节疼痛、嗜睡、食欲下降等的发生率同依西美坦单药比较差异无统计学意义。未发生3级及以上不良事件,无治疗相关死亡,显示氟维司群联合依西美坦的安全性良好,同既往研究数据基本一致[6-7,9]。
综上所述,氟维司群联合依西美坦可提高激素受体阳性、NSAIs耐药的绝经后晚期乳腺癌患者的PFS,并使肿瘤控制率显著提高。氟维司群联合依西美坦的总体耐受性及安全性良好。由于本研究的病例数相对较少,氟维司群联合依西美坦作为激素受体阳性、NSAIs治疗后进展的绝经后晚期乳腺癌的治疗选择值得进一步探索。
[1] TORRE L A,BRAY F,SIEGEL R L,etal.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65:87-108.
[2] 徐蓉,陈斌.乳腺癌内分泌药物治疗研究[J].黑龙江医学,2014;38(8):883-885.
[3] PALMIERI C,PATTEN D K,JANUSZEWSKI A,etal.Breast cancer:current and future endocrine therapies[J].Mol Cell Endocrinol,2014,382:695-723.
[4] CAREY L A,Perou C M.Palbociclib-taking breast-cancer cells out of gear[J].N Engl J Med,2015,373:273-274.
[5] GRADISHAR W,Anderson B,Balassanian R,etal.Invasive breast cancer version 1.2016,NCCN clinical practice guidelines in oncology[J].J Natl Compr Canc Netw,2016,14:324-354.
[6] MEHTA R S,BARLOW W E,ALBAIN K S,etal.Combination anastrozole and fulvestrant in metastatic breast cancer[J].N Engl J Med,2012,367:435-44.
[7] JOHNSTON S R,KILBURN L S,ELLIS P,etal.Fulvestrant plus anastrozole or placebo versus exemestane alone after progression on non-steroidal aromatase inhibitors in postmenopausal patients with hormone-receptor-positive locally advanced or metastatic breast cancer (SoFEA):a composite,multicentre,phase 3 randomised trial[J].Lancet Oncol,2013,14:989-98.
[8] YARDLEY D A,NOGUCHI S,PRITCHARD K I,etal.Everolimus plus exemestane in postmenopausal patients with HR(+) breast cancer:BOLERO-2 final progressionfree survival analysis[J].Adv Ther,2013,30:870-884.
[9] 高亚琳,杨逸雨,李靖若.晚期乳腺癌内分泌治疗现状及展望[J].中华乳腺病杂志,2016;10(1):54-56.
[10] DI Leo A,JERUSALEM G,PETRUZELKA L,etal.Results of the CONFIRM phase III trial comparing fulvestrant 250 mg with fulvestrant 500 mg in postmenopausal women with estrogen receptor-positive advanced breast cancer[J].J Clin Oncol,2010,28:4594-4600.

