血红素铁对妊娠母鼠繁殖成绩及组织铁调基因表达的影响
李美荃 张春勇 计乔平 陈克嶙 郭荣富
(云南农业大学动物科学技术学院,云南省动物营养与饲料重点试验室,昆明650021)
血红素铁对妊娠母鼠繁殖成绩及组织铁调基因表达的影响
李美荃 张春勇 计乔平 陈克嶙 郭荣富*
(云南农业大学动物科学技术学院,云南省动物营养与饲料重点试验室,昆明650021)
本试验旨在探索血红素铁与硫酸亚铁(FeSO4)对妊娠母鼠繁殖成绩,妊娠母鼠组织与胎鼠铁含量,妊娠母鼠组织铁调素(hepcidin)、膜铁转运蛋白(Fpn)、猫白血病病毒C亚类受体(Flvcr)、转铁蛋白受体1(Tfr1)、转铁蛋白受体2(Tfr2)、二价金属转运体1(DMT1)和血红素转运蛋白(HCP)表达的影响。随机选取2月龄体况接近的昆明小鼠母鼠80只,随机分为8组,分别为对照组、缺铁组、血红素铁组(15、60、90 mg/kg血红素铁)、FeSO4组(75、300、450 mg/kg FeSO4),每组10只。配种受孕起对照组饲喂正常饲粮(基础饲粮中添加400 mg/kg FeSO4);其他各组均饲喂基础饲粮,妊娠第10~13天注射40 mg/kg去铁胺(DFO),诱导妊娠母鼠缺铁模型;妊娠第14天血红素铁组和FeSO4组开始在基础饲粮中添加血红素铁或FeSO4,缺铁组不添加。试验期为妊娠后1~20 d。结果表明:1)60 mg/kg血红素铁组胎鼠重最高,极显著高于对照组与缺铁组(P<0.01)。2)60 mg/kg血红素铁组与450 mg/kg FeSO4组母鼠血液血红蛋白(HGB)含量、红细胞数(RBC)和红细胞容积(HCT)极显著高于缺铁组(P<0.01)。3)60 mg/kg血红素铁组胎鼠铁含量最高,极显著高于对照组与FeSO4组(P<0.01);450 mg/kg FeSO4组母鼠肝脏、脾脏和胎盘铁含量均为最高。4)90 mg/kg血红素铁组和450 mg/kg FeSO4组母鼠肝脏hepcidin表达量较高,极显著高于缺铁组与对照组(P<0.01);15 mg/kg血红素铁组母鼠肝脏Fpn、Tfr2表达量较高,极显著高于对照组和缺铁组(P<0.01);60 mg/kg血红素铁组母鼠肝脏Tfr1、Flvcr表达量较高,极显著高于对照组和缺铁组(P<0.01);75 mg/kg FeSO4组母鼠肝脏Tfr1表达量较高,极显著高于对照组和缺铁组(P<0.01)。5)缺铁组母鼠十二指肠Fpn、HCP、DMT1、Flvcr表达量均极显著高于对照组(P<0.01)。6)缺铁组母鼠胎盘Fpn、Tfr1、DMT1、Flvcr、HCP表达量极显著高于对照组(P<0.01);90 mg/kg血红素铁组和450 mg/kg FeSO4组母鼠胎盘hepcidin表达量较高,极显著高于缺铁组与对照组(P<0.01)。7)饲粮血红素铁添加量为61.00 mg/kg或FeSO4添加量为336.11 mg/kg时,胎鼠铁含量最高;饲粮血红素铁添加量为93.49 mg/kg时,母鼠肝脏铁含量最高。综合得出,母鼠饲粮中添加适宜量的血红素铁或FeSO4均可显著促进胎鼠增重,诱导母鼠靶组织铁调基因的表达,提高母鼠组织和妊娠20 d胎鼠机体铁含量;HCP和Flvcr在母鼠肠道对血红素铁吸收或胎盘转运起至关重要的作用,但肠道吸收或胎盘转运FeSO4主要以DMT1和Tfr2为主。
妊娠母鼠;血红蛋白;铁含量;铁调素;血红素铁
铁是动物必需的微量元素之一,缺铁或铁过量均影响仔猪健康和制约仔猪遗传潜力的充分发挥。目前,缺铁性贫血是新生仔猪面临的普遍问题。从妊娠母猪寻找新型、安全高效的有效铁源已成为改善母猪繁殖性能和促进新生仔猪生长发育的重要研究课题。白松涛[1]、赵惠君[2]研究报道,妊娠后期及哺乳期缺铁会严重导致婴幼儿生长不良。母体摄入的血红素铁与非血红素铁会影响新生儿肝脏储铁的含量。血红素铁是与血红蛋白(HGB)及肌红蛋白、脑红蛋白中的卟啉结合的铁,它以卟啉铁的形式直接被肠黏膜上皮细胞吸收。Cao等[3]采用同位素跟踪法证明铁的状态(血红素铁或非血红素铁)影响胎盘铁的转移,母体血清铁调素(hepcidin)含量及母体、初生儿铁的状态与母体摄入的血红素与非血红素铁密切相关,妊娠末期,母体摄入血红素铁可能更优先转移入胎儿。Furuyama等[4]研究报道,血红素在调节细胞信号通路和基因表达方面起重要作用。近十年研究显示,hepcidin在机体维持铁稳态中起着重要作用,其通过调节膜铁转运蛋白1(Fpn1)、二价金属转运体1(DMT1)、肠细胞色素b(Dcytb)、转铁蛋白受体1(Tfr1),协调和控制铁离子在细胞和内环境之间的转运[5-6]。hepcidin可以直接与膜铁转运蛋白(Fpn)作用,使其内化和降解,控制铁的输出[7]。现行仔猪的补铁方式尚需要进一步完善。迄今,血红素铁对新生仔猪补铁效应的研究鲜见报道。本试验以妊娠母鼠构建缺铁模型,研究血红素铁和FeSO4对妊娠母鼠繁殖成绩,妊娠母鼠组织与胎鼠铁含量,妊娠母鼠组织hepcidin、Fpn、猫白血病病毒C亚类受体(Flvcr)、Tfr1、转铁蛋白受体2(Tfr2)、DMT1和血红素转运蛋白(HCP)表达的影响,为探索新生仔猪有效补铁途径提供科学依据。
1 材料与方法
1.1 试验材料
血红素铁(由云南省动物营养与饲料重点实验室单胃动物营养研究室提供,从猪血液中提取,纯度为98%,血红素含量为20%,铁含量为2%,剩余成分为HGB、肽、氨基酸等);FeSO4、去铁胺(DFO)均为试剂级,购自美国Sigma公司。
1.2 试验设计
随机选取来源一致、健康、饲养方式相同和体重相近的2月龄昆明小鼠母鼠80只,单笼饲养,母鼠平均体重为32.15 g。每笼放入1只公鼠配种,母鼠受孕后,移除公鼠。妊娠母鼠随机分为8组,分别为对照组、缺铁组、血红素铁组(15、60、90 mg/kg血红素铁)、FeSO4组(75、300、450 mg/kg FeSO4),每组10只。配种受孕起开始饲喂,缺铁组、血红素铁组、FeSO4组母鼠均饲喂基础饲粮,妊娠期母鼠第10~13天注射40 mg/kg DFO,诱导缺铁模型,第14天血红素铁组和FeSO4组开始在基础饲粮中添加血红素铁或FeSO4,缺铁组不添加;对照组母鼠饲喂在基础饲粮中添加400 mg/kg FeSO4的正常饲粮[根据NRC(1995)标准]。试验期为妊娠后1~20 d。
1.3 饲粮配制与饲养管理
基础饲粮组成及营养水平见表1。在清洁动物房内,试验鼠单笼饲养于专用鼠代谢笼,环境温度在(24±1) ℃,相对湿度在40%~60%。自由饮食及饮水,自然昼夜节律变化光照。
1.4 样品采集
第20天07:30空腹称重后,前腔静脉采血3 mL,随后屠宰。采集母鼠胎盘、肝脏、脾脏、十二指肠及胎鼠,称重后迅速剪碎,液氮速冻,-80 ℃保存备用。
1.5 血液指标测定
母鼠血液HGB含量、红细胞数(RBC)和红细胞容积(HCT)采用迈瑞BC-2800全自动血液细胞分析仪测定。
1.6 原子吸收法测定铁含量
准确称取100 mg待测组织样品置于去铁处理后的消化管中,加入工作液1 mL(高氯酸∶浓硝酸=1∶4),放入消化器孔内。首先在70 ℃消化3~4 h,然后依次升温到100、120、150、180、200 ℃,直至消化到溶液透明澄清为止。消化完毕溶液晾凉后转移到10 mL容量瓶中,用去离子水清洗消化管,移入定容瓶直至用去离子水定容到10 mL刻度待测。
1.7 铁调基因表达量测定
1.7.1 总RNA提取
各组织总RNA提取按照RNAsimple Total RNA Kit[天根生化科技(北京)有限公司试剂]说明书进行,每50~100 mg组织加1 mL裂解液,经过研磨粉碎匀浆后,加入氯仿萃取。最后得到的总RNA溶解于超纯水中,总RNA的纯度与浓度分别用分光光度计在260与280 nm下检测吸光度(OD)值,OD260 nm/OD280 nm在1.8~2.0方可采用。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet (air-dry basis) %
1)预混料为每千克饲粮提供 Premix provided the following per kilogram of the diet:CuSO424.01 mg, MnSO481.89 mg,ZnSO468.83 mg,Na2SeO30.33 mg,KI 0.27 mg,MgO 927.64 mg,VA 2 400 IU,VD 1 000 IU,VE 32 IU,VB15 mg,VB27 mg,泛酸 pantothenic acid 16 mg,烟酸 nicotinic acid 15 mg,胆碱 choline 2 000 mg,叶酸0.5 mg。
2)消化能为计算值,其他为实测值。DE was a calculated value, while the others were measured values.
1.7.2 反转录
总RNA样品按试剂盒(TaKaRa,日本)说明书要求配制反转录反应液,总体系10 μL,反转录产物(cDNA)于-20 ℃保存。
1.7.3 实时荧光定量PCR
cDNA用于实时荧光定量PCR。以β-肌动蛋白(β-actin)为内参基因,各基因引物序列见表2。引物采用Primer Express软件设计。

1.8 数据分析
所有组织的铁调节基因均是以β-actin为内参基因进行相对定量,表达量参考Pfaffl[8]的方法计算。数据采用SPSS 19.0统计软件进行统计处理,结果用平均值±标准差表示,组间差异显著的采用Duncan氏法进行多重比较。
2 结 果
2.1 血红素铁和FeSO4对妊娠母鼠繁殖性能的影响
由表3可见,60 mg/kg血红素铁组、300 mg/kg FeSO4组母鼠增重最多,极显著高于对照组和缺铁组(P<0.01)。60 mg/kg血红素铁组胎鼠重和母鼠肝脏重最高,其中胎鼠重极显著高于对照组和缺铁组(P<0.01)。
2.2 血红素铁和FeSO4对妊娠母鼠血液HGB含量、RBC和HCT的影响
由表4可见,60 mg/kg血红素铁组与450 mg/kg FeSO4组母鼠血液HGB含量、RBC和HCT极显著高于缺铁组(P<0.01)。
2.3 血红素铁和FeSO4对妊娠母鼠组织与胎鼠铁含量的影响
由表5可见,90 mg/kg血红素铁组、450 mg/kg FeSO4组母鼠肝脏铁含量较高,极显著高于对照组和缺铁组(P<0.01)。450 mg/kg FeSO4组母鼠脾脏铁含量最高,极显著高于对照组和缺铁组(P<0.01)。300 mg/kg FeSO4组和450 mg/kg FeSO4组母鼠胎盘铁含量极显著高于血红素铁组(P<0.01)。缺铁组母鼠肝脏、脾脏、胎盘和胎鼠铁含量均极显著低于对照组(P<0.01)。
母鼠肝脏和胎鼠铁含量与饲粮血红素铁添加量呈二次曲线变化(P<0.01)。由二次曲线求值得出,饲粮血红素铁添加量为93.49 mg/kg时,母鼠肝脏铁含量最高(图1-A、图1-B);饲粮血红素铁添加量为61.00 mg/kg时,胎鼠铁含量最高(图1-C、图1-D);饲粮FeSO4添加量为336.11 mg/kg时,胎鼠铁含量最高(图1-E);饲粮FeSO4添加量为511.85 mg/kg时,母鼠肝脏铁含量最高(图1-F)。

表2 引物序列Table 2 Primer sequences

表3 血红素铁和FeSO4对妊娠母鼠繁殖性能的影响Table 3 Effects of heme Fe and FeSO4 on breeding performance of pregnant mouse
同列数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下表同。
In the same column, values with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean extremely significant difference (P<0.01). The same as below.

表4 血红素铁和FeSO4对妊娠母鼠血液HGB含量、RBC和HCT的影响Table 4 Effects of heme Fe and FeSO4 on blood HGB content, RBC and HCT of pregnant mouse

表5 血红素铁和FeSO4对妊娠母鼠组织与胎鼠铁含量的影响Table 5 Effects of heme Fe and FeSO4 on iron content in tissues of pregnant mice and their foetuses mg/kg
2.4 血红素铁和FeSO4对妊娠母鼠肝脏铁调节基因表达的影响
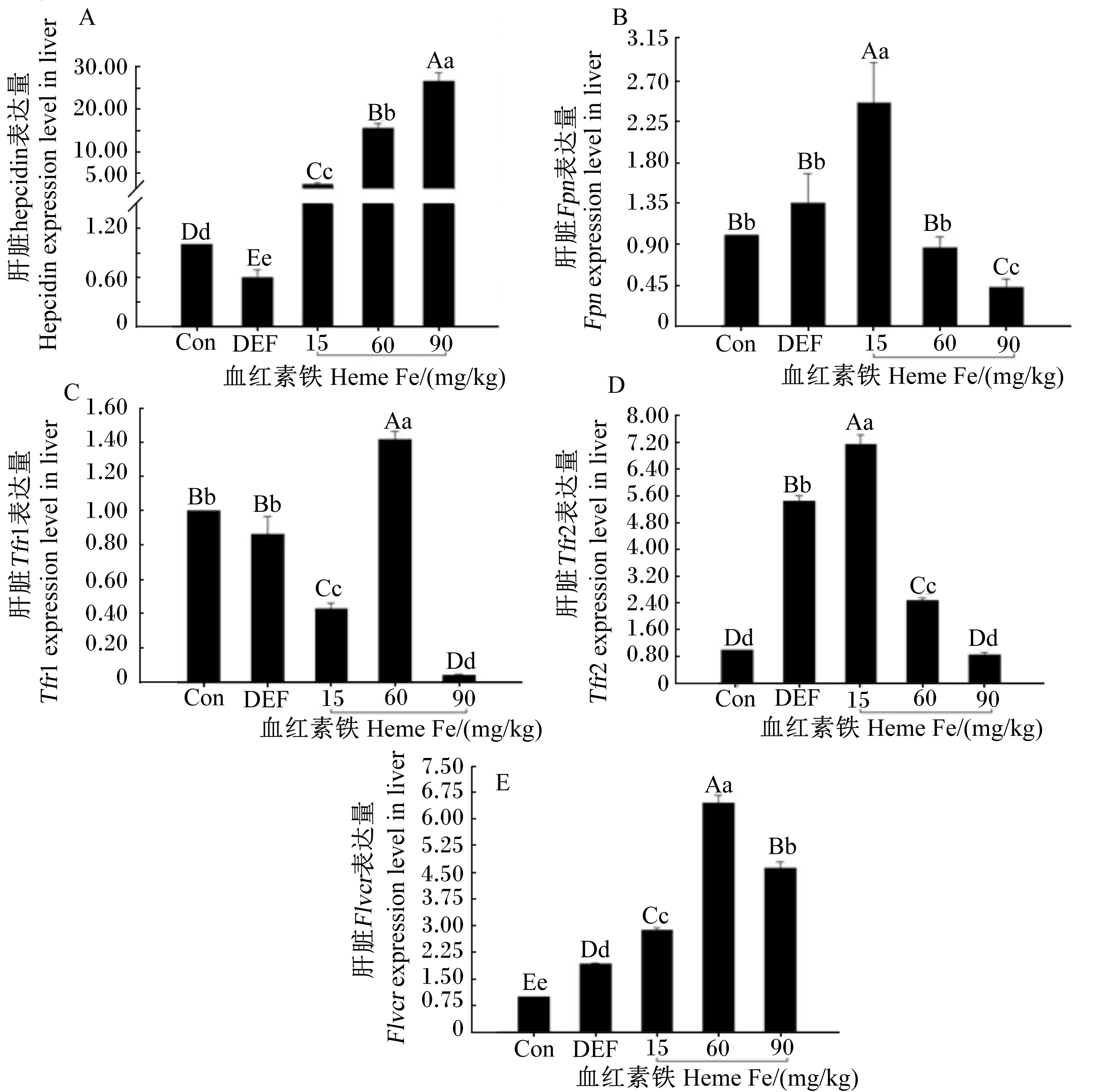
由图2-A可知,缺铁组母鼠肝脏hepcidin表达量极显著低于对照组(P<0.01);随着血红素铁添加量的增加,肝脏hepcidin表达量上升;90 mg/kg血红素铁组肝脏hepcidin表达量较高,与对照组差异极显著(P<0.01)。由图2-B可知,母鼠肝脏Fpn表达量随着血红素铁添加量的增加而降低,15 mg/kg血红素铁组肝脏Fpn表达量较高,与对照组和缺铁组相比差异极显著(P<0.01)。由图2-C可知,60 mg/kg血红素铁组母鼠肝脏Tfr1表达量较高,与对照组和缺铁组相比差异极显著(P<0.01)。由图2-D可知,缺铁组母鼠肝脏Tfr2表达量极显著高于对照组(P<0.01);Tfr2表达量随着血红素铁添加量的增加而降低,15 mg/kg血红素铁组较高,与对照组和缺铁组相比差异极显著(P<0.01)。由图2-E可知,60 mg/kg血红素铁组母鼠肝脏Flvcr表达量较高,极显著高于对照组和缺铁组(P<0.01)。
由图3-A可知,随着FeSO4添加量的增加,母鼠肝脏hepcidin表达量上升;450 mg/kg FeSO4组肝脏hepcidin的表达量较高,与对照组差异极显著(P<0.01)。由图3-B可知,母鼠肝脏Fpn表达量随着FeSO4添加量的增加而降低,75 mg/kg FeSO4组肝脏Fpn表达量较高,与对照组和缺铁组相比差异极显著(P<0.01)。由图3-C可知,75 mg/kg FeSO4组母鼠肝脏Tfr1表达量较高,与对照组和缺铁组相比差异极显著(P<0.01)。由图3-D可知,母鼠肝脏Tfr2表达量随着FeSO4添加量的增加而降低,75 mg/kg FeSO4组极显著高于对照组(P<0.01)。由图3-E可知,FeSO4组母鼠肝脏Flvcr表达量极显著高于对照组(P<0.01)。
2.5 血红素铁和FeSO4对妊娠母鼠十二指肠铁调节基因表达的影响
由图4-A可知,缺铁组母鼠十二指肠Fpn表达量极显著高于对照组(P<0.01);Fpn表达量血红素铁添加量的增加而降低,90 mg/kg血红素铁组Fpn表达量较低,与对照组和缺铁组相比差异极显著(P<0.01)。由图4-B可知,缺铁组和15 mg/kg血红素铁组母鼠十二指肠HCP表达量较高,与对照组相比差异极显著(P<0.01);随血红素铁添加量的增加,HCP表达量下降。由图4-C、图4-D可知,缺铁组母鼠十二指肠DMT1、Flvcr
表达量极显著高于对照组(P<0.01),随血红素铁添加量的增加,DMT1、Flvcr表达量下降。

Con:对照组 control group;DEF:缺铁组 Fe deficiency group。下图同。 The same as below.
**表示差异极显著(P<0.01)。** mean extremely significant difference (P<0.01).
图1 饲粮血红素铁添加量与妊娠母鼠肝脏和胎鼠铁含量的二次曲线变化
Fig.1 Quadratic curve changes of dietary heme Fe supplemental level and iron content of pregnant mice liver and fetuses
由图5-A可知,75 mg/kg FeSO4组母鼠十二指肠Fpn表达量极显著高于对照组(P<0.01);Fpn表达量随着FeSO4添加量的增加而降低,450 mg/kg FeSO4组较低,与对照组和缺铁组相比差异极显著(P<0.01)。由图5-B可知,各FeSO4组母鼠十二指肠HCP表达量均极显著高于对照组(P<0.01),与缺铁组差异不显著(P>0.05)。由图5-C、图5-D可知,随FeSO4添加量的增加,母鼠十二指肠DMT1、Flvcr表达量下降,但均极显著高于对照组(P<0.01),且极显著低于缺铁组(P<0.01)。
2.6 血红素铁和FeSO4对妊娠母鼠胎盘铁调基因表达的影响
由图6-A可知,缺铁组母鼠胎盘hepcidin表
达量低于对照组,差异极显著(P<0.01)。随着血红素铁添加量的增加,hepcidin表达量上升;血红素铁组中,90 mg/kg血红素铁组hepcidin的表达量较高,与对照组差异极显著(P<0.01)。由图6-B可知,缺铁组和15 mg/kg血红素铁组母鼠胎盘Fpn表达量较高,与对照组相比差异极显著(P<0.01);Fpn表达量随着血红素铁添加量的增加而降低。由图6-C、图6-D、图6-E可知,缺铁组母鼠胎盘Tfr1、DMT1、Flvcr表达量较高,与其他组相比差异极显著(P<0.01)。由图6-F可知,缺铁组和15 mg/kg血红素铁组母鼠胎盘HCP表达量极显著高于其他组(P<0.01) 。
数据柱形标注不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下图同。
Data columns with different small letters mean significant difference (P<0.05), and with different capital letters mean extremely significant difference (P<0.01). The same as below.
图2 血红素铁对妊娠母鼠肝脏hepcidin(A)、Fpn(B)、Tfr1(C)、Tfr2(D)、Flvcr(E)表达的影响
Fig.2 Effects of heme Fe on expressions of hepcidin (A),Fpn(B),Tfr1 (C),Tfr2 (D) andFlvcr(E) in liver of pregnant mice
由图7-A可知,随着FeSO4添加量的增加,母鼠胎盘hepcidin表达量上升;FeSO4组中,450 mg/kg FeSO4组hepcidin的表达量较高,与对照组差异极显著(P<0.01)。由图7-B可知,75 mg/kg FeSO4组母鼠胎盘Fpn表达量较高,与对照组相比差异极显著(P<0.01);Fpn表达量随着FeSO4添加量的增加而降低。由图7-C、图7-D、图7-E、图7-F可知,缺铁组母鼠胎盘Tfr1、DMT1、Flvcr、HCP表达量较高,与其他组相比差异极显著(P<0.01)。
3 讨 论
3.1 适宜添加量的血红素铁和FeSO4改善妊娠母鼠的繁殖成绩
微量元素铁对胎儿生长发育具有重要影响。抗贫血胶囊改善大鼠缺铁性贫血的研究中发现,补充血红素铁可显著增加大鼠体重,增加血清铁含量。解超等[9]研究报道,鹅血红素显著增加患缺铁性贫血症幼龄大鼠体重和体长,促进其生长发育。本试验结果表明,饲喂血红素铁和FeSO4可以提高母鼠生产性能,母鼠饲喂血红素铁更能提高胎儿体重。铁过载时注射DFO,可降低机体铁含量。缺铁情况下,补加血红素铁有提高胎鼠个数的趋势。

图3 FeSO4对妊娠母鼠肝脏hepcidin(A)、Fpn(B)、Tfr1(C)、Tfr2(D)、Flvcr(E)表达的影响Fig.3 Effects of FeSO4 on expressions of hepcidin (A), Fpn (B), Tfr1 (C), Tfr2 (D) andFlvcr (E) in liver of pregnant mice

图4 血红素铁对妊娠母鼠十二指肠Fpn(A)、HCP(B)、DMT1(C)、Flvcr(D)表达的影响Fig.4 Effects of heme Fe on expressions of Fpn (A), HCP (B), DMT1 (C) and Flvcr (D) in duodenum of pregnant mice
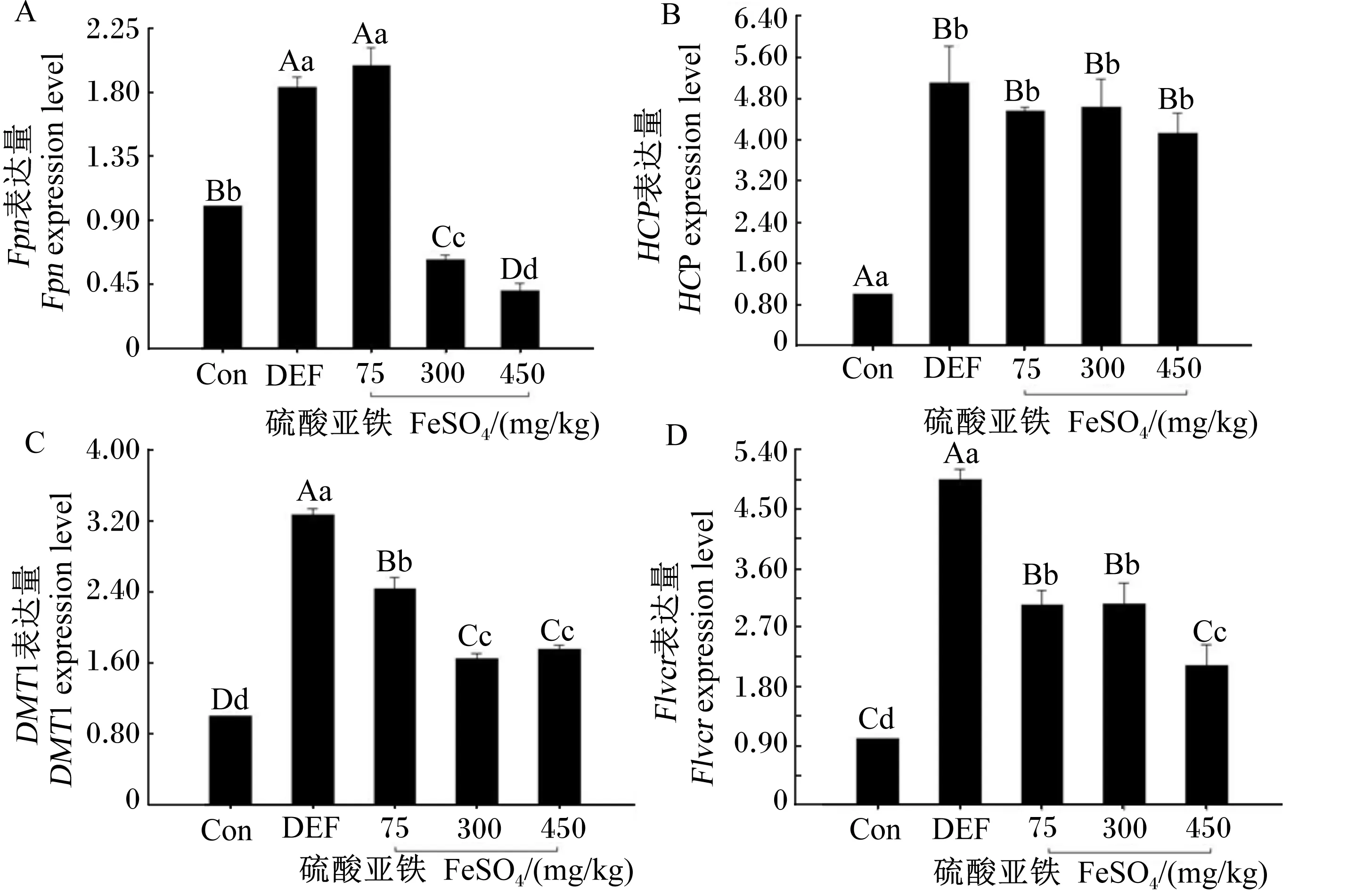
图5 FeSO4对妊娠母鼠十二指肠Fpn(A)、HCP(B)、DMT1(C)、Flvcr(D)表达的影响Fig.5 Effects of FeSO4 on expressions of Fpn (A), HCP (B), DMT1 (C) and Flvcr (D) in duodenum of pregnant mice

图6 血红素铁对妊娠母鼠胎盘hepcidin(A)、Fpn(B)、Tfr1(C)、DMT1(D)、Flvcr(E)、HCP(F)表达的影响Fig.6 Effects of heme Fe on expressions of hepcidin (A), Fpn (B), Tfr1 (C), DMT1 (D), Flvcr (E) andHCP (F)in placenta of pregnant mice
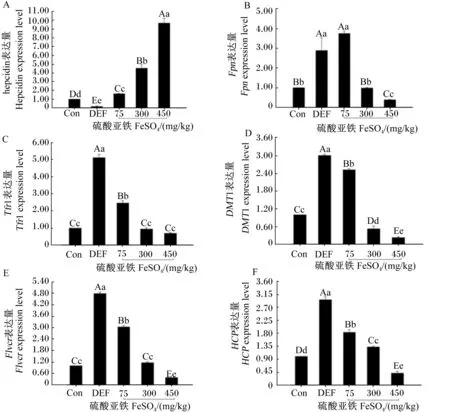
图7 FeSO4对妊娠母鼠胎盘hepcidin(A)、Fpn(B)、Tfr1(C)、DMT1(D)、Flvcr(E)、HCP(F)表达的影响Fig.7 Effects of FeSO4 on expressions of hepcidin (A), Fpn (B), Tfr1 (C), DMT1 (D),Flvcr (E) and HCP (F)in placenta of pregnant mice
3.2 适宜添加量的血红素铁和FeSO4提高妊娠母鼠血液HGB含量和RBC
HGB是标识动物机体铁含量的重要指标。游开绍等[10]对氯高铁血红素和富马酸亚铁治疗小儿缺铁性贫血的疗效进行了比较,结果表明氯高铁血红素口服液治疗后,血液HGB含量显著高于对照组,血液中红细胞游离原卟啉、血红蛋白中红细胞游离原卟啉含量低于对照组,说明氯高铁血红素治疗小儿缺铁性贫血的效果优于富马酸亚铁。钟才云等[11]用大鼠HGB恢复性试验研究血红素铁的抗贫血作用与生物利用率,证明血红素铁具有良好的抗贫血效果,与本试验结果一致。本试验结果表明,饲喂母鼠60 mg/kg血红素铁时与450 mg/kg FeSO4时其血液HGB含量、RBC极显著高于缺铁组。饲粮添加铁源能够提高母鼠血液中HGB含量。
3.3 适宜添加量的血红素铁和FeSO4增加妊娠母鼠组织及胎鼠铁含量
动物机体肝脏,脾脏是储铁的重要器官,反映机体铁营养的重要参数。胎鼠个体铁含量直接反应由母鼠转运至胎儿的铁量。De Carli等[12]研究报道,短期膳食镁的限制,可以降低由于长期饲喂高脂肪饮食造成的生长期大鼠脾脏铁含量。本试验结果表明,缺铁情况下,DFO耗竭,极显著降低胎鼠铁含量。母鼠饲喂90 mg/kg血红素铁、450 mg/kg FeSO4母鼠肝脏铁含量较高,母鼠饲喂FeSO4胎盘内铁含量显著高于饲喂血红素铁。血红素铁可显著增加胎鼠个体铁含量。
3.4 血红素铁和FeSO4对妊娠母鼠肝脏、十二指肠、胎盘铁调节基因表达的影响
hepcidin是介导铁调节的重要因子,本试验以hepcidin为中心,对母鼠肝脏、十二指肠、胎盘组织的铁储存、吸收、转运相关基因Fpn、Tfr1、Tfr2、Flvcr、DMT1、HCP进行表达量的检测。
3.4.1 妊娠母鼠肝脏
hepcidin是重要的铁调节器。Pigeon等[13]、Bolondi等[14]研究报道,小鼠或人类肝脏铁过载,会增加hepcidin的表达量。本试验中,缺铁组母鼠肝脏hepcidin表达量低于对照组;随着血红素铁和FeSO4添加量的增加,hepcidin表达量上升。
Bolondi等[14]和Donovan等[15]研究报道,在Fpn和血浆铜蓝蛋白作用下,亚铁离子(Fe2+)被转运至血液中完成再循环的过程,Fpn起到了“出口”的作用。Boumaiza等[16]研究报道,生产功能性hepcidin可以在大肠杆菌中实现,经纯化后,能促使铁输出蛋白Fpn降解。本试验中,Fpn表达量随着血红素铁、FeSO4添加量的增加,Fpn表达量下降;hepcidin与Fpn表达量趋势相反。
Tfr是铁转运的重要蛋白。本试验中,母鼠饲喂60 mg/kg血红素铁和75 mg/kg FeSO4时肝脏Tfr1表达量较高,随后降低;Tfr2表达量随着血红素铁和FeSO4添加量的增加,Tfr2表达量降低。当机体缺铁时,Tfr表达量会升高,促进机体对铁的吸收,当机体铁过载时,其表达量会降低,控制机体对铁的输入。
Flvcr是血红素铁输出转运的主效蛋白。Vinchi等[17]通过小鼠肝脏试验证实,Flvcr做为血红素的输出者,调控血红素的合成,且能够降解和控制细胞色素P450。本试验中,饲喂60 mg/kg血红素铁时,母鼠肝脏Flvcr表达量较高,随后降低;母鼠饲喂不同添加量的FeSO4时,肝脏Flvcr表达量差异不显著,推测由于FeSO4属于无机铁,Flvcr主要输出有机铁。
3.4.2 妊娠母鼠十二指肠
血红素铁是很好的生物强铁化剂,可以直接被肠黏膜吸收。Wyllie等[18]给正常或铁缺乏大鼠饲喂氯化血红素铁,证实血红素是被小肠黏膜细胞吸收。铁的状态调控Fpn的含量,Fpn是哺乳动物唯一Fe2+输出口,Fpn突变会导致铁过载疾病[19]。本试验结果表明,随铁含量的增加,Fpn表达量下调,Fpn表达量受机体内铁状态调控。
HCP是近年来发现的哺乳动物血红素细胞输入蛋白,是游离血红素进入细胞的途径。Shayeghi等[20]研究报道,证实了十二指肠上皮细胞HCP具有直接摄取血红素,并将其转运入细胞内的功能,进入细胞内的铁池被重新利用,高表达的HCP1,可使血红素铁的吸收增加2~3倍。本试验结果表明,缺铁组和饲喂15 mg/kg血红素铁时十二指肠HCP表达量较高,HCP与血红素铁的吸收密切相关,母鼠饲喂不同剂量无机铁源,十二指肠HCP表达量差异不显著。推测HCP仅与有机铁的吸收相关。
Leong等[21]研究报道,10日龄缺铁小鼠,机体内缺乏铁调节的吸收机制,小肠上皮细胞DMT1和Fpn变化不显著,20日龄缺铁小鼠,机体内转铁蛋白表达量会显著上升,补铁后会显著下调转铁蛋白的表达。本试验母鼠属于成年鼠,机体内有完整的铁吸收转运机制,所以铁缺乏时,DMT1表达量显著上升。
Flvcr做为血红素的输出者,主要调控血红素的合成,与母鼠饲喂无机铁关系不密切。本试验结果显示,Flvcr主要受有机铁调控。
3.4.3 妊娠母鼠胎盘
Garcia-Valdes等[22]研究报道,肥胖孕妇缺铁性风险更大,主要由于hepcidin的调控,胎盘会通过增加Tfr1降低产妇缺铁状态。本试验结果表明,随着血红素铁和FeSO4添加量的增加,胎盘hepcidin表达量上升。hepcidin与胎盘铁的输出密切相关。
Bastin等[23]研究发现Fpn1在胎盘主要表达于合体滋养层细胞的基底膜,其基底面面向胎盘的胎儿面,与铁从母体向胎儿单向传递一致,并且在妊娠的后3个月最高,此时期也是胎儿需要铁较多的时期,这表明Fpn1在铁从母体到发育的胎儿的转运中有着重要作用。李四保等[24]研究报道,不同缺铁程度孕妇相应新生儿铁状态无显著差异,随着母体缺铁程度的加重,血清hepcidin含量下调,胎盘Fpn表达量上调。本试验结果显示缺铁组和15 mg/kg血红素铁或75 mg/kg FeSO4时,母鼠胎盘Fpn表达量较高。Fpn表达量随着铁含量的增加,Fpn表达量降低。
本试验中,缺铁组母鼠胎盘Tfr1、DMT1表达量较高。结果提示,当机体内铁含量低时,通过增加Tfr1、DMT1表达量增加铁的转运。
Byon等[25]研究报道,Flvcr与红细胞形成紧密相关,可能有助于血小板的成熟,但对正常造血干细胞的功能是可有可无的。本试验中,缺铁组母鼠胎盘Flvcr表达量较高。
HCP与血红素铁吸收转运密切相关。有研究报道高表达量的HCP1可使血红素铁的吸收增加2~3倍。本试验研究报道,母鼠饲喂血红素铁,胎鼠机体铁含量高于饲喂FeSO4。推测与铁在胎盘吸收转运机制相关。
综上所述,母鼠饲喂适宜血红素铁可显著促进胎鼠生长发育和增加胎鼠机体铁含量,增加母鼠血液HGB含量;血红素铁可通过调节肠道铁吸收,胎盘铁转运,从而促进铁从母鼠运输至胎鼠,HCP和Flvcr在肠道对血红素铁吸收或胎盘转运起至关重要的作用。但肠道吸收或胎盘转运FeSO4主要以DMT1或Tfr2为主。二者在吸收转运方面有很大差异;母鼠肝脏和胎鼠与饲粮血红素铁添加量呈二次曲线变化,母鼠肝脏铁含量最高时,其血红素铁饲粮适宜添加量为93.49 mg/kg。母鼠饲粮血红素铁添加量为61.00 mg/kg,胎鼠机体铁含量最高。
4 结 论
① 血红素铁可改善胎鼠生长发育和提高胎鼠机体铁含量;饲粮血红素铁适宜添加量为61.00 mg/kg,此添加量下胎鼠铁含量最高。
② 血红素铁和FeSO4均可增加母鼠RBC、HGB含量。饲粮血红素铁适宜添加量为93.49 mg/kg,此添加量下母鼠肝脏铁含量最高。
③ 血红素铁和FeSO4可调节母鼠靶组织铁代谢基因的表达,从而提高组织铁含量,血红素铁诱导母鼠胎盘HCP、Flvcr表达量上调,有利于血红素铁通过胎盘进入胎儿。HCP和Flvcr在母鼠肠道对血红素铁吸收和胎盘转运起至关重要的作用,肠道吸收或胎盘转运FeSO4主要以DMT1和Tfr2为主,二者在吸收转运方面有很大差异,需进一步研究。
[1] 白松涛.妊娠期缺铁性贫血治疗方法的系统性评价[D].硕士学位论文.遵义:遵义医学院,2012.
[2] 赵惠君.儿童缺铁和缺铁性贫血的防治[J].实用儿科临床杂志,2012,27(3):163-165.
[3] CAO C,O’BRIEN K O.Pregnancy and iron homeostasis: an update[J].Nutrition Reviews,2012,71(1):35-51.
[4] FURUYAMA K,KANEKO K,VARGAS V P D.Heme as a magnificent molecule with multiple missions:heme determines its own fate and governs cellular homeostasis[J].The Tohoku Journal of Experimental Medicine,2007,213(1):1-16.
[5] GANZ T.Systemic iron homeostasis[J].Physiological Reviews,2013,93(4):1721-1741.
[6] FINBERG K E.Regulation of systemic iron homeostasis[J].Current Opinion in Hematology,2013,20(3):208-214.
[7] SINGH B,ARORA S,AGRAWAL P,et al.Hepcidin:a novel peptide hormone regulating iron metabolism[J].Clinica Chimica Acta,2011,412(11/12):823-830.
[8] PFAFFL M W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Research,2001,29 (9):e45.
[9] 解超,王宝维,葛文华,等.鹅血红素对患缺铁性贫血症幼龄大鼠生长发育、铁代谢和器官组织元素分布的影响[J].动物营养学报,2015,27(2):408-417.
[10] 游开绍,吴斌,赵子庆,等.氯高铁血红素与富马酸亚铁治疗小儿缺铁性贫血的疗效比较[J].中国新药与临床杂志,1995,14(4):211-213.
[11] 钟才云,马凤楼,蔡凤鸣,等.血红素铁治疗女大学生缺铁性贫血的研究[J].中国校医,1995,9(3):167-169.
[12] DE CARLI E,LOBO A R,SALES C H,et al.Short-term dietary magnesium restriction lowers spleen iron concentrations in growing rats fed a high-fat diet[J].LWT:Food Science and Technology,2014,59(2):1298-1303.
[13] PIGEON C,ILYIN G,COURSELAUD B,et al.A new mouse liver-specific gene,encoding a protein homologous to human antimicrobial peptide hepcidin,is overexpressed during iron overload[J].Journal of Biological Chemistry,2001,276(11):7811-7819.
[14] BOLONDI G,GARUTI C,CORRADINI E,et al.Altered hepatic BMP signaling pathway in human HFE hemochromatosis[J].Blood Cells,Molecules,and Diseases,2010,45(4):308-312.
[15] DONOVAN A,BROWNLIE A,ZHOU Y,et al.Positional cloning of zebrafish ferroportin1 identifies a conserved vertebrate iron exporter[J].Nature,2000,403(6771):776-781.
[16] BOUMAIZA M,JAOUEN M,DESCHEMIN J C,et al.Expression and purification of a new recombinant camel hepcidin able to promote the degradation of the iron exporter ferroportin1[J].Protein Expression and Purification,2015,115:11-18
[17] VINCHI F,INGOGLIA G,CHIABRANDO D,et al.Heme exporter FLVCR1a regulates heme synthesis and degradation and controls activity of cytochromes P450[J].Gastroenterology,2014,146(5):1325-1338.
[18] WYLLIE J C,KAUFMAN N.An electron microscopic study of heme uptake by rat duodenum[J].Laboratory Investigation,1982,47(5):471-476.
[19] MORENO-CARRALERO M I,MUOZ-MUOZ J A,CUADRADO-GRANDE N,et al.A novel mutation in the SLC40A1 gene associated with reduced iron exportinvitro[J].American Journal of Hematology,2014,89(7):689-694.
[20] SHAYEGHI M,LATUNDE-DADA G O,OAKHILL J S,et al.Identification of an intestinal heme transporter[J].Cell,2005,122(5):789-801.
[21] LEONG W I,BOWLUS C L,TALLKVIST J,et al.DMT1 andFPN1 expression during infancy:developmental regulation of iron absorption[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2003,285(6):G1153-G1161.
[22] GARCIA-VALDES L,CAMPOY C,HAYES H,et al.The impact of maternal obesity on iron status,placental transferrin receptor expression and hepcidin expression in human pregnancy[J].International Journal of Obesity,2015,39(4):571-578.
[23] BASTIN J,DRAKESMITH H,REES M,et al.Localisation of proteins of iron metabolism in the human placenta and liver[J].British Journal of Haematology,2006,134(5):532-543.
[24] 李四保,刘玉峰,王玉梅,等.血清铁调素及胎盘膜铁转运蛋白1在母婴铁转运中的作用[J].中华血液学杂志,2015,36(4):307-311.
[25] BYON J C H,CHEN J,DOTY R T,et al.FLVCRis necessary for erythroid maturation,may contribute to platelet maturation,but is dispensable for normal hematopoietic stem cell function[J].Blood,2013,122(16):2903-2910.
*Corresponding author, professor, E-mail: rongfug@163.com
(责任编辑 王智航)
Effects of Heme Iron on Reproductive Performance and Iron-Regulated Gene Expressions in Tissues of Pregnant Mice
LI Meiquan ZHANG Chunyong JI Qiaoqing CHEN Kelin GUO Rongfu*
(KeyLaboratoryofAnimalNutritionandFeedScienceofYunnanProvince,CollegeofAnimalScienceandTechnology,YunnanAgriculturalUniversity,Kunming650021,China)
This study was conducted to compare the effects of heme iron (Fe) and ferrous sulfate (FeSO4) on reproductive performance, the Fe content in pregnant mice tissues and fetal mice, and the expressions of Fe-regulated genes [hepcidin, ferroportin (Fpn), feline leukemia virus subgroup C receptor (Flvcr), heme carrier protein (HCP), transferrin receptor 1 (Tfr1), transferrin receptor 2 (Tfr2) and divalent metal transporter 1 (DMT1)] in tissues of pregnant mice. EightyKunmingfemale mice with similar body condition at 2 months of age were selected and randomly divided into 8 groups with 10 mice per group. The groups were control group, Fe deficiency group, heme Fe (15, 60 and 90 mg/kg) groups and FeSO4(75, 300 and 450 mg/kg) groups. Since pregnant, control group was fed normal diet (a basal diet supplemented with 400 mg/kg FeSO4); the other groups were fed the basal diet, and were injected 40 mg/kg deferoxamine to induce Fe deficiency model at 10 to 13 d of pregnant; heme Fe and FeSO4were supplemented in heme Fe groups and FeSO4groups from 14 d of pregnant, while none of them was supplemented in Fe deficiency group. The experiment was carried out at 1 to 20 d of pregnant. The results showed as follows: 1) the weight of fetal mice in 60 mg/kg group was significantly higher than that in control group and Fe deficiency group (P<0.01). 2) Blood hemoglobin (HGB) content, red blood cell (RBC) and hematocrit (HCT) in 60 mg/kg heme Fe group and 450 mg/kg FeSO4group were significantly higher than those in Fe deficiency group (P<0.01). 3) The Fe content in the fetal mice in 60 mg/kg heme Fe group was significantly higher than that in control group and FeSO4groups (P<0.01); the Fe content in liver, spleen and placenta was the highest in450 mg/kg FeSO4group. 4) The expression of hepcidin in liver of pregnant mice was higher in 90 mg/kg heme Fe group and 450 mg/kg FeSO4group, which was significantly higher than that in Fe deficiency group and control group (P<0.01); the expressions ofFpnandTfr2 in liver in 15 mg/kg heme Fe group were higher, which were significantly higher than those in Fe deficiency group and control group (P<0.01); the expressions ofTfr1 andFlvcrin liver in 60 mg/kg heme Fe group were higher, which were significantly higher than those in Fe deficiency group and control group (P<0.01); the expression ofTfr1 in liver in 75 mg/kg FeSO4group was higher, which was significantly higher than that in Fe deficiency group and control group (P<0.01). 5)Fpn,HCP,DMT1 andFlvcrexpressions in duodenum of pregnant mice in Fe deficiency group were significantly higher than those in control group (P<0.01). 6) PlacentaFpn,HCP,DMT1,FlvcrandTfr1 expressions were significantly higher than those in control group (P<0.01); the expression of hepcidin in placenta in 90 mg/kg heme Fe and 450 mg/kg FeSO4was higher, which was significantly higher than that in Fe deficiency group and control group (P<0.01). 7) The Fe content of fetal mice was the highest when heme Fe was 61.00 mg/kg or FeSO4was 336.11 mg/kg; the Fe content in liver of pregnant mice was the highest when heme Fe was 93.49 mg/kg. In conclusion, the supplementation of heme Fe and FeSO4at proper levels can increase the weight of fetal mice, regulate the expressions of Fe-regulating genes in target tissues of pregnant mice, and increase the body Fe content of pregnancy mice and 20 d fetal mice;HCPandFlvcrplay critical roles in the intestinal absorption or placental transport of heme Fe, while intestinal absorption and placental transport of FeSO4mainly rely onDMT1 andTfr2.[ChineseJournalofAnimalNutrition, 2017, 29(6):1996-2009]
pregnant mice; hemoglobin; iron content; hepcidin; heme iron
10.3969/j.issn.1006-267x.2017.06.021
2016-12-01
云南省重大科技计划——生物育种(2012ZA018-3)
李美荃(1986—),女,黑龙江哈尔滨人,博士研究生,从事动物营养与饲料科学研究。E-mail: limeiquan2010@163.com
*通信作者:郭荣富,教授,博士生导师,E-mail: rongfug@163.com
S852.2
A
1006-267X(2017)06-1996-14

