半乳糖凝集素3对内皮细胞生长、迁移及炎症反应的影响*
仲 琳, 梁平平▲, 龚 磊, 王佳慧, 朱玉洁, 林泽润, 杨 军△
(青岛大学医学院附属烟台毓璜顶医院 1心内科, 2生物芯片实验室, 3中心实验室,山东 烟台 264000)
半乳糖凝集素3对内皮细胞生长、迁移及炎症反应的影响*
仲 琳1, 梁平平1▲, 龚 磊2, 王佳慧3, 朱玉洁1, 林泽润1, 杨 军1△
(青岛大学医学院附属烟台毓璜顶医院1心内科,2生物芯片实验室,3中心实验室,山东 烟台 264000)
目的: 探讨半乳糖凝集素3(GAL-3)对人脐静脉内皮细胞(HUVECs)生长、迁移及炎症反应的影响及其作用机制。方法: 体外培养HUVECs,给予GAL-3重组蛋白2 mg/L或GAL-3短发夹RNA(shRNA)慢病毒载体处理,实验分为正常对照组、GAL-3重组蛋白处理组、阴性对照组和GAL-3-shRNA组。通过实时荧光定量PCR检测GAL-3、单核细胞趋化蛋白1(MCP-1)、IL-6、基质金属蛋白酶9(MMP-9)和cyclin D1的mRNA水平;利用Western blot 检测 GAL-3、MCP-1和IL-6的蛋白表达;利用ELISA检测MCP-1和IL-6在培养基中的水平;通过CCK-8实验和划痕实验检测HUVECs的活力和迁移能力;利用Western blot检测信号分子热休克蛋白90(HSP90)、ERK1/2、p-ERK1/2、JNK和p-JNK的蛋白水平。结果: 首先,给予GAL-3重组蛋白处理后,GAL-3、MCP-1和IL-6的mRNA及蛋白水平,MMP-9和cyclin D1的mRNA水平,MCP-1和IL-6在培养基的分泌水平均明显高于正常对照组;而GAL-3-shRNA感染细胞后,上述分子的表达水平均低于正常对照组和阴性对照组。其次,GAL-3重组蛋白处理后,细胞活力和迁移能力明显高于正常对照组;而GAL-3-shRNA感染后,细胞活力和迁移能力均低于正常对照组和阴性对照组。此外,GAL-3重组蛋白处理组中,p-ERK1/2和HSP90 的蛋白水平高于正常对照组;而GAL-3-shRNA 组中,p-ERK1/2和HSP90 的蛋白水平均低于正常对照组和阴性对照组。p-JNK的蛋白水平在各组间比较,差异无统计学显著性。结论: GAL-3促进血管内皮细胞的生长、迁移及炎症反应的发生,其机制可能与HSP90-ERK1/2信号通路有关。
半乳糖凝集素3; 内皮细胞; 细胞迁移; 炎症
动脉粥样硬化(atherosclerosis,AS)是一个慢性增殖和慢性炎症的发展过程,研究发现在动脉粥样斑块病变部位常存在病理性新生血管的形成和炎症因子的释放,它们不仅可以加速AS病变的进展,还可以导致不稳定斑块的形成。其中血管重塑和急性炎症是导致斑块内出血和斑块破裂重要因素,而血管内皮细胞的异常增殖和迁移是血管重塑的重要环节[1]。
半乳糖凝集素3(galectin-3,GAL-3)是β-半乳糖苷动物凝集素家族成员之一[2],主要表达于上皮细胞、免疫细胞和巨噬细胞,不仅参与细胞的增殖、迁移、黏附、分化、凋亡和炎症反应等过程,同时也在心血管疾病,如动脉粥样硬化性心脏病、心力衰竭、心肌缺血再灌注、急性冠脉综合征等的发生发展过程中发挥重要作用[3]。 研究发现,GAL-3作为一种强大的促炎症因子,可以促使单核细胞向巨噬细胞的分化及其在血管内膜损害部位的聚集,激发炎症因子如白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)等的释放[4]。同时,GAL-3也可作为细胞增殖的标志物。研究发现,在活化的血管平滑肌细胞(vascular smooth muscle cells,VSMCs)中GAL-3的表达水平明显增加,可通过促进VSMCs增殖和迁移而加速动脉斑块的形成[5]。Mackinnon等[6]在研究ApoE缺陷鼠模型中发现GAL-3 能促进AS的形成。此外,Falcone等[7]发现,不稳定型心绞痛患者的GAL-3血浆水平显著高于稳定型心绞痛患者,进一步提示GAL-3与病变斑块的易损性有关。但是GAL-3对内皮细胞迁移、增殖和炎症因子表达的影响以及可能的作用机制尚未见报道。本研究通过外源加入GAL-3重组蛋白及利用RNA干扰抑制GAL-3表达的方法,观察GAL-3在内皮细胞增殖、迁移以及炎症反应中的作用和机制,为动脉粥样硬化和不稳定斑块的防治提供新的思路。
材 料 和 方 法
1 材料与试剂
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购自中国科学院细胞库;胎牛血清(fetal bovine serum,FBS)和DMEM细胞培养液购自Gibco;GAL-3 RNA干扰慢病毒购自上海吉凯基因化学有限公司;兔抗GAL-3、MCP-1和IL-6多克隆抗体购自Abcam;兔抗细胞外信号调节激酶1/2(extracellular signal-regulated kinases 1/2, ERK1/2)、p-ERK1/2、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和p-JNK单克隆抗体购自Cell Signaling Technology;鼠抗β-肌动蛋白(β-actin)单克隆抗体购自Santa Cruz;HRP标记的羊抗兔 II 抗和HRP标记的兔抗鼠 II 抗购自北京中杉金桥;MCP-1和IL-6 ELISA试剂盒购自上海龙腾科技股份有限公司;人源GAL-3重组蛋白购自PeproTech;逆转录试剂盒购自Thermo Fisher Scientific;real-time PCR试剂盒购自Applied Biosystems;总RNA提取试剂盒、总蛋白质提取试剂盒购自上海生工生物工程股份有限公司;CCK-8试剂盒购自Dojindo;其它生化试剂均为进口分装或国产分析纯。所用引物由生工生物工程股份有限公司设计合成,见表1。
2 主要方法
2.1 细胞培养 HUVECs常规培养于含10% FBS的DMEM培养液中,置于37 ℃、5% CO2的细胞培养箱中培养。将HUVECs以1×108/L接种于6孔板中培养,细胞每隔2 d换液1次。

表1 引物序列
F: forward; R: reverse.
2.2GAL-3基因缺陷性HUVECs的构建及鉴定 由上海吉凯基因化学技术有限公司以GV248为载体,根据人GAL-3基因序列(NM_002306)设计和合成3条靶向短发夹RNA (short hairpin RNA,shRNA)序列 [shRNA1(5’-TGCCTCGCATGCTGATAACAA-3’)、shRNA2(5’-GAGAACAACAGGAGAGTCATT-3’)和shRNA3(5’-CCTGGAGCACCTGGAGCTTAT-3’)]和1条阴性对照(control) shRNA序列(5’-TTCTCCGAACGTGTCACGT-3’),并包装成慢病毒形式。将HUVECs常规培养至30%左右时,用GAL-3-shRNA慢病毒载体和阴性对照慢病毒载体感染HUVECs 12 h左右,感染复数(multiplicity of infection,MOI)为20。以含10% FBS的1640培养液继续常规培养,48 h后于荧光显微镜下观察荧光表达,利用 PCR和Western blot实验验证基因干扰效率。
2.3 实验分组 将HUVECs分为4个组:(1)正常对照组:无处理组;(2)GAL-3重组蛋白处理组:在培养基中加入人源GAL-3重组蛋白至终浓度为2 mg/L,培养24 h;(3)阴性对照组:HUVEC感染阴性对照慢病毒载体;(4)GAL-3-shRNA组:HUVECs感染GAL-3-shRNA慢病毒载体。
2.4 实时荧光定量PCR实验 按照TRIzol试剂盒说明书提取各实验组总RNA,并测定其浓度。取1 μg总RNA按试剂盒说明书逆转录成cDNA,20 μL实时定量PCR反应体系如下:SYBR® Select Master Mix 10 μL, cDNA(75 ng)1 μL, 上、下游引物各0.5 μL, RNase-free water 8 μL。PCR反应条件为95 ℃ 5 min; 95 ℃ 15 s, 60 ℃ 1 min, 共40个循环。利用ABI Prism 7900软件得到每个样品的Ct值,每组设3个复孔,取Ct平均值,以2-ΔΔCt分析实时定量PCR结果。
2.5 Western blot实验 根据蛋白提取试剂盒说明书,提取各实验组细胞的蛋白。根据BCA试剂盒说明书测定蛋白浓度,取50 μg蛋白上样,SDS-PAGE充分分离后,转至聚偏氟乙烯膜,封闭液室温封闭1 h,加入稀释的 I 抗(GAL-3 1∶5 000; MCP-1 1∶200; IL-6 1∶200; HSP90 1∶1 000; ERK1/2 1∶3 000; p-ERK1/2 1∶3 000; JNK 1∶200; p-JNK 1∶500),于4 ℃过夜,次日用TBST洗膜3次,每次10 min,加入相应 II 抗室温孵育1 h,TBST洗膜,加入ECL液显影,β-actin作为内参照,利用ImageJ软件计算条带灰度比,利用统计软件进行统计分析。
2.6 ELISA法检测MCP-1和IL-6的水平 将正常HUVECs和慢病毒稳定感染的HUVECs接种于6孔板中,待细胞完全贴壁后,弃上清,加入不含FBS的DMEM培养液,其中GAL-3处理组加入人源GAL-3重组蛋白2 mg/L,继续孵育24 h,收集上清,根据人MCP-1和IL-6 ELISA检测试剂盒说明书,检测培养上清的MCP-1和IL-6分泌水平,样本及标准品均设3个复孔,结果取均值,以pg/L表示。
2.7 CCK-8法检测细胞活力 将对数生长期的正常HUVECs和慢病毒稳定感染的HUVECs消化后,以每孔2×103的密度接种于96孔培养板中,常规培养至细胞融合率达60%~70%时,其中GAL-3处理组加入人源GAL-3重组蛋白2 mg/L,处理24 h,弃上清,加入100 μL的无血清DMEM培养基以及10 μL CCK-8溶液,孵育4 h,用酶联免疫检测仪在450 nm处检测(A)值,细胞活力=实验组A值/对照组A值,每组设3个复孔,结果取均值,所得比值进行统计分析。
2.8 细胞划痕实验 将正常HUVECs和慢病毒稳定感染的HUVECs接种于6孔板中,24 h后细胞融合率达90%,使用200 μL的无菌枪头在培养皿中央垂直划线,用PBS清洗2次加入无血清的DMEM培养液,在划痕处拍照作为初始对照。其中GAL-3处理组加入人源GAL-3重组蛋白2 mg/L,继续孵育24 h,于显微镜下拍照,采用Image-Pro Plus 6.0软件测量划痕的距离,细胞迁移率(%)= (原划痕宽度-现划痕宽度)/原划痕宽度×100%。
3 统计学处理
用SPSS 19.0软件包进行统计分析,符合正态分布计量数据以均数±标准差(mean±SD)表示,多组间比较采单因素方差分析(one-way ANOVA) ,用Bonferroni 校正的t检验进行各组间均数的两两比较,以P<0.05表示差异有统计学意义。
结 果
1 GAL-3-shRNA慢病毒干扰效率的检测结果
GAL-3-shRNA慢病毒载体和阴性对照慢病毒载体感染HUVECs 48 h,实时定量PCR和Western blot结果显示,GAL-3-shRNA组的 GAL-3 mRNA 和蛋白表达水平明显低于正常组和阴性对照组(P<0.05),其中GAL-3-shRNA2组的GAL-3 mRNA 和蛋白表达水平最低,提示在本实验中GAL-3-shRNA2组干扰效率最好,并应用于后续实验中,见图1。
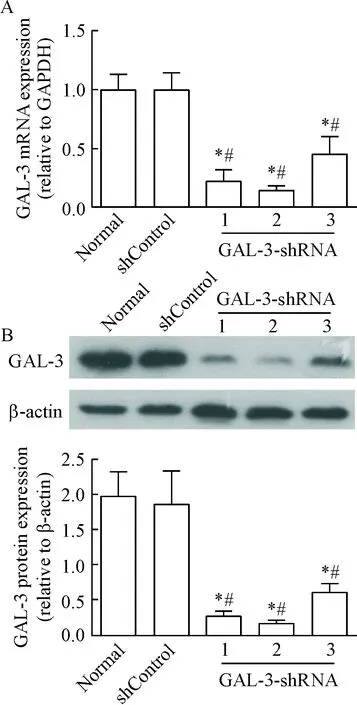
Figure 1.The lentiviral vector of shRNA reduced the mRNA (A) and protein (B) expression of GAL-3. Mean±SD.n=3.*P<0.05vsnormal;#P<0.05vsshControl.
图1 慢病毒载体干扰GAL-3的mRNA和蛋白表达
2 GAL-3重组蛋白诱导内皮细胞自身GAL-3的表达
GAL-3重组蛋白2 mg/L处理细胞24 h,实时荧光定量PCR和Western blot实验结果显示:与正常组相比,GAL-3重组蛋白处理组的GAL-3 mRNA和蛋白表达水平升高(P<0.05),提示外源性GAL-3重组蛋白诱导细胞自身GAL-3的表达,增强GAL-3的作用效应,见图2。
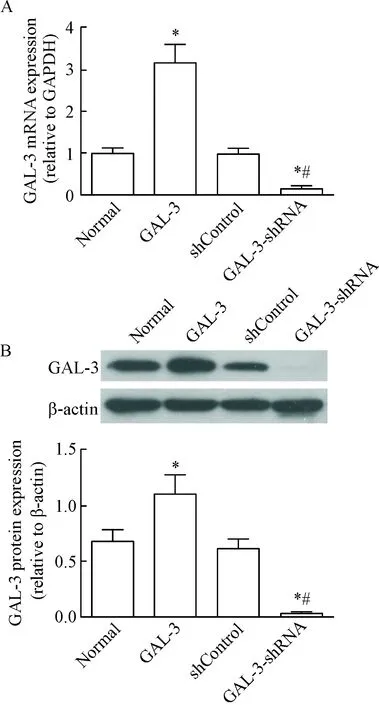
Figure 2.Recombinant GAL-3 protein induced the endogenous mRNA (A) and protein (B) expression of GAL-3 in HUVECs. Mean±SD.n=3.*P<0.05vsnormal;#P<0.05vsshControl.
图2 GAL-3重组蛋白诱导HUVECs内源GAL-3的mRNA表达和蛋白表达
3 GAL-3重组蛋白诱导内皮细胞MCP-1和IL-6的表达
通过实时荧光定量PCR和Western blot对各实验组检测发现,与正常组相比,GAL-3重组蛋白处理组MCP-1和IL-6的mRNA和蛋白表达水平明显升高(P<0.05),而GAL-3-shRNA组MCP-1和IL-6的mRNA和蛋白表达水平显著低于正常组和阴性对照组(P<0.05)。同时ELISA对各实验组上清检测发现,与正常组相比,GAL-3重组蛋白明显诱导HUVECs分泌炎症因子MCP-1和IL-6(P<0.05)。而与正常组和阴性对照组相比,GAL-3-shRNA组MCP-1和IL-6分泌水平明显降低(P<0.05),见图3。

Figure 3.The mRNA expression (A), secretion (B) and protein expression (C) of MCP-1 and IL-6 in each group were detected respectively by RT- PCR, ELISA and Western blot, respectively. Mean±SD.n=3.*P<0.05vsnormal group;#P<0.05vsshControl group.
图3 RT-PCR、ELISA和Western blot分别检测各组MCP-1和IL-6 mRNA表达水平、分泌水平和蛋白表达水平
4 GAL-3诱导内皮细胞MMP-9和cyclin D1的表达
实时定量PCR检测发现,与正常组相比,GAL-3重组蛋白处理组MMP-9和cyclin D1的mRNA表达水平明显升高(P<0.05),而GAL-3-shRNA组MMP-9和cyclin D1的mRNA表达水平显著低于正常组和阴性对照组(P<0.05),见图4。
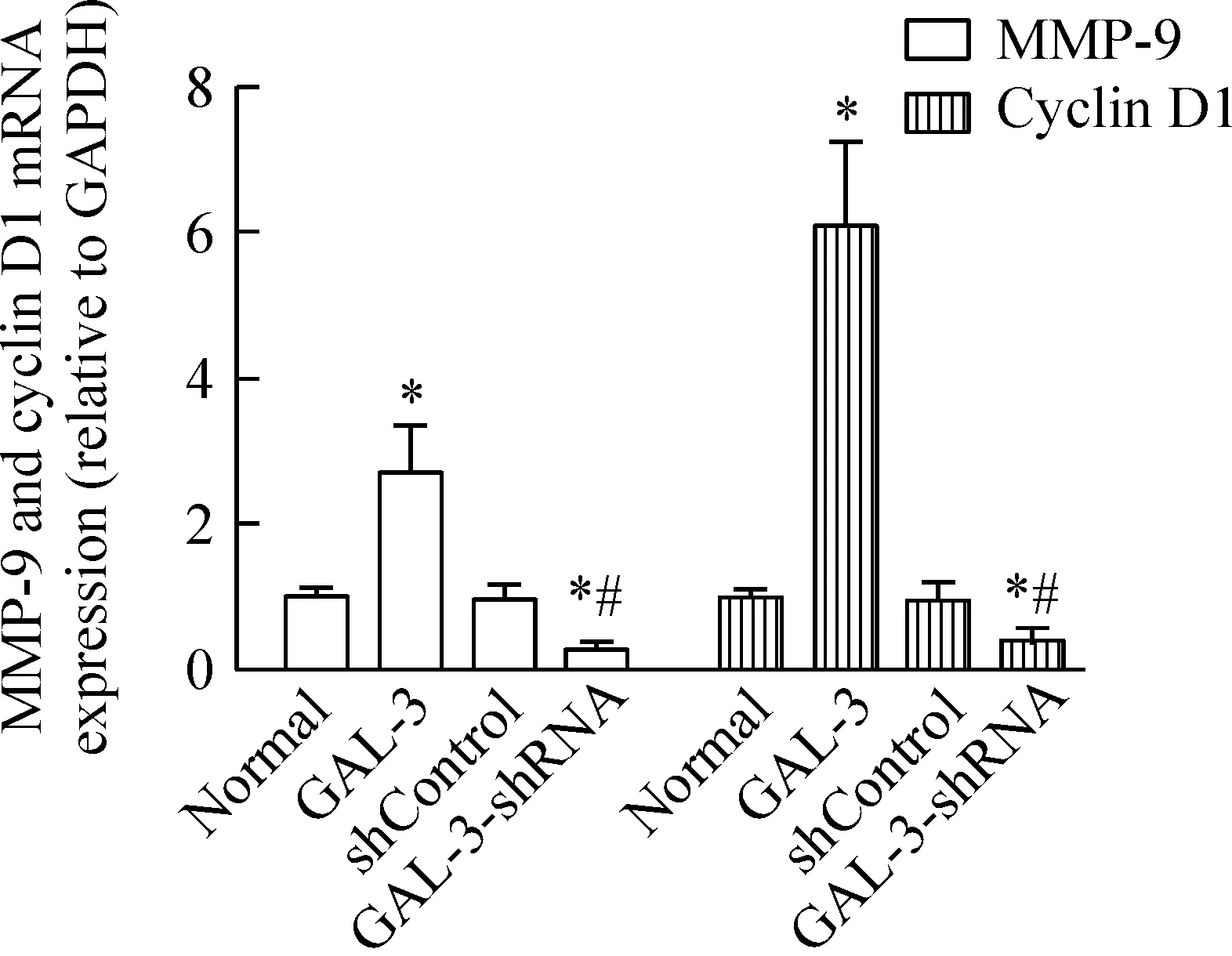
Figure 4.The mRNA expression levels of MMP-9 and cyclin D1 in each group were detected by RT-qPCR. Mean±SD.n=3.*P<0.05vsnormal group;#P<0.05vsshControl group.
图4 RT-qPCR检测各组MMP-9和cyclin D1的mRNA表达水平
5 GAL-3诱导内皮细胞的迁移和增殖
通过划痕实验检测发现:与正常组相比,GAL-3重组蛋白明显诱导HUVECs的迁移(P<0.05),而GAL-3-shRNA组HUVECs的迁移能力明显低于正常组和阴性对照组(P<0.05),提示GAL-3参与内皮细胞的迁移。此外,通过CCK-8实验发现,GAL-3重组蛋白处理组的细胞活力明显高于正常组(P<0.05),而与正常组和阴性对照组相比,GAL-3-shRNA组的细胞活力则明显降低(P<0.05),见图5。
6 GAL-3参与HSP90-ERK1/2信号通路的激活,而与JNK信号通路无关
与正常组相比,GAL-3重组蛋白显著诱导HSP90和p-ERK1/2的蛋白水平增高,而GAL-3-shRNA组中的HSP90和p-ERK1/2蛋白水平明显低于正常组和阴性对照组(P<0.05),提示GAL-3可以明显激活HSP90-ERK1/2信号通路。同时,JNK信号通路作为诱导细胞凋亡的重要通路,本实验检测发现,p-JNK的蛋白水平在各组间差异无统计学显著性,提示GAL-3不参与JNK信号通路的激活,见图6。

Figure 5.The ability of migration (A, ×100) and the viability (B) of HUVECs in each group were detected by wound healing assay and CCK-8 assay, respectively. Mean±SD.n=3.*P<0.05vsnormal group;#P<0.05vsshControl group.
图5 各组HUVECs的迁移能力和细胞活力
讨 论
大量证据表明,血管重塑依赖于内皮细胞的活化,当血管内膜受到外界损伤或炎症刺激时,可诱导内皮细胞大量迁移、增殖和分泌细胞外基质,从而导致血管重塑,并促使不稳定斑块的形成,是临床上急性心血管事件重要的始动环节[8],因此针对血管内皮细胞的增殖、迁移及炎症反应的实验研究,可为临床不稳定性斑块的早期识别和干预奠定基础。本研究通过加入GAL-3重组蛋白及RNA干扰技术,证实GAL-3可诱导HUVECs生长、迁移以及炎症反应,其机制可能与HSP90/ERK1/2信号通路激活有关。
研究表明,炎症反应是激活内皮细胞的关键,其中GAL-3能促进巨噬细胞活化及单核细胞趋化,增加MCP-1、IL-6、MMP-9等因子的表达,而这些炎症因子及趋化因子在AS发展中起着重要的作用[2]。MCP-1作为重要的趋化因子,其诱导单核细胞迁移和渗透是激发内皮细胞炎症因子IL-6等释放的重要环节[9]。研究表明,阻断MCP-1表达可以明显减少血管内皮细胞炎症反应并起到稳定斑块的作用。我们的实验结果发现,HUVECs中炎症因子MCP-1和IL-6可被GAL-3重组蛋白诱导表达,而GAL-3 RNA干扰则可有效抑制炎症因子的表达水平,进一步证实GAL-3参与内皮细胞细胞的炎症反应。此外研究发现,GAL-3 的表达可以作为转录的标志,活化状态细胞GAL-3表达水平高于静息状态的细胞[10],进一步促进炎症因子的释放。因此,GAL-3重组蛋白明显诱导HUVECs自身的GAL-3表达, 从而扩大其自身作用效应,其机制可能与GAL-3激活内皮细胞而使其处于增殖状态有关,但具体机制尚不清楚

Figure 6.The protein level of HSP90 (A) and the phosphorylation of ERK1/2 (B) and JNK (C). Mean±SD.n=3.*P<0.05vsnormal group;#P<0.05vsshControl group.
图6 Western blot检测检测各组HSP90、p-ERK1/2和p-JNK的蛋白水平变化
。
此外,细胞外基质的降解是血管重塑重要的内在因素之一,MMP-9通过降解细胞外基质的大多数蛋白质,诱导血管重塑,促使易损斑块的形成[11]。细胞周期调控细胞的增殖与凋亡,cyclin D1作为重要的细胞周期蛋白,其表达水平高低反映细胞的增殖能力。为了进一步验证GAL-3对HUVECs的生长和迁移的影响,本研究通过检测了MMP9、Cyclin D1表达、以及CCK-8增殖实验和细胞划痕实验探讨HUVECs的增殖和迁移能力。结果发现,GAL-3能够调节HUVECs的生长与迁移。因此,GAL-3的促炎症反应和促生长效应可能是其参与AS不稳定斑块形成过程主要环节。
HSP90 为作为心脏内源性保护蛋白,外界刺激因素(如热应激、缺氧、炎症反应等)可诱导细胞内HSP90 表达增加,以减轻细胞的损伤[12]。此外,研究发现,在大鼠骨髓间充质干细胞中HSP90可以选择性地增强ERK1/2信号通路,从而调控细胞增殖和迁移[13]。ERK1/2与JNK同属于丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族的成员[14],ERK1/2主要参与从细胞膜到细胞核的信号转导,是调控细胞生长、分化、凋亡的重要信号通路。JNK信号通路可受外界应激刺激而被活化,从而引起一系列级联反应,诱导细胞凋亡。本研究结果显示,GAL-3可调控HUVECs的生长与迁移,GAL-3重组蛋白明显诱导HSP90和ERK1/2磷酸化水平上调,而GAL-3基因干扰可有效抑制HSP90和p-ERK1/2的表达水平,但不影响JNK活性。因此,GAL-3诱导HUVECs生长、迁移以及炎症反应可能与HSP90/ERK1/2信号通路有关,但与JNK信号通路无关。
综上所述,GAL-3促进血管内皮细胞生长、迁移及炎症反应的发生,为防治血管重塑和动脉粥样硬化提供了新的思路。
[1] 谭晓勇, 罗 茂, 卢培林, 等. miR-30c调控PAI-1对血管内皮细胞活力和迁移的影响[J].中国病理生理杂志, 2016, 32(12): 2199-2204.
[2] 禹艳红, 潘善培, 谢琪璇, 等. Galectin-3在雌性小鼠生殖系统中的表达及脂多糖的影响[J].中国病理生理杂志, 2009, 25(7):1409-1414.
[3] Meijers WC, López-Andrés N, de Boer RA. Galectin-3, cardiac function, and fibrosis[J]. Am J Pathol, 2016, 186(8):2232-2234.
[4] Chen SS, Sun LW, Brickner H, et al. Downregulating galectin-3 inhibits proinflammatory cytokine production by human monocyte-derived dendritic cells via RNA inter-ference[J]. Cell Immunol, 2015, 294(1):44-53.
[5] Arar C, Gaudin JC, Capron L, et al. Galectin-3 gene (LGALS3) expression in experimental atherosclerosis and cultured smooth muscle cells[J]. FEBS Lett, 1998, 430(3):307-311.
[6] Mackinnon AC, Liu X, Hadoke PW, et al. Inhibition of galectin-3 reduces atherosclerosis in apolipoprotein E-deficient mice[J]. Glycobiology, 2013, 23(6):654-663.
[7] Falcone C, Lucibello S, Mazzucchelli I, et al. Galectin-3 plasma levels and coronary artery disease: a new possible biomarker of acute coronary syndrome[J]. Int J Immunopathol Pharmacol, 2011, 24(4):905-913.
[8] Moran A, Gu D, Zhao D, et al. Future cardiovascular disease in China: Markov model and risk factor scenario projections from the coronary heart disease policy model-China[J]. Circ Cardiovasc Qual Outcomes, 2010, 3(3):242-252.
[9] Tanimoto A, Murata Y, Wang KY, et al. Monocyte chemoattractant protein-1 expression is enhanced by granulocyte-macrophage colony-stimulating factor via Jak2-Stat5 signaling and inhibited by atorvastatin in human monocytic U937 cells[J]. J Biol Chem, 2008, 283(8): 4643-4651.
[10]李庆宽, 张育民. 半乳糖凝集素-3与冠状动脉粥样硬化性心脏病的研究进展[J].心血管病学进展, 2013, 34(3): 394-398.
[11]Kampoli AM, Tousoulis D, Papageorgiou N, et al. Matrix metalloproteinases in acute coronary syndromes: current perspectives[J]. Curr Top Med Chem, 2012, 12(10): 1192-1205.
[12]Kazimirko VK, Kutovoy VV, Bobyk VI, et al. Chape-rones function HSP60 and HSP90 and their role in cardiac pathology[J]. Lik Sprava, 2014, (9-10):19-24.
[13]Gao F, Hu X, Xie X, et al. Heat shock protein 90 stimulates rat mesenchymal stem cell migration via PI3K/Akt and ERK1/2 pathways[J]. Cell Biochem Biophys, 2015, 71(1): 481-489.
[14]Wang Z, Niu Q, Peng X, et al. Mitofusin 2 ameliorates aortic remodeling by suppressingras/raf/ERK pathway and regulating mitochondrial function in vascular smooth muscle cells[J]. Int J Cardiol, 2015, 178:165-167.
(责任编辑: 陈妙玲, 罗 森)
Effects of galectin-3 on growth, migration and inflammation of endothe-lial cells
ZHONG Lin1, LIANG Ping-ping1, GONG Lei2, WANG Jia-hui3, ZHU Yu-jie1, LIN Ze-run1, YANG Jun1
(1DepartmentofCardiology,2BiochipLaboratory,3CentralLaboratory,YantaiYuhuangdingHospitalAffiliatedtoMedicalCollegeofQingdaoUniversity,Yantai264000,China.E-mail:yangjun19640124@163.com)
AIM: To explore the effects of galectin-3 (GAL-3) on the viability, migration and inflammation of human umbilical vein endothelial cells (HUVECs) and the mechanisms. METHODS: The HUVECs were culturedinvitroand treated with GAL-3 recombinant protein at 2 mg/L or GAL-3 short hairpin RNA (shRNA). The HUVECs were divided into normal group, recombinant GAL-3 group, shControl group and GAL-3-shRNA group. The mRNA expression of GAL-3, monocyte chemotactic protein (MCP)-1, IL-6, matrix metalloproteinase (MMP)-9 and cyclin D1 was detected by real-time quantitative PCR, and the protein expression of GAL-3, IL-6 and MCP-1 was detected by Western blot. The secretion levels of MCP-1 and IL-6 in the culture medium were measured by ELISA. The viability and the ability of migration of the HUVECs were examined by CCK-8 assay and wound healing assay. The protein levels of heat shock protein 90 (HSP90), ERK1/2, p-ERK1/2, JNK and p-JNK were determined by Western blot. RESULTS: The expression of GAL-3, MCP-1 and IL-6 at mRNA and protein levels, the mRNA expression of MMP-9 and cyclin D1, and the secretion levels of MCP-1 and IL-6 in the culture medium were significantly higher than those in normal group (P<0.05) after the HUVECs were treated with GAL-3 recombinant protein. However, these molecules mentioned above in GAL-3-shRNA group were significantly lower than those in normal group and negative control group (P<0.05). Compared with normal group, the viability and migration ability of the HUVECs in recombinant GAL-3 group were significantly increased, but the viability and migration ability of the HUVECs in GAL-3-shRNA group were lower than those in normal group and shControl group (P<0.05). In addition, the protein levels of p-ERK1/2 and HSP90 in recombinant GAL-3 group were higher than those in normal group (P<0.05), but those in GAL-3-shRNA group were lower than those in normal group and shControl group (P<0.05). The protein level of p-JNK was not oviously changed among the 4 groups. CONCLUSION: GAL-3 is involved in regulating the cell growth, migration and the release of inflammatory cytokines in vascular endothelial cells, which may be mediated by HSP90-ERK1/2 signaling pathway.
Galectin-3; Endothelial cells; Cell migration; Inflammation
1000- 4718(2017)06- 1065- 08
2016- 10- 19
2017- 01- 12
国家自然科学基金资助项目(No. 81571636);山东省自然科学基金资助项目(No. ZR2015HM058);山东省医药卫生发展计划资助项目(No. 2015WS0017);烟台市科技发展计划项目(No. 2013WS224; No. 2015WS021)
R363
A
10.3969/j.issn.1000- 4718.2017.06.018
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 13808900219; E-mail: yangjun19640124@163.com
▲并列第1作者

