元素分析仪与质谱仪联用鉴定蜂蜜掺假的研究
陈亚威, 张业鹏
(湖北工业大学机械工程学院, 湖北 武汉 430068)
元素分析仪与质谱仪联用鉴定蜂蜜掺假的研究
陈亚威, 张业鹏
(湖北工业大学机械工程学院, 湖北 武汉 430068)
绝大多数的天然蜂蜜均来自C3植物,其总体蜂蜜和蜂蜜蛋白均来自相同的植物碳源,二者的碳同位素组成应该相等,即δ13CH=δ13CP。由于商业利益驱使的一些掺假行为,例如掺入C4植物糖浆,总体蜂蜜δ13CH发生改变,变化大小取决于掺假量和掺假糖浆的δ13C,但是蜂蜜蛋白δ13CP很稳定几乎不变。本实验利用稳定同位素技术鉴定62个蜂蜜样品,结果显示有19.35%的蜂蜜不合格,掺假掺杂主要以添加碳-4植物源转化产物和淀粉糖浆为主。
元素分析-同位素质谱; 蜂蜜; 掺假;δ13C值
蜂蜜中主要含葡萄糖、果糖和蔗糖,以及丰富的蛋白质、氨基酸、有机酸、多种维生素和矿物质等,特别是其含有淀粉酶、蔗糖转化酶、过氧化氢酶和脂酶等多种活性酶类。由于近些年蜂蜜在国内外需求量的增大,我国蜂蜜年销量远大于产量,导致蜂蜜掺假掺杂行为出现。目前,测定蜂蜜掺假的主要方法有液相色谱示差折光检测法、薄层色谱法(TLC法)、糖类指纹图谱法、元素分析同位素比值质谱法和离子色谱法等。对于现在市面上的掺假手段,如在蜂蜜中加入C3或C4植物糖浆,以上方法耗时长,受干扰多,灵敏度不高。随着稳定同位素比质谱技术的发展,以及连续流在线装置的集成化、多功能化和多样化,稳定同位素分析结果成为快速评鉴蜂蜜是否掺假的强有力证据。稳定同位素比质谱仪与Flash 2000元素分析仪联用,实现了快速高效、高精度和准确度测定总体蜂蜜δ13CH和蜂蜜蛋白δ13CP,成为国内外商品蜜检测工具。
1 实验准备
1.1 实验样品
本实验所有蜂蜜来源于湖北省食品质量安全监督检验研究所日常抽检的62个蜂蜜样品。
1.2 材料与试剂
钨酸钠(Na2WO4·2H2O)、超纯水(Millipore公司)、硫酸(H2SO4)、锡杯(8 mm×5 mm)、标准物质(IAEA)、0.45 μm水相滤膜。
分别制备10%的钨酸钠溶液和0.335 mol/L硫酸溶液。
1.3 主要仪器设备
Flash 2000 HT元素分析仪,与元素分析仪联用的Delta V Advantage稳定同位素比质谱仪(EA-IRMS),恒温水浴锅,低速离心机。
1.4 样品制备
制备总体蜂蜜和蜂蜜蛋白,使用锡囊包裹。制备已知δ13C标准物质(如Caffeine),使用锡囊包裹。
总体蜂蜜的制备:将蜂蜜样品充分搅拌,分出试样,装入样品瓶,密封,常温下保存。蜂蜜试样经0.10~0.14 mm孔径尼龙滤布过滤,除去试样中固体杂质后,使用百(十)万分之一天平称取0.05 g,再用锡杯包裹。按上述方法重复制备3份式样。
蜂蜜蛋白的制备:称取10 g左右干净的蜂蜜样品于50 mL离心管中,然后在离心管中加入5 mL的超纯水后充分混匀。在一个50 mL的烧杯里分别加入2.0 mL 10 % 的钨酸钠溶液和2.0 mL 0.335 mol/L的硫酸溶液,迅速混匀后,再加到上述盛蜂蜜试样的离心管中,然后再混匀。把混匀后的蜂蜜样品离心管放置于80℃水浴锅中震荡加热不少于60 min,注意在加热的过程中每间隔5~10 min把蜂蜜样品离心管拿出来再振荡20 s,直到有絮状物析出。用超纯水注满离心管并充分混匀后放入离心机,在3500 r/min的转速下离心5 min,后弃去上层清液,用超纯水充分洗涤沉淀物,如此反复离心和洗涤沉淀物5次,最后把上清液倒完,将含有全部沉淀蛋白质的离心管置于80℃烘箱中烘干3 h 以上。使用百(十)万分之一天平称取烘干的蛋白试样80~120 μg,再用锡杯包裹。每个蜂蜜蛋白样品可重复制备3个。未有絮状物析出的试样,继续补加10 % 钨酸钠溶液和0.335 mol /L硫酸溶液各2.0 mL,离心5 min后仍未见沉淀,认为是无蛋白蜂蜜样品。把含有蛋白的蜂蜜样品包好入锡杯中备用。
1.5 实验条件
EA-IRMS质谱条件:氧化管温度,1 000℃;还原管温度,825 ℃;炉温,50℃;真空度,1.0×10-6Pa;氦气流速,120 mL/min;GC管温,90℃。每个样品平行测定2次。
2 实验原理
采用Flash 2000 HT元素分析仪与Delta V Advantage稳定同位素比质谱仪联用设备,在线测定总体蜂蜜和蜂蜜蛋白的δ13C。将处理好的试样装入锡囊中,通过固体自动进样器,载入具有纯氧脉冲、氧化还原剂、脱卤去硫剂存在的在线式全自动Flash燃烧管中,试样中的有机碳全部转化为CO2,经化学纯化及GC分离,由ConFlo IV装置的Open Split接口,导入IRMS中,测定CO2的δ13C,就相当于原试样中有机碳的δ13C。
Flash 2000 HT元素分析仪的氧化炉和还原炉采用一体化设计,即动态快速燃烧炉,与氧化炉和还原炉分开设计相比,具有更低的样品消耗量和更高的灵敏度。在动态快速燃烧模块中,Flash燃烧管从下到上依次填充Ag2Co3O4、Cu和Cr2O3这三种化学填料,分别用作脱卤去硫剂、还原剂和氧化剂,不同的化学填料之间通过薄层石英棉隔开。
另外,Flash 2000 HT元素分析仪的另一端还配置了高温裂解 (TC/EA)模块。这样,一台元素分析仪就实现了多元素 (C/N/H/O)的同位素比测定,更有利于后续开展蜂蜜试样的多元素同位素比值分析和真实性鉴别工作。
3 实验过程
包裹好的蜂蜜样品,按照已创建的测试序列,依次摆放在固体进样器的样品盘上(第1个样品放在进样口,后面的样品依次摆放),然后盖上盘盖,待上机测定。
在计算机上打开Acquisition软件窗口,在Flash HT / CO2模式下,打开待测序列,选择待测目标,点击Start,在弹出的Start Sequence窗口,为Results文件夹和Results文件命名,然后开始测试。计算机会自动给出蜂蜜样品的δ13C值。
4 实验结果与分析
62个蜂蜜样品的测试结果见表1。
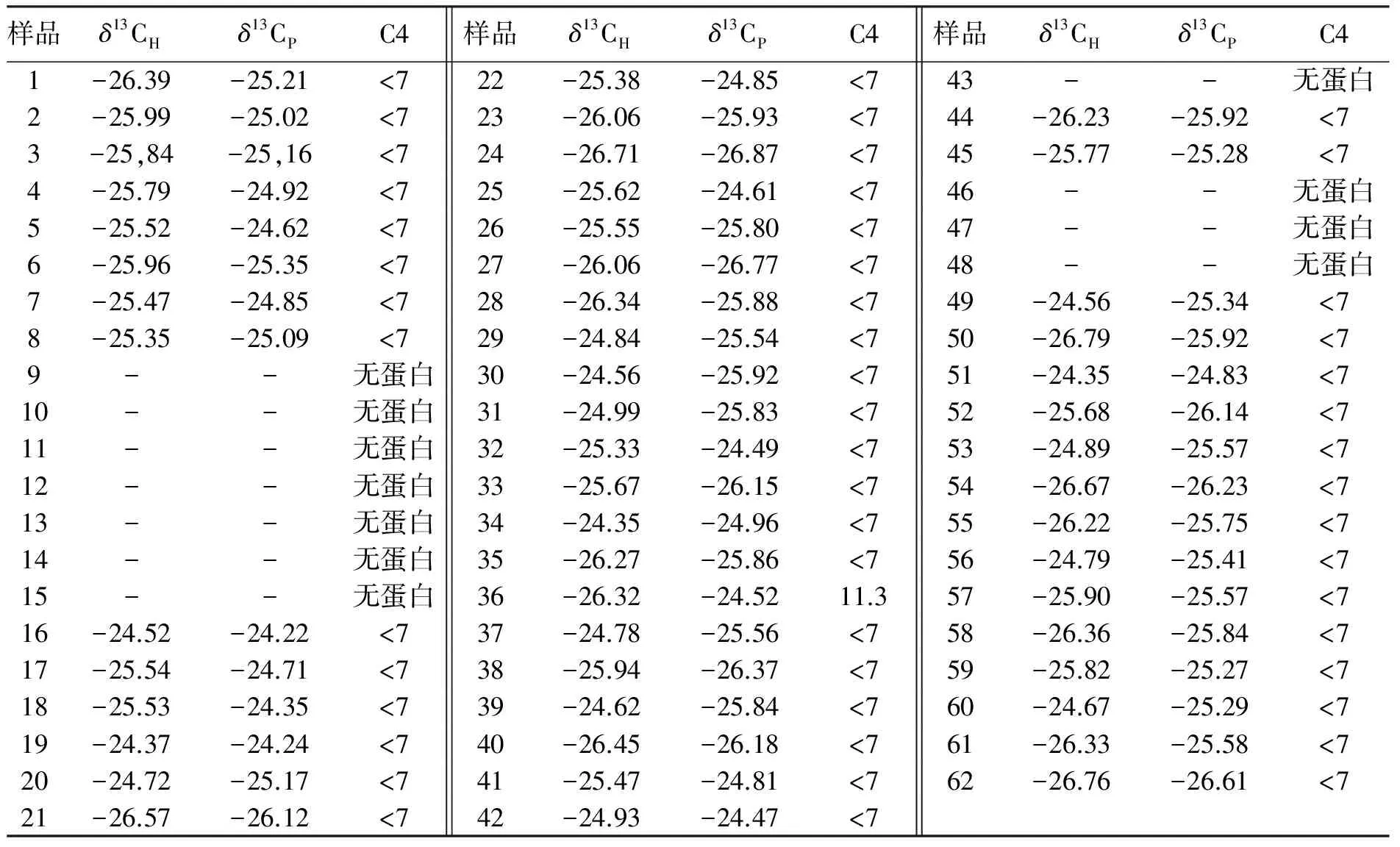
表1 EA-IRMS测定不同蜂蜜样品的稳定碳同位素比值 ‰
从表1的统计数据来看,本实验中蜂蜜样品中总的δ13CH值和蜂蜜蛋白δ13CP的值的范围在-24.3‰~-26.9‰之间变化,大部分蜂蜜的δ13CH值和蜂蜜蛋白δ13CP都十分接近,根据美国分析化学家协会正式分析方法(AOAC 998.12)和中华人民共和国国家标准方法(GB/T 18932.1-2002),采用动态燃烧装置与稳定同位素比质谱仪联用技术测定总体蜂蜜δ13CH和蜂蜜蛋白δ13CP,根据同位素质量平衡方程可计算商品蜂蜜中的C4植物糖浆的碳含量
这里, -9.7代表一般地C4植物糖浆的δ13C平均值 (‰)。当计算结果为负值时,其C4植物糖含量按0计;当计算结果大于或等于7 % 时,应认为含有C4植物糖(主要指玉米糖或甘蔗糖),即认为掺假。
表1中9、10、11、47号等11个蜂蜜样品中是没有提取出来蜂蜜蛋白的,由于真实蜂蜜中含有蛋白,所以这11个蜂蜜样品为假蜂蜜样品。而36号蜂蜜样品计算结果C4大于7%,所以36号蜂蜜样品也为掺假蜂蜜样品。其他蜂蜜样品C4均小于7%,所以在使用本实验方法时,有12个蜂蜜样品判定为掺假蜂蜜样品,占蜂蜜样品总数的19.35%。
图1为测定纯蜂蜜的δ13C的离子流强度-时间(Intensity-Time)谱图,前面连续2个参考气CO2的平峰脉冲,蜂蜜试样中的碳,经过在线快速燃烧和恒温GC分离,全部转化为CO2,进行同位素比质谱分析,样品气CO2在谱图上显示为尖峰。
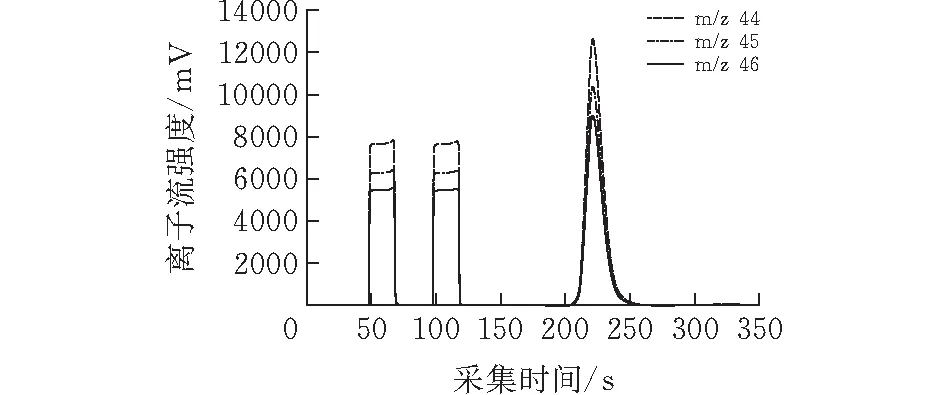
图 1 EA-IRMS方法测定蜂蜜碳δ13C的离子流强度-时间的谱图分析
使用电阻各不相同的万用三杯接收器分别接收m/z 44、m/z 45和m/z 46的离子流,在谱图上以电
压信号表示,所有CO2脉冲的离子流强度由低到高依次为m/z 44、m/z 45和m/z 46。根据参比峰和样品峰的m/z 45与m/z 44离子流强度之比,得出样品气CO2的13C/12C。每个蜂蜜试样重复测定3次,δ13C测定精度均好于0.15‰。说明本实验精度较高,结果准确。
[1] GB/T 18932.1-2002. 蜂蜜中碳-4 植物糖含量测定方法-稳定碳同位素比率法[S].
[2] GB/T 18932.22-2003.蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的测定方法-液相色谱示差折光检测法[S].
[3] 费晓庆,吴斌,沈崇钰,等.液相色谱/元素分析-同位素比值质谱联用法鉴定蜂蜜掺假[J].色谱,2011,29(1):15-19.
[4] 丁涛. 液相色谱-同位素质谱联用法在蜂蜜掺假鉴定方面的应用[C].第四届华东地区色谱、质谱学术报告会, 2010.
[5] Tremblay P, Paquin R. Improved detection of sugar addition to maple syrup using malic acid as internal standard and in C-13 isotope ratio mass spectrometry (IRMS)[J]. Journal of Agricultural & Food Chemistry, 2007, 55(2):197-203.
[6] Simsek A, Bilsel M, Goren A C.13C/12C pattern of honey from Turkey and determination of adulteration in commercially available honey samples using EA-IRMS[J]. Food Chemistry, 2012, 130(4):1115-1121.
[7] Padovan G J, Jong D D, Rodrigues L P, et al. Detection of adulteration of commercial honey samples by the13C/12C isotopic ratio[J]. Food Chemistry, 2003, 82(4):633-636.
[8] 黄文诚. 用不同的方法检测高果糖玉米糖浆掺假的蜂蜜[J]. 中国蜂业, 2009, 60(9):51-52.
[9] 罗东辉,罗海英,冼燕萍,等.同位素质谱联用技术鉴别无蛋白蜂蜜的真实性[J].现代食品科技,2012,28(7):862-866.
[责任编校: 张 众]
Element Analyzer with a Stable Isotope Ratio Massspectrometry Combined with Identification of Adulteration in Honey
CHEN Yawei, ZHANG Yepeng
(SchoolofMechanicalEngin.,HubeiUniv.ofTech.,Wuhan430068,China)
Honey is a kind of high-quality natural sweetening agent. The vast majority of natural honey comes from C3 plants. The overall honey and honey protein are from the same plant carbon source, whose carbon isotope composition should be equal; that is, Delta13CH= Delta13CP. Due to some adulteration of commercial interest, for example, the incorporation of plant C4 syrup, honey, overall13CHis changed depending on the size and amount of syrup adulteration adulteration of delta13C; however, Delta13CPprotein is stable but honey is almost the same. In this study, 62 honey were identified by stable isotope technique.The results showed that 19.35% samples of honey adulteration is not qualified, mainly because carbon doped -4 plant transformation products and starch syrupwere were added. Therefore,the monitoring and management of this kind of adulteration should be strengthened.
elemental analysis isotope mass spectrometry;honey;adulteration;δ13C
2017-03-08
陈亚威(1991-), 男,湖北武汉人,湖北工业大学硕士研究生,研究方向为食品质量控制与检测
1003-4684(2017)02-0021-03
S896.1, TS207.3
A

