“房颤一站式治疗”的方法学与疗效评估
杜先锋 综述 储慧民 审校
综述
“房颤一站式治疗”的方法学与疗效评估
杜先锋 综述 储慧民 审校
心房颤动简称“房颤”,是目前临床最受关注且循证医学进展最为迅速的心律失常之一。除抗凝、心室率控制等治疗手段外,从症状控制角度而言,导管消融(包括射频、冷冻等能量来源)是目前指南推荐的首选治疗方法,但其尚未能作为有效的心源性卒中预防手段而得到认可;而经皮左心耳封堵技术则弥补了该空白,成为卒中高危、不能耐受长期抗凝的房颤患者更好的选择之一。由此而衍生的“房颤一站式治疗”也成为当前业界的热门话题之一。本文就“房颤一站式治疗”的方法学及疗效进展进行讨论。
心房颤动;导管消融;左心耳封堵;卒中;抗凝治疗
心房颤动(atrial fibrillation,AF)简称“房颤”,是临床上最为常见的心律失常之一。房颤症状的治疗及卒中风险的干预进展一直是近年来心血管领域最为热门的话题之一。当前,房颤的治疗原则仍以针对基础疾病的“上游治疗”、抗凝治疗、节律控制及室率控制为主,但随着最新循证医学证据的不断积累,新型口服抗凝药(NOAC)的应用、经皮左心耳封堵(left atrial appendage closure,LAAC)以及联合导管射频消融或冷冻球囊消融与经皮LAAC的“房颤一站式治疗”都是目前的热点。
1 导管消融能抑制房颤进展吗?
2014年AHA/ACC/HRS房颤指南[1]中,已将症状性、非永久性房颤列为导管消融的适应证,其中阵发性房颤的导管消融已列为ⅠA类适应证,并去除了诸多前提限制。2016年ESC房颤指南[2]中,也已将导管消融作为阵发性房颤的首选治疗手段之一。但在导管消融让更多房颤患者转复窦律并从中获益的同时,我们也应该清醒地认识到,导管消融仍不能完全消除房颤消融术后房性心律失常。2013年Verma等[3]利用植入性心电监测设备(ICM)对有症状及无症状性房颤患者在导管消融前后的心律变化进行持续监测,结果表明尽管消融术可显著降低房性心律失常负荷,但仍不能使其完全消除。在术后无症状的患者中,甚至发现房性心律失常发作频率、周期及无症状天数均显著高于术前。德国Tilz等[4]曾对202例行导管射频消融治疗的长程持续性房颤患者进行5年多的随访,结果发现单次手术后仅20.3%的患者可长期维持窦律。由此可见,导管消融仍无法完全阻止房颤进展,这与其固有的病理生理机制有关。
目前,学术界公认房颤是纤维性心房心肌病的一种表现形式。从病理生理机制上看,心房纤维化、心房重构与房性心律失常之间存在因果关系。人类术中标本分析提示,心房纤维化系细胞外间隙胶原组织过度沉积,导致细胞偶联发生改变,产生心肌细胞间冲动传导各向异性的不均一,进而促使各种折返性心律失常的发生[5]。临床上,心房纤维化可无相应症状表现,也可表现为房颤、心房内折返性心动过速及病态窦房结综合征。心房纤维化是心房肌的一种不可逆转的病理生理进程,按其纤维化程度可分为轻度、中度及重度。Marrouche等[6]通过延迟增强磁共振(DE-MRI)技术对心房纤维化进行定位及量化,提出所谓“Utah分级”,即0%~5%增强为Utah Ⅰ级,5%~20%增强为Utah Ⅱ级,20%~35%增强为Utah Ⅲ级,>35%增强为Utah Ⅳ级。临床研究发现,Utah分级所估算的心房纤维化程度与年龄分布存在显著相关性[7],这也从侧面证明了心房纤维化进程的不可逆性。
因此,目前的房颤指南Ⅲ类适应证中,对于不能接受抗凝治疗的患者不推荐行导管消融,也不推荐使用导管消融维持窦律作为抗凝治疗的替代,即暂未推荐房颤导管消融作为预防血栓栓塞事件的治疗手段。
2 房颤抗凝任重道远
中国是全球房颤抗凝治疗的“重灾区”。2011年公布的RE-LY研究数据[8]显示,作为房颤大国的中国,口服抗凝药(OAC)使用率却只有10%左右,显著低于全球甚至亚洲平均水平。在与此相对应的房颤抗凝治疗率调查中,来自中国的数据更令人担忧。2005年的EuroHeart调查[9]及2003年的ATRIA队列研究[10]显示,在欧美国家的房颤患者中华法林的治疗率分别达到67%及55%,而2008年我国Zhou等[11]发表的中国心房颤动现状的流行病学调查结果却显示,在29 079例房颤患者中,华法林的使用率只有2.7%。新近发布的中国房颤注册研究(CAFR)[12]显示,非瓣膜性房颤(non-valvular atrial fibrillation,NVAF)患者初始抗凝一年后,有44.4%的患者停药,2年停药率高达57.6%。Gallagher等[13]调查显示,房颤抗凝治疗的依从性呈逐年递减趋势,这在不同年龄段的人群中均适用。
这些研究结果在让人震惊的同时,也给所有心血管医生带来了思考:我们在大力、全面推进房颤抗凝治疗的同时,还有哪些可以突破的领域?在卒中预防方面,我们还有什么工作可以开展?
3 干预心耳,内外科谁更有优势?
为了在房颤治疗上有所突破,人们把视线聚焦在了针对左心耳(LAA)的干预上。流行病学调查发现,房颤引起20%以上的缺血性卒中,使栓塞性卒中的风险至少高于无房颤人群的5倍[14]。而LAA则是房颤患者血栓的重要来源。经尸检、食管超声心动图(TEE)或外科术中直视发现,房颤患者心腔内血栓发生率为13%,其中90%以上的心房血栓均来自于LAA[15]。理论上LAA的封闭或封堵手术可显著降低房颤患者心源性栓塞的发生率。
曾几何时,LAAC一直作为术中的辅助治疗手段而存在。2014年AHA/ACC/HRS房颤指南[1]也认为,心脏外科术中预防性切除或封闭LAA,是一种降低房颤患者未来血栓栓塞事件风险的手段。但事实真的如此吗?2017年Circulation杂志上发表的著名的Mayo Clinic心脏外科数据库调查结果[16]显示,在9 792例冠脉搭桥术和/或瓣膜外科手术患者中,行外科LAAC的患者469例(11例外科切除,458例套扎),并与非LAAC者相比,结果发现,术后早期(30 d内)房颤的发生率为34%,其中行外科LAAC的患者占68%,LAAC是心脏外科术后房颤发生的独立预测因子[OR值3.88(2.89~5.20)]。从预防卒中的角度来看,该研究经过平均9.1年的随访发现,无论是原始分组还是按照倾向性积分校正后的分组,外科LAAC对远期卒中的发生率均无影响[HR=1.07(0.72~1.58)],且对远期生存率也无影响[HR=0.92(0.75~1.13)]。无独有偶,2015年发表的一项外科联合手术对卒中预防的研究[17]中,入选260例持续性房颤或长程持续性房颤患者行二尖瓣外科手术(MVS),同时行外科LAAC,随机分为联合外科消融组[又随机分为肺静脉隔离(pulmonary vein isolation,PVI)亚组或双方Maze术式亚组]和不消融组。结果发现,外科LAAC联合消融治疗虽然可以显著降低房颤的发生率,但其获益与消融策略无关,而且外科联合治疗也未能改善死亡率[HR=0.76(0.32~1.84)]或复合终点[死亡、卒中、心衰住院、心衰加重,HR=1.12(0.67~1.89)]。
但值得我们关注的是,与单纯外科心内膜消融相比,外科联合手术不仅显著延长了长程持续性房颤患者的手术时间[(276.9±63.5)minvs.(203.15±67.34)min,P<0.001]和住院天数(5 dvs. 1 d,P<0.001),更增加了主要并发症及死亡率的风险(20.8%vs. 2.9%,P=0.036)。外科杂交手术12个月(24%vs. 63%,P<0.001)及24个月(19%vs. 54%,P<0.001)的手术成功率均低于单纯心内膜消融。
由此可见,外科途径对房颤的联合干预似乎并没有达到理想的效果,其显著的创伤及并发症风险可能使得房颤的外科联合治疗举步维艰。2016年欧洲房颤指南[2]也指出,外科对LAA的封闭干预需考虑到术后心耳残余漏或不完全切除所带来的卒中风险,无论是开胸心脏手术术中封闭或切除LAA,还是外科房颤消融时封闭或切除LAA,甚至经胸腔镜单独行LAAC手术,术后对于有卒中风险的患者仍推荐继续口服抗凝药治疗。
在此背景下,经皮LAAC应运而生。目前临床上循证医学依据最多的左心耳封堵设备为Watchman封堵器。在早期的PROTECT AF前瞻性研究[18]中,随机选择了房颤合并血栓栓塞高风险的患者,经皮LAAC与华法林治疗对比,结果提示主要终点事件(卒中、心血管及不明原因死亡、全身性栓塞)发生率可较单用华法林抗凝治疗降低40%,卒中风险可较华法林治疗降低32%,充分验证了经皮LAAC技术的安全性和有效性。该研究长达4年的随访结果[19]进一步证实,无论是主要终点事件,还是心血管死亡及全因死亡,经皮LAAC均显著优于华法林;其后的CAP研究[20]进一步验证了经皮LAAC技术成熟后可相对于早期经验进一步提高安全性(安全性终点可较PROTECT AF研究进一步降低53%)。ASAP研究[21]则前瞻性入组了华法林禁忌的房颤卒中高危患者,结果发现经皮LAAC可在此类人群中降低卒中风险达77%,手术成功率及安全性均令人满意。针对华法林耐受人群的前瞻性注册研究——PREVAIL研究[22],其安全性终点更是较PROTECT AF研究进一步降低49%。从临床效果来看,经皮LAAC由于围术期相关并发症的原因,初期临床获益相对较低,但随着时间的延长,到3年时其临床获益已超过华法林;而从经济效益来看,虽然经皮LAAC手术费用较高,但其整体费用在5年时已与NOACs持平,7年时与华法林持平,10年后经皮LAAC的经济效益优势明显[23]。因此,目前最新的房颤指南[2]认为,经皮LAAC技术已可作为口服抗凝药不能耐受的房颤患者抗凝治疗的可靠替代方案。而我国2014年发布的《左心耳干预预防心房颤动患者血栓栓塞事件:目前的认识和建议》[24]也将经皮LAAC列为高卒中风险和长期口服抗凝药禁忌患者的Ⅱ b类适应证(B级证据)。
4 房颤的“内科一站式治疗”
在肯定经皮LAAC有效替代抗凝治疗的基础上,“房颤一站式治疗”的理念呼之欲出,其最终目的是通过一次性住院手术,达到卒中预防和症状治疗的联合干预。
最早的“内科一站式治疗”经验[25]发表在2012年的Journal of the American Heart Association杂志上,该研究共入选了30例房颤患者,其中阵发性房颤43%,持续性房颤40%,长程持续性房颤17%,平均CHADS2评分2.5分,平均CHA2DS2-VASc评分3分,HAS-BLED评分2分。30例患者均顺利完成房颤导管消融并成功植入Watchman封堵器,平均封堵器尺寸24 mm;术中经TEE确认封堵器到位,即刻残余漏者3例。联合手术效率较高,平均术程97.3 min,其中经皮LAAC时间38 min,平均住院日2 d,可较传统外科杂交或联合手术显著提高手术室及病房周转率。内科联合手术安全性较好,围术期未发生严重并发症(无心包积液、空气栓塞或大出血)。术后随访1年,窦律维持率为70%,封堵器残余漏2例,所有患者均未出现血栓栓塞事件。另一项发表在Europace上的研究[26]也得到了类似的结论,35例CHA2DS2-VASc及HAS-BLED评分均为3.1分的症状性房颤患者接受内科联合治疗后,即刻成功率为97%,其中Watchman与ACP(Amplatzer cardiac plug)封堵器分别为29例及6例;围术期3例出现心包填塞,未发现其他严重并发症。术后TEE随访,仅1例患者存在<5 mm的微小残余漏,其余均完全封闭。术后13个月随访窦律维持率为78%,97%停用口服抗凝药,结果令人满意。其中1例Watchman封堵器植入患者因房颤复发进行了再次消融,术中未见封堵器对消融操作存在不良影响。
“房颤一站式治疗”中,如果先行经皮LAAC术式,封堵器尤其是ACP封堵器的外盘是否会影响消融导管操作呢?德国汉堡圣乔治中心2015年的报道[27]显示,使用两种封堵器的联合治疗均未影响后续术中的房颤导管操作,8例患者中有3例在PVI基础上行前壁及二尖瓣峡部线消融,其中1例还进行了LAA电隔离。消融术前TEE证实,所有病例均未出现封堵器移位、残余漏或血栓,术后随访仅1例患者在第113天发现Watchman封堵器表面出现附着血栓(图1),该患者一直使用达比加群酯150 mg·2次/d抗凝。

A、C和B、D分别为封堵完成后在消融前及消融后的经食管心超(TEE)结果。6号患者:左房消融前(A)及消融后(B)均未见封堵器移位、残余漏及血栓形成。8号患者:消融前后也未见上述情况发生(C),但该患者在消融后第113天随访时发现封堵器血栓附着(10 cm×12 cm,附着于封堵器的前上部,如D中虚箭头所示),而此前该患者一直服用达比加群抗凝治疗。AV:主动脉瓣;LA:左房;Watchman:Watchman左心耳封堵器
如果先行房颤消融,我们可能有何顾虑呢?Phillips等[28]对98例平均CHA2DS2-VASc积分2.6分的房颤患者,在导管消融后即刻进行了经皮LAAC(均使用Watchman封堵器),消融前后超声对比发现,部分病例在左上肺静脉与左心耳之间的嵴部(ridge)存在消融后的即刻水肿。但从经皮LAAC术后即刻超声结果看,似乎封堵器与水肿部位还有明显距离。所有病例中经皮LAAC成功率为94%,术后12个月完全封堵率为86%,消融成功率为77%。6周随访时新发封堵器边缘漏28例(抗凝方案:29%使用华法林,39%使用达比加群酯,32%使用利伐沙班);6个月随访时18例残余漏消失,另外10例1年随访时残余漏均<2 mm。这可能与消融后水肿导致器械血栓及封堵器“露肩”(shoulder protrusion)有关。
与此同时,该研究也是目前“房颤一站式治疗”随访时间最长的报道。经过长达5年的随访,98例患者中仅1例(CHA2DS2-VASc评分5分)在术后24个月时发生左侧额叶急性梗死(神经内科考虑其病因为动脉粥样硬化)。该患者起搏器程控记录提示联合治疗术后一直维持窦律,术后TEE结果也一直令人满意(仅2 mm固定边缘漏)。1例患者术后5个月因非疾病原因自杀,尸检发现封堵器表面完全内皮化,无心源性血栓(图2)。
对于“房颤一站式治疗”我们需要关注的另一个问题是心耳干预与房颤负荷的相关性。Romanov等[29]入选了89例CHA2DS2-VASc评分≥2分、HAS-BLED评分≥3分的房颤患者,随机接受单纯PVI(44例)或PVI联合经皮LAAC(45例)治疗。经过24个月的随访发现,额外行经皮LAAC的患者如我们所预期,并未改善房颤远期复发率(60%vs. 66%,P=0.49),但其在空白期内的房颤负荷显著高于仅行PVI组,在术后第1和第2个月组间差异均有统计学意义(P值分别为0.004和0.04),即经皮LAAC有增加患者空白期内房颤负荷的风险。故而我们需要考虑的是,单纯行经皮LAAC的患者其围术期3个月内的左房压和房颤负荷是否均会显著升高?如果答案是肯定的,那么经皮LAAC后常规45 d抗凝方案是否有延长的必要?
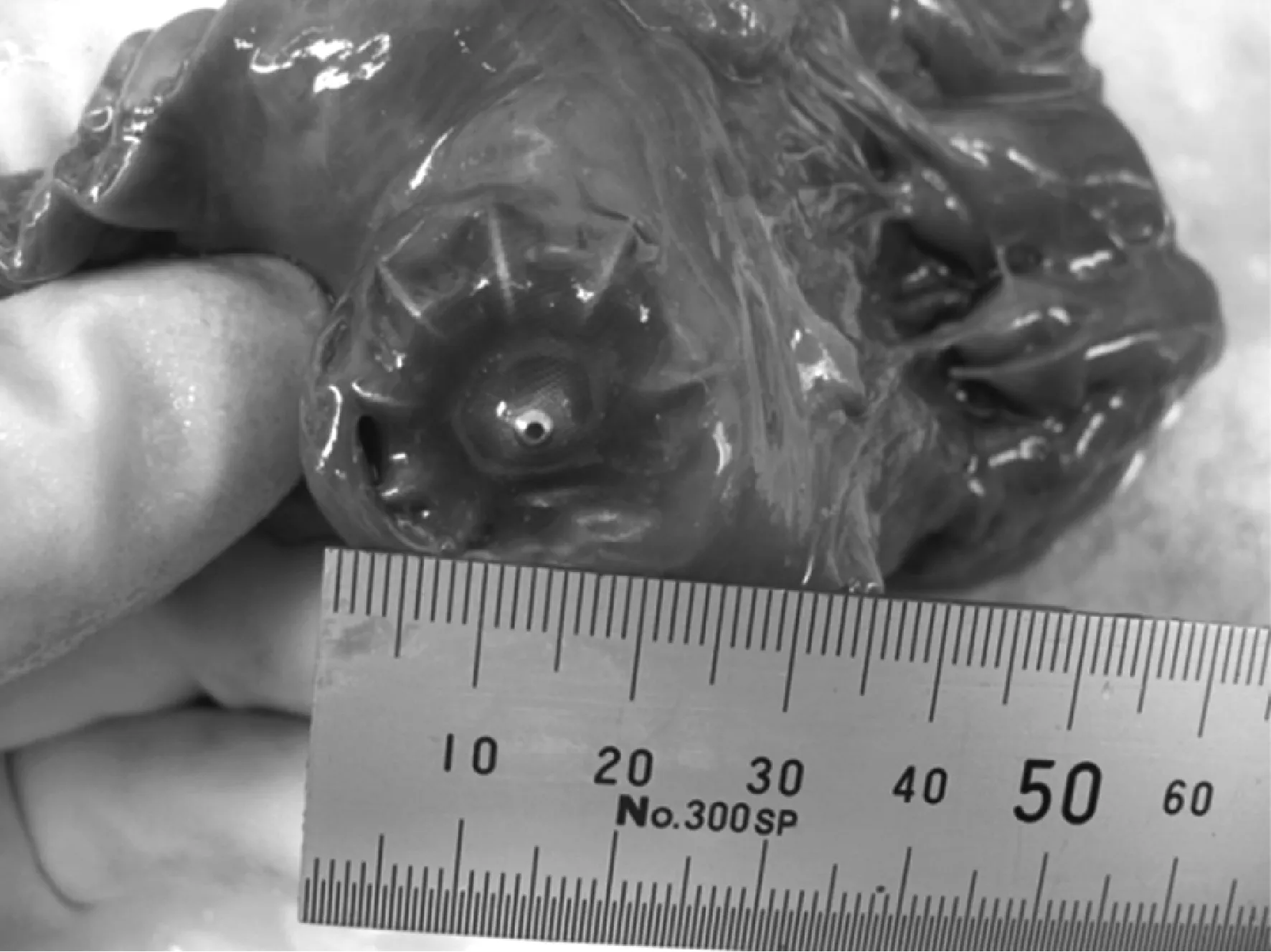
图2 LAAC术后5个月封堵器表面完全内皮化
对于“房颤一站式治疗”的尝试还不仅仅局限于导管射频消融,2016年Europace刚刚发布了冷冻球囊消融联合经皮LAAC的研究结果[30],设计上述两种主流LAA封堵器,入选人群中有20%是持续性房颤患者,既往有卒中/一过性脑缺血(TIA)病史者占86%。结果同样令人满意,经过24个月随访,单次消融成功率达71%,再次消融成功率达84%,一年时TEE随访完全封堵率为92%,未发生血栓栓塞事件或出血事件。
5 一站式治疗:宁波经验
宁波市第一医院心律失常诊疗中心是国内最早倡导房颤内科介入一站式治疗的中心之一,早在2015年就完成了国内首例房颤消融联合经皮LAAC手术。统计近50例一站式治疗数据发现,平均CHADS2评分(3.1±1.2)分,平均CHA2DS2-VASc评分(4.8±1.5)分,平均HAS-BLED评分(3.5±1.1)分,房颤合并左房血栓史及卒中/TIA病史者占86%。92%的患者于局麻加深度镇静下完成手术,平均手术耗时(185.8±37.4)min,平均X线时间(25.0±45.8)min,X线剂量(246.5±180.5) mGy。术中使用Watchman封堵器30例,平均封堵器直径(28.5±3.2)mm;ACP封堵器20例,平均封堵器直径(25.2±3.5)mm。术中未出现封堵失败病例及严重围术期并发症,总体安全性良好。
目前,一站式治疗所针对的患者人群主要是不适合抗凝或卒中高危的症状性房颤患者。总体而言,一站式治疗的安全性好,可降低卒中或血栓栓塞事件,且不增加手术风险。联合手术还可以减少患者对二次手术的恐惧,空白期之后抗凝方案即可改为双联抗血小板治疗,从而可减少高卒中风险患者房颤消融术后长期抗凝治疗带来的出血风险。目前我们尚未发现因肺静脉与心耳间嵴部水肿导致左心耳口径测量不符所致的封堵器安置不当或脱落的情况,也未发现联合术式导致手术中断、延长手术时间的情况或增加血管并发症等的风险。即使使用ACP封堵器,也未发现封堵盘遮挡嵴部对消融造成的不利影响。当然,联合手术的缺点是增加了单次手术及住院费用[平均手术费用(13.7±1.7)万元]。
我们有理由相信,随着联合手术经验的不断积累,“房颤一站式治疗”会在改变房颤介入治疗策略的同时,让更多高卒中风险或不能耐受口服抗凝药的症状性房颤患者进一步获益。
[1] January CT,Wann LS,Alpert JS,et al.2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society[J]. J Am Coll Cardiol,2014,64(21): e1-e76.
[2] Kirchhof P,Benussi S,Kotecha D,et al. 2016 ESC guidelines for the management of atrial fibrillation developed in collaboration with EACTS[J].Europace,2016,18(11): 1609-1678.
[3] Verma A,Champagne J,Sapp J,et al.Discerning the incidence of symptomatic and asymptomatic episodes of atrial fibrillation before and after catheter ablation (DISCERN AF): a prospective, multicenter study[J]. JAMA Intern Med,2013,173(2): 149-156.
[4] Tilz RR,Rillig A,Thum AM,et al. Catheter ablation of long-standing persistent atrial fibrillation: 5-year outcomes of the Hamburg Sequential Ablation Strategy[J]. J Am Coll Cardiol,2012,60(19): 1921-1929.
[5] Hirsh BJ,Copeland-Halperin RS,Halperin JL. Fibrotic atrial cardiomyopathy, atrial fibrillation, and thromboembolism: mechanistic links and clinical inferences[J].J Am Coll Cardiol,2015,65(20): 2239-2251.
[6] Marrouche NF,Wilber D,Hindricks G,et al. Association of atrial tissue fibrosis identified by delayed enhancement MRI and atrial fibrillation catheter ablation: the DECAAF study[J]. JAMA,2014,311(5): 498-506.
[7] Mahnkopf C,Badger TJ,Burgon NS,et al. Evaluation of the left atrial substrate in patients with lone atrial fibrillation using delayed-enhanced MRI: implications for disease progression and response to catheter ablation[J]. Heart Rhythm,2010,7(10): 1475-1481.
[8] Ezekowitz MD,Nagarakanti R,Noack H,et al. Comparison of dabigatran and warfarin in patients with atrial fibrillation and valvular heart disease: the RE-LY trial (randomized evaluation of long-term anticoagulant therapy)[J]. Circulation,2016,134(8): 589-598.
[9] Nieuwlaat R,Capucci A,Camm AJ,et al. Atrial fibrillation management: a prospective survey in ESC member countries: the Euro Heart Survey on Atrial Fibrillation[J]. Eur Heart J,2005,26(22): 2422-2434.
[10] Go AS,Hylek EM,Chang Y,et al. Anticoagulation therapy for stroke prevention in atrial fibrillation: how well do randomized trials translate into clinical practice?[J].JAMA,2003,290(20): 2685-2692.
[11] Zhou Z,Hu D. An epidemiological study on the prevalence of atrial fibrillation in the Chinese population of mainland China[J]. J Epidemiol,2008,18(5): 209-216.
[12] Wang ZZ,Du X,Wang W,et al. Long-term persistence of newly initiated warfarin therapy in chinese patients with nonvalvular atrial fibrillation[J]. Circ Cardiovasc Qual Outcomes,2016,9(4): 380-387.
[13] Gallagher AM,Rietbrock S,Plumb J,et al. Initiation and persistence of warfarin or aspirin in patients with chronic atrial fibrillation in general practice: do the appropriate patients receive stroke prophylaxis?[J]. J Thromb Haemost,2008,6(9): 1500-1506.
[14] Wolf PA,Abbott RD,Kannel WB.Atrial fibrillation: a major contributor to stroke in the elderly. The Framingham Study[J]. Arch Intern Med,1987,147(9):1561-1564.[15] Blackshear JL,Odell JA. Appendage obliteration to reduce stroke in cardiac surgical patients with atrial fibrillation[J].Ann Thorac Surg,1996,61(2):755-759.
[16] Melduni RM,Schaff HV,Lee HC,et al. Impact of left atrial appendage closure during cardiac surgery on the occurrence of early postoperative atrial fibrillation, stroke, and mortality: a propensity score-matched analysis of 10 633 patients[J].Circulation,2017,135(4):366-378.
[17] Gillinov AM,Gelijns AC,Parides MK,et al. Surgical ablation of atrial fibrillation during mitral-valve surgery[J].N Engl J Med,2015,372(15):1399-1409.
[18] Reddy VY,Doshi SK,Sievert H,et al. Percutaneous left atrial appendage closure for stroke prophylaxis in patients with atrial fibrillation: 2.3-year follow-up of the PROTECT AF (Watchman left atrial appendage system for embolic protection in patients with atrial fibrillation) Trial[J]. Circulation,2013,127(6): 720-729.
[19] Reddy VY,Sievert H,Halperin J,et al. Percutaneous left atrial appendage closure vs warfarin for atrial fibrillation: a randomized clinical trial[J]. JAMA,2014,312(19): 1988-1998.
[20] Holmes DR,Reddy VY,Turi ZG,et al. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised non-inferiority trial[J]. Lancet,2009,374(9689): 534-542.
[21] Reddy VY,Möbius-Winkler S,Miller MA,et al. Left atrial appendage closure with the Watchman device in patients with a contraindication for oral anticoagulation: the ASAP study (ASA plavix feasibility study with Watchman left atrial appendage closure technology)[J]. J Am Coll Cardiol,2013,61(25): 2551-2556.
[22] Holmes DR,Kar S,Price MJ,et al. Prospective randomized evaluation of the Watchman left atrial appendage closure device in patients with atrial fibrillation versus long-term warfarin therapy: the PREVAIL trial[J]. J Am Coll Cardiol,2014,64(1): 1-12.
[23] Reddy VY,Akehurst RL,Armstrong SO,et al. Time to cost-effectiveness following stroke reduction strategies in AF: warfarin versus NOACs versus LAA closure[J]. J Am Coll Cardiol,2015,66(24): 2728-2739.
[24] 黄从新.左心耳干预预防心房颤动患者血栓栓塞事件:目前的认识和建议[J].中华心律失常学杂志,2014,18(6): 401-415.
[25] Swaans MJ,Post MC,Rensing BJ,et al. Ablation for atrial fibrillation in combination with left atrial appendage closure: first results of a feasibility study[J]. J Am Heart Assoc,2012,1(5): e002212.
[26] Calvo N,Salterain N,Arguedas H,et al. Combined catheter ablation and left atrial appendage closure as a hybrid procedure for the treatment of atrial fibrillation[J].Europace,2015,17(10): 1533-1540.
[27] Heeger CH,Rillig A,Lin T,et al. Feasibility and clinical efficacy of left atrial ablation for the treatment of atrial tachyarrhythmias in patients with left atrial appendage closure devices[J]. Heart Rhythm,2015,12(7): 1524-1531.
[28] Phillips KP,Walker DT,Humphries JA. Combined catheter ablation for atrial fibrillation and Watchman left atrial appendage occlusion procedures: five-year experience[J].J Arrhythm,2016,32(2): 119-126.
[29] Romanov A,Pokushalov E,Artemenko S,et al. Does left atrial appendage closure improve the success of pulmonary vein isolation? Results of a randomized clinical trial[J]. J Interv Card Electrophysiol,2015,44(1): 9-16.
[30] Fassini G,Conti S,Moltrasio M,et al. Concomitant cryoballoon ablation and percutaneous closure of left atrial appendage in patients with atrial fibrillation[J].Europace,2016,18(11): 1705-1710.
The methodology and efficacy evaluation of “one-stop treatment of atrial fibrillation”
Du Xian-feng, Chu Hui-min
(Arrhythmia Treatment Center, Ningbo First Hospital, Ningbo Zhejiang 315010, China)
Atrial fibrillation(AF) as one kind of arrhythmias has gained the most attention clinically and the greatest progress in evidence-based medicine at present. Besides the therapies such as anticoagulant therapy and ventricular rate control, catheter ablation(energy sources including radiofrequency and freezing) is the first choice of treatment recommended by guidelines at present from the perspective of symptom control. However, its effectiveness in preventing against cardiac apoplexy has not been authorized yet. The technique of percutaneous left atrial appendage occlusion fills the blank and becomes one of the better choices for AF patients who are high-risky of stroke and intolerance of permanent anticoagulant therapy. The derivative “one-stop treatment of AF” thereof has become one of hot topics of current industry. This paper discusses the methodology of the “one-stop treatment of AF” and advances of its curative effect.
atrial fibrillation; catheter ablation; left atrial appendage occlusion; stroke; anticoagulant therapy
315010 浙江 宁波,宁波市第一医院心律失常诊疗中心
杜先锋,副主任医师,主要从事心律失常诊治及心脏电生理与起搏介入治疗。
储慧民,E-mail:markchu@126.com
10.13308/j.issn.2095-9354.2017.03.014
2017-04-10) (本文编辑:李政萍)
R541.75
A
2095-9354(2017)03-0212-06

