特异性抑制JAK/STAT3信号通路对大鼠肝细胞癌的影响*
于景霞 刘 婷 李沁恺 徐铭益 陆伦根
上海交通大学附属第一人民医院消化科(200080)
特异性抑制JAK/STAT3信号通路对大鼠肝细胞癌的影响*
于景霞#刘 婷 李沁恺 徐铭益 陆伦根&
上海交通大学附属第一人民医院消化科(200080)
背景:研究表明,异常激活的JAK/STAT3信号通路可促进肝细胞癌(HCC)发生、发展;转化生长因子-β1(TGF-β1)在肿瘤进展中发挥双向调节作用。目的:探讨特异性抑制JAK/STAT3信号通路对HCC的影响以及TGF-β1信号通路在其中的可能作用。方法:30只Wistar大鼠随机分为对照组、HCC组和HCC+AG490组,后两组以二乙基亚硝胺制作HCC模型,HCC+AG490组造模第1周腹腔内注射JAK特异性抑制剂AG490。第16周末处死大鼠,记录肝内肿瘤结节的最大直径,计数最大直径>1 cm的肿瘤结节数,以real-time PCR、免疫组化和免疫荧光染色检测肝组织中STAT3、TGF-β1的表达和分布。结果:与对照组相比,HCC组肝组织中STAT3、TGF-β1 mRNA表达显著增高(P<0.05)。磷酸化STAT3(p-STAT3)、TGF-β1蛋白在对照组肝组织中呈阴性表达,在HCC组则分别呈阳性和强阳性表达,且两者有明显的共表达区域。HCC+AG490组STAT3、TGF-β1 mRNA表达较HCC组显著降低(P<0.05),p-STAT3、TGF-β1蛋白呈弱阳性表达,直径>1 cm的肿瘤结节数和最大直径均显著小于HCC组[1.20±1.03和(1.14±0.18) cm 对4.30±1.06和(1.78±0.27) cm,P均<0.05]。结论:特异性抑制JAK/STAT3信号通路可抑制HCC发生、发展,其机制可能与抑制TGF-β1信号通路有关。
癌,肝细胞; STAT3转录因子; 转化生长因子β1
研究表明,异常激活的Janus蛋白酪氨酸激酶/信号转导和转录活化蛋白3(JAK/STAT3)信号通路可促进肝细胞癌(HCC)发生、发展[1-2]。正常肝组织内,作为STAT3活化状态的磷酸化STAT3(p-STAT3)几乎不表达,在HCC组织中的表达则显著增强,并与预后不良相关,提示阻断JAK/STAT3信号通路可能作为HCC的治疗靶点[2]。AG490是一种人工合成的JAK特异性抑制剂[3],可特异性地抑制JAK/STAT3信号通路激活。转化生长因子-β1(TGF-β1)是一种多能细胞因子,可调节细胞增殖、分化、凋亡,参与损伤修复、血管形成、细胞外基质形成[4],并在肿瘤进展中发挥双向调节作用[5]。本研究旨在探讨在大鼠HCC模型中特异性抑制JAK/STAT3信号通路对HCC发生、发展的影响,以及TGF-β1信号通路在其中的可能作用。
材料与方法
一、实验动物和主要试剂
清洁级健康雄性Wistar大鼠30只,约6周龄,体质量140~160 g,由中国科学院上海实验动物中心提供,饲养于上海交通大学附属第一人民医院实验动物中心,自由饮水和进食。
二乙基亚硝胺(diethylnitrosamine,DEN)、AG490(Sigma-Aldrich Co.LLC.),TRIzol RNA 分离试剂(Invitrogen,Thermo Fisher Scientific),real-time PCR引物[生工生物工程(上海)股份有限公司],逆转录试剂盒(TaKaRa Bio Inc.), real-time PCR试剂盒(Promega Corporation),p-STAT3单克隆抗体、TGF-β1单克隆抗体(Abcam plc.),GTVisionTMⅢ抗鼠/兔通用型免疫组化检测试剂盒[基因科技(上海)股份有限公司],FITC标记山羊抗兔、Cy3标记山羊抗鼠荧光二抗(Jackson ImmunoResearch)。
二、动物分组和HCC模型建立
将30只Wistar大鼠随机分为3组,对照组实验过程中饮用灭菌食用水,HCC组饮水中添加浓度为0.05 g/L的致癌物DEN,HCC+AG490组除予DEN干预外,造模第1周以1 mg·kg-1·d-1的剂量腹腔内注射JAK/STAT3信号通路抑制剂AG490。第16周末处死所有大鼠,完整取下肝脏,记录肝内肿瘤结节的最大直径,计数最大直径>1 cm的肿瘤结节数,同时留取肝组织行real-time PCR和免疫组化、免疫荧光染色。
三、方法
1.Real-time PCR:以TRIzol试剂提取肝组织总RNA,行RNA定量和电泳鉴定。以Primer Premier 5.0软件设计STAT3、TGF-β1引物序列,β-actin作为内参(表1)。参照试剂盒说明书将总RNA逆转录合成cDNA,以之为模板行real-time PCR扩增。反应条件: 95 ℃预变性10 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环。2-△△Ct法计算目的基因mRNA相对表达量。实验重复3次。

表1 Real-time PCR引物序列
2.免疫组化染色:肝组织以4%甲醛溶液固定,石蜡包埋、切片,切片脱蜡、水化,PBS浸洗,抗原修复,阻断内源性过氧化物酶,加入p-STAT3(1∶100)或TGF-β1(1∶100)单克隆抗体,4 ℃孵育过夜,按试剂盒说明书操作加入A液和B液,DAB显色,苏木精复染,脱水,封片,光学显微镜下观察、拍照。
3.免疫荧光染色:切片制作和处理同免疫组化染色,一抗孵育过夜后加入荧光二抗(1∶300),37 ℃ 孵育30 min,DAPI染核,封片,免疫荧光显微镜下观察、拍照。
四、统计学分析
结 果
一、肝组织STAT3、TGF-β1 mRNA表达
Real-time PCR检测显示,与对照组相比,HCC组肝组织中STAT3、TGF-β1 mRNA相对表达量显著增高,分别为2.06±0.24(P=2.62E-5)和3.23±0.36(P=3.44E-4);HCC+AG490组两者相对表达量分别为1.41±0.14和1.57±0.26,均较HCC组显著降低(P=2.13E-4,P=3.38E-6)。
二、肝组织p-STAT3、TGF-β1蛋白表达和定位
免疫组化染色显示,p-STAT3蛋白在对照组肝组织中呈阴性表达,在HCC组肝组织中呈阳性表达,在HCC+AG490组肝组织中,表达强度较HCC组减弱。TGF-β1蛋白在各组肝组织中的表达趋势与p-STAT3蛋白一致,在对照组肝组织内几乎不表达,在HCC组肝组织内则呈强阳性表达,HCC+AG490组表达强度较HCC组明显减弱(图1)。
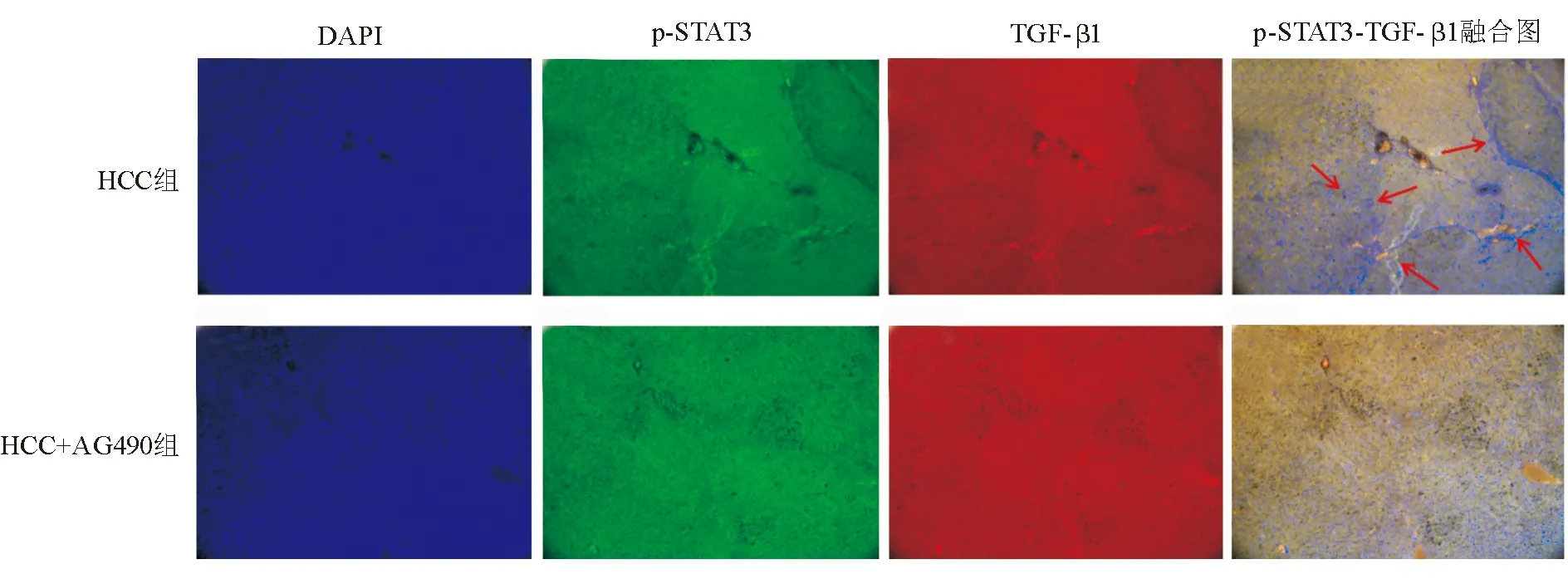
免疫荧光染色显示,HCC组肝组织内可观察到p-STAT3蛋白(绿色荧光)和TGF-β1蛋白(红色荧光)阳性表达,两者有明显的共表达区域,HCC+AG490组肝组织内两者表达强度明显减弱,共表达区域明显减少(图2)。
三、HCC模型肿瘤结节数和最大直径
对照组大鼠肝组织内未见肝癌结节,HCC组和HCC+AG490组大鼠肝组织内可观察到大小不等的肝癌结节。HCC组直径>1 cm的肿瘤结节数为4.30±1.06,最大直径为(1.78±0.27) cm,HCC+AG490组两组数据分别为1.20±1.03和(1.14±0.18) cm,均显著小于HCC组(P=3.21E-6,P=6.61E-6)。
讨 论
生理情况下,胞外细胞因子如白细胞介素-6(IL-6)、表皮生长因子(EGF)、肝细胞生长因子(HGF)等与膜受体结合后,可与JAK偶联,进一步使下游STAT3发生磷酸化, p-STAT3以二聚体的形式转移至胞核内,与靶基因特异性结合,发挥转录调控作用,参与调节细胞增殖、分化、凋亡等生物学过程[6]。JAK/STAT3信号通路激活的同时,其负反馈调节因子如含SH2结构域的蛋白酪氨酸磷酸酶(SHP)和细胞因子信号转导抑制因子3(SOCS3)亦被激活,以确保STAT3在迅速、短暂的激活后被及时灭活[7]。而在肿瘤微环境中,升高的IL-6、生长因子、活性氧簇(ROS)等可使STAT3持续激活,扰乱细胞生理活动,从而促进肿瘤发生。在特定组织细胞中特异性敲除STAT3基因的动物实验研究表明,STAT3是一个重要的促癌转录因子,参与了结肠癌[8]、HCC[1]等恶性肿瘤的发生,肝细胞特异性STAT3基因敲除可显著降低DEN诱导的小鼠HCC模型的肿瘤发生率,缩小肿瘤体积[1]。

图1 各组大鼠肝组织p-STAT3、TGF-β1免疫组化染色(×200)
箭头所示为p-STAT3蛋白与TGF-β1蛋白共表达区域
TGF-β1可与细胞表面跨膜受体TβRⅠ/Ⅱ结合,通过Smad或非Smad途径影响基因转录,发挥多种生物学功能[4]。研究表明,TGF-β信号通路可介导上皮-间质转化(EMT),增强肿瘤的迁移和侵袭能力[9];TGF-β1与HCC的肿瘤血管生成亦有密切关联,可为肿瘤生长和进展提供有利条件[10-11];此外,TGF-β介导的EMT还可使肿瘤细胞去分化而获得肿瘤干细胞特性,从而促进肿瘤进展[9]。
本研究以大鼠HCC模型为研究对象,观察以AG490特异性抑制JAK/STAT3信号通路对HCC以及TGF-β1信号通路的影响,结果显示HCC组和HCC+AG490组大鼠肝组织中STAT3 基因表达和蛋白磷酸化水平差异显著。HCC组大鼠肝组织中p-STAT3呈阳性表达,提示HCC发生过程中存在STAT3过度激活,而AG490可有效抑制STAT3基因表达和蛋白磷酸化。在HCC组和HCC+AG490组大鼠肝组织中,STAT3、TGF-β1基因和蛋白表达的变化趋势具有一致性,且免疫荧光染色证实两者在HCC组织中呈共表达。JAK/STAT3信号通路抑制后,模型大鼠肝癌结节的数量和体积均显著减小,表明HCC生长受抑。上述发现提示JAK/STAT3和TGF-β1信号通路在HCC的发生、发展中存在密切联系。
综上所述,本研究发现在HCC的发生、发展过程中存在JAK/STAT3信号通路过度激活,伴随TGF-β1信号通路活化;特异性抑制JAK/STAT3信号通路可抑制HCC发生、发展,其机制可能与抑制TGF-β1信号通路有关。上述发现为HCC的防治提供了新的靶点和思路。
1 He G,Yu GY,Temkin V,et al.Hepatocyte IKKbeta/NF-kappaB inhibits tumor promotion and progression by preventing oxidative stress-driven STAT3 activation[J].Cancer Cell,2010,17 (3):286-297.
2 Calvisi DF,Ladu S,Gorden A,et al.Ubiquitous activation of Ras and Jak/Stat pathways in human HCC[J].Gastroenterology,2006,130 (4):1117-1128.
3 Meydan N,Grunberger T,Dadi H,et al.Inhibition of acute lymphoblastic leukaemia by a Jak-2 inhibitor[J].Nature,1996,379 (6566):645-648.
4 Kamato D,Burch ML,Piva TJ,et al.Transforming growth factor-β signalling:role and consequences of Smad linker region phosphorylation[J].Cell Signal,2013,25 (10):2017-2024.
5 Ikushima H,Miyazono K.TGFbeta signalling:a complex web in cancer progression[J].Nat Rev Cancer,2010,10 (6):415-424.
6 Hirano T,Ishihara K,Hibi M.Roles of STAT3 in mediating the cell growth,differentiation and survival signals relayed through the IL-6 family of cytokine receptors[J].Oncogene,2000,19 (21):2548-2556.
7 Yasukawa H,Sasaki A,Yoshimura A.Negative regulation of cytokine signaling pathways[J].Annu Rev Immunol,2000,18:143-164.
8 Grivennikov S,Karin E,Terzic J,et al.IL-6 and Stat3 are required for survival of intestinal epithelial cells and development of colitis-associated cancer[J].Cancer Cell,2009,15 (2):103-113.
9 Katsuno Y,Lamouille S,Derynck R.TGF-β signaling and epithelial-mesenchymal transition in cancer progression[J].Curr Opin Oncol,2013,25 (1):76-84.
10 Li GC,Zhang HW,Zhao QC,et al.Mesenchymal stem cells promote tumor angiogenesis via the action of transforming growth factor β1[J].Oncol Lett,2016,11 (2):1089-1094.
11 Benetti A,Berenzi A,Gambarotti M,et al.Transforming growth factor-beta1 and CD105 promote the migration of hepatocellular carcinoma-derived endothelium[J].Cancer Res,2008,68 (20):8626-8634.
(2016-10-22收稿;2016-12-25修回)
Effect of Specific Inhibition of JAK/STAT3 Signaling Pathway on Hepatocellular Carcinoma in Rats
YUJingxia,LIUTing,LIQinkai,XUMingyi,LULungen.
DepartmentofGastroenterology,ShanghaiGeneralHospital,ShanghaiJiaoTongUniversitySchoolofMedicine,Shanghai(200080)
LU Lungen,Email:lungenlu1965@163.com
Carcinoma,Hepatocellular; STAT3 Transcription Factor; Transforming Growth Factor beta1
10.3969/j.issn.1008-7125.2017.05.004
国家科技部“十二五”国家科技重大专项(2013ZX10002004-002-003);国家自然科学基金(81570547)
#Email:yujingxia9535@163.com
&本文通信作者,Email:lungenlu1965@163.com
Background:Studies showed that aberrant activation of JAK/STAT3 signaling pathway promoted the tumorigenesis and progression of hepatocellular carcinoma (HCC),and transforming growth factor-β1 (TGF-β1) has either tumor-suppressing or tumor-promoting effect in regulation of tumor progression.Aims:To investigate the effect of specific inhibition of JAK/STAT3 signaling pathway on HCC and whether TGF-β1 signaling pathway is involved in this process or not.Methods:Thirty Wistar rats were randomly divided into three groups:control group,HCC group,and HCC+AG490 group.In the latter two groups,diethylnitrosamine was administered in drinking water to induce HCC model,and in HCC+AG490 group,AG490,a specific inhibitor of JAK was injected intraperitoneally in the first week of model establishment.At the end of the 16th week,all rats were sacrificed.The maximum diameter of tumor nodules in the liver was recorded and the number of tumors with maximum diameter greater than 1 cm was counted.Expression and distribution of STAT3 and TGF-β1 in liver tissue were determined by real-time PCR,immunohistochemistry,and immunofluorescence.Results:Compared with the control group,expressions of STAT3 and TGF-β1 mRNA in liver tissue were significantly increased in HCC group (P<0.05).Phosphorylated STAT3 (p-STAT3) and TGF-β1 proteins were absent in liver tissue in control group,and both were up-regulated and co-expressed in HCC group.While in HCC+AG490 group,expressions of STAT3 and TGF-β1 mRNA were significantly lower than those in HCC group (P<0.05);the liver tissue was weakly positive for p-STAT3 and TGF-β1 proteins,and the number of tumor nodules greater than 1 cm and the maximum diameter were markedly reduced when compared with the HCC group [1.20±1.03 and (1.14±0.18) cmvs.4.30±1.06 and (1.78±0.27) cm,Pall<0.05].Conclusions:Specific inhibition of JAK/STAT3 signaling pathway may restrain the tumorigenesis and progression of HCC partially by interfering TGF-β1 signaling pathway.

