氢基质自养微生物还原降解水中溴酸盐的可行性
李海翔, 张 欢, 蒋敏敏, 韩亚梅, 林 华, 夏四清
1.桂林理工大学环境科学与工程学院, 广西环境污染控制理论与技术重点实验室, 广西 桂林 541004 2.同济大学环境科学与工程学院, 污染控制与资源化研究国家重点实验室, 上海 200092 3.桂林理工大学, 岩溶地区水污染控制与用水安全保障协同创新中心, 广西 桂林 541004
氢基质自养微生物还原降解水中溴酸盐的可行性
李海翔1,3, 张 欢1, 蒋敏敏1, 韩亚梅1, 林 华1,3, 夏四清2
1.桂林理工大学环境科学与工程学院, 广西环境污染控制理论与技术重点实验室, 广西 桂林 541004 2.同济大学环境科学与工程学院, 污染控制与资源化研究国家重点实验室, 上海 200092 3.桂林理工大学, 岩溶地区水污染控制与用水安全保障协同创新中心, 广西 桂林 541004
BrO3-(溴酸盐)作为饮用水中存在的2B级潜在致癌物已引起社会公众的广泛关注. 微生物还原降解是一种净化水中BrO3-的有效途径. 基于序批式试验,研究了厌氧条件下微生物利用氢气作为电子供体还原降解水中BrO3-的可行性及关键影响因素. 结果表明,氢自养微生物能利用氢气为电子供体、BrO3-为电子受体,将BrO3-完全还原成一种稳定的无毒的终产物Br-. 在120 h的反应期内,ρ(BrO3-)从初始时的1.02 mgL降至0.56 mgL(去除率为44.5%),最高去除速率达0.26 mg(L·d),出水ρ(Br-)相应地升至0.29 mgL. 对照处理中,ρ(BrO3-)和ρ(Br-)均没有明显的降低和升高趋势. 影响因素试验表明,NO3--N和SO42-作为常规氧化性污染物(电子受体),反硝化和SO42-还原对BrO3-还原耗氢产生了竞争,致使BrO3-生物还原过程受到电子供体的竞争性抑制. 反硝化对BrO3-还原效率的影响程度比SO42-还原更加强烈. 初始ρ(BrO3-)对氢自养微生物还原降解BrO3-效率有较大影响. 氢自养微生物还原降解BrO3-最适宜的pH范围处于7.0~7.5之间. 研究显示,利用氢气作为电子供体的氢自养微生物将BrO3-还原成无毒的Br-是一种较为可行的生物处理技术或手段.
溴酸盐(BrO3-);氢自养微生物;生物还原
近年来,公众对水体中BrO3-(溴酸盐)的危害及毒理学效应越来越关注[1]. BrO3-是水经臭氧消毒产生的一类副产物,已被国际癌症研究机构定为2B级潜在致癌物,并且在高剂量时具有一定的DNA和染色体水平的遗传毒性[2-5]. 此外,BrO3-是一种强氧化剂,已经证明BrO3-会导致肾病,在动物试验中发现BrO3-使动物细胞出现肿瘤[6]. 我国新修订的GB 5749—2006《生活饮用水卫生标准》和GB 19298—2014《包装饮用水》中均已规定ρ(BrO3-)的标准限值为10 μgL[7-8]. 美国国家环境保护局和欧盟对ρ(BrO3-)的规定为MCL(最大污染水平)不得高于10 μgL[9]. 随着我国新标准的实施,饮用水中BrO3-被检测出超标的情况时有发生. 张萍等[10]对5种品牌瓶装水的BrO3-进行检测,发现有3种品牌严重超标(16~59 μgL). 2011年底国家质检总局公布了220种瓶(桶)装饮用水BrO3-检测情况,结果显示有6种出现超标(14~81 μgL)[11]. 2015年7月,北京市食药监局连续三批次查出饮用天然矿泉水BrO3-超标问题,最高超标2.1倍[12]. 由此可见,BrO3-已成为影响人们饮水安全的一大隐患.
BrO3-具有强稳定性、高溶解性、非挥发性和快迁移性等特点. 膜过滤、离子交换、吸附、化学还原等物化技术可以去除BrO3-[13-14],但因其非选择性、产生二次污染、甚至还需后续处理等原因,致使在实际应用中受到限制. 生物法作为一种绿色、高效的处理技术,已被用于处理一些无机化合物,如硝酸盐(NO3--N)、硫酸盐(SO42-)、高氯酸盐(ClO4-)等[15-17]. 有学者发现,BrO3-在厌氧或还原条件下能够被转化成无毒的Br-[13,18-22],但是在上述研究中,多以有机物(如乙醇、醋酸)、硫单质作为微生物生长代谢所需的能源或碳源. 然而,外加的电子供体(如有机碳源)会造成水体二次污染,其用量必须严格控制以适应其反应. 近些年来,以氢气为电子供体,无机碳(碳酸氢盐或CO2)为碳源的氢自养还原工艺在处理地下水或饮用水中的氧化性物质(如NO3--N、SO42-、CrO42-)中备受关注[17,23-26]. 早期应用该技术的氢气曝气方式氢气利用率低,而且溢出水面的氢气易发生爆炸,因而限制了传统曝气方式的应用. MBfR(氢基质生物膜反应器)是一种将微孔中空纤维膜曝气和氢自养还原工艺结合起来的新型水处理技术. 在MBfR中,受污染的水在膜层外部流动,氢气以一定的压力通入中空纤维膜内,在压力的作用下从膜的内层通过微孔扩散到外层,被纤维膜外生长的生物膜中的氢自养细菌作为电子供体而利用,同时将水中的氧化性物质还原降解. 这种逆向气体扩散方式强化了气液传质,提高了氢气利用效率(接近100%),降低了处理成本,还有效防止了爆炸性气体的产生[23-26]. 相比传统的氢气曝气方式,该工艺具有显著的高效性、经济性和安全性. 由此可见,氢气作为一种无毒、廉价、无二次污染的无机电子供体,在MBfR中被自养生物膜利用进行生物还原将成为一种去除BrO3-的有效途径.
该研究基于人工模拟BrO3-污染水体,考察以氢气为电子供体的自养微生物还原降解BrO3-的可行性及还原途径,同时分析初始ρ(NO3--N)、ρ(SO42-)、ρ(BrO3-)、pH等因素对BrO3-还原的影响,以期为后续开展MBfR去除BrO3-提供一些基础数据或理论参考,继而为BrO3-生物处理技术发展提供理论支撑.
1 材料与方法
1.1 模拟营养成分
试验用水为人工配水,其中以NaHCO3为无机碳源,NaNO3为无机氮源,同时含有营养元素以满足微生物生长代谢[23],以KH2PO4+Na2HPO4作为缓冲介质,维持溶液在中性左右,并防止还原过程中pH过度升高,具体成分见表1. 进行正式试验时,添加目标污染物模拟污染水样,模拟试验用水贮存在10 L的棕色玻璃瓶中. 由于在MBfR运行中,水中的DO(溶解氧)一般作为第一电子受体首先被氢自养微生物利用[25],目标污染物作为后续电子受体被还原,所以水中DO仅作为影响因素加以考虑,无需进行DO的脱除. 由于摇瓶(熟料血清瓶)体积有限,而且微生物处于悬浮状态,受水中DO耗氢的影响较大,为了降低DO对氢气利用的竞争,在营养液被注入摇瓶前通入氮气以去除水中的DO.
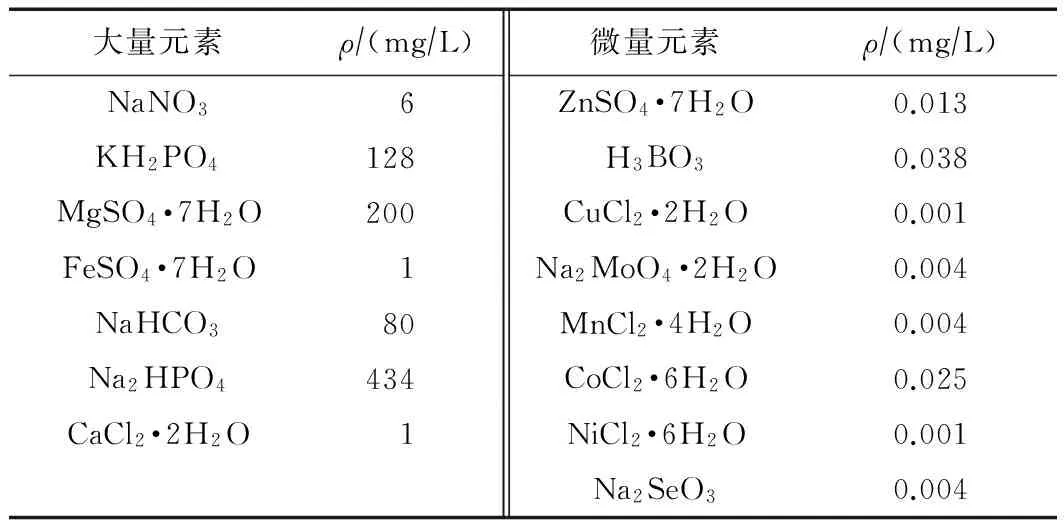
表1 模拟配水营养成分
1.2 氢自养菌培养及驯化
接种细菌来自广西环境污染控制理论与技术重点实验室的MBfR膜表面细菌. 取下来的生物膜样品与无菌水混匀,经过超声波打碎,再将混合液于7 000 r/min条件下冷冻离心10 min,产生的悬浊液为接种菌液. 将20 mL接种菌液添加到400 mL的塑料血清瓶中,投加营养液,保持液体总体积200 mL,初始pH调为7.2,氢气以0.04 MPa的压力注入血清瓶的顶空部分,人工轻轻晃动摇瓶,使反应溶液混合均匀,直至血清瓶膨胀后不再注入氢气,然后将血清瓶置于恒温振荡培养箱内培养(160 r/min、30 ℃). 反复此过程,直到摇瓶溶液中细菌生长速率恒定后认为驯化完成. 随后,添加目标污染物BrO3-,考察细菌能否进行还原反应和正常生长. 试验做3次平行,空白处理分别为无底物(BrO3-)、细菌灭活及无氢气,具体试验条件见表2. 每隔12 h取一次样,监测摇瓶内污染物浓度和细菌密度(生物量)的动态变化.

表2 批式可行性试验条件
1.3 影响因素试验
氢自养生物还原过程中要需要考虑的影响因素有初始ρ(NO3--N)、ρ(SO42-)、ρ(BrO3-)及pH. 在考察其中一个因素的影响时,固定其他因素不变〔ρ(NO3--N)、ρ(SO42-)、ρ(BrO3-)和pH的固定值分别为1、0、1 mg/L和7.2〕,分别考察ρ(NO3--N)分别为1、5、10、20、50 mg/L,ρ(SO42-)分别为10、20、50、100 mg/L,ρ(BrO3-)分别为0.1、0.5、1、2、4 mg/L,pH分别为6.5、7.0、7.5、8.0、8.5、9.0时对氢自养生物还原过程的影响. 为了确保准确性,每组试验设3个平行,反应周期均为120 h.
1.4 水质分析与生物量测定
水样经0.22 μm滤膜过滤后测定各参数.ρ(NO3--N)采用紫外分光光度法测定.ρ(SO42-)、ρ(BrO3-)和ρ(Br-)采用离子色谱仪(ICS-1000,美国戴安公司)测定,配备AS19分析柱和保护柱. 测试程序:样品注射;梯度淋洗,10 s内ρ(KOH)由1 120 mg/L升至2 800 mg/L;淋洗液2 800 mg/L持续35 min. 流速1 mL/min,最大抑制电流124 mA,液体注射体积为250 μL. 各离子的出峰时间:SO42-为14.6 min,BrO3-为5.1 min,Br-为9.4 min. 检测限:ρ(SO42-)为0.1 mg/L,ρ(BrO3-)为0.005 mg/L,ρ(Br-)为0.1 mg/L.
由于自养微生物生长缓慢,在水体中的微生物密度较低,生物量难以准确测定. 因此,将模拟水中ρ(VSS)(VSS为挥发性悬浮固体)视作自养微生物的生物量,在600 nm处测定混合液的OD600(光密度),根据文献[27-28]的方法建立生物量与OD600之间的相关性并最终计算出微生物的生物量(以干质量计).
2 结果与讨论
2.1 氢自养微生物对BrO3-的生物还原
由图1可见,当细菌接种到加有BrO3-的基质溶液中并通入氢气后,溶液中ρ(BrO3-)随时间推移逐渐降低,从反应初始的1.02 mg/L降至120 h时的0.56 mg/L,BrO3-去除率为44.5%,最高去除速率达到0.26 mg/(L·d). 对照组中,无氢气和细菌灭活处理组的ρ(BrO3-)经过120 h的反应期后降低不明显. 细菌灭活处理的ρ(BrO3-)有较小的下降趋势,这可能是生物固体物理吸附所致. 无氢气表示没有提供氢自养菌生长代谢需要的电子供体,所以细菌无法利用氢气获取能量,BrO3-无法作为电子受体被利用,因此,此对照组中出水ρ(BrO3-)稍微降低,亦可能为生物固体的物理吸附作用所致. 同时监测ρ(Br-)发现,试验组中的ρ(Br-)随时间推移逐渐升高,至反应结束时ρ(Br-)为0.29 mg/L,而细菌灭活处理和无氢气对照组中的ρ(Br-)均没有明显增加. 而初始混合液中不含Br-,因此可以推断出在有氢气和活性细菌的条件下,ρ(BrO3-)的降低主要是氢自养菌的生物还原作用所致.
由图1还可看出,氢自养细菌的生物量的变化规律与反应体系中ρ(BrO3-)和ρ(Br-)变化趋势相一致. 正常条件下(活体+氢气)微生物生物量呈明显上升趋势,从反应初始的4.85 mg/L升至反应结束时的10.78 mg/L(增加近1.3倍). 在无底物对照组,生物量有升高再降低的趋势,原因可能是自养菌利用氢气和基质中的营养物质进行生长代谢并从后期开始内源代谢甚至死亡,反应初始和结束时的生物量相当.
无氢气对照组的微生物生物量呈缓慢下降,这可能是因为反应器中的氢自养细菌无可用的电子供体存在,逐步死亡消耗后所致.
当向反应器中投加BrO3-以后,出水ρ(BrO3-)持续降低,并且ρ(Br-)随ρ(BrO3-)降低而升高. 通过对比试验可知,水中ρ(BrO3-)的降低是由氢自养微生物还原所致. 大量研究[18-20,29-30]表明,BrO3-生物还原途径如图2所示. 由图2可见,BrO3-先被还原为BrO2-,再逐步还原为Br-和O2,而O2在氢自养还原条件下可以获得电子生成H2O. 虽然BrO2-对微生物是一种有毒性的中间产物,但是在近中性条件下不稳定且容易被转化为稳定的还原产物Br-[30]. 基于完全反应化学计量学,还原1 mg/L的BrO3-将产生0.625 mg/L的Br-. 在反应周期内,监测出水ρ(Br-)与去除ρ(BrO3-)之比处于0.614~0.678之间,与完全反应理论比相近. 以上结果表明,在该研究条件下,自养微生物利用氢气为电子供体还原BrO3-的反应为完全还原,没有中间产物BrO2-的积累,即BrO3-被还原成了Br-(BrO3-+3H2→Br-+3H2O).
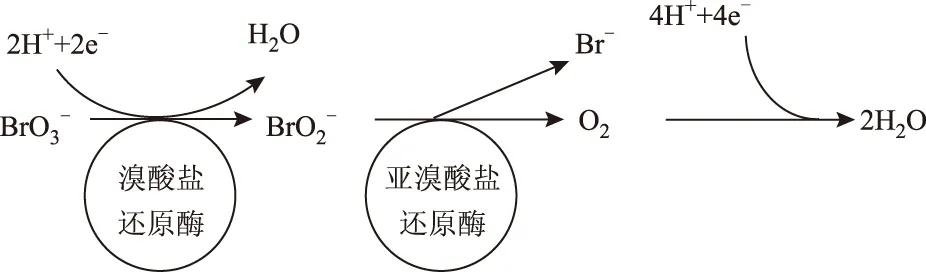
图2 BrO3-生物还原途径Fig.2 The pathway of bromate reduction
2.2ρ(NO3--N)的影响
NO3--N是地表水或地下水中的常规氧化性污染物,含量明显高于BrO3-. NO3--N作为第一电子受体,在BrO3-还原过程中可被氢自养菌还原,因此有必要考察NO3--N对BrO3-还原产生的影响. 由图3可见,出水ρ(BrO3-)随ρ(NO3--N)升高而逐渐升高,ρ(Br-)相应地逐渐降低,BrO3-去除率由50.2%〔ρ(NO3--N)=1 mg/L〕降至15.3%〔(ρ(NO3--N)=50 mg/L)〕,可见反硝化作用对BrO3-还原抑制显著,BrO3-去除率明显降低. 当ρ(NO3--N)达到5 mg/L时已对BrO3-还原产生了明显的抑制效应. NO3--N将会是BrO3-还原活性酶的竞争者或对电子供体的竞争,而这一竞争性也体现在NO3--N和ClO4-共存体系的还原过程中(NO3--N和ClO4-有独立的还原途径)[31-32]. 另有研究[18]表明,反硝化作用的还原产物(NO2--N、N2O等)对细菌活性酶有毒害作用,因而高浓度的NO3--N还原导致中间产物的积累也对BrO3-还原产生抑制. 基于上述结果,NO3--N对电子供体的强烈竞争及反硝化中间产物对微生物酶活性的抑制是影响BrO3-还原的关键机制. 由此可见,在BrO3-还原过程中必须考虑控制共存的NO3--N,尤其是水中ρ(NO3--N)明显高于ρ(BrO3-)的情形.

图3 ρ(NO3--N)对BrO3-还原的影响Fig.3 Effect of nitrate concentrations on bromate reduction
2.3ρ(SO42-)的影响
作为和NO3--N类似的常规污染物,SO42-在水中的含量也普遍高于BrO3-,因此它对BrO3-还原势必产生影响. 由图4可见,随着反应体系中ρ(SO42-)的升高,BrO3-的还原效率逐渐降低.ρ(SO42-)为100 mg/L时出水中ρ(BrO3-)比ρ(SO42-)为10 mg/L时升高58.6%,同时ρ(Br-)降低55.5%,可见SO42-还原对BrO3-还原产生了抑制. 由于SO42-和BrO3-的还原机制是独立的,因此SO42-对BrO3-还原产生的抑制为电子供体的竞争性抑制,尤其是SO42-还原需消耗的电子供体量较大(1 mol SO42-还原需8 mol e-),使氢气可利用率降低. 另外,SO42-还原产物(如S2-/H2S)也会像反硝化产物一样对自养微生物酶活性产生毒性. Chung等[23-24]利用氢自养菌还原砷酸盐(AsO43-)和硒酸盐(SeO32-)时表明,反应体系中的ρ(SO42-)是控制生物还原的关键参数之一. 然而,BrO3-还原的吉布斯自由能高于SO42-还原的吉布斯自由能[25],因而同一反应体系中自养菌会偏好利用BrO3-获取能量,由此判断SO42-对BrO3-还原的抑制程度不及NO3--N还原强烈.
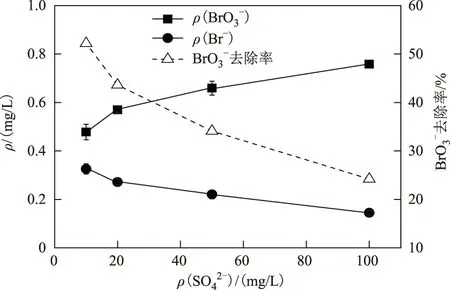
图4 ρ(SO42-)对BrO3-还原的影响Fig.4 Effect of sulfate concentrations on bromate reduction
2.4ρ(BrO3-)的影响
由图5可见,BrO3-去除率随着ρ(BrO3-)的增加而降低. 虽然BrO3-的绝对去除量随着进水ρ(BrO3-)的增加而增加,最高去除达到1.19 mg/L〔进水ρ(BrO3-)=3.98 mg/L〕,但是,去除率却并未随绝对去除量的增加而增加,相反,BrO3-去除率逐渐降至30%左右. 出水ρ(Br-)随初始ρ(BrO3-)的增加而增加. 当ρ(BrO3-)过高时,也可能会产生自抑制作用,即中间产物的毒性会抑制微生物的活性,可导致BrO3-还原效率降低[29-30]. 综上,氢自养菌还原BrO3-有一定负荷限制,过高时会影响去除率,出水浓度达不到预期目标.

图5 初始ρ(BrO3-)对BrO3-还原的影响Fig.5 Effect of initial bromate concentrations on bromate reduction
2.5 pH的影响
pH是微生物生长代谢的关键影响因素. 由图6可见,氢自养菌对BrO3-的还原在pH为6.5~9.0变化时较为敏感. pH上升过程中,BrO3-的还原效率呈先升后降的趋势. 出水ρ(BrO3-)在pH>7.5时有降低趋势,而pH<7.5时呈上升趋势,在pH=7.0时最低,此时BrO3-的去除率(31.3%)达到最大;而当pH=9.0时BrO3-去除率降至最低(10.8%). 上述结果表明,氢自养菌还原BrO3-的最佳pH在7.0~7.5之间,当pH大于8.0或小于6.5时均会影响到微生物的活性,从而导致还原效率的降低. Kirisits等[22]考察pH对BrO3-还原的影响时发现,较低的pH范围(6.8~7.2)时还原效果优于高pH范围(7.5~8.2). Butler等[21]利用固定床生物膜反应器修复BrO3-污染水体时得出,有利于还原菌活性的pH在6.9~7.8之间. Chung等[23,26]利用氢基质生物膜反应器处理SeO32-和CrO42-时也得出相近的pH范围. 综上所述,pH对氢自养微生物的活性有较大影响,合适的pH范围(偏中性)有利于微生物发挥其最大功能.
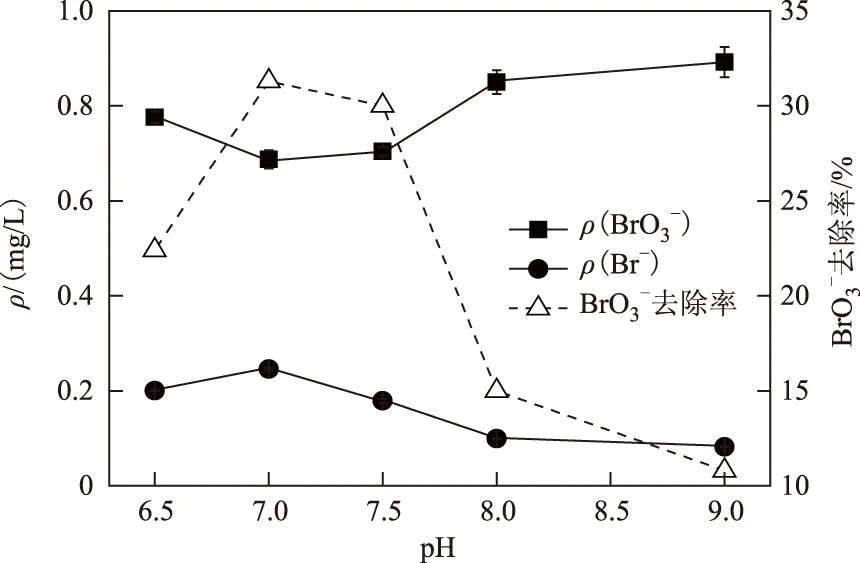
图6 不同pH对BrO3-还原的影响Fig.6 Effect of initial pH on bromate reduction
3 结论
a) 氢自养微生物以氢气为电子供体、BrO3-为电子受体,将BrO3-逐步还原成一种稳定的无毒的终产物Br-,而微生物能够在还原过程中获取能量以代谢生长,从而实现了净化水中BrO3-的目的.
b) NO3--N和SO42-作为水中的常规氧化性污染物(电子受体)对氢自养微生物还原BrO3-产生了对电子供体的竞争性抢夺及还原副产物影响酶活性的抑制效应,从而影响BrO3-还原效率. NO3--N还原对BrO3-还原效率的影响程度比SO42-还原更加强烈.
c) 氢自养微生物还原BrO3-有一定浓度限制,过高时会影响去除效率;BrO3-还原降解对pH较为敏感,最佳pH处于7.0~7.5之间.
[1] CARTIER T,BAERT A,CABILLIC P J,etal.Risk assessment of chemicals in drinking water:perchlorate and bromate[J].Environnement Risques & Sante,2012,11(4):316- 321.
[2] International Agency for Research on Cancer (IARC).Potassium bromate[J].IARC Monographs on the Evaluation of Carcinogenic Risks to Humans,1999,73:481- 496.
[3] CROFTON K M.Bromate:concern for developmental neurotoxicity?[J].Toxicology,2006,221(23):212- 216.
[4] PINKERNELL U,VON G U.Bromate minimization during ozonation:mechanistic considerations[J].Environmental Science & Technology,2001,35(12):2525- 2531.
[5] MOORE M M,CHEN T.Mutagenicity of bromate:implications for cancer risk assessment[J].Toxicology,2006,221(23):190- 196.
[6] MELNICK R L.An alternative hypothesis on the role of chemically induced protein droplet nephropathy in renal carcinogenesis[J].Regulatory Toxicology and Pharmacology,1992,16(3):111- 125.
[7] 卫生部,中国国家标准化管理委员会.GB 5749—2006 生活饮用水卫生标准[S].北京:中国标准出版社,2007.
[8] 国家卫生和计划生育委员会.GB 19298—2014 食品安全国家标准 包装饮用水[S].北京:中国标准出版社,2015.
[9] MOHAMED S,ZHAI W,AMY G.Bromate ion removal by activated carbon[J].Water Research,1996,30(7):1651- 1660.
[10] 张萍,史亚利,蔡亚岐,等.离子色谱-质谱联用测定瓶装水中的高氯酸盐和溴酸盐[J].环境化学,2007,26(4):544- 546. ZHANG Ping,SHI Yali,CAI Yaqi,etal.The determination of perchlorate and bromate in bottled-water by ion chromatography-electrospray tandem mass spectrometry[J].Environmental Chemistry,2007,26(4):544- 546.
[11] 国家质量监督检验检疫总局.国家监督抽查:6种瓶(桶)装饮用水溴酸盐含量超标[J].消费指南,2011(11):21- 25.
[12] 李铎,肖鹏.半月内三批次矿泉水被检出溴酸盐超标[N].北京商报,2015- 07- 16(003).
[13] BUTLER R,GODLEY A,LYTTON L,etal.Bromate environmental contamination:review of impact and possible treatment[J].Critical Reviews in Environmental Science and Technology,2005,35(3):193- 217.
[14] 朱佳,董紫君,陶益,等.焙烧条件对RuAC催化剂去除溴酸盐的影响[J].环境科学研究,2014,27(8):922- 928. ZHU Jia,DONG Zijun,TAO Yi,etal.Effect of calcination conditions on the activity of activated carbon supported with ruthenium catalyst for bromate reduction[J].Research of Environmental Sciences,2014,27(8):922- 928.
[15] LI Ruihua,MORRISON L,COLLINS G,etal.Simultaneous nitrate and phosphate removal from wastewater lacking organic matter through microbial oxidation of pyrrhotite coupled to nitrate reduction[J].Water Research,2016,96(6):32- 41.
[16] LIANG Shuang,SHI Qiong,GAO Xinyu,etal.Perchlorate removal by autotrophic bacteria associated with zero-valent iron:effect of calcium ions[J].Journal of Chemical Technology and Biotechnology,2016,90(4):722- 729.
[17] TANG Y,ONTIVEROS-VALENCIA A,FENG L,etal.A biofilm model to understand the onset of sulfate reduction in denitrifying membrane biofilm reactors[J].Biotechnology and Bioengineering,2013,110(3):763- 772.
[18] HIJNEN W,JONG R,VAN DER KOOIJ D.Bromate removal in a denitrifying bioreactor used in water treatment[J].Water Research,1999,33(4):1049- 1053.
[19] ASSUNÇAO A,MARTINS M,SILVA G,etal.Bromate removal by anaerobic bacterial community:mechanism and phylogenetic characterization[J].Journal of Hazardous Materials,2011,197:237- 243.
[20] DEMIREL S,BAYHAN I.Nitrate and bromate removal by autotrophic and heterotrophic denitrification processes:batch experiments[J].Journal of Environmental Health Science and Engineering,2013,11:27.
[21] BUTLER R,EHRENBERG S,GODLEY A R,etal.Remediation of bromate-contaminated groundwater in an ex situ fixed-film bioreactor[J].Science of the Total Environment,2006,366(1):12- 20.
[22] KIRISITS M J,SNOEYINK V L,INAN H,etal.Water quality factors affecting bromate reduction in biologically active carbon filters[J].Water Research,2001,35(4):891- 900.
[23] CHUNG J,NERENBERG R,RITTMANN B E.Bioreduction of selenate using a hydrogen-based membrane biofilm reactor[J].Environmental Science & Technology,2006,40(5):1664- 1671.
[24] CHUNG J,LI Xiaohao,RITTMANN B E.Bio-reduction of arsenate using a hydrogen-based membrane biofilm reactor[J].Chemosphere,2006,65(1):24- 34.
[25] NERENBERG R,RITTMANN B E.Hydrogen-based,hollow-fiber membrane biofilm reactor for reduction of perchlorate and other oxidized contaminants[J].Water Science and Technology,2004,49(1112):223- 230.
[26] CHUNG J,NERENBERG R,RITTMANN B E.Bio-reduction of soluble chromate using a hydrogen-based membrane biofilm reactor[J].Water Research,2006,40(8):1634- 1642.
[27] NERENBERG R,KAW A I Y,RITT M B E.Kinetics of a hydrogen oxidizing,perchlorate reducing bacterium[J].Water Research,2006,40(17):3290- 3296.
[28] 张彦浩,钟佛华,夏四清.pH对氢自养型反硝化菌反硝化性能的影响[J].环境污染与防治,2010,32(4):40- 47. ZHANG Yanhao,ZHONG Fohua,XIA Siqing.Effects of pH on denitrification of hydrogenotrophic denitrifying bacteria[J].Environmental Pollution & Control,2010,32(4):40- 43.
[29] MARTIN K J,DOWNING L S,NERENBERG R.Evidence of specialized bromate-reducing bacteria in a hollow fiber membrane biofilm reactor[J].Water Science and Technology,2009,59(10):1969- 1974.
[30] VAN GINKEL C G,VAN HAPEREN A M,VAN DER TOGT B.Reduction of bromate to bromide coupled to acetate oxidation by anaerobic mixed microbial cultures[J].Water Research,2005,39(1):59- 64.
[31] XU Jianlin,SONG Yanguang,MIN B K,etal.Microbial degradation of perchlorate:principles and applications[J].Environmental Engineering Science,2003,20(5):405- 422.
[32] KENGEN S,RIKKEN G B,HAGEN W R,etal.Purification and characterization of (per)chlorate reductase from the chlorate-respiring strain GR-1[J].Journal of Bacteriology,1999,181(21):6706- 6711.
Feasibility of Bioreductive Degradation of Bromate in Water by Autohydrogenotrophic Microorganisms
LI Haixiang1,3, ZHANG Huan1, JIANG Minmin1, HAN Yamei1, LIN Hua1,3, XIA Siqing2
1.Guangxi Key Laboratory of Environmental Pollution Control Theory and Technology, College of Environmental Science and Engineering, Guilin University of Technology, Guilin 541004, China 2.State Key Laboratory of Pollution Control and Resource Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China 3.Collaborative Innovation Center for Water Pollution Control and Water Safety in Karst Area, Guilin University of Technology, Guilin 541004, China
Bromate (BrO3-) as a possible human carcinogen (Group 2B) in drinking water attracts extensive public concern. Microbial reductive degradation is an effective pathway to remove bromate from water. The feasibility and influencing factors of bromate biodegradation by microorganisms using hydrogen as an electron donor were investigated under anaerobic conditions based on bath experiments. The results showed that bromate can be bioreduced to bromide (Br-) as a stable non-toxic ultimate product by autohydrogenotrophic microorganisms using hydrogen as the electron donor and bromate as the electron acceptor. During a period of 120 hours, bromate concentration was reduced from initial 1.02 to 0.56 mg/L (removal efficiency of 44.5%) with a maximum removal rate up to 0.26 mg/(L·d), corresponding to effluent bromide concentration rising to 0.29 mg/L. However, neither bromate nor bromide concentration showed significant decrease or increase in the controls. The results obtained from the investigation of influencing factors revealed that nitrate (NO3--N) and sulfate (SO42-) were conventional oxidized contaminants (electron acceptors), while denitrification and sulfate reduction caused a competition for hydrogen consumption by bromate reduction, and these generated an inhibition on the bioreduction of bromate. Denitrification affected bromate reduction efficiency more strongly than sulfate reduction. The initial concentration of bromate had a great influence on degradation efficiency. The appropriate pH range from 7.0 to 7.5 was most suitable for autohydrogenotrophic microorganisms to degrade bromate. The reduction of bromate to non-toxic bromide using autohydrogenotrophic microorganisms with hydrogen as the electron donor is a feasible biological treatment technology, and it will provide a theoretical reference for membrane biofilm reactor (MBfR) treating bromate-polluted water.
bromate (BrO3-); autohydrogenotrophic microorganisms; biological reduction
2016-07-31
2017-02-15
国家自然科学基金项目(51408146);广西自然科学基金项目(2016GXNSFAA380204;2016GXNSFBA380207)
李海翔(1984-),男,湖北荆州人,副教授,博士,主要从事水污染控制理论与技术研究,lihaixiang0627@163.com.
X52
1001- 6929(2017)06- 0960- 07
A
10.13198/j.issn.1001- 6929.2017.02.07
李海翔,张欢,蒋敏敏,等.氢基质自养微生物还原降解水中溴酸盐的可行性[J].环境科学研究,2017,30(6):960- 966.
LI Haixiang,ZHANG Huan,JIANG Minmin,etal.Feasibility of bioreductive degradation of bromate in water by autohydrogenotrophic microorganisms[J].Research of Environmental Sciences,2017,30(6):960- 966.