宫颈鳞癌组织中β-catenin、E-cadherin、PTEN蛋白表达变化及其意义
杨冬梅,黄利红,夏琼,刘佩佩
(华中科技大学同济医学院附属普爱医院,武汉430033)
宫颈鳞癌组织中β-catenin、E-cadherin、PTEN蛋白表达变化及其意义
杨冬梅,黄利红,夏琼,刘佩佩
(华中科技大学同济医学院附属普爱医院,武汉430033)
目的 观察宫颈鳞癌组织中β-连环蛋白(β-catenin)、E-钙黏蛋白(E-cadherin)、磷酸酶及张力蛋白同源(PTEN)蛋白的表达变化,并探讨其临床意义。方法 82例份宫颈鳞癌组织标本为观察组,32例份宫颈上皮内瘤变(CIN)组织标本为CIN组,30例份正常宫颈组织标本为正常组。采用免疫组化SP法进行检测各组β-catenin、E-cadherin及PTEN蛋白,表达与宫颈癌临床病理参数的关系,分析β-catenin、E-cadherin及PTEN蛋白的相关性,采用ROC曲线判断β-catenin、E-cadherin及PTEN蛋白在宫颈癌诊断中的灵敏度及特异度。结果 观察组β-catenin阳性表达率高于CIN组和对照组,E-cadherin、PTEN蛋白阳性表达率均低于CIN组和对照组(P均<0.05)。CIN组β-catenin阳性表达率高于对照组,E-cadherin、PTEN蛋白阳性表达率均低于对照组(P均<0.05)。β-catenin表达与宫颈鳞癌组织学分级、临床分期及淋巴结转移相关(P均<0.05);E-cadherin、PTEN蛋白表达与宫颈鳞癌组织学分级、临床分期、浸润深度与淋巴结转移相关(P均<0.05)。β-catenin诊断宫颈鳞癌的灵敏度、特异度分别为89.02%、87.10%,E-cadherin诊断宫颈鳞癌的灵敏度、特异度分别为85.37%、83.87%,PTEN蛋白诊断宫颈鳞癌的灵敏度、特异度分别为84.15%、85.48%。宫颈鳞癌组织中β-catenin表达与E-cadherin、PTEN呈负相关(r分别为-0.736,-0.702;P<0.05),E-cadherin表达与PTEN蛋白表达呈正相关(r=0.694,P<0.05)。结论 宫颈鳞癌组织中β-catenin高表达,E-cadherin、PTEN蛋白低表达。β-catenin、E-cadherin及PTEN蛋白诊断宫颈鳞癌的敏感度和特异度均较高。β-catenin、E-cadherin及PTEN在宫颈鳞癌的发生发展中可能存在相互作用。
宫颈肿瘤;宫颈癌;宫颈鳞癌;β-连环蛋白;E-钙黏蛋白;磷酸酶及张力蛋白同源
宫颈癌是女性生殖系统的常见的恶性肿瘤之一,发病率居妇科恶性肿瘤的第二位,且呈年轻化趋势[1]。宫颈鳞癌发病率占宫颈癌的90%以上,但其具体病因尚未明确。研究认为宫颈癌的发生发展与原癌基因的激活、抑癌基因的失活及信号通路的激活等关系密切[1]。β-连环蛋白(β-catenin)是一种细胞膜内黏着蛋白,可与、E-钙黏蛋白(E-cadherin)形成复合体,可保证组织结构的完整性和功能性。同时β-catenin又是Wnt信号通路的调节中心环节调控细胞的分化,其在细胞核内可与T淋巴细胞的转录因子相结合,激活原癌基因,导致肿瘤的发生[2]。E-cadherin可维持上皮细胞的正常状态,在肿瘤的在肿瘤的转移、侵袭过程中发挥重要作用[3]。磷酸酶及张力蛋白同源(PTEN)是一种抑癌基因,可反馈性抑制肿瘤细胞信号通路,抑制肿瘤细胞增殖、加速细胞凋亡[4]。目前关于β-catenin、E-cadherin及PTEN蛋白在宫颈癌组织肿的表达报道则较少。我们观察了宫颈鳞癌组织中β-catenin、E-cadherin、PTEN蛋白的表达变化,并探讨其临床意义,旨在为临床治疗宫颈癌提供新的靶点。
1 资料与方法
1.1 标本来源 2014年1月~2016年12月间我院病理科存档的宫颈组织标本144例份,其中宫颈鳞癌组织标本82例份(观察组)、宫颈上皮内瘤变(CIN)组织标本32例份(CIN组)、正常宫颈组织标本30例份(正常组)。患者年龄26~76(48.24±4.26)岁;三组标本提供者均未接受放、化疗。根据国际妇产科联盟对宫颈癌的分期标准[5]将观察组分为Ⅰ期42例、Ⅱ期40例;组织的分化程度为低分化50例,高、中分化32例;浸润深度≤1/2者46例、>1/2者36例;存在淋巴结转移30例,无淋巴结转移52例;肿瘤直径≥4 cm者28例,<4 cm者54例。本研究纳入患者临床资料完整,且未合并其他肿瘤。
1.2 各组β-catenin、E-cadherin及PTEN蛋白检测方法 采用免疫组化SP法。所有操作均严格按照使用说明书进行。单克隆抗体均是由北京中杉金桥生物技术有限公司提供,分别为鼠抗人β-catenin单克隆抗体、鼠抗人E-cadherin单克隆抗体和小鼠抗人PTEN单克隆抗体,二氨基联苯胺显色剂及载玻片购自武汉博士德生物工程有限公司。将各组标本制作成石蜡切片,常规脱蜡、包埋、切片,以0.01 mol/L的枸橼酸盐缓冲液(pH=6.0)加热修复抗原,待温度降至室温30 min后,加入0.01mol/L的PBS溶液冲洗3次,5 min/次;加入5%的正常山羊血清,37 ℃封闭40 min,然后滴加一抗,4 ℃过夜;37 ℃依次滴加生物素标记的二抗和辣根酶标记链酶卵白素液,分别反应25 min;二氨基联苯胺显色,苏木精复染,脱水、透明和封片。以空白PBS液作阴性对照。每张切片在高倍镜(×400)下随机选择10个不重复视野。结合染色强度和阳性细胞百分比综合判定结果[2]。染色强度为无着色计0分,黄色计1分,棕黄色计2分,黄褐色计3分;阳性细胞百分比<10%计0分,10%~<40%计1分,40%~<70%计2分,≥70%计3分;将上述两项得分相加, 0~1分为蛋白表达阴性,2分为弱阳性,3~4分为阳性,5~6分为强阳性,其中2~6分为蛋白表达阳性。
1.3 统计学方法 采用SPSS19.0统计软件。计数资料用百分率(%)表示,组间比较采用χ2检验; 采用ROC曲线判断β-catenin、E-cadherin及PTEN蛋白在宫颈鳞癌诊断中的灵敏度、特异度,采用Pearson相关性分析法分析β-catenin、E-cadherin及PTEN蛋白表达的相关性。P<0.05为差异具有统计学意义。
2 结果
2.1 各组β-catenin、E-cadherin及PTEN蛋白表达比较 各组β-catenin、E-cadherin及PTEN蛋白阳性表达率比较见表1。
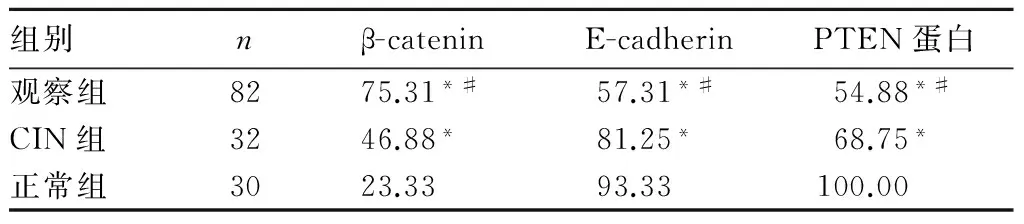
表1 各组β-catenin、E-cadherin及PTEN蛋白阳性表达率比较(%)
注:与正常组比较,*P<0.05;与CIN组比较,#P<0.05。
2.2 β-catenin、E-cadherin及PTEN蛋白表达与宫颈鳞癌临床病理参数的关系 β-catenin、E-cadherin及PTEN蛋白表达与宫颈鳞癌临床病理参数的关系见表2。β-catenin表达与宫颈鳞癌组织学分级、临床分期及淋巴结转移相关(P均<0.05),而与年龄、浸润深度和肿瘤直径无关(P均>0.05);E-cadherin、PTEN蛋白表达与宫颈鳞癌组织学分级、临床分期、浸润深度与淋巴结转移相关(P均<0.05),而与年龄和肿瘤直径无关(P>0.05)。
2.3 β-catenin、E-cadherin及PTEN蛋白诊断宫颈鳞癌的灵敏度、特异度 ROC曲线分析结果显示,β-catenin诊断宫颈鳞癌的灵敏度、特异度分别为89.02%、87.10%,E-cadherin诊断宫颈鳞癌的灵敏度、特异度分别为85.37%、83.87%,PTEN蛋白诊断宫颈鳞癌的灵敏度、特异度分别为84.15%、85.48%。
2.4 宫颈鳞癌组织中β-catenin、E-cadherin及PTEN蛋白表达的相关性 相关性分析显示,宫颈鳞癌组织中β-catenin表达与E-cadherin、PTEN呈负相关(r分别为-0.736,-0.702;P<0.05),E-cadherin表达与PTEN蛋白表达呈正相关(r=0.694,P<0.05)。
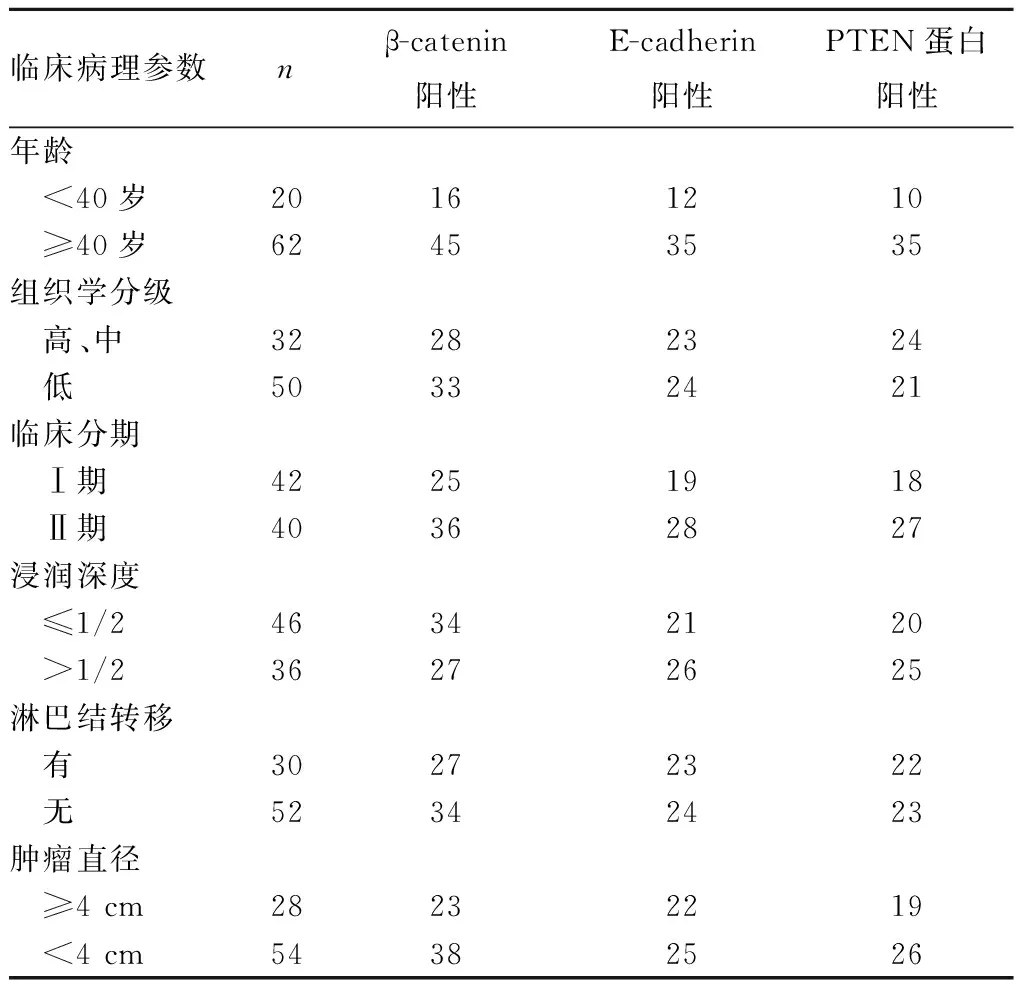
表2 β-catenin、E-cadherin及PTEN蛋白表达与宫颈鳞癌临床病理参数的关系(例)
3 讨论
β-catenin作为一种细胞膜上的多功能蛋白质,是钙离子依赖性黏蛋白家族成员,由多条肽链组成,人体中的编码基因为CTNNB1,位于3号染色的p21和p22上[6]。β-catenin不仅是组成Cadherin/Catenin 复合体的一部分,而且可以调节Wnt信号转导通路[7]。本研究结果显示,观察组β-catenin阳性表达率高于CIN组和对照组,CIN组β-catenin阳性表达率高于对照组。同时β-catenin表达与宫颈鳞癌组织学分级、临床分期及淋巴结转移相关,而与年龄、浸润深度和肿瘤直径无关,提示宫颈鳞癌组织中存在β-catenin表达异常,且与宫颈癌的发展具有紧密联系。β-catenin在细胞内有两种形式:游离型和结合型,游离型β-catenin参与Wnt信号转导,作用机制是通过核膜在细胞质或细胞核中结合转录因子Tcf/Lef,从而激活Wnt信号转导通路中的靶基因,发挥调节细胞增殖或凋亡的作用,加速肿瘤细胞的恶性增殖。结合型β-catenin在正常细胞中可以与细胞膜上的E-cadherin结合,从而调节细胞的黏附作用。Wnt信号转导通路处于失活状态时,多数β-catenin为结合型,形成蛋白复合体,可以通过磷酸化被降解,一旦Wnt信号转导通路处于激活状态,Wnt蛋白与多种蛋白受体结合,导致与β-catenin相结合的相关蛋白解离斌刚进入细胞质,阻断磷酸化进程,继而造成β-catenin沉积在细胞质中,而β-catenin又可以与细胞核中的转录因子相结合,激活Wnt信号转导通路中的肿瘤靶基因[2,8]。
E-cadherin是一种钙黏蛋白,具有Ca2+依赖性,分子量为120 kD,能够通过与α-、β-和γ-catenin形成复合体E-cadherin/catenin维持上皮细胞的形态及结构完整性,从而参与宫颈上皮细胞的分化成熟[8]。研究结果显示,观察组E-cadherin阳性表达率均低于CIN组和对照组,CIN组E-cadherin低于对照组。E-cadherin表达与宫颈鳞癌组织学分级、临床分期、浸润深度与淋巴结转移相关,而与年龄和肿瘤直径无关。这与相关研究[9]结果一致。PTEN是继p53后机体内肿瘤细胞中的的一种抑癌基因,可以调控细胞的生长周期,加速细胞的凋亡,调节细胞的黏附及迁移作用,另外能够参与生成新的血管,从而抑制恶性肿瘤生长,编码PTEN的蛋白同时具有脂质磷酸酶和蛋白磷酸酶的双重活性,对细胞中的信号因子产生广泛作用[10,11]。从PTEN表达情况的研究结果来看,在CIN组及观察组中的表达明显降低,且PTEN蛋白表达与宫颈鳞癌组织学分级、临床分期、浸润深度与淋巴结转移相关,而与年龄和肿瘤大小无关。说明PTEN表达的缺失是宫颈癌发生的主要事件,并且与其关系密切。
β-catenin、E-cadherin及PTEN蛋白诊断宫颈鳞癌的灵敏度及特异度均超过80%,表明三种指标均能有效地诊断宫颈癌,分析其原因主要与三种蛋白质的作用机理密切相关,研究中的不足是需要对三种指标的联合检测进行研究。宫颈鳞癌组织中β-catenin表达与E-cadherin和PTEN表达呈负相关,E-cadherin表达与PTEN蛋白表达呈正相关。说明三种蛋白间联系密切,β-catenin和E-cadherin可在细胞膜上形成复合体,共同维持细胞的形态及结构功能性,PTEN 的缺失表达会导致磷脂酰肌醇三磷酸去磷酸化失败,持续激活磷脂酰肌醇-3激酶/蛋白激酶B信号通路,加速E-cadherin的表达缺失。而β-catenin与PTEN之间的具体联系尚有待进一步研究[4]。
综上所述,宫颈鳞癌组织中β-catenin高表达,E-cadherin、PTEN蛋白低表达。β-catenin、E-cadherin及PTEN蛋白诊断宫颈鳞癌的敏感度和特异度均较高。β-catenin、E-cadherin及PTEN在宫颈鳞癌的发生发展中可能存在相互作用。
[1] 刘卫梅.β-catenin及EGFR在宫颈鳞癌组织中的表达及临床意义[J].中国医药指南,2016,14(16):58-58.
[2] 张嘉美,赵宁,吴晓玲,等.Wnt/β-catenin信号通路对细胞凋亡和坏死的调控研究进展[J].中国细胞生物学学报,2015,37(9):1309-1316.
[3] 邓秀文,邹文.E-cadherin和Vimentin表达与早期宫颈癌临床病理特征及预后的关系[J].临床肿瘤学杂志,2016,21(2):160-165.
[4] 卢丹,钱静,孙飞,等.宫颈癌演变过程中PTEN、survivin基因的表达及其意义[J].扬州大学学报(农业与生命科学版),2014,35(4):10-13.
[5] 李双,李雄,张媛,等.宫颈癌的手术-病理分期和评分系统的建立和验证[J].现代妇产科进展,2016,25(11):801-807.
[6] 刘医辉.β-catenin在子宫病变中的研究进展[J].大家健康(中旬版),2014,13(7):324-325.
[7] 周慧丽,周惠斌,何立花.β-catenin、p120 ctn在尖锐湿疣及宫颈鳞癌中的表达和意义[J].现代中西医结合杂志,2013,22(8):806-808.
[8] 郝丹,田晓予.E-cadherin、Ezrin在宫颈癌组织中的表达及临床意义[J].河南科技大学学报(医学版),2015,33(3):169-172.
[9] 田园,冯定庆,伍娇娇,等.E-cadherin表达和AKT磷酸化水平与宫颈病变的相关性分析[J].安徽医科大学学报,2014,49(7):1007-1012.
[10] 郭苏阳,李胜泽,郭伟,等.Twist和E-cadherin在宫颈鳞癌中的表达及其与KAI1表达的关系[J].华中科技大学学报(医学版),2015,44(4):411-415.
[11] 李程程,宋伟奇.宫颈癌部分相关抑癌基因研究进展[J].内蒙古民族大学学报(自然科学版),2015,30(5):441-443.
湖北省自然科学基金资助项目(2014CFB36)。
10.3969/j.issn.1002-266X.2017.19.016
R711
B
1002-266X(2017)19-0054-03
2017-02-10)

