胰腺上皮样血管肉瘤的临床病理分析
曹 晨,宋 欣,王利群,张 凭
解放军总医院 1. 病理科; 2. 药学部,北京 100853
胰腺上皮样血管肉瘤的临床病理分析
曹 晨1,宋 欣1,王利群1,张 凭2
解放军总医院 1. 病理科; 2. 药学部,北京 100853
目的 探讨胰腺上皮样血管肉瘤的临床病理学特征及鉴别诊断要点。方法 在光学显微镜下对胰腺上皮样血管肉瘤进行组织学形态观察,并借助免疫组化进一步对血管肉瘤的形态进行分析。结果 大体上为灰白色结节状,切面呈灰白色,质地中等,显微镜下组织学表现为肿瘤细胞呈上皮样、多边形,病理性核分裂象多见,弥漫分布,异型性明显,免疫组化显示肿瘤细胞高表达CK、CD31、CD34和Vimentin等,血管和间叶分化,肿瘤高度恶性。结论 胰腺上皮样血管肉瘤具有高度侵袭性,转移迅速,预后差,在临床病理诊断中,必须首先与发生于该部位常见的恶性肿瘤如癌、转移癌、恶性黑色素瘤、其他肉瘤等鉴别。
血管肉瘤;胰腺;病理诊断;鉴别诊断
上皮样血管肉瘤(epithelioid angiosarcoma, EA)是一种来源于血管内皮细胞的罕见特殊形态恶性肿瘤, 分为皮肤、内脏和软组织亚型[1-2]。EA最常出现在四肢深部软组织,通常是肌内,也可发生在各种脏器,包括甲状腺、肝脏、脾脏、肺脏、胃、肾上腺、骨骼及扁桃体等部位[3],发病年龄多为中老年,且男性多见。EA瘤细胞呈上皮样、多边形,大多数充满丰富的嗜酸性胞浆,边界不清,病理性核分裂象多见,易被误诊为转移性上皮性肿瘤或滑膜肉瘤[4]。目前发生于胰腺的血管肉瘤报道尚少,国外仅有2例文献报道[5-6],而国内还未曾报道。因胰腺EA临床罕见,人们对其临床表现、发病过程、病理特征、鉴别诊断及治疗预后等方面了解甚少,且需要与部分黑色素瘤、间皮瘤、间变性淋巴瘤或其他肉瘤鉴别[7]。本文将报道1例发生于胰腺的EA,结合文献探讨其临床病理特点,以提高诊断及鉴别诊断水平。
1 资料与方法
1.1 临床资料 患者男性,53岁,因上腹部胀痛并周身皮肤黄染1个月入院。查体: 皮肤巩膜黄染,全身浅表淋巴结无肿大,腹平软,无明显压痛、反跳痛,未触及包块。实验室检查: Hb 8.1 g/dl,CA125 42.4 u/ml;腹部超声(外院):胰体部占位约1.8 cm×1.5 cm。腹部CT(外院):胰腺颈部占位约2.1 cm×1.9 cm。腹部CT检查(我院):胰颈占位,主动脉旁多发淋巴结,考虑胰腺癌伴淋巴结转移。术中行胰体尾+脾切除术,探查胰腺头颈质软,胰体尾一约3 cm×3 cm×2 cm大小肿物,质较硬,边界不清,与周围组织无明显粘连。脾脏正常大小,质软。盆腔无转移结节,肠系膜根部未触及肿大淋巴结。
1.2 方法 手术切除组织采用10%中性甲醛固定,肉眼检查,将标本切开取材,利用石蜡包埋制片,进行常规HE染色及免疫组织化学染色。免疫组织化学染色采用Envision两步法,所用一抗为Ki-67、CK、CK19、Vimentin、CD30、CD31、CD34、CD117、F8、EMA、Calretinin、LCA、Melan-A、HMB45、S-100、α1-AT及D2-40均由北京中杉公司提供。结合相关文献,探讨、阐述胰腺EA这一罕见疾病的临床病理学特点。
2 结果
2.1 肉眼检查 胰腺大小9 cm×3 cm×2 cm,距胰腺切缘1 cm胰体部可见灰白肿物,大小3 cm×3 cm×2 cm,切面灰白,质中,边界不清,胰腺切缘面积为3 cm×2 cm,胰尾部脾门粘连。脾脏大小13 cm×9.5 cm×5 cm,脾脏表面光滑,切面暗红色,与髓质分界区清。胰周及脾门检出淋巴结9枚,大者1.5 cm×0.5 cm×0.5 cm,小者0.3 cm×0.3 cm×0.3 cm。临床诊断首先考虑胰腺癌。
2.2 镜下观察 肿瘤组织未见明显包膜,呈浸润性生长;肿瘤细胞呈上皮样、多边形,异型性明显;瘤细胞体积大,边界不清,多形性,胞浆丰富,嗜酸性;细胞核圆形、卵圆形,核仁明显,部分细胞核空泡化,染色质清晰,出现水泡外观,可见频繁有丝分裂的圆形核。核分裂象多见,可见病理性核分裂象,并可见大片坏死及出血。血管腔大小不一,腔内充满红细胞。瘤组织内可见大量以淋巴细胞、嗜酸性粒细胞为主的炎细胞浸润。脾脏内未见肿瘤组织。
2.3 免疫表型 瘤细胞表达 CD31、CD34、Vimentin、CK、CK19、EMA;F8、Calretinin、CD30、LCA、Melan-A、HMB45、S-100、CD117、α1-AT、D2-40不表达, Ki67指数约50%。
2.4 病理诊断 结合免疫组化染色结果,符合胰体上皮样血管肉瘤(见图1~9)。
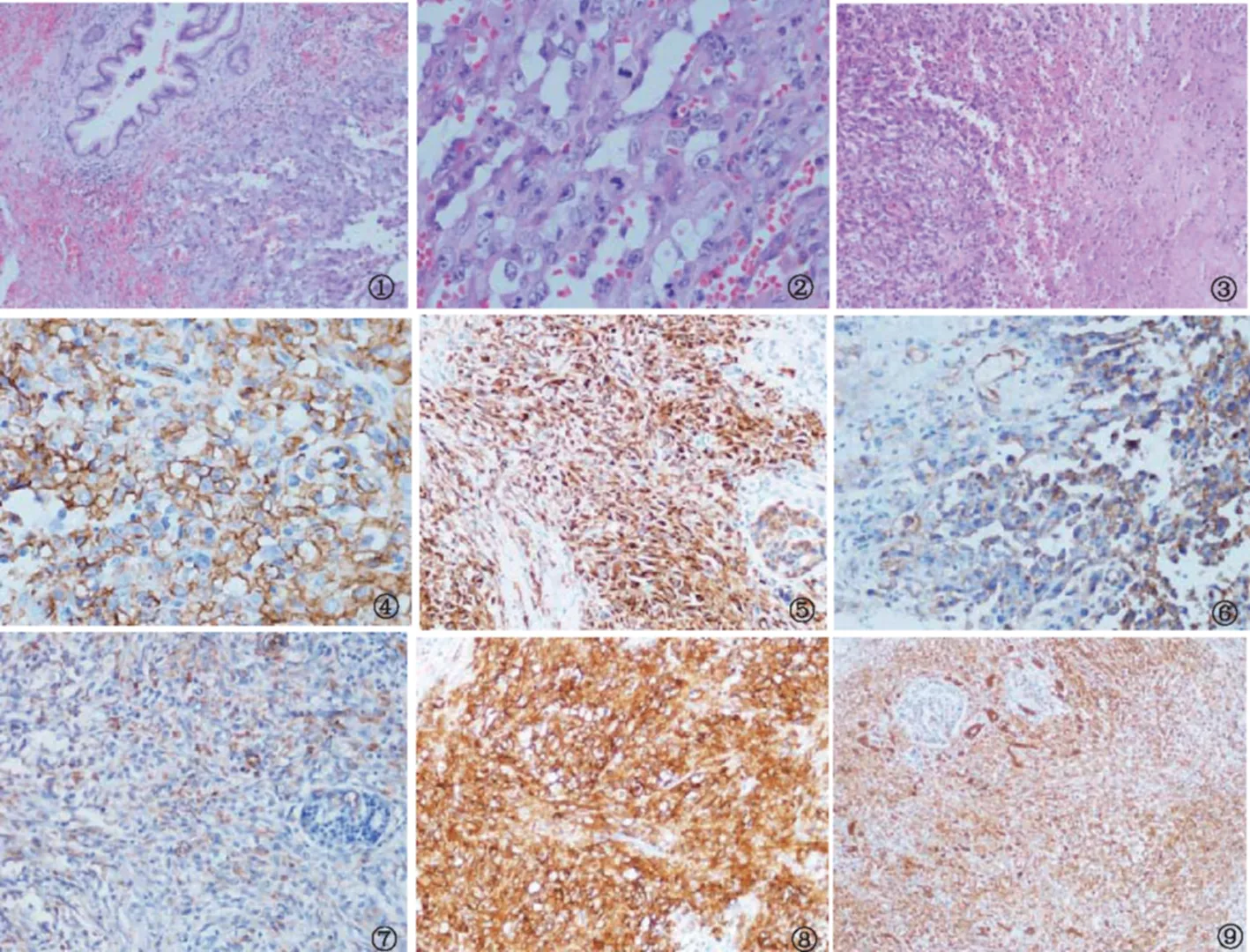
图1 低倍镜下所见(100×),肿瘤细胞呈上皮样、多边形,异型性明显;图2 高倍镜下所见(400×),瘤细胞体积大,边界不清,多形性,胞浆丰富,嗜酸性;细胞核圆形、卵圆形,核仁明显,部分细胞核空泡化,染色质清晰、出现水泡外观,可见频繁有丝分裂的圆形核;图3 低倍镜下所见(100×),肿瘤区可见大片坏死及出血,血管腔内充满红细胞,瘤组织内见炎细胞浸润;图4 高倍镜下所见(Envision二步法400×),肿瘤细胞胞质高表达CD34,小血管清晰阳性;图5 高倍镜下所见(Envision二步法 400×),肿瘤细胞胞质高表达CK,左下方有血管腔隙形成;图6 高倍镜下所见(Envision二步法 400×),肿瘤细胞胞质表达CD31 ;图7 高倍镜下所见(Envision二步法400×),肿瘤细胞胞质表达Vimentin;图8 高倍镜下所见(Envision二步法 400×),肿瘤细胞胞质表达EMA;图9 低倍镜下所见(Envision二步法 100×), 肿瘤细胞胞质高表达CK19
Fig 1 Under low magnification (100×), tumor cells were epithelioid, polygonal, atypia significantly; Fig 2 Under high magnification (400×), the tumor cells were large, unclear, pleomorphic, rich in cytoplasm and eosinophilic; nucleus were round, oval, with prominent nucleoli, some nuclei were vacuolated, the chromatin was clear, and the appearance of blisters appeared; Fig 3 Under low magnification (100×), large necrosis and hemorrhage were found in the tumor area. The blood vessels were filled with red blood cells; Fig 4 Under high magnification (Envision two- step method 400×), CD34 was highly expressed in the cytoplasm of tumor cells, and the small vessels were positive; Fig 5 Under high magnification (Envision two-step method 400×), The CK was highly expressed in cytoplasm of the tumor cells, and there was a lacuna in the lower left; Fig 6 Under high magnification (Envision two-step method 400×), the CD31 was expressed in cytoplasm of tumor cells; Fig 7 Under high magnification (Envision two-step method 400×), the Vimentin was expressed in cytoplasm of tumor cells; Fig 8 Under high magnification (Envision two-step method 400×), the EMA was expressed in cytoplasm of tumor cells; Fig 9 Under low magnification (Envision two-step method 100×), the CK19 was expressed in cytoplasm of tumor cells
3 讨论
1971年Bucu等报道第1例胰腺体部的血管肉瘤[5], 2008年Seth等报道第2例胰腺的EA[6],而国内至今未曾报道。
病因:研究已经证明,促炎症反应,包括胆石症、接触化学制剂,如氯乙烯、二氧化钍、放射治疗均与胆囊、肝脏和腹部/骨盆区域血管肉瘤的发展有关[8-10]。但本例患者否认肿瘤病史、化学毒物接触史。氯乙烯氧化自由基可使抑癌基因P53发生点突变及其他点突变,从而激活e-Ki-ras-2原癌基因,这有可能是聚氯乙烯导致血管肉瘤发生的原因。化学物质刺激对血管内瘤的发生有重要影响,长期的炎症刺激可导致血管肉瘤的发生。由于电镜下可见肿瘤典型血管腔形成,加之内皮细胞免疫组化染色标记,故Holden等[11]最先推论血管肉瘤可能为淋巴组织衍生而来,并有血管管腔的分化。
临床及影像学表现:血管肉瘤可发生于全身任何部位,发病高峰年龄50~60岁,男性好发。胰腺EA的临床症状可表现为肠梗阻、腹痛、腹胀、消瘦等,无特异性,这些症状在胰腺的其他肿瘤中也可以存在,这种非特异性的表现通常会延误诊断[1]。本例患者以上腹部胀痛并周身皮肤黄染为首发症状病理学特点:肉眼观为单发肿物,肿瘤组织未见明显包膜,边界不清,呈浸润性生长,切面灰白,质中。有文献称肿瘤细胞形态多样,内皮细胞呈梭形、立方形或不规则形。本例患者显微镜下观察肿瘤组织未见明显包膜,呈浸润性生长;肿瘤细胞呈上皮样、多边形,异型性明显;瘤细胞体积大,边界不清,多形性,胞浆丰富,嗜酸性;细胞核圆形、卵圆形,核仁明显,部分细胞核空泡化,染色质清晰、出现水泡外观,可见频繁有丝分裂的圆形核。核分裂象多见,可见病理性核分裂象,并可见大片坏死及出血。血管腔大小不一,腔内充满红细胞。瘤组织内可见大量以淋巴细胞、嗜酸性粒细胞为主的炎细胞浸润。脾脏内未见肿瘤组织。与文献报道的EA相似。
免疫表型:免疫组化染色对胰腺上皮样血管肉瘤诊断意义重大,肿瘤细胞可以表达不同的内皮细胞标志。本例瘤细胞表达CD31、CD34、Vimentin、CK、CK19、EMA;F8、Calretinin、CD30、LCA、Melan-A、HMB45、S-100、CD117、α1-AT、D2-40不表达, Ki67指数约50%。CD34、CD31是血管来源肿瘤的特异性标志物,与CD34相比,CD31的特异性好,其敏感性又与CD34相似。Vimentin对几乎所有EA均强阳性表达。CK阳性可作为诊断EA的辅助指标。
鉴别诊断:现有多种免疫组化指标可应用于EA的鉴别诊断。CK、EMA弥漫阳性,表明上皮样来源,若肿瘤细胞血管分化特征不明显,则易于转移癌混淆,此时需借助标记血管的抗体,CD31、CD34阳性可佐证,与转移癌相区分。当瘤细胞呈上皮样时,CK、EMA、CK19也可以阳性[1,12],另外D2-40及S-100阴性又需与恶性黑色素瘤进行正确鉴别。恶性黑色素瘤形态多种多样,有时很难与血管肉瘤鉴别,但恶性黑色素瘤的细胞排列呈巢状,而无明显的血管形成区域,常有黑色素,其特征性免疫标记物HMB45标记阳性,可以鉴别。F8是一种常用标记血管内皮细胞的抗体,但敏感性较差,而CD31的敏感性优于F8;来源间叶组织的细胞Vimentin标记可为阳性。低分化癌有时可形成假肉瘤样形态,具有自由交通的血管腔,可表达CK、Vimentin,但不表达CD31、CD34;恶性外周神经鞘瘤肿瘤细胞丰富,瘤细胞梭形、短梭形,核杆状或卵圆形,部分呈柬状排列,部分区似有栅状排列,核异型,核分裂易见,肿瘤细胞表达Vimentin、S-100,不表达CD34、CD31、CK及EMA。上述标志常联合使用,可以提高诊断的精准性。
目前EA尚无统一、标准、有效的治疗方案,手术切除是唯一已知的有效治疗模式。临床现多采用以手术切除为基础,辅以放疗、化疗、支持治疗的综合治疗方法。在所有软组织肿瘤中,血管肉瘤预后最差。肿块大小、治疗模式、年龄等均是影响预后的重要因素,而能否取得成功,肿瘤局部扩大切除是重中之重[13]。由于胰腺EA及其罕见,诊断困难,故继续研究这些恶性肿瘤的病因和发展途径可以帮助确定罕见病变具有的独特特点,使其更适合治疗。
本例患者肿瘤呈高度恶性,故手术治疗效果欠佳,患者于术后2个月去世。
综上所述,胰腺EA极其罕见。EA长期存活十分罕见,而目前手术切除仍然是已知的唯一的有效治疗方式。血管肉瘤的侵袭性很强,因此正确的诊断和治疗非常重要。对于EA的最终诊断依然要靠组织病理学检查,对疑难病例需通过多种抗体免疫组织化学染色进行鉴别,尤其与低分化癌及恶性黑色素瘤相鉴别,以免漏诊和误诊。
[1] Allison KH, Yoder BJ, Bronner MP, et al. Angiosarcoma involving the gastrointestinal tract: a series of primary and metastatic cases [J]. Am J Surg Pathol, 2004, 28(3): 298-307.
[2]Brown CJ, Falck VG, MacLean A. Angiosarcoma of the colon and rectum: report of a case and review of the literature [J]. Dis Colon Rectum, 2004, 47(6): 2202-2207.
[3]刘梅, 巴恩平, 赵坡, 等. 上皮样血管肉瘤的临床病理分析[J]. 中华病理学杂志, 2002, 31(5): 407-410. Liu M, Ba EP, Zhao P, et al. A Clinicopathological analysis of fifteen epithelioid angiosarcoma [J]. Chin J Pathol, 2002, 31(5): 407-410.
[4]赖日权, 陈晓东, 田野, 等. 上皮样血管肉瘤4例临床病理分析[J]. 诊断病理学杂志, 2002, 9(5): 274-276. Lai RQ, Chen XD, Tian Y, et al. Epithelioid angiosarcoma: a clinicopathological study of 4 cases [J]. J Diag Pathol, 2002, 9(5): 274-276.
[5]Bancu VE, Vincze L, Kesztenbaum E, et al. Angioplastic sarcoma of the body of the pancreas; subtotal splenopancreatectomy [J]. Chirurgia (Bucur), 1971, 20(5): 927-930.
[6]Seth AK, Argani P, Campbell KA. Angiosarcoma of the pancreas: discussion of a rare epithelioid neoplasm [J]. Pancreas, 2008, 37(4): 230-231.
[7]荀文娟,何春年. 上皮样血管肉瘤1例报道并文献复习[J]. 临床与实验病理学杂志, 2011, 27(9): 980-982.
[8]Costantini R, Bartolomeo N, Francomano F, et al. Epithelioid angiosarcoma of the gall bladder: case report [J]. J Gastrointest Surg, 2005, 9(8): 822-825.
[9]Popper H, Thomas LB, Telles NC, et al. Development of hepatic angiosarcoma in man induced by vinyl chloride, thorotrast, and arsenic: comparison with cases of unknown etiology [J]. Am J Pathol, 1978, 92(6): 349-376.
[10]Aitola P, Poutiainen A, Nordback I. Small-bowel angiosarcoma after pelvic irradiation: a report of two cases [J]. Int J Colorectal Dis, 1999, 14(6): 308-310.
[11]Holden C A, Spaull J, Das AK, et al. The histogenesis of angiosarcoma of the face and scalp: an immunohistochenical and ulterastmitural study [J]. Histopathology, 1987, 11(1): 37-51.
[12]Delvaux V, Sciot R, Neuville B, et al. Multifocal epithelioid angiosarcoma of the small intestine [J]. Virchows Arch, 2000, 437(1): 90-94.
[13]高远红, 徐建华, 钱图南, 等. 血管肉瘤研究进展[J]. 临床肿瘤学杂志, 2001, 6(3): 283-286.
(责任编辑:马 军)
Clinical pathological analysis of pancreatic epithelioid angiosarcoma
CAO Chen1, SONG Xin1, WANG Liqun1, ZHANG Ping2
1. Department of Pathology; 2. Department of Pharmacy, Chinese PLA General Hospital, Beijing 100853, China
Objective To investigate the clinicopathological features of pancreatic epithelioid angiosarcoma and key points for differential diagnosis.Methods Under optical microscope, histological morphology of pancreatic epithelioid angiosarcoma was observed, and form was analyzed by angiosarcoma immunohistochemistry. Results The morphology of tumor cells were gray-white nodular, white and medium in texture. Histological findings showed that the tumor cells were epithelioid, polygonal, pathological mitotic like, diffuse distribution, atypia, and immunohistochemistry showed that tumor cells were highly expressed CK, CD31, CD34, Vimentin, other vascular and mesenchymal differentiation, tumor height malignant.Conclusion Pancreatic epithelioid angiosarcoma has a high degree of invasion, the prognosis is poor. In the clinical pathologyic diagnosis, it must firstly differentiate with common malignant tumors such as cancer, metastatic cancer, malignant melanoma and other sarcoma.
Angiosarcoma; Pancreas; Pathological diagnosis; Differential diagnosis
10.3969/j.issn.1006-5709.2017.05.026
曹晨,硕士,研究方向:免疫组化病理技术及研究。E-mail: caochen8585@163.com
张凭,主管药师,博士,研究方向:肿瘤小分子诊断试剂的研发。E-mail: gundhir@163.com
R576
A
1006-5709(2017)05-0573-03
2017-01-17

