土壤残存草甘膦对杉木幼苗生理及养分吸收的影响*
周垂帆 林静雯 李 莹 刘爱琴
(福建农林大学林学院 国家林业局杉木工程技术研究中心 福州 350002)
土壤残存草甘膦对杉木幼苗生理及养分吸收的影响*
周垂帆 林静雯 李 莹 刘爱琴
(福建农林大学林学院 国家林业局杉木工程技术研究中心 福州 350002)
【目的】 基于林地除草导致的草甘膦残留问题,通过杉木盆栽探究杉木对土壤残存草甘膦的形态学和生理学响应,分析土壤残存草甘膦对杉木养分吸收的影响机制,为林业生产中草甘膦的合理施用提供理论依据,为杉木人工林的可持续经营提供基础资料。【方法】 参考土壤残存草甘膦含量在培养基质中添加不同浓度草甘膦 (0、2、5、10、20、50 mg·kg-1),通过盆栽试验,测定杉木对草甘膦的形态学和生理学响应,分析草甘膦对杉木养分吸收的影响机制。【结果】 草甘膦对杉木幼苗的生长发育产生影响,在高浓度草甘膦处理下,杉木幼苗生物量增量显著低于对照,同时叶片出现黄化现象。不同浓度草甘膦处理下杉木幼苗叶片生理学指标表现为: 随着草甘膦浓度增加,叶片相对电导率、MDA含量、SOD活性、POD活性、脯氨酸含量总体均呈上升趋势,可溶性蛋白呈下降趋势,叶绿素a、叶绿素b和叶绿素总量均先升后降,而莽草酸含量无显著变化。草甘膦对杉木根系和叶片元素的吸收和利用影响显著,随着草甘膦浓度增加,杉木幼苗根系Cu、Mg和Ca含量均呈上升趋势。杉木叶片Cu含量增加,Mn含量先上升后下降,Zn含量则呈先降后增。【结论】 高浓度草甘膦对杉木生长有负面作用,造成杉木幼苗生理紊乱,引起其养分吸收失衡,最终导致杉木幼苗生长量和成活率降低,因此在林业除草过程中应合理控制草甘膦用量,且在抚育过程中喷施草甘膦应远离杉木根系,以减少根系对草甘膦的吸收,降低其不利影响。
杉木; 草甘膦; 生理响应; 养分吸收
除草是营林生产过程的重要环节,美国孟山都公司研发的林用除草剂——草甘膦具有杀草广谱、内吸传导性强、适用性广、效果好、经济效益显著等特点,被广泛用于林业生产并在各个环节发挥着重要作用(贺利中等, 2010)。资料表明,国外人工林抚育化学除草技术应用和研究较早,且发展较快,拥有较高的水平和完善的化学除草技术, 业已取得明显的生态、经济和社会效益。瑞典曾大量使用草甘膦消灭欧洲云杉(Piceaabies) 幼林地杂灌草,除草效果明显,印尼、菲律宾等以经济林为主的国家在橡胶(Heveabrasiliensis)、咖啡(Coffeaarabica)等种植园喷施草甘膦用于清除热带丛生杂草(陈国海等, 1993)。草甘膦在我国林业中的应用也取得了明显成效,如广东省1985—1995年10年间林业、果园使用草甘膦除草面积由300万hm2上升至666.7万hm2,安徽省泾县从2002年起使用草甘膦除草开设与维护森林防火线,有效降低了林火发生率(林静雯等, 2015)。在我国南方,杉木(Cunninghamialanceolata)是重要速生用材树种之一,在我国林业生产中占据重要地位。近年来, 由于炼山清理林地杂灌草易引起雾霾、水土流失、地力衰退等系列生态问题被许多地方禁用,草甘膦开始广泛用于采伐迹地清理和幼苗抚育杂草的清除,成为杉木人工林生产中使用量最大的除草剂之一(林德喜等, 1998; 应金花, 2001)。草甘膦清除杂草的机制为: 通过喷施在植物的绿色部分,抑制5-烯醇丙酮酰莽草酸-3-磷酸酯合成酶的活性,阻碍莽草酸-3-磷酸与磷酸烯醇丙酮酸生成5-烯醇丙酮酰莽草酸-3-磷酸酯,使植物生存必需的芳香氨基酸合成途径受阻,同时引起莽草酸及其衍生物在植物体内大量积累,最终导致植株黄化干枯直至死亡。虽然草甘膦的使用大大提高了除草效率,降低了生产成本,促进了林业生产,但草甘磷是具有毒性、用量大、影响范围广的有机污染物,在保护林木免受杂草危害的同时也污染土壤环境,制约了杉木人工林的可持续发展。
国内外关于草甘膦的研究表明,按正常使用量 1 kg·hm-2计算,表层 13 cm 土壤中草甘膦残余量可达 0.45~2 mg·kg-1; 在草甘膦用量比较大的地区,其残存量高达10~20 mg·kg-1(Zhouetal., 2013)。虽然草甘膦对控制杂草起到关键作用,但在土壤中残留的草甘膦对后茬作物生长有负面作用,能够造成植物生理紊乱,引起植物养分吸收失衡,最终降低作物生长量和产量。如草甘膦对抗草甘膦大豆(Glycinemax)幼苗有显著伤害,可增加抗草甘膦的超氧化物歧化酶、过氧化物酶和过氧化氢酶活性,以及丙二醛含量和相对电导率(原向阳等, 2010)。喷施草甘膦后,向日葵(Helianthusannuus)叶片Fe、Mn浓度出现显著降低的症状(Ekeretal., 2006)。以往研究均是针对农作物,而有关土壤残存对林木影响的研究目前鲜有报道。由于林地杂灌众多,林业使用草甘膦要比农业使用的剂量更大且更频繁,林地表层土壤残余量可能要更高,因此草甘膦在人工林的土壤残留量及对苗木生长危害更应引起关注。本研究基于草甘膦残留问题,通过盆栽试验,探究杉木对草甘膦的形态学和生理学响应,分析土壤残存草甘膦对杉木养分吸收的影响机制,为林业生产中草甘膦的合理施用提供理论依据,为杉木人工林的可持续经营提供基础资料。
1 材料与方法
1.1 供试杉木苗
试验所用杉木苗为培育5个月的实生苗,来源于福建漳平五一国有林场杉木半同胞家系。供试苗木于沙床上缓苗1个月,参试苗木为长势均一、根系完整的无病害苗木。
1.2 试验设计
试验在福建农林大学林学院玻璃温室采用沙培方式进行。将洗净河沙过2 mm筛后等量装入口径16 cm、高20 cm的种植盆内,苗木用清水洗净根部后移栽至种植盆,每盆1株,浇足水分,驯化培养1周。参考草甘膦在土壤中的残存量,试验设6个草甘膦浓度(0、2、5、10、20、50 mg·kg-1),每种处理8个重复,共48株。驯化结束后将不同浓度草甘膦用等体积的蒸馏水溶解,均匀浇入对应处理的沙子中,浇入时避免处理液接触植株。为保证苗木对水分和养分的需求,每7天浇30 mL 1/2 Hoagland营养液,营养液组成为: 0.136 g·L-1KH2PO4、0.506 g·L-1KNO3、1.181 g·L-1Ca(NO3)2·4H2O、0.493 g·L-1MgSO4·7H2O、37.250 g·L-1Na2EDTA、0.031 g·L-1FeSO4·7H2O、Arnon微量元素(2.863 mg·L-1H3BO3、0.075 mg·L-1CuSO4·5H2O、0.230 mg·L-1ZnSO4·7H2O、1.801 mg·L-1MnCl2·4H2O、0.094 mg·L-1H2MoO4·4H2O),调节营养液pH为5.5,并适时补充蒸馏水。胁迫从2015年9月20日始至2015年10月30日止,为期40天(Zouetal., 2014)。
胁迫结束后各处理选取苗木生长良好的4个重复,剪取苗木相同部位叶片,测定相对电导率、丙二醛(MDA)、脯氨酸(Pro)、可溶性蛋白、莽草酸和叶绿素含量,以及超氧化物歧化酶(SOD)和过氧化物酶(POD)活性,并收获苗木测定根系和叶片P、Ca、Mg、Fe、Zn、Cu、Mn等元素含量。
1.3 生理学指标测定
相对电导率采用上海雷磁DDS-307电导仪测定; MDA含量采用硫代巴比妥酸法(TBA)测定; Pro含量采用酸性茚三酮法测定; 可溶性蛋白含量参考马斯亮兰G-250染色法测定;莽草酸含量参考娄远来等(2005)的方法测定; 叶绿素含量采用等体积丙酮-无水乙醇提取分光光度法测定; SOD活性采用氮蓝四唑(NBT)光化还原法测定; POD活性采用愈创木酚法(Lietal., 2012)测定。
1.4 杉木养分含量测定
将杉木幼苗根和叶分别经105 ℃杀青后用80 ℃烘干至恒质量,采用HNO3-HClO4消煮,用钼锑抗比色法测定P含量(汪攀等, 2015),采用原子吸收分光光度法测定Ca、Mg、Fe、Zn、Cu、Mn含量(Wuetal., 2011)。
1.5 分析方法
采用Microsoft Excel 2003进行数据处理,SPSS 18.0软件进行单因素方差分析(one-way ANOVA)和多重比较,LSD法对处理间数据进行差异显著性分析。
2 结果与分析
2.1 草甘膦对杉木幼苗生长的影响
从图1可看出,草甘膦处理10天后,大于20 mg·kg-1草甘膦浓度处理的杉木幼苗顶部新叶均出现明显发黄的现象,这可能是草甘膦抑制了杉木根系吸收养分而引起的缺素症。40天后,低浓度草甘膦处理的杉木幼苗长势较好,一级分枝多且根系发达,而高浓度草甘膦处理的杉木幼苗植株矮小、主根缩短、侧根减少;50 mg·kg-1草甘膦处理的杉木幼苗甚至出现叶片褐化萎蔫、根部腐烂的现象(图2)。

图1 草甘膦处理10天后杉木幼苗叶片形态变化Fig.1 Morphological changes of Chinese fir seedling leaf under glyphosate treatment after 10 days

图2 不同浓度草甘膦对杉木幼苗单株形态的影响Fig.2 Effect of glyphosate on Chinese fir seedling individual modally
草甘膦处理40天后杉木幼苗的生长情况如表1所示。可以看出,0~10 mg·kg-1草甘膦处理的杉木幼苗死亡率较低, 20 mg·kg-1处理死亡率达50%,50 mg·kg处理杉木幼苗全部死亡。此外,2 mg·kg-1和5 mg·kg-1草甘膦处理的杉木幼苗生物量增量极显著高于对照杉木苗(P<0.01),而10 mg·kg-1和20 mg·kg-1草甘膦处理的杉木幼苗生物量增量则显著低于对照(P<0.05),这说明低浓度草甘膦对杉木幼苗生长具有一定促进作用,而高浓度草甘膦则显著抑制幼苗生长。
2.2 草甘膦对杉木幼苗叶片细胞膜系统和叶绿素含量的影响
从图3可看出,随着草甘膦浓度升高,杉木幼苗叶片相对电导率和MDA含量均呈上升趋势。草甘膦浓度在2~5 mg·kg-1时,叶片相对电导率与对照之间差异不显著(P>0.05),当草甘膦浓度大于5 mg·kg-1时,叶片相对电导率极显著高于对照(P<0.01),而幼苗叶片MDA含量除低浓度草甘膦(2 mg·kg-1和5 mg·kg-1)处理外均显著高于对照(P<0.05),这说明高浓度草甘膦会导致杉木幼苗叶片细胞膜通透性增加,同时增加细胞膜脂过氧化程度,使杉木幼苗的细胞膜系统受到损伤。
① 不同小写字母表示不同处理间在P< 0.05水平差异显著,下同。Different lowercase letters indicate significant differences at theP<0.05 level between treatments. The same below.

图3 不同浓度草甘膦对杉木幼苗MDA含量和相对电导率的影响Fig.3 Effect of glyphosate on MDA content and relative conductivity of Chinese fir seedling
由表2可知,随着草甘膦浓度增大,杉木幼苗叶片叶绿素a、叶绿素b和叶绿素总量先增后降,以5 mg·kg-1处理为最大,且均显著高于对照(P<0.05)。叶绿素a/b处理间差异不显著(P>0.05)。5 mg·kg-1草甘膦处理叶片叶绿素a、叶绿素b和叶绿素总量较对照分别提高11.9%、26.9%和16.5%,叶绿素a/b较对照降低11.9%。
2.3 草甘膦对杉木幼苗叶片抗氧化酶活性、叶片渗透调节物质和莽草酸含量的影响
从图4可看出,随着草甘膦浓度增加,杉木幼苗SOD活性先降后升,POD活性呈上升趋势。高浓度草甘膦(10 mg·kg-1和20 mg·kg-1)处理杉木幼苗均保持较高的SOD活性和POD活性,在20 mg·kg-1草甘膦处理时达到最大,2种酶活性分别较对照提高50.0%和66.2%;而低浓度草甘膦(2 mg·kg-1和5 mg·kg-1)处理与对照差异不显著(P>0.05),说明杉木幼苗体内的2种抗氧化酶对高浓度草甘膦反应敏感。

表2 不同浓度草甘膦对杉木幼苗叶绿素含量的影响Tab.2 Effect of glyphosate chlorophyll content of Chinese fir seedling

图4 不同浓度草甘膦对杉木幼苗SOD和POD活性的影响Fig.4 Effect of glyphosate on SOD and POD of Chinese fir seedling
图5可看出,随着草甘膦浓度增加,杉木幼苗叶片脯氨酸含量大体呈上升趋势,而可溶性蛋白呈下降趋势。其中, 20 mg·kg-1草甘膦浓度处理杉木幼苗叶片脯氨酸含量最大,约为对照的3倍,当草甘膦浓度在2~10 mg·kg-1时幼苗叶片脯氨酸含量均略低于对照,但二者之间不存在显著差异(P>0.05),说明低浓度草甘膦对杉木幼苗叶片脯氨酸积累的影响不明显。幼苗叶片可溶性蛋白以草甘膦浓度20 mg·kg-1处理降幅最大,比对照叶片减少37.3%。因此,草甘膦浓度过高会诱导脯氨酸合成和积累,同时阻碍细胞内可溶性蛋白的合成。

图5 不同浓度草甘膦对杉木幼苗脯氨酸和可溶性蛋白含量的影响Fig.5 Effect of glyphosate on contents of proline and soluble protein of Chinese fir seedling
从图6可看出,草甘膦浓度较低(2 mg· kg-1和5 mg·kg-1)时,杉木幼苗叶片莽草酸含量略低于对照;草甘膦浓度较高时,莽草酸含量虽有所增加,但各处理之间差异不显著(P>0.05)。表明试验浓度范围内,杉木幼苗叶片莽草酸含量受草甘膦影响较小,可能是由于莽草酸合成是在植物叶绿体中进行的,而草甘膦作为大分子结构化合物被杉木根系吸收后,大量积累在根尖细胞,运输到地上部分的较少,因此对叶片细胞叶绿体结构和功能的破坏较小。

图6 不同浓度草甘膦对杉木幼苗莽草酸含量的影响Fig.6 Effect of glyphosate on shikimic acid content of Chinese fir seedling
2.4 草甘膦对杉木幼苗养分吸收的影响
图7所示为不同浓度草甘膦处理下微量元素Cu、Mn、Zn、Fe和大量元素Ca、Mg在杉木幼苗根系和叶片中的积累量。可以看出,随着草甘膦浓度增加,杉木幼苗根系Cu、Mg和Ca含量均呈上升趋势,且20 mg·kg-1处理与对照之间差异极显著(P<0.01),说明草甘膦可有效提高杉木幼苗根系对Cu、Mg、Ca元素的吸收。相反,根系Mn和Fe含量则有所下降,Zn含量先升后降,但各处理之间差异不显著(P>0.05)。杉木幼苗叶片仅Cu含量随着草甘膦浓度升高而呈显著上升趋势,Mn含量呈先上升后下降的趋势。Zn含量与Mn含量的变化趋势相反,当草甘膦浓度为5 mg·kg-1时Mn含量显著高于对照(P<0.05),Zn含量则显著低于对照(P<0.05)。Fe、Mg、Ca含量在不同浓度草甘膦处理时基本无明显变化。
值得注意的是,杉木幼苗根系Cu、Zn、Fe、Mg含量在不同浓度草甘膦处理时均大于叶片,而幼苗叶片Mn和Ca含量大于根系。然而当草甘膦浓度上升至10 mg·kg-1时其根系Ca含量超过叶片,这可能是由于草甘膦浓度升高使Ca元素在植物体中的传导途径受阻,根系对Ca元素的吸收速率大于其传导速率。

图7 不同浓度草甘膦对杉木幼苗根、叶金属元素养分含量的影响Fig.7 Effect of glyphosate on metal nutrient contents in root and leaf of Chinese fir seedling
草甘膦还影响杉木幼苗根系和叶片P含量,即影响杉木对P元素的吸收和运输。由图8可知,随着草甘膦浓度增加,根系P含量有所减少,但处理间差异不显著(P>0.05);叶片P含量呈上升趋势,且不同浓度草甘膦处理叶片P含量均高于对照。
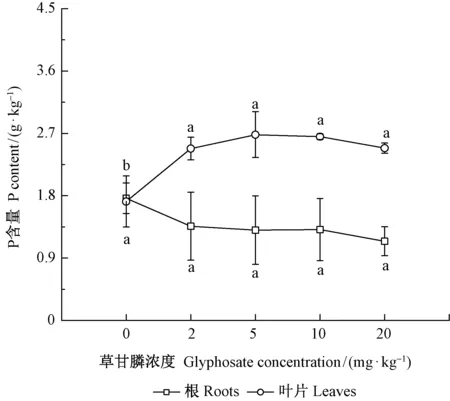
图8 不同浓度草甘膦对杉木幼苗根、叶磷素养分含量的影响Fig.8 Effect of glyphosate on phosphate content in root and leaf of Chinese fir seedling
3 讨论
林业生产中不合理施用草甘膦清除杂灌草会引发林地土壤残留问题,加之草甘膦半衰期较长,可达数十天甚至上百天(Zhouetal., 2012; 林静雯等, 2015),在土壤环境中长期积累可能会对营林生产过程中苗木的生长发育产生影响。本研究发现,高浓度草甘膦显著抑制杉木幼苗生长,当超过某一浓度范围甚至引起苗木叶片发黄、根部死亡;而低浓度草甘膦处理时杉木生物量增量显著高于对照,这种“低促高抑”现象可能是由于低浓度草甘膦阻碍植物莽草酸代谢途径,抑制木质素等细胞壁物质合成,增大植物细胞壁的延展性(Dukeetal., 2006),也有研究认为,活性氧分子是实现植物细胞伸展的必要因子(Rodriguezetal., 2002),因此低浓度草甘膦诱导下杉木体内产生的活性氧可能促进细胞伸展,但草甘膦浓度增加又使杉木体内活性氧过量积累进而造成细胞损伤,抑制杉木生长(Bernardsetal., 2009)。

在逆境条件下,植物通过增加渗透调节物质来提高细胞保水能力,以维持植物体正常代谢功能。脯氨酸和可溶性蛋白均是细胞重要渗透调节物质,起到保护细胞膜和细胞生命物质的作用(Oliveiraetal., 2014)。本研究中,杉木幼苗根部受到草甘膦药剂胁迫后,叶片细胞内的脯氨酸含量不断积累,而可溶性蛋白含量明显下降,说明杉木叶片细胞通过不断合成脯氨酸来调节细胞质渗透势,进而缓解草甘膦胁迫对植物细胞造成的伤害,与抗氧化酶系统一样,这也是细胞的自我防御机制之一。与本研究结果相似,黄建丽(2012)发现草甘膦处理下草本植物紫茎泽兰(Eupatoriumadenoporum)和白茅(Imperatacylindrica)的脯氨酸含量均显著升高。杉木幼苗叶片可溶性蛋白含量下降,也进一步说明草甘膦抑制细胞内蛋白质的合成过程并影响其代谢。然而张磊等(2010)研究认为,草甘膦作用下细胞繁殖速度较慢、体积较大,细胞内碳水化合物含量较高,因此球形棕囊藻(Phaeocystisglobosa)细胞可溶性蛋白含量随着草甘膦浓度增加而提高。莽草酸是合成植物芳香族氨基酸的必需物质,Pline等(2002)研究发现喷施草甘膦后棉花(Cossypiumhirsutum)莽草酸含量显著升高,指出草甘膦能够阻碍莽草酸途径,使该途径的前体物质——莽草酸不能继续分解生成芳香族氨基酸,导致莽草酸大量积累。因此,莽草酸积累量可反映植物对草甘膦的敏感性。然而本研究中杉木幼苗叶片莽草酸含量在草甘膦处理下基本没有变化,表现为试验浓度范围内杉木幼苗对草甘膦具有较强的耐受性。此外,在本研究中草甘膦随营养液施入沙土,经由根系吸收后传导至叶片细胞的草甘膦浓度较低,而采用喷雾形式时草甘膦药剂直接接触叶面,因此对莽草酸途径的抑制作用较强。
作为内吸传导型除草剂,残留在土壤中的草甘膦可以经由根系吸收传导至整株,不仅会影响叶片的正常生理功能,而且也会影响根系对养分的吸收和传导(Cakmaketal., 2009)。本研究发现,草甘膦的存在显著提高杉木根系对Cu、Mg、Ca元素的吸收,还促进Cu和P元素在叶片中的积累,Mn和Zn含量也发生波动。与本研究结果不同,Zobiole等(2011)发现随着草甘膦浓度增加和胁迫时间推移,大豆(Glycinemax)中的大量元素和微量元素积累量均逐渐减少,并归因于草甘膦对叶绿素前缀化合物卟啉和δ-氨基乙酰丙酸(ALA)形成的抑制作用。但本研究表明,低浓度草甘膦可促进杉木幼苗光合作用,根系吸收更多的Mg和Ca以满足叶绿素合成的需要。另外,Ca元素还具有稳定细胞膜结构、调节细胞渗透性的作用,因此根系细胞会更多地吸收、利用环境介质中的Ca来减少草甘膦对细胞膜的破坏。Cu、P和Zn是植物体内多种酶的组成成分,Mn能催化许多呼吸酶的活性,因此草甘膦对杉木幼苗叶片酶活性的影响也直接反映叶片细胞中这几种元素的积累量变化。此外,杉木幼苗叶片P元素积累过多会导致呼吸作用增强,植物代谢过程消耗大量碳水化合物,茎叶生长受到抑制,这也是高浓度草甘膦抑制杉木幼苗生长的原因之一。
4 结论
从草甘膦对杉木幼苗形态的影响情况来看,土壤中草甘膦残存量过高浓度会抑制杉木幼苗生长,甚至使幼苗全部死亡。这主要是由于草甘膦由根部吸收进入杉木地上部分,从而影响杉木幼苗叶片的细胞膜系统、叶绿素含量、抗氧化酶活性、渗透调节物质含量、莽草酸积累量等生理生化指标。此外,草甘膦作用下杉木幼苗细胞膜脂氧化损伤加剧,膜通透性增加,并诱导SOD和POD活性提高以清除机体内氧化损伤产生的活性氧,渗透调节剂脯氨酸合成并在细胞内积累以降低细胞水势,可溶性蛋白合成受阻。因此,研究结果证实: 在林业除草过程中应合理控制草甘膦的用量,喷施草甘膦应远离杉木根系,以减少根系对草甘膦的吸收,降低其不利影响。本研究为实验室的模拟试验,可以评估残存草甘膦对苗木生长的潜在危害,但要确认其真实情况,需要进一步的野外幼林抚育除草试验,以更加明确土壤残留草甘膦对林木幼苗生长的影响机制。
陈国海,李建国. 1993. 除草剂在林业上的应用. 世界林业研究,(5):29-34.
(Chen G H, Li J G. 1993. The application of herbicide in forestry. World Forestry Research,(5):29-34.[in Chinese])
贺利中, 谭 坚, 龙塘生, 等. 2010. 化学除草抚育对未成林造林地植被物种组成的影响. 西北农林科技大学学报: 自然科学版, 38(12):148-154.
(He L Z, Tan J, Long T S. 2010.Effects of chemical weed control on the species composition of vegetation of the immature forest land. Journal of Northwest Agriculture and Forestry University,38(12):148-154.[in Chinese])
黄建丽. 2012. 草甘膦对紫茎泽兰和白茅生理指标的影响及草甘膦在植物体内生物传导途径的研究.金华: 浙江师范大学硕士学位论文.
(Huang J L.2012. Efficacy of glyphosate applications on the physiological indices of two weeds,EupatoriumadenoporumandImperatacylindricaL.Jinhua:MS thesis of Zhejiang Normal University. [in Chinese]).
江海澜, 王俊刚, 邓小霞,等. 2011. 草甘膦对龙葵苗期生理指标的影响. 西北农业学报, 20(6):186-189.
(Jiang H L, Wang J G, Deng X X. 2011. The effects of glyphosate on morel seedling physiological indicators. Journal of Northwest Agriculture, 20(6):186-189. [in Chinese])
林德喜, 洪长福, 黄龙发. 1998. 杉木幼林地喷施草甘膦后土壤的变化. 土壤,(2):100-102,105.
(Lin D X, Hong C F, Huang L F.1998. The change of the soil after spraying glyphosate in Chinese fir seedling. Soil,(2):100-102,105. [in Chinese])
林静雯, 李 莹, 周垂帆,等. 2015. 林用除草剂草甘膦的环境行为及生态风险研究进展. 世界林业研究,28(4):58-63.
(Lin J W, Li Y, Zhou C F. 2015.Research progress on environmental behavior and ecological risk of glyphosate in forestry. World Forestry Research, 28(4):29-34. [in Chinese])
娄远来, 邓渊钰, 沈晋良.2005. 甲磺隆和草甘膦对空心莲子草乙酰乳酸合酶活性和莽草酸含量的影响. 植物保护学报, 32(2):185-188.
(Lou Y L, Deng Y Y ,Shen J L.2005 Effect of metsulfuron and glyphosate on alternanthera herb acetyl lactic acid synthase activity and the influence of shikimic acid content. Journal of Plant Protection, 32(2):185-188.[in Chinese])
舒 骏, 周俊宏, 成向荣,等. 2015. 草甘膦添加表面活性剂对五节芒生理生化活性的影响. 林业科学研究, 28(5):725-730.
(Shu J, Zhou J H, Cheng X R,etal.2015.Effect of glyphosate with two surfactants on physiological and biochemical characteristics ofMiscanthusfloridulus. Forest Research, 28(5):29-34. [in Chinese])
汪 攀, 吴鹏飞, 马祥庆. 2015. 杉木根系细胞壁活化铁磷能力及其影响因子分析.林业科学, 51(9):59-64.
(Wang P, Wu P F, Ma X Q. 2015.Mobilization of insoluble iron bound phosphate and effective factors by root cell walls of Chinese fir. Scientia Silvae Sinicae, 51(9):59-64. [in Chinese])
应金花. 2001. 用于杉木幼林抚育的化学除草剂配方优化研究. 福建林学院学报, 21(1):72-75.
(Ying J H.2001. The study of chemical herbicide formulation optimization used in young Chinese fir forest. Journal of Fujian Forestry College, 21(1): 72-75. [in Chinese])
原向阳, 郭平毅, 张丽光. 2010. 干旱胁迫下草甘膦对抗草甘膦大豆幼苗保护酶活性及脂质过氧化作用的影响. 中国农业科学, 43(4):698-705.
(Yuan X Y, Guo P Y, Zhang L G. 2010. Glyphosate and post-drought rewatering on protective enzyme activities and membrane lipid peroxidation in leaves of glyphosate-resistant soybean[Glycinemax(L.) Merr.] seedlings. Scientia Agricultura Sinica, 43(4):698-705. [in Chinese])
张静潮, 杨冬鹤. 2010. 常温和低温下草甘膦对铁皇冠SOD、CAT、POD活性和MDA含量的影响. 哈尔滨师范大学自然科学学报, 26(4):90-93.
(Zhang J C, Yang D H.2010. Activity of SOD, CAT, POD and content of MDA inMicrosoriumpteropuscaused by glyphosate stress at normal and low temperature. Natural Science Journal of Harbin Normal University, 26(4):90-93. [in Chinese])
张 磊, 段舜山, 孙凯峰. 2010. 有机磷农药草甘膦异丙胺盐对球形棕囊藻的刺激效应. 生态环境学报, 19(1):51-56.
(Zhang L, Duan S S, Sun K F. 2010. Hormesis effect of organophosphorus pesticide Glyphosate is opropylammonium onPhaeocystisglobosa. Ecology and Environmental Sciences, 19(1):51-56. [in Chinese])
Bernards M L, Thelen K D, Penner D. 2009. Glyphosate interaction with manganese in tank mixtures and its effect on glyphosate absorption and translocation. Weed Science,53(6): 787-794.
Cakmak I, Yazici A, Tutus Y,etal. 2009. Glyphosate reduced seed and leaf concentrations of calcium, manganese, magnesium, and iron in non-glyphosate resistant soybean. European Journal of Agronomy, 31(3):114-119.
Cedergreen N,Olesen C F. 2010. Can glyphosate stimulate photosynthesis? Pesticide Biochemistry & Physiology, 96(3):140-148.
Duke S O, Cedergreen N, Velini E D,etal. 2006. Hormesis: Is it an important factor in Herbicide use and Allelopathy? Outlooks on Pest Management, 17(1):29-33.
Eker S, Ozturk L, Yazici A, Erenoglu B,etal. 2006. Foliar-applied glyphosate substantially reduced uptake and transport of iron and manganese in sunflower (HelianthusannuusL.) plants. Journal of Agricultural and Food Chemistry, 54(26):10019-10025.
Li X, Zhang L, Li Y,etal.2012. Changes in photosynthesis, antioxidant enzymes and lipid peroxidation in soybean seedlings exposed to UV-B radiation and/or Cd. Plant and Soil, 352(1/2):377-387.
Michalková V,Pekár S. 2009. How glyphosate altered the behaviour of agrobiont spiders (Araneae: Lycosidae) and beetles (Coleoptera: Carabidae). Biological Control, 51(3):444-449.
Oliveira M T, Medeiros C D, Frosi G,etal.2014. Different mechanisms drive the performance of native and invasive woody species in response to leaf phosphorus supply during periods of drought stress and recovery. Plant Physiol Biochem,82C:66-75.
Pline W A, Wilcut J W, Duke S O,etal. 2002. Tolerance and accumulation of shikimic acid in response to glyphosate applications in glyphosate-resistant and nonglyphosate-resistant cotton (GossypiumhirsutumL.). Journal of Agricultural & Food Chemistry, 50(3):506-512.
Rodriguez A A, Grunberg K A,Taleisnik E L. 2002. Reactive oxygen species in the elongation zone of maize leaves are necessary for leaf extension. Plant Physiology, 129(4):1627-1632.
Wu P, Tigabu M, Ma X,etal. 2011. Variations in biomass, nutrient contents and nutrient use efficiency among Chinese fir provenances. Silvae Genetica, 60(3/4):95-105.
Zhou C F, Wang Y J, Yu Y C,etal. 2012. Does glyphosate impact on Cu uptake by, and toxicity to, the earthwormEiseniafetida? Ecotoxicology,21(8):1-9.
Zhou C, Wang Y, Li C,etal. 2013. Subacute toxicity of copper and glyphosate and their interaction to earthworm (Eiseniafetida). Environmental Pollution, 180:71-77.
Zobiole L H S, Kremer R J, Oliveira R S,etal. 2011.Glyphosate affects chlorophyll, nodulation and nutrient accumulation of “second generation” glyphosate-resistant soybean (GlycinemaxL.). Pesticide Biochemistry and Physiology, 99(1):53-60.
Zou X, Wu P, Chen N,etal. 2014. Chinese fir root response to spatial and temporal heterogeneity of phosphorus availability in the soil. Canadian Journal of Forest Research, 45 (4):402-410.
(责任编辑 王艳娜 郭广荣)
Effect of Glyphosate Residues in Soil on Physiological Characteristics and Nutrient Absorption of Chinese fir Seedlings
Zhou Chuifan Lin Jingwen Li Ying Liu Aiqin
(EngineeringResearchCenterofChinesefir,StateForestryAdministrationCollegeofForestry,FujianAgricultureandForestryUniversityFuzhou350002)
【Objective】 Glyphosate is usually more or less left over forest land after using for weeding. To explore effects of the glyphosate residues on Chinese fir, a pot experiment was conducted to determine the physiological mechanism of Chinese fir in responses to residual glyphosate in soil, and the effect of glyphosate on the nutrient uptake of Chinese fir. This study aimed to provide the theoretical basis for the rational application of glyphosate in forestry production, and to provide the basic data for the sustainable management of Chinese fir plantation. 【Method】 Chinese fir seedlings were planted in sand with addition of different glyphosate levels (0, 2, 5, 10, 20, 50 mg·kg-1). Morphological and physiological features of Chinese fir were measured, and the nutrient content was determined. 【Result】 The results showed that under high concentrations of glyphosate, biomass of Chinese fir significantly decreased compared to the control (P<0.05), and fir leaves showed chlorosis. At glyphosate level of 50 mg·kg-1, seedlings all died. Physiological parameters of seedlings showed that increasing glyphosate levels led to increased relative conductivity, MDA content, SOD activity, and POD activity in leaves, and decreased proline and soluble protein content. Chlorophyll a, chlorophyll b and total chlorophyll content first rose then declined, while shikimic acid content showed no significant change. The macro and micronutrient accumulation in roots and leaves of Chinese fir seedlings were affected by glyphosate. With the increase in glyphosate, Cu, Ca and Mg levels increased in the roots, while there was no significant change in the accumulation of Mn, Fe and Zn. In addition, the accumulation of Cu in Chinese fir leaves increased and Mn increased first and then decreased, and Zn increased after decline. 【Conclusion】 Overall, we found that glyphosate had negative effect on Chinese fir growth, led to physiological disorder, disturbed plant nutrient absorption, and negatively influenced seeding growth and survival rate. Therefore our findings suggest that reducing herbicide dose for weed control would improve the yield of Chinese fir young plantations.
Chinese fir; glyphosate; physiological character; nutrient absorption
10.11707/j.1001-7488.20170407
2016-03-03;
2016-04-26。
国家自然科学基金项目(31400465); 福建省自然科学基金项目(2015J05050); 中国博士后科学基金项目(2015M570550)。
S765.1
A
1001-7488(2017)04-0056-09
刘爱琴为通讯作者。

