工业碱木质素羟甲基化改性研究
徐强,孙倩倩,赵新坤,曹胜磊,佘雕*,孙润仓
(1.中国科学院教育部水土保持与生态环境研究中心黄土高原土壤侵蚀与旱地农业国家重点实验室;2.西北农林科技大学水土保持研究所;3.西北农林科技大学资源环境学院,陕西 杨凌712100;4.北京林业大学林木生物质化学北京市重点实验室,北京100083)
工业碱木质素羟甲基化改性研究
徐强1,2,孙倩倩3,赵新坤3,曹胜磊3,佘雕1,2*,孙润仓4
(1.中国科学院教育部水土保持与生态环境研究中心黄土高原土壤侵蚀与旱地农业国家重点实验室;2.西北农林科技大学水土保持研究所;3.西北农林科技大学资源环境学院,陕西 杨凌712100;4.北京林业大学林木生物质化学北京市重点实验室,北京100083)
羟甲基化可以显著提高碱木质素的羟基含量,是增强木质素反应活性的有效改性方法。为提高碱木质素的反应活性并分析碱木质素结构变化,笔者通过红外光谱(FTIR)、碳谱(DEPT 135)和异核单量子关系(HSQC)对羟甲基化木质素和原料木质素的结构分别进行表征,分析碱木质素在羟甲基化反应过程中结构变化,并对反应过程进行初步探索和验证。研究结果表明:在碱性条件下,木质素对羟基肉桂酸单元(PCA)、阿魏酸单元(FA)侧链上C7、C8双键,对羟基苯基单元(H)的C-3、C-5,愈创木基单元(G)的C-5和甲醛发生加成反应,形成羟甲基,而木质素的其他结构单元,如:紫丁香基单元(S)、β-O-4醚键结构(A)、苯基香豆满(C),并不能和甲醛发生反应。碱木质素改性的最优条件为:反应温度80℃,反应时间3 h,pH为11,m(碱木质素)∶m(甲醛)为6∶1。在最优条件下得到的羟甲基化碱木质素的羟甲基质量分数为2.32%。本研究结果可为羟甲基化碱木质素基新材料的进一步研究和开发提供参考。
羟甲基化;碱木质素;核磁共振;游离甲醛;正交试验
木质素是自然界中最丰富的聚芳香类天然高分子物质,在全球范围内每年光合作用大约产生1 500亿t[1]。木质素主要由3种前驱体物质即对香豆醇(p-coumaryl alcohol)、松柏醇(coniferyl alcohol)和芥子醇(sinapyl alcohol)通过酶脱氢聚合及自由基偶合而成。因木质素可再生、可降解、无毒以及含有诸多活性基团(如羟基、羰基、羧基、甲基)等优点,且木质素来源丰富,价格低廉,被认为是制备化学品的优良原材料,在材料领域备受关注[2]。木质素具有抗微生物、抗真菌和吸收紫外线辐射的性能,通过对木质素进行改性也可以将其作为阻燃剂、抗氧化剂、分散剂和电容器使用[3-8],木质素也表现出与酚类类似的结构,可替代苯酚,主要用作木材黏合剂[9]。然而,由于木质素的低活性、复杂性和不均一性,并未被充分利用[10]。对木质素羟甲基化、脱甲基化、酚化、磺化和氧化改性能够有效提高其反应活性[11-14]。其中,羟甲基化改性可以提高木质素羟基含量,增加亲水性基团,提高反应活性。在酚醛胶制备中,通常将木质素进行羟甲基化改性从而使木质素苯环更易替代苯酚,进而实现低毒性、低成本、高性能酚醛胶的制备[15-16]。然而有关在羟甲基化改性中对改性前后木质素结构方面的研究尚不多见。因此,笔者以玉米芯碱木质素为研究对象,研究羟甲基化改性前后碱木质素结构的变化,并对其反应机理进行初步分析。此外,通过改变羟甲基化反应条件,即温度、时间、pH、物料比,探讨碱木质素最佳羟甲基化工艺,为羟甲基木质素后续缩合提供参考依据。
1 材料与方法
1.1 试剂与仪器
试剂:玉米芯碱木质素(固体质量分数96%),山东龙力生物科技有限公司;甲醛溶液,分析纯,北京蓝弋化工产品有限责任公司;氢氧化钠,分析纯,北京蓝弋化工产品有限责任公司;盐酸,分析纯,北京易秀博谷生物科技有限公司。
仪器:Nicolet iN10傅里叶变换红外光谱仪(ThermoFisher Scientific 公司,中国);Bruker AV III 400M 超导核磁共振仪,德国Bruker公司。
1.2 羟甲基化碱木质素的制备
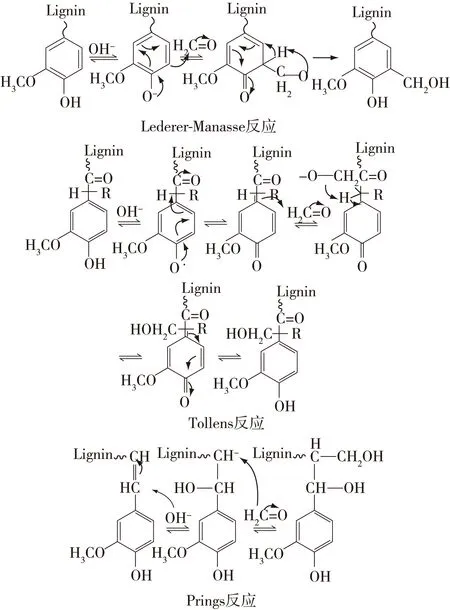
图1 木质素羟甲基化反应过程Fig. 1 Reaction process of lignin hydroxymethylation
将一定量的玉米芯碱木质素、甲醛溶液、去离子水置入装有温度计、搅拌机和冷凝管的三口烧瓶中。使用1 mol/L的氢氧化钠调节溶液pH>9,加热。反应一定时间后,转移至500 mL烧杯中,用 5 mol/L盐酸调节溶液pH至2,析出的碱木质素经离心、冲洗(除去盐类杂质),最后冷冻干燥,得出样品。其反应过程见图1。在碱性条件下(pH>9),木质素和甲醛可能发生3种反应:Lederer-Manasse反应,Tollens反应和Prings反应[17]。在Lederer-Manasse反应中,酚羟基被OH-活化而变为氧负离子,氧负离子上的电子离域到芳香环上,与芳香环形成 p-π共轭体系,使酚羟基邻位和对位的电子云密度增加。作为亲电试剂的甲醛靠近酚羟基对位或邻位时,发生亲电加成反应,在邻位或对位接入羟甲基;在Tollens反应中,当木质素存在特定结构单元时(具有α位质子,β位吸电子基团),碱性条件下酚羟基发生活化,氧的负电子离域到芳香环上,从而使Cα与C1间形成双键,与芳香环形成p-π共轭体系,又因芳香环侧链β位吸电子基团影响,Cα与C1双键上的电子向Cα发生偏移,Cα上电子云密度增大,当甲醛靠近Cα时,发生亲电加成反应生成羟甲基;对于具有Cα和Cβ双键的木质素结构单元,酚羟基首先在碱性条件下发生活化形成氧负离子,氧负离子的电子离域到芳香环上,Cα与C1间形成双键,溶液中的OH-进攻Cα、Cα和Cβ双键的电子转移到Cβ上,作为亲电试剂的甲醛和具有负电子的Cβ发生亲电加成反应生成羟甲基,这种形成过程为Prings反应。
1.3 性能测试
1.3.1 红外光谱分析
釆用配备了MCT检测器的Nicolet 系列傅立叶变换红外光谱仪(Thermo Nicolet)进行测定。在玛瑙研钵中,将干燥的样品研磨为细粉末。然后滴入 1~2 滴乙醇,涂于标准载物片,红外灯烘干后放置于载物台上进行测定。波谱的范围为4 000~650 cm-1(扫描128次)。
1.3.2 核磁共振分析
采用BrukerAV III 400M超导核磁共振仪,在以100.6 MHz的FT模式下对13C NMR进行测定。对于DEPT135,80 mg羟甲基化碱木质素和碱木质素原料样品溶解于0.5 mL的NaOD中,在30°脉冲倾斜角,9.2 μs脉冲宽度,1.36 s采集时间,1.89 μs弛豫延迟时间,15 000次扫描条件下测定。使用溶解于0.5 mL的D2O中的60 mg羟甲基化碱木质素和碱木质素原料分别进行异核单量子相干(HSQC)NMR试验,对于1H-维度,采样点数为1 024次,弛豫时间为1.5 s。扫描次数为128次,在13C-维度上记录128和256次增量,使用的偶合常数1JC-H为146 Hz。
1.3.3 游离甲醛质量分数的测定
参考GB/T 14074—2006进行游离甲醛测定。试样中游离甲醛易与盐酸羟胺发生反应,使用电位差法,用氢氧化钠滴定反应形成的盐酸。
取1 g(精确到0.000 1 g)试样放入250 mL烧杯中,加入50 mL水和少量1 mol/L 氢氧化钠使试样充分溶解。将pH计的电极插至溶液中,用浓度为1 mol/L 的盐酸溶液和0.1 mol/L的盐酸溶液将pH调至3.5。在(23±1)℃条件下滴入10 mL 10%的盐酸羟胺溶液,搅拌(10±1)min。使用适当容量的滴定管以0.1 mol/L的氢氧化钠溶液将被测定液pH迅速滴定至3.5。同时做空白试验,平行测定2次。游离甲醛质量分数根据以下公式计算:
式中:W为游离甲醛质量分数,%;V为滴定试样所消耗氢氧化钠溶液的体积,mL;V0为滴定空白试样所消耗氢氧化钠溶液的体积,mL;C为氢氧化钠溶液浓度,mol/L;m为试样质量,g;0.030 03为与1.0 mL氢氧化钠溶液(0.1 mol/L)相当的甲醛质量,g。
1.3.4 羟甲基质量分数的测定
参考GB/T 14074—2006进行测定。在碱性条件下羟甲基与碘反应,再使用硫代硫酸钠标准液滴定剩余的碘,从而测定羟甲基质量分数。
称取试样0.1 g(精确到0.000 1 g),置于250 mL碘量瓶中,依次加入50 mL去离子水,25 mL 0.1 mol/L碘溶液,10 mL 2 mol/L强氧化钠溶液,盖紧瓶塞并摇匀,使用水封口,静置30 min后,加入10 mL 4 mol/L盐酸溶液,摇匀后立即用硫代硫酸钠标准液滴定至淡黄色,加入淀粉指示剂后继续滴定至蓝色消失。同时做空白试验,平行测定2次。羟甲基质量分数根据以下公式计算:
式中:M为羟甲基质量分数,%;V为滴定试样所消耗硫代硫酸钠标准溶液的体积,mL;V0为滴定空白样所消耗硫代硫酸钠标准溶液的体积,mL;C为硫代硫酸钠溶液浓度,mol/L;m为试样质量,g;W为游离甲醛质量分数,%;0.015为修正值;1.03为羟甲基分子质量与甲醛分子质量之比。
2 结果与分析
2.1 红外光谱表征

从图2可以看出,与碱木质素相比,羟甲基化碱木质素在3 362 cm-1处羟基O—H的伸缩振动,2 938 cm-1处甲基、亚甲基的C—H伸缩振动,1 457 cm-1处亚甲基C—H的弯曲振动均显著增强,说明改性后羟甲基(—CH2OH)的含量增多;而在1 030 cm-1处芳香环C—H平面内变形振动,835 cm-1处苯环C—H 平面外变形振动显著减弱,说明苯环上C—H减少,可能由改性后甲醛接入到苯环上所导致。
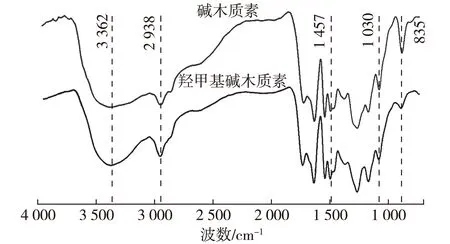
图2 碱木质素和羟甲基化碱木质素的FTIR谱图Fig. 2 The FTIR spectra of alkali lignin and hydroxymethyl alkali lignin
2.2 核磁表征
2.2.1 DEPT 135
DEPT谱是13C核磁共振谱中的一种检测技术,主要用于区分13C谱图中的伯碳(CH3)、仲碳(CH2)、叔碳(CH)和季碳(C)。DEPT 135谱图可有效区分仲碳。伯碳、叔碳的峰向上(信号为正),仲碳为倒峰(信号为负)。碱木质素和羟甲基化碱木质素的DEPT 135谱图见图3。位于低位移区域,羟甲基化碱木质素与碱木质素存在明显区别。在δ61.3附近,羟甲基化碱木质素出现了新的倒峰(CH2信号),而碱木质素没有信号,可能是碱木质素在羟甲基化改性后甲醛接入到碱木质素上形成亚甲基结构所导致。此外,羟甲基化碱木质素在δ68.5和δ48.7附近均出现向上的峰。而碱木质素仅在δ48.7处出现较弱的峰,在δ68.5处附近则未出现峰。其原因可能为碱木质素中对羟基肉桂酸和阿魏酸侧链的C7、C8双键与甲醛发生羟甲基化反应,其侧链上C7—H和C8—H由低场移向了高场,所以羟甲基化碱木质素在δ68.5和δ48.7附近出现了较强CH信号,而碱木质素中香豆酸、阿魏酸侧链C7、C8双键上CH信号存在于低场区域,同时,碱木质素包含少量非双键C7—H和C8—H结构,因此,在δ68.5和δ48.7附近CH信号峰较弱或未出现CH信号峰。在δ55.9附近,羟甲基化碱木质素和碱木质素均有相近信号峰,可能归属于碱木质素中甲氧基中的CH3。
在高位移区域,二者较为相似。碱木质素在δ111.9附近处的峰归属于愈创木基结构中C-2,而羟甲基化碱木质素愈创木基结构中C-2则出现在δ112.4附近。碱木质素G型单元中C-5峰出现在δ115.1处,而羟甲基化碱木质素G型单元中C-5峰则出现在δ117.1附近。碱木质素对羟基肉桂酸单元中C-8峰出现在δ116.5附近,而羟甲基化碱木质素则出现于δ118.3处。碱木质素中阿魏酸酯C6—H6峰出现于δ121处,而羟甲基化碱木质素则出现在δ119.3处。对于碱木质素,在δ129.3处的峰归属于对羟基肉桂酸单元C-2/C-6,δ140.5附近归属于对羟基肉桂酸单元C-7。而对于羟甲基化碱木质素而言,δ130.2归属于对羟基肉桂酸单元C-2/C-6的化学位移,δ142.4附近处的峰归属于对羟基肉桂酸单元C-7。该结果与已有研究结果类似[19-20]。在高位移区域,碱木质素改性前后,芳香环上C—H信号发生一定偏移,可能是木质素苯环上接入的羟甲基使苯环上相邻CH峰的化学位移发生了改变。
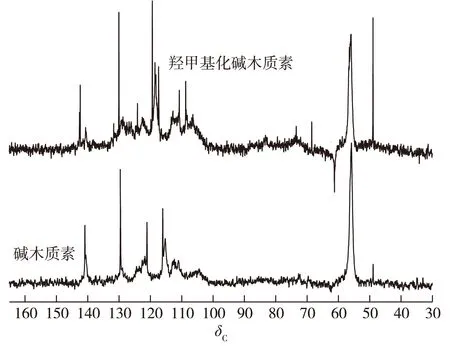
图3 碱木质素和羟甲基化碱木质素的DEPT 135谱图Fig. 3 The DEPT 135 spectra of alkali lignin and hydroxymethyl alkali lignin
2.2.2 二维HSQC谱图
异核单量子关系(HSQC), 属于NMR(核磁共振)C—H 谱图中的一种,探究直接相连的碳氢之间关系。木质素是复杂的聚芳香类物质,由多种结构单元构成,即对羟基苯基单元(H),愈创木基单元(G),紫丁香基单元(S),阿魏酸酯单元(FA),对羟基肉桂酸单元(PCA),β-O-4醚键结构(A),苯基香豆满(C)等。通过HSQC谱图对这些单元进行辨别以及归属,能够有效探究碱木质素羟甲基化反应过程,以及碱木质素在改性后的结构变化。图4为碱木质素和羟甲基化碱木质素的13C—1H HSQC谱图,表1为图4中各信号峰的归属,图5为从表1中归纳的碱木质素典型结构单元。本研究结果与已有研究结果基本一致[20-21]。
由图4可以看出,在侧链区域,碱木质素与羟甲基化碱木质素的甲氧基信号,苯基香豆满中C9—H9信号基本没有发生变化,说明碱木质素羟甲基化改性过程中该结构单元不参加反应。但β-O-4结构中C9—H9信号在改性后变强,可能是因为碱木质素羟甲基改性后β-O-4结构中C9—H9增多,即对羟基肉桂酸单元和阿魏酸单元侧链的C7、C8双键与甲醛发生了Prings加成反应形成了羟甲基。此外,碱木质素改性后在δC61.3/δH4.52处出现了新的信号,可能是来自于Ar—CH2OH单元中的亚甲基,即甲醛接在木质素苯环上形成新的羟甲基侧链。而且,在图3中δ61.3处出现了亚甲基峰,进一步验证了—CH2OH成功接入到木质素中。
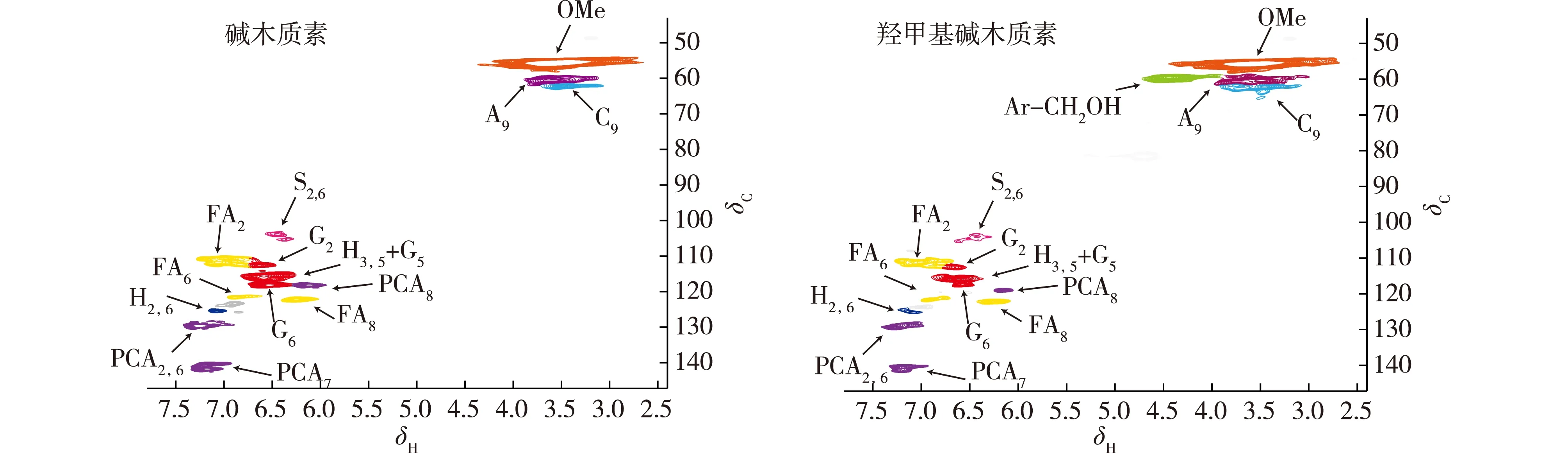
图4 碱木质素与羟甲基化碱木质素HSQC谱图Fig. 4 The 2D-HSQC-NMR spectra of alkali lignin and hydroxymethyl alkali lignin
在芳香区域,H3,5和G5信号在羟甲基化改性后减弱,说明甲醛在对羟基苯基的C-3和C-5、愈创木基的C-5上发生了Lederer-Manasse加成反应。H2,6,G2,G6和S2,6改性前后峰的信号基本未发生变化,表明在对羟基苯基单元(H),愈创木基单元(G),紫丁香基单元(S)的C-2 和 C-6 上没有发生羟甲基化反应。这可能是因为在碱性条件下,酚羟基发生活化形成的氧负电子离域到芳香环上,形成了p-π共轭,使酚羟基的邻、对位的电子云密度增大,而在酚羟基的间位电子云密度低,C-2和C-6正好处于酚羟基的间位,吸引亲核试剂的能力很弱,不易与甲醛发生亲核加成反应。阿魏酸、对羟基肉桂酸单元的C-2和C-6信号峰没有明显变化,但C-7和C-8则在羟甲基改性后信号减弱,可能是由于阿魏酸、对羟基肉桂酸单元侧链中的双键和甲醛发生了Prings加成反应导致C-7和C-8由低场向高场发生偏移。DEPT 135谱图也显示在δ68.5和δ48.7附近处出现向上的峰,由此可见,阿魏酸、对羟基肉桂酸单元的侧链与甲醛发生了羟甲基化反应。
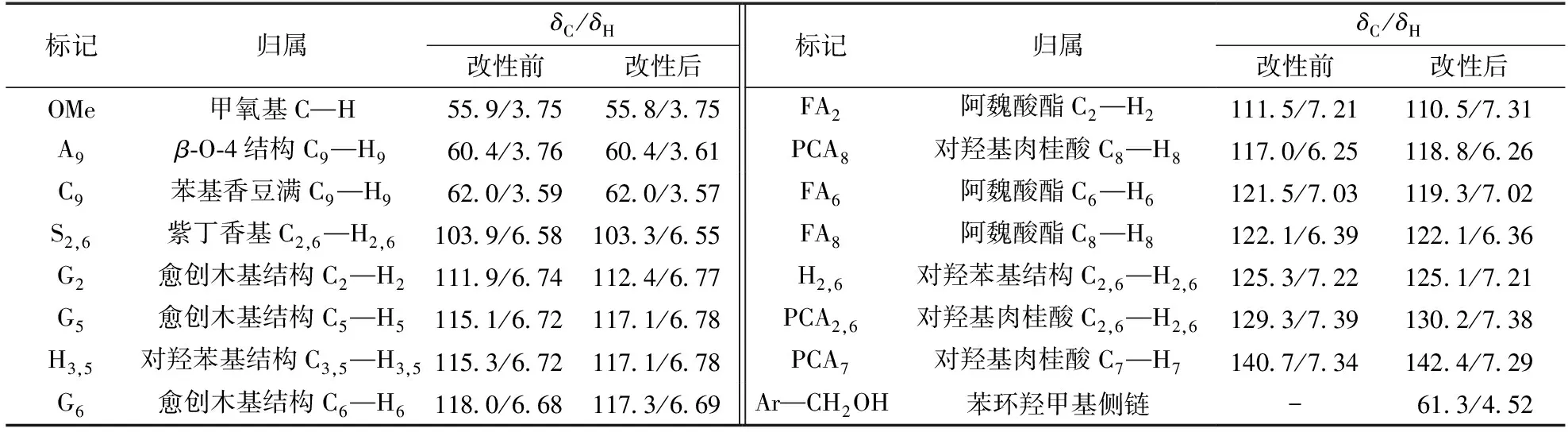
表1 碱木质素13C—1H HSQC谱图归属Table 1 Assignments of 13C—1H cross signals in quantitative heteronuclear-single-quantum-coherence spectra (HSQC) of alkali lignin and hydroxymethyl alkali lignin
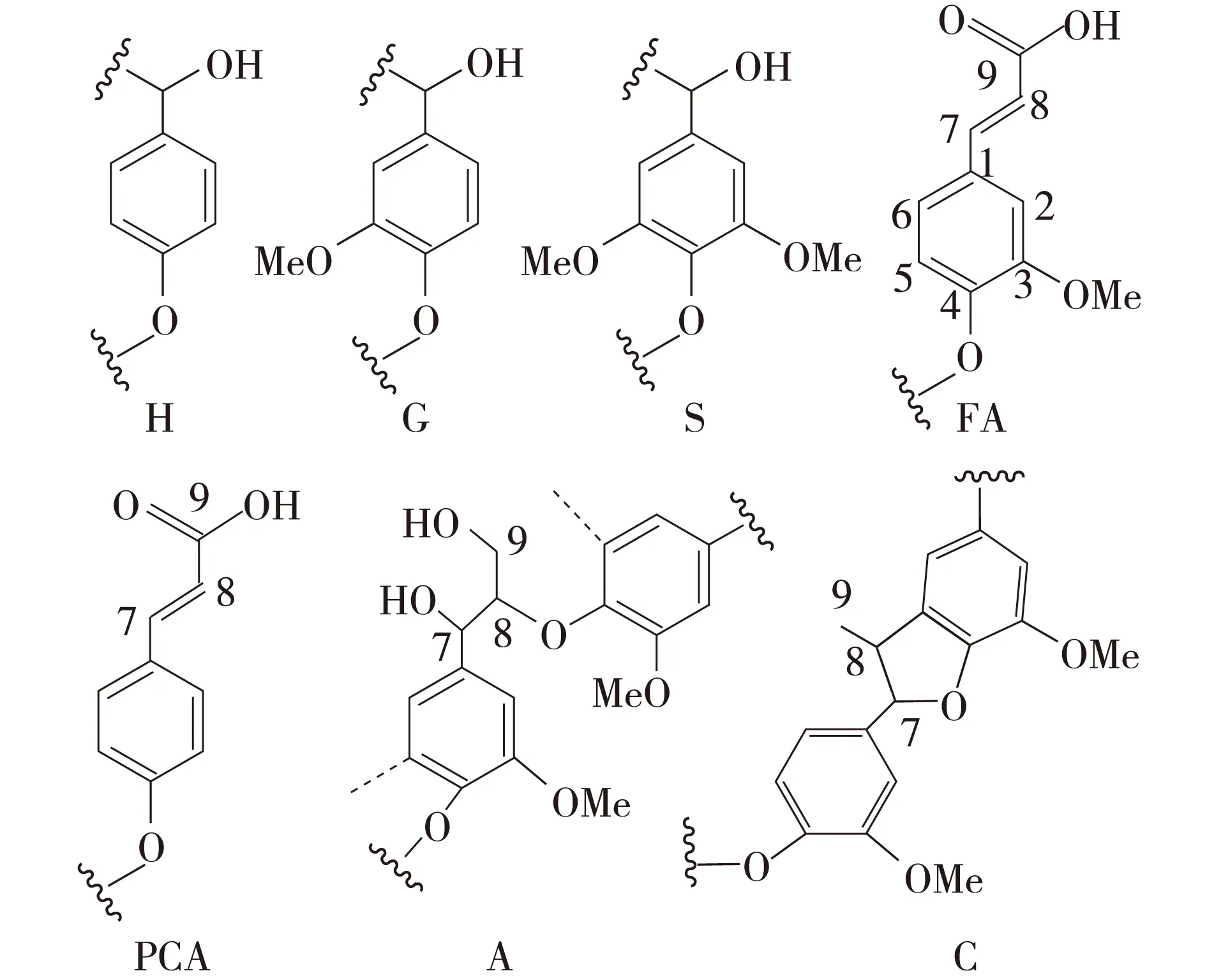
H:对羟基苯基单元;G:愈创木基单元;S:紫丁香基单元; FA:阿魏酸酯单元;PCA:对羟基肉桂酸单元; A:β-O-4醚键结构;C:苯基香豆满图5 碱木质素典型结构单元Fig. 5 Classical substructures of alkaline lignin
DEPT 135和HSQC图谱均表明甲醛与碱木质素发生了羟甲基化反应。发生羟甲基化反应主要来有两种反应过程,甲醛和对羟基肉桂酸或阿魏酸侧链的C7和C8双键发生了Prings加成反应形成了羟甲基;和对羟基苯基的C-3、C-5,愈创木基的上发生了Lederer-Manasse加成反应形成了羟甲基。
2.3 羟甲基质量分数分析
在羟甲基化改性过程中,过度反应条件如反应温度过高,时间过长,溶液碱性过高等均会导致羟甲基化的碱木质素发生缩合反应,不利于碱木质素活化改性;过于温和的反应条件又会使得羟甲基化反应程度低,不利于提高碱木质素活性。因此,有必要对碱木质素羟甲基化反应条件进行优化试验。通过对反应温度、物料比、反应时间、pH等因素进行L16(45)正交试验设计,以羟甲基质量分数作为评价指标,确定碱木质素羟甲基改性的最优实验条件。正交试验采用四因素,每个因素分为四水平(表2)。
碱木质素羟甲基含量正交试验结果见表3,表4为正交试验相关因素分析。从表3和表4结果可以看出,影响碱木质素羟甲基化程度的因素主要为反应温度、时间、溶液pH和物料比。各因素的主次顺序为温度>时间>pH>木质素与甲醛质量比。反应温度从根本上决定碱木质素羟甲基化反应进程。当反应温度较低时,反应缓慢,羟甲基的质量分数较低,仅为1.67%,而未反应的游离甲醛的质量分数也最高;而当温度较高时,羟甲基质量分数显著增大,在80℃达到最大值2.11%。但随温度的进一步升高,羟甲基的质量分数却明显降低至2.05%,这可能是活化后的羟甲基木质素在高温下自身发生缩合反应,导致羟甲基的质量分数降低。当反应时间过短,不足3 h时,羟甲基化反应不够充分,因此羟甲基质量分数不足2%;当反应时间为3 h时,羟甲基质量分数可达到2.07%左右;当反应时间超过3 h时,羟甲基质量分数降低至1.92%。溶液的酸碱性也影响木质素的羟甲基化反应,在pH为11时羟甲基的质量分数最高,为2.02%。木质素和甲醛的物料比对羟甲基化影响程度最小,当m(木质素)∶m(甲醛)为6∶1时,羟甲基的质量分数最高,为2.02%。因此,通过该正交试验可确定碱木质素羟甲基化的最优实验条件为:温度80℃,时间3 h,pH为11,m(木质素)∶m(甲醛)为6∶1。在最优条件下,碱木质素羟甲基质量分数达2.32%。
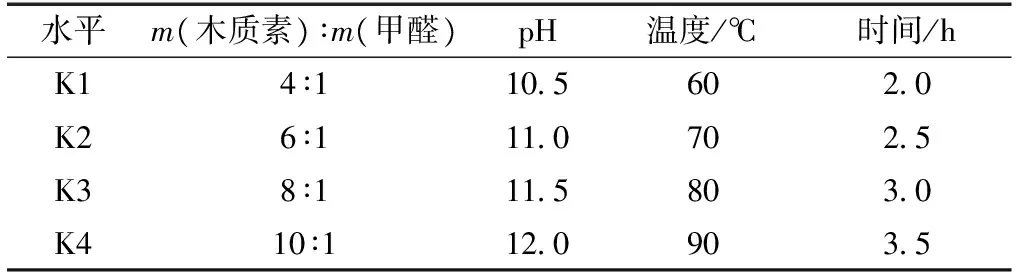
表2 正交试验因素和水平Table 2 Orthogonal test factors and levels
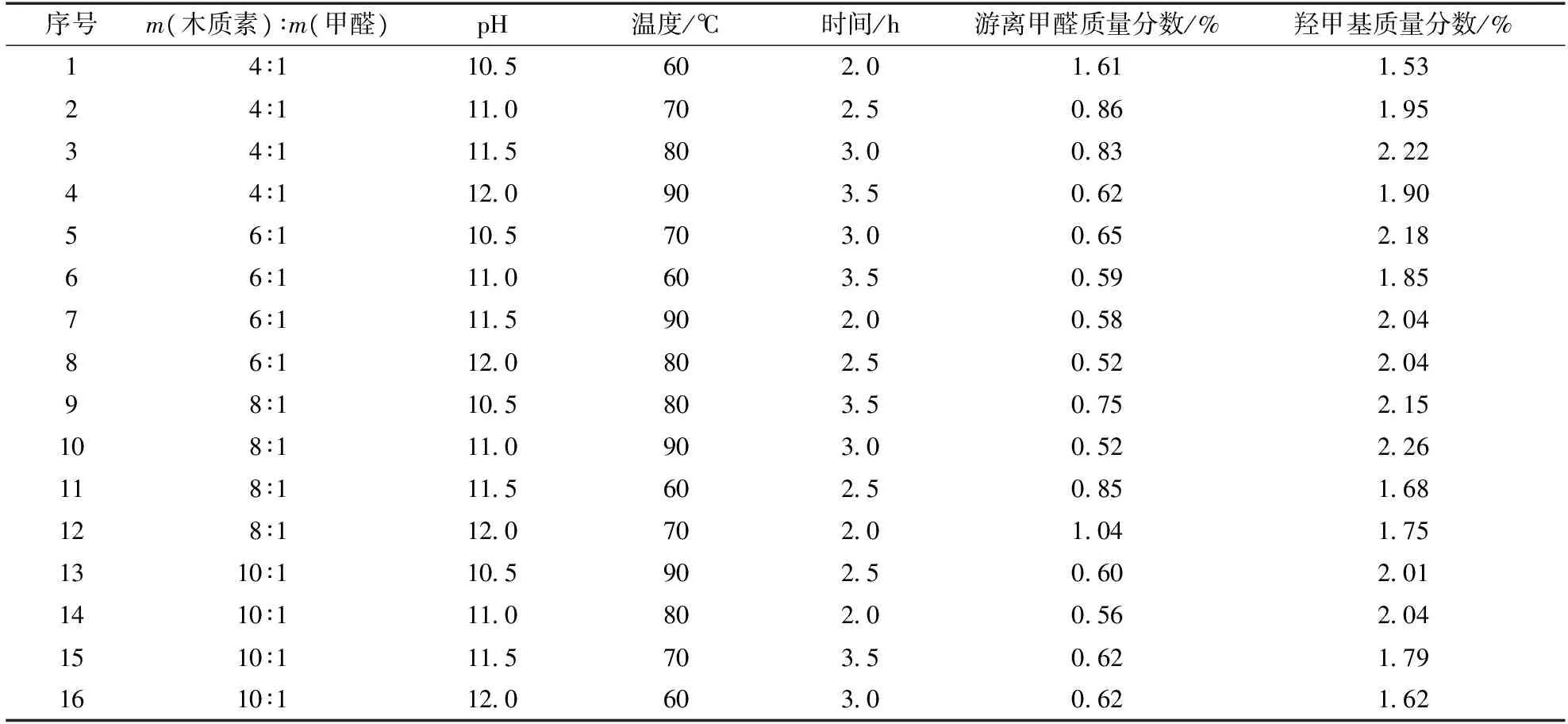
表3 碱木质素羟甲基质量分数结果Table 3 Results of hydroxymethyl mass of alkali lignin
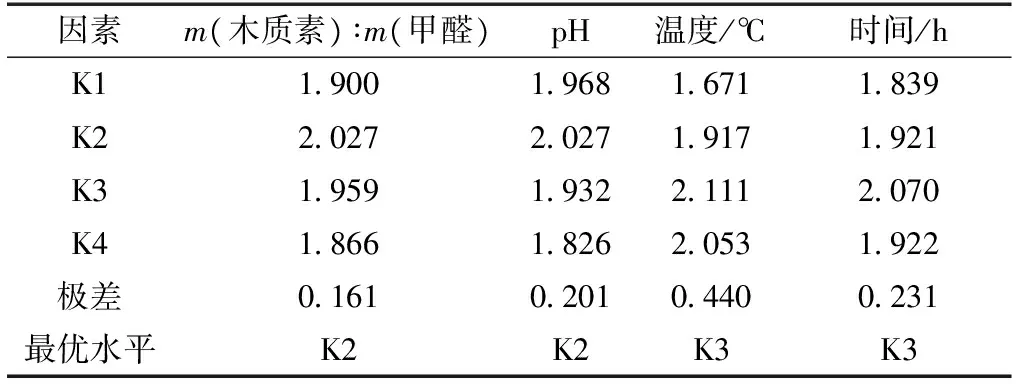
表4 正交试验因素分析Table 4 Orthogonal test factors analysis
3 结 论
本文以玉米芯碱木质素为原料,在碱性条件下探讨了碱木质素羟甲基化反应。同时,通过红外、核磁共振方法分析了碱木质素改性前后的结构变化,并对反应过程进行了探讨。研究发现,发生羟甲基化反应主要有两种反应过程,在碱木质素侧链区域甲醛和对羟基肉桂酸或阿魏酸单元侧链的双键发生Prings反应形成了羟甲基;在碱木质素芳香区域和对羟基苯基的C-3、C-5,愈创木基的C-5上发生Lederer-Manasse反应形成了羟甲基。而木质素的其他结构单元均未与甲醛发生羟甲基化反应。通过正交试验进一步优化碱木质素羟甲基化反应,得出最佳工艺条件为:反应温度80℃,反应时间3 h,pH为11,m(木质素)∶m(甲醛)为6∶1。在此最优条件下羟甲基的质量分数为2.32%。本研究仅初步分析了碱木质素在羟甲基化改性后的结构变化,在今后工作中将针对改性后的碱木质素进行深入研究,以拓展羟甲基化碱木质素的应用价值。
[1]刘玉环, 阮榕生, 蒋启海, 等. 木质纤维素及其组分转化木材胶粘剂的发展趋势[J]. 世界林业研究, 2006,19(5):50-53. LIU Y H, RUAN R S, JIANG Q H, et al. Wood adhesive derived from lignocellulosics history and future[J]. World Forestry Research, 2006,19(5):50-53.[2]STEWART D. Lignin as a base material for materials applications:chemistry, application and economics[J]. Industrial Crops and Products, 2008,27(2):202-207.
[3]CRUZ J M, DOMNGUEZ J M, HERMINIA D A, et al. Antioxidant and antimicrobial effects of extracts from hydrolysates of lignocellulosic materials[J]. Journal of Agricultural and Food Chemistry, 2001,49(5):2459-2464.
[4]TOH K, NAKANO S, YOKOYAMA H, et al. Anti-deterioration effect of lignin as an ultraviolet absorbent in polypropylene and polyethylene[J]. Polymer Journal, 2005, 37(8):633-635.
[5]LIU L, QIAN M, SONG P, et al. Fabrication of green lignin-based flame retardants for enhancing the thermal and fire retardancy properties of polypropylene/wood composites[J]. ACS Sustainable Chemistry & Engineering, 2016,4(4):2422-2431.
[6]UGARTONDO V, MITJANS M, VINARDELL M P. Comparative antioxidant and cytotoxic effects of lignins from different sources[J]. Bioresource Technology, 2008,99(14):6683-6687.
[7]白孟仙, 秦延林, 杨东杰. 木质素系染料分散剂的研究和应用综述[J]. 生物质化学工程, 2012, 46(6):35-39. BAI M X, QIN Y L, YANG D J. Research and application of lignin-based dye dispersants[J]. Biomass Chemical Engineering, 2012,46(6):35-39.
[9]WEI Z, MA Y, WANG C, et al. Preparation and properties of lignin-phenol-formaldehyde resins based on different biorefinery residues of agricultural biomass[J]. Industrial Crops and Products, 2013,43(1):326-333.
[10]VISHTAL A, KRASLAWSKI A. Challenges in industrial applications of technical lignins[J]. Bioresources, 2011,6(3):3547-3568.
[11]PODSCHUN J, STÜCKER A, BUCHHOLZ R I, et al. Phenolated lignins as reactive precursors in wood veneer and particleboard adhesion[J]. Industrial & Engineering Chemistry Research, 2016,55(18):5231-5237.
[12]HU L, PAN H, ZHOU Y, et al. Methods to improve lignin’s reactivity as a phenol substitute and as replacement for other phenolic compounds:a brief review[J]. Bioresources, 2011,6(3):3515-3525.
[13]LEE W J, CHANG K C, TSENG I M. Properties of phenol-formaldehyde resins prepared from phenol-liquefied lignin[J]. Journal of Applied Polymer Science, 2011,124(6):4782-4788.
[14]刘纲勇, 邱学青, 邢德松. 工业木质素在木材胶粘剂中应用的研究进展[J]. 精细化工, 2007,24(2):190-193. LIU G Y, QIU X Q, XING D S. Research progress in applications of industrial ligninsto wood adhesives[J]. Fine Chemicals, 2007,24(2):190-193.
[15]TACHON N, BENJELLOUN M B, DELMAS M. Organosolv wheat straw lignin as a phenol substitute for green phenolic resins[J]. Bioresources, 2016,11(3):5797-5815.
[16]ZHAO M, JING J, ZHU Y, et al. Preparation and performance of lignin-phenol-formaldehyde adhesives[J]. International Journal of Adhesion and Adhesives, 2016, 64:163-167.
[17]ALTON G C, ALLAN R W. The present status and potential of kraft lignin-phenol-formaldehyde wood adhesives[J]. Journal of Adhesion Science and Technology, 1985,18(4):301-314.
[18]FAIX O. Classification of lignins from different botanical origins by FT-IR spectroscopy[J]. Holzforschung, 2009,45(S1):21-28.
[19]CAPANEMA E A, Balakshin M Y, Kadla J F. A comprehensive approach for quantitative lignin characterization by NMR spectroscopy[J]. Journal of Agricultural and Food Chemistry, 2004,52(7):1850-1860.
[20]YANG S, WEN J L, YUAN T Q, et al. Characterization and phenolation of biorefinery technical lignins for lignin-phenol-formaldehyde resin adhesive synthesis[J]. RSC Advances, 2014,4(101) :57996-58004.
[21]WEN J L, SUN S L, XUE B L, et al. Recent advances in characterization of lignin polymer by solution-state nuclear magnetic resonance(NMR) methodology[J]. Materials, 2013,6(1):359-391.
Study on hydroxymethylation of industrial lignin
XU Qiang1,2, SUN Qianqian3, ZHAO Xinkun3, CAO Shenglei3, SHE Diao1,2*, SUN Runcang4
(1. State Key Laboratory of Soil Erosion and Dryland Farming on the Loess Plateau, Research Center of Soil and WaterConservation and Ecological Environment, Chinese Academy of Sciences and Ministry of Education;2. Institute of Soil andWater Conservation, Northwest A& F University;3. College of Resources and Environment, Northwest A& F University,Yangling 712100, Shaanxi, China; 4. Beijing Key Laboratory of Lignocellulosic Chemistry, Beijing Forestry University,Beijing 100083, China)
Lignin is a natural polymer that can be used as a raw material for the preparation of chemicals and materials. Hydroxymethylation is an effective modification method to increase the activity of the lignin and therefore improve the utilization of the lignin. This study compared the structure changes of lignin before and after the hydroxymethylation reaction to evaluate the improvement of the activity of lignin. The structures of the hydroxymethylated lignin and the raw lignin were characterized by FTIR, DEPT 135 and HSQC. In addition, the hydroxymethylation reaction was optimized by orthogonal design with altering the conditions including temperature, time, pH, and the mass ratio of lignin to formaldehyde. The results showed that the C7 and C8 inp-coumaric acid units (PCA) and ferulic acid units (FA), the C3 and C5 inp-hudroxyphenyl units, and the C5 inguaiacyl units (G) reacted with formaldehyde to formhydroxymethyl groups. This hydroxymethylation reactions mainly included Prings reaction and Lederer-Manasse reaction. However, other units, such as syringyl units (S),β-O-4 aryl ether linkages (A) and phenylcoumarane substructure (C), did not react with formaldehydeunder alkaline conditions. The optimal conditions of hydroxymethylation were under the reaction temperature of 80℃, reaction time of 3 h, the pH of 11 and the mass ratio of alkali lignin to formaldehyde of 6∶1, where the hydroxymethyl content reached 2.32%. This study explained the changes in the structure of the alkali lignin after hydroxymethylation, and the results could be helpful to promote the application of industrial alkali lignin.
hydroxymethylation; alkaline lignin; NMR; free formaldehyde; orthogonal array experiment
2016-11-16
2016-12-20
国家自然科学基金(31370368);国家“十二五”科技支撑计划课题(2015BCA01B01)。
徐强,男,研究方向为农业资源管理与利用。通信作者:佘雕,男,副教授。E-mail:diaoshe888@163.com
TQ351;S781.4
A
2096-1359(2017)03-0090-07

