田菁来源半乳甘露低聚糖对青春双歧杆菌的增殖
陆旻妍,杨磊,赖晨欢,周梦怡,奚晓桐,余世袁,勇强*
(1.南京林业大学林业资源高效加工利用协同创新中心;2.南京林业大学化学工程学院,南京210037)
田菁来源半乳甘露低聚糖对青春双歧杆菌的增殖
陆旻妍1,2,杨磊1,2,赖晨欢1,2,周梦怡1,奚晓桐2,余世袁1,2,勇强1,2*
(1.南京林业大学林业资源高效加工利用协同创新中心;2.南京林业大学化学工程学院,南京210037)
田菁是被广泛应用的盐碱地改良先锋植物,半乳甘露聚糖是田菁种子的主要成分。半乳糖、甘露糖和半乳甘露低聚糖为半乳甘露聚糖酶法完全和不完全水解产物。为揭示不同分子质量半乳甘露聚糖不完全降解产物的生物学功能差异,笔者研究了半乳糖、甘露糖和不同分子质量分布的半乳甘露低聚糖对青春双歧杆菌(Bifidobacteriumadolescentis)的增殖作用及其代谢产物。青春双歧杆菌分别以3 g/L(质量浓度)半乳糖和甘露糖为碳源培养24 h,糖利用率分别为99.67%和72.00%,菌体质量浓度从初始的0.04 g/L分别增殖到1.82和0.39 g/L,生成的总短链脂肪酸(乙酸、乳酸和丙酸)质量浓度分别为6.76和3.02 g/L。不同分子质量分布的半乳甘露低聚糖能有效增殖青春双歧杆菌,半乳甘露低聚糖平均分子质量越低,对青春双歧杆菌的增殖作用越强。青春双歧杆菌以3 g/L,分子质量分布为5~10,2~5和≤2 ku的半乳甘露低聚糖为碳源培养24 h,半乳甘露低聚糖利用率分别为59.00%,61.67%和86.33%,青春双歧杆菌菌体质量浓度从初始浓度的0.04 g/L分别增殖到0.51,0.79和1.71 g/L。青春双歧杆菌以分子质量≤2 ku的半乳甘露低聚糖为碳源培养24 h,代谢产物乙酸、乳酸和丙酸的质量浓度分别为4.14,2.48和0.81 g/L。
半乳甘露低聚糖;田菁;青春双歧杆菌;增殖;短链脂肪酸
Invitroproliferation ofBifidobacteriumadolescentisby
双歧杆菌是婴幼儿肠道内的优势菌群,占母乳喂养婴儿粪便中微生物数量的99%,它也是成人肠道中占优势的有益菌[1]。双歧杆菌具有促进肠道蠕动,降低肠道pH,抑制腐败细菌生长,合成B族维生素,促进蛋白质吸收,提高机体免疫力等生理功能[2]。半乳甘露低聚糖(galactomanno-oligosaccharides, GMOS) 为功能性低聚糖家族的新成员,是半乳甘露聚糖的不完全降解产物[3],它具有促进人或动物体内双歧杆菌等有益菌群增殖[4]、提高机体免疫力等功能[5],是优良的功能性食品基料和无公害饲料添加剂[6-7]。有关半乳甘露低聚糖的体外增殖研究尚不多见,缪月秋等[8]采用胡芦巴酶解产物增殖青春双歧杆菌,发现分子质量较小的半乳甘露多糖酶解片段更有利于青春双歧杆菌增殖,但并未做深入研究。Asano等[9]研究了咖啡甘露低聚糖的体外发酵,发现咖啡甘露低聚糖的二糖到六糖组分能被人体肠道益生菌利用,代谢产物主要为乙酸、丙酸和丁酸。半乳甘露低聚糖是盐碱地改良先锋植物田菁种子中半乳甘露聚糖的不完全降解产物[10],笔者在体外模拟肠道内严格厌氧环境,研究了不同分子质量分布的半乳甘露低聚糖对青春双歧杆菌的增殖作用及其代谢产物,并对青春双歧杆菌代谢半乳甘露低聚糖的机理进行了探讨,研究结果可为半乳甘露聚糖选择性降解制备半乳甘露低聚糖技术的建立及半乳甘露低聚糖的应用推广提供理论依据。
1 材料与方法
1.1 菌 种
青春双歧杆菌(Bifidobacteriumadolescentis),ATCC 15703,严格厌氧菌株冻干粉,安瓿瓶保存,由中国普通微生物菌种保藏中心提供。
1.2 不同分子质量分布的半乳甘露低聚糖制备
田菁半乳甘露聚糖经内切β-甘露聚糖酶水解、离心,上清液中单糖采用酿酒酵母发酵除去,用截留分子质量为10,5和2 ku的超滤离心管(德国,Sartorius)将上清液中的半乳甘露低聚糖分级成分子质量范围分别为5~10 ku(GMOSⅠ)、2~5 ku(GMOSⅡ)和≤2 ku(GMOSⅢ)的半乳甘露低聚糖。GMOSⅠ、GMOSⅡ和GMOSⅢ中甘露糖基和半乳糖基的摩尔比分别为2.06,2.30和1.82。不同分子质量分布的半乳甘露低聚糖溶液浓缩到一定浓度后备用。
1.3 青春双歧杆菌培养基
1.3.1 活化培养基
葡萄糖(质量分数,下同)1%,大豆蛋白胨0.5%,胰蛋白胨0.5%,酵母提取物1%,CaCl20.000 8%,NaCl 0.008%,K2HPO40.004%,KH2PO40.004%,NaHCO30.04%,MgSO40.001 9%,L-半光氨酸0.1%,硫代乙醇酸钠0.1%,CaCO32%,调节pH至7.0。
1.3.2 增殖培养基
以质量浓度为3 g/L的半乳糖、甘露糖和半乳甘露低聚糖替代活化培养基中质量浓度为10 g/L的葡萄糖,即为增殖培养基。
1.4 青春双歧杆菌体外培养
青春双歧杆菌活化:活化培养基于121℃灭菌,15 min后转入DUAL GAS YQX-1型厌氧培养箱中,调节pH至7.0,接入青春双歧杆菌冻干粉,于37℃下活化培养36 h。
青春双歧杆菌增殖:增殖培养基于121℃灭菌,15 min后转入DUAL GAS YQX-1型厌氧培养箱中,调节pH至7.0,用移液枪吸取4.75 mL混匀的培养基于5 mL具塞螺纹试管中,接入0.25 mL种母活化液,混匀后旋紧试管塞,于37℃培养36 h,定时取样分析。试验按双平行设计,数据取其平均值。
1.5 分析方法
1.5.1 菌体浓度测定
采用比浊法测定。用盐酸中和青春双歧杆菌培养液中过量的CaCO3,培养液于3 000 r/min转速下离心15 min,沉淀用生理盐水洗涤、离心 3次,使用蒸馏水定容到原体积。以蒸馏水为空白对照,采用分光光度计在600 nm下测定菌液吸光度(A),根据绘制的菌体吸光度与菌体质量浓度(C)的标准曲线计算培养液中菌体浓度。
1.5.2 半乳糖和甘露糖定量分析
半乳糖和甘露糖分析采用高效液相离子色谱(DINOX ICS-3000)分析,外标法测定。色谱条件:CarboPac PA10(4 mm×250 mm)色谱柱,进样量10 μL,流动相3 mmol/L NaOH,流速0.2 mL/min,柱温30℃,脉冲安培检测器检测。
1.5.3 半乳甘露低聚糖分析
取1 mL半乳甘露低聚糖溶液于水解瓶中,加入1 mL质量分数为8%的H2SO4,于121℃下反应1 h,取出冷却后使用质量分数为50%的NaOH中和反应液pH至4~6,定容至一定体积,采用高效液相离子色谱测定其中甘露糖和半乳糖质量浓度。半乳甘露低聚糖质量浓度按以下公式计算。
半乳甘露低聚糖质量浓度(g/L)=
(Cman+Cgal)×0.9×D
式中:Cman为酸解液中甘露糖质量浓度,g/L;Cgal为酸解液中半乳糖质量浓度,g/L;D为稀释倍数;0.9为半乳甘露聚糖与半乳糖和甘露糖之间转换系数。
1.5.4β-甘露聚糖酶酶活力测定
于25 mL刻度试管中加入0.9 mL质量浓度5.0 g/L洋槐豆胶底物溶液(用pH 5.0的柠檬酸-磷酸氢二钠缓冲液配制),50℃预热5 min,加入0.1 mL适当稀释的酶液,于50℃条件下反应30 min,立即加入3.0 mL DNS试剂,煮沸7 min,冷却后定容至25 mL,摇匀,采用DNS法测定水解产生的还原糖。以每分钟水解底物产生1 μmol还原糖(以甘露糖计)酶量定义为1个β-甘露聚糖酶酶活单位[11]。
1.5.5β-甘露糖苷酶酶活力测定
在试管中加入0.1 mL适当稀释的酶液和0.9 mL的1 mmol/L对硝基苯基-β-D-吡喃甘露糖苷(pNPM)溶液(50℃下预热5 min),于50℃条件下保温10 min,立即加入2.0 mL的1 mol/L Na2CO3溶液终止反应,加入10 mL蒸馏水,摇匀。于400 nm下测定释放的对硝基苯酚吸光度。以每分钟水解pNPM释放1 μmol对硝基苯酚所需要酶量定义为1个β-甘露糖苷酶酶活力单位[11]。
1.5.6 短链脂肪酸定量分析
乙酸、丙酸和乳酸分析采用高效液相色谱(Agilent 1200)分析,外标法测定。色谱条件:Bio-Rad Aminex HPX-87H色谱柱(7.8 mm×300 mm),进样量10 μL,流动相5 mmol/L H2SO4,流速0.6 mL/min,柱温55℃,示差折光检测器检测。
2 结果与分析
2.1 半乳糖、甘露糖对青春双歧杆菌的增殖
肠道益生菌通常以单糖形式利用功能性低聚糖,研究肠道益生菌对单糖半乳糖、甘露糖的利用有助于对益生菌利用半乳甘露低聚糖的认识。青春双歧杆菌分别在以半乳糖、甘露糖为碳源的培养基中培养,碳源消耗和菌体生长情况见图1。半乳糖、甘露糖对青春双歧杆菌具有较好增殖作用,且半乳糖对青春双歧杆菌增殖作用更强。青春双歧杆菌以3 g/L(质量浓度)半乳糖为碳源培养12 h后,半乳糖几乎完全消耗,残留半乳糖质量浓度为0.01 g/L,半乳糖利用率达99.67%;菌体质量浓度从培养初期0.04 g/L提高至1.82 g/L,增殖45.5倍。青春双歧杆菌以质量浓度3 g/L甘露糖为碳源培养24 h后,培养液中甘露糖质量浓度降低至0.84 g/L,甘露糖利用率为72.00%;菌体质量浓度从培养初期0.04 g/L提高至0.39 g/L,增殖9.75倍。青春双歧杆菌对半乳糖的利用率高于甘露糖的原因可能为双歧杆菌细胞膜中负责运送单糖进入细胞的透膜酶对半乳糖的亲和力高于甘露糖[12]。尽管单糖半乳糖、甘露糖对青春双歧杆菌有良好增殖作用,但食物或食物消化物中的半乳糖、甘露糖不能到达消化道中双歧杆菌定植的大肠部位,它们在消化道小肠部位即被小肠吸收,因此,食物或食物消化物中半乳糖、甘露糖不能对肠道内双歧杆菌增殖。半乳甘露低聚糖很难被人或动物体消化道中消化酶分解,且不能被小肠绒毛细胞壁所吸收,可以随食物残渣达到大肠部位作为双歧杆菌的营养,从而促进双歧杆菌增殖。
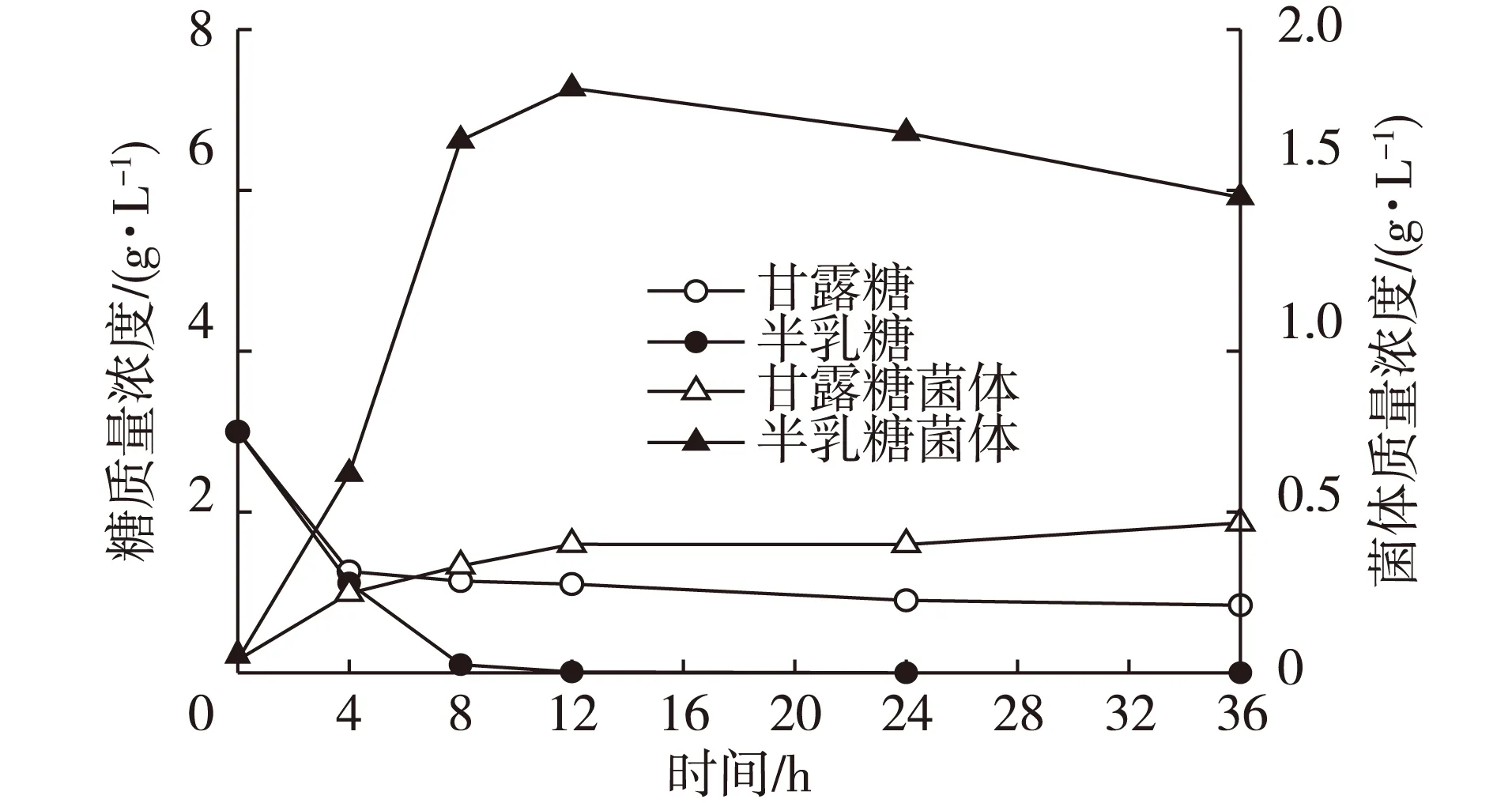
图1 半乳糖、甘露糖对青春双歧杆菌的增殖作用Fig. 1 Effects of galactose and mannose on proliferation of Bifidobacterium adolescentis
2.2 不同分子质量分布的半乳甘露低聚糖对青春双歧杆菌的增殖
研究不同分子质量分布的半乳甘露低聚糖对双歧杆菌的增殖作用有利于酶法制备半乳甘露低聚糖策略的建立以及揭示双歧杆菌代谢半乳甘露低聚糖的机理。青春双歧杆菌分别在以分子质量分布为5~10 ku(GMOSⅠ)、2~5 ku(GMOSⅡ)和≤2 ku(GMOSⅢ)的半乳甘露低聚糖为碳源的培养基中培养,碳源消耗和菌体生长情况见图2。不同分子质量范围的半乳甘露低聚糖对青春双歧杆菌均有增殖作用,且半乳甘露低聚糖平均分子质量越低,青春双歧杆菌对半乳甘露低聚糖利用率越高,半乳甘露低聚糖对青春双歧杆菌增殖作用越大。青春双歧杆菌分别在质量分数3 g/L GMOSⅠ、GMOSⅡ和GMOSⅢ的培养基中培养24 h,培养基中半乳甘露低聚糖残留质量浓度分别为1.23,1.15和0.41 g/L,青春双歧杆菌对半乳甘露低聚糖利用率分别为59.00%,61.67%和86.33%;青春双歧杆菌菌体质量浓度分别从初始浓度0.04 g/L提高至0.51,0.79和1.71 g/L,分别增殖了12.75,19.75和42.75倍。以上结果说明半乳甘露低聚糖平均分子质量即平均聚合度越低,越有利于其对青春双歧杆菌的增殖。双歧杆菌通常只能转运环境中单糖进入细胞,而对于聚合度在2以上的低聚糖,首先需在相关水解酶作用下将低聚糖分解成可被转运的单糖。

图2 不同分子质量分布的半乳甘露低聚糖(GMOS)(a)(b)(c)对青春双歧杆菌的增殖作用Fig. 2 Effects of GMOS(a)(b)(c) with different molecular weight distribution on proliferation of B. adolescentis
图3 青春双歧杆菌代谢半乳糖(a)和甘露糖(b)的产物Fig. 3 Metabolites of galactose (a) and mannose (b) by B. adolescentis
青春双歧杆菌利用GMOS的能力主要取决于其合成能够降解GMOS成单糖的甘露聚糖降解酶量。水解酶类通常由底物诱导产生,底物诱导作用越大,青春双歧杆菌合成的β-甘露聚糖酶和β-甘露糖苷酶量越多,越有利于对GMOS的利用。青春双歧杆菌以不同分子质量分布的半乳甘露低聚糖为碳源的培养液(培养24 h)中β-甘露聚糖酶活力和β-甘露糖苷酶活力测定结果见表1。
表1 青春双歧杆菌培养液中β-甘露聚糖酶和β-甘露糖苷酶活力Table 1 Activity of β-mannanase and β-mannosidase inBifidobacterium adolescentis culture /(U·mL-1)
在以GMOSⅠ、GMOSⅡ和GMOSⅢ为碳源的青春双歧杆培养液中,通过对培养液中β-甘露聚糖酶和β-甘露糖苷酶的活力测定发现,随碳源GMOS分子质量降低,培养液中β-甘露聚糖酶活力和β-甘露糖苷酶活力逐渐升高,这可能是因为低分子质量GMOS对青春双歧杆菌合成β-甘露聚糖酶和β-甘露糖苷酶的诱导作用强于高分子质量GMOS。
2.3 青春双歧杆菌代谢半乳糖和甘露糖的产物
青春双歧杆菌分别以质量分数为3 g/L甘露糖和半乳糖为碳源厌氧培养,培养过程中代谢产物变化情况见图3。青春双歧杆菌代谢半乳糖和甘露糖的主要产物按生成量排序依次为乙酸、乳酸和丙酸。青春双歧杆菌分别在质量分数为3 g/L的半乳糖和甘露糖培养基中增殖24 h,乙酸、乳酸、丙酸质量浓度分别为3.86,1.50,1.40 g/L和2.02,0.47,0.53 g/L。半乳糖对青春双歧杆菌的增殖作用强于甘露糖,且青春双歧杆菌代谢半乳糖产生的短链脂肪酸量高于甘露糖。功能性低聚糖的重要生理功能之一为经双歧杆菌等有益菌代谢后产生短链脂肪酸,从而降低肠道pH,有利于抑制病原微生物和防治便秘[13],由此可知,含半乳糖的甘露低聚糖具有更好的生理功能。
2.4 青春双歧杆菌代谢不同分子质量分布的半乳甘露低聚糖过程
青春双歧杆菌分别以质量浓度3 g/L GMOSⅠ、GMOSⅡ和GMOSⅢ为碳源厌氧培养,培养过程中青春双歧杆菌代谢不同分子质量分布的半乳甘露低聚糖产物变化情况见图4。青春双歧杆菌代谢不同分子质量分布的半乳甘露低聚糖,短链脂肪酸生成规律一致,依次为乙酸、乳酸、丙酸。张军华等[14]研究青春双歧杆菌代谢低聚木糖发现其主要代谢产物为乳酸,其次为乙酸、丙酸和丁酸。Falony等[15]的研究发现,当双歧杆菌利用较难发酵糖类时,代谢流更偏向于乙酸和乳酸的生成。与对青春双歧杆菌增殖作用的趋势一致,青春双歧杆菌代谢平均分子质量较低的GMOSⅢ产生短链脂肪酸最多。由图2c和图4c可以看出,青春双歧杆菌以质量浓度3 g/L GMOSⅢ为碳源培养,在0~8 h期间,培养液中短链脂肪酸累积趋势与半乳甘露低聚糖消耗和菌体增殖趋势一致,培养8 h后,培养液中半乳甘露低聚糖质量浓度、菌体质量浓度和短链脂肪酸质量浓度分别为0.83,1.67和6.51 g/L;培养8~12 h期间,当菌体质量浓度达到一定值后,由于微生物自身拮抗作用,菌体质量浓度不再增加,此时被菌体利用的半乳甘露低聚糖除少量用于维持菌体生命活动外,主要用于短链脂肪酸合成,培养12 h时,培养液中短链脂肪酸乙酸、乳酸和丙酸质量浓度分别为3.93,2.30和0.96 g/L;培养12 h后,培养液中半乳甘露低聚糖几乎被消耗,菌体质量浓度和短链脂肪酸质量浓度均不再增加。
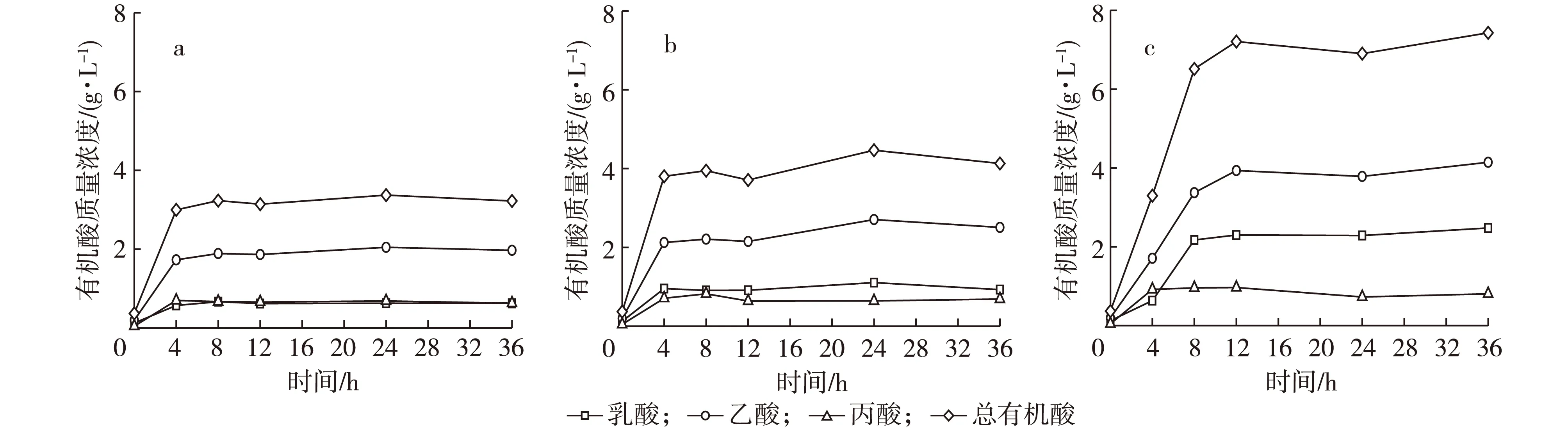
图4 青春双歧杆菌代谢不同分子质量分布的半乳甘露低聚糖(GMOS)(a)(b)(c)过程Fig. 4 Metabolism course of GMOS (a)(b)(c) with different molecular weight distribution by B. adolescentis
3 结 论
半乳糖、甘露糖对青春双歧杆菌有较好的增殖作用,青春双歧杆菌代谢半乳糖以及产生短链脂肪酸的能力高于甘露糖。青春双歧杆菌分别以质量浓度3 g/L半乳糖和甘露糖为碳源培养24 h,半乳糖和甘露糖的利用率分别为99.67%和72.00%,菌体质量浓度从初始的0.04 g/L分别增殖到1.82和0.39 g/L;生成的短链脂肪酸质量浓度分别为6.76和3.02 g/L。
不同分子质量分布的半乳甘露低聚糖能有效增殖青春双歧杆菌,半乳甘露低聚糖平均分子质量越低,对青春双歧杆菌的增殖作用越强。青春双歧杆菌分别以质量浓度3 g/L,分子质量分布为5~10,2~5和≤2 ku的半乳甘露低聚糖为碳源培养24 h,半乳甘露低聚糖利用率分别为59.00%,61.67%和86.33%,青春双歧杆菌菌体质量浓度分别从初始浓度的0.04 g/L提高到0.51,0.79和1.71 g/L。
青春双歧杆菌代谢半乳甘露低聚糖的主要产物为乙酸、其次为乳酸和丙酸。青春双歧杆菌以平均分子质量≤2 ku的半乳甘露低聚糖为碳源培养24 h,代谢产物乙酸、乳酸和丙酸的质量浓度分别为3.80,2.30和0.74 g/L。
[1]COLLADO M C, SANZ Y. Method for direct selection of potentially probioticBifidobacterium strains from human feces based on their acid-adaptation ability[J]. Journal of Microbiological Methods, 2006, 66(3):560-563.
[2]YUAN X, WANG J, YAO H. Feruloyl oligosaccharides stimulate the growth ofBifidobacteriumbifidum[J]. Anaerobe, 2005, 11(4):225-229.
[3]DAVISON R L. Handbook of water-soluble gums and resins[M].New York:McGraw Hill Book Company, 1980:46-47.
[4]CHEE S H, IJI P A, CHOCT M, et al. Characterisation and response of intestinal microflora and mucins to manno-oligosaccharide and antibiotic supplementation in broiler chickens[J]. British Poultry Science, 2010, 51(3):368-380.
[5]CEBRA J J. Influences of microbiota on intestinal immune system development[J]. The American Journal of Clinical Nutrition, 1999, 69(5):1046-1051.
[6]BILGICLI N, IBANOGLU S, HERKEN E N. Effect of dietary fibre addition on the selected nutritional properties of cookies[J]. Journal of Food Engineering, 2007, 78(1):86-89.
[7]胡静, 林英庭. 半乳甘露寡糖在动物生产中的研究进展[J]. 饲料博览, 2012, 29(9):29-31. HU J, LIN Y T. Research application of galacto-mannan-oligosaccharides in animal production[J]. Feed Review, 2012, 29(9):29-31.
[8]缪月秋, 梅秋红, 顾龚平, 等. 胡芦巴中性杂多糖酶解工艺优化及其产物对青春双歧杆菌增殖作用的研究[J]. 安徽农业大学学报, 2006, 33(2):238-242. MIAO Y Q, MEI Q H, GU G P, et al. Optimization for the enzyme hydrolysis of fenugreek neutral heteropolysaccharide and the effects of its products on reproduction ofBifidobacteriumadolescentis[J]. Journal of Anhui Agricultural University, 2006, 33(2):238-242.
[9]ASANO I, HAMAGUCHI K, FUJII S, et al.Invitrodigestibility and fermentation of mannooligosaccharides from coffee mannan[J]. Food Science and Technology Research, 2003, 9(1):62-66.
[10]杨文博, 咚树敏, 沈庆等.β-甘露聚糖酶酶解植物胶及其产物对双歧杆菌的促生长作用[J]. 微生物学通报, 1995, 22(4), 204-207. YANG W B, TONG S M, SHEN Q, et al.β-mannanase from NK27 strain degradate plant gum and products promote growth of bifidobacterium[J]. Microbiology, 1995, 22(4):204-207.
[11]MUDAU M M. The production, purification and characterization of endo-1,4-β-mannanase from newly isolated strains ofScopulariopsiscandida[D]. Bloemfontein in South Africa:Faculty of Natural and Agricultural Sciences, 2006.
[12]PARCHE S, AMON J, JANKOVIC I, et al. Sugar transport systems ofBifidobacteriumlongumNCC 2705[J]. Journal of Molecular Microbiology Biotechnology, 2007, 12(1-2):9-19.
[13]MASCO L, CROCKAERT C, VAN HOORDE K, et al.Invitroassessment of the gastrointestinal transit tolerance of taxonomic reference strains from human origin and probiotic product isolates ofBifidobacterium[J]. Journal of Dairy Science, 2007, 90(8):3572-3578.
[14]张军华, 勇强, 余世袁. 青春双歧杆菌代谢低聚木糖机理研究[J]. 林产化学与工业, 2007, 27(5):1-5. ZHANG J H, YONG Q, YU S Y. Metabolism of xylooligosaccharides byBifidobacteriumadolescentis[J]. Chemistry and Industry of Forest Products, 2007, 27(5):1-5.
[15]FALONY G, LAZIDOU K, VERSCHAEREN A, et al.Invitrokinetic analysis of fermentation of prebiotic inulin-type fructans by bifidobacterium species reveals four different phenotypes[J]. Applied and Environmental Microbiology, 2009, 75(2):454-461.
galactomanno-oligosaccharides fromSesbaniacannabina
LU Minyan1,2, YANG Lei1,2, LAI Chenhuan1,2, ZHOU Mengyi1,XI Xiaotong2, YU Shiyuan1,2, YONG Qiang1,2*
(1. Jiangsu Co-Innovation Center for Efficient Processing and Utilization of Forest Products, Nanjing Forestry University;2. College of Chemical Engineering, Nanjing Forestry University, Nanjing 210037, China)
Sesbaniacannabinais widely used as a pioneer plant in improving saline alkali land, and galactomannan is the main component ofS.cannabinaseeds. Galactose, mannose and galactomanno-oligosaccharides are complete and incomplete degradation products of galactomannan. In order to reveal the differences in the biological functions of incomplete degradation products of galactomannan with different molecular weight, galactose, mannose and galactomanno-oligosaccharides with different molecular weight distribution were used as carbon source forinvitroproliferation ofBifidobacteriaadolescentis, and the main metabolites were analyzed. When 3 g/L of galactose and mannose was used as carbon source for proliferation ofB.adolescentis, the sugar consumption were 99.67% and 72.00%, respectively, the cell concentration increased from 0.04 g/L (initial concentration) to 1.82 and 0.39 g/L, and the production of total short chain acids(acetic acid, lactic acid and propionic acid) were 6.76 and 3.02 g/L, respectively. The galactomanno-oligosaccharides with different molecular weight distribution could proliferateB.adolescentiseffectively, and the lower molecular weight of the galactomanno-oligosaccharides, the greater effect on the growth of theB.adolescentis. When 3 g/L galactomanno-oligosaccharides with the molecular weight distribution of 5-10 ku, 2-5 ku and the molecular weight less than 2 ku were used as carbon source for proliferation ofB.adolescentisfor 24 h, respectively, the consumption of galactomanno-oligosaccharides were 59.00%, 61.67% and 86.33%, theB.adolescentisconcentration increased from initial concentration of 0.04 g/L to 0.51, 0.79 and 1.71 g/L, respectively. When 3 g/L galactomanno-oligosaccharides with the molecular weight less than 2 ku was used as carbon source for proliferation ofB.adolescentisfor 24 h, the metabolites concentration of acetic acid, lactic acid and propionic acid were 4.41, 2.48 and 0.81 g/L, respectively.
galactomanno-oligosaccharides;Sesbaniacannabina;Bifidobacteriaadolescentis; proliferation; short chain fatty acid
2016-09-25
2016-12-27
国家林业公益性行业科研专项(201404615);江苏省前瞻性联合研究项目(BY2015006-05);江苏省重点研发计划(BF2015007);江苏高校自然科学研究项目(15KJB530009)。
陆旻妍,女,研究方向为生物化工。通信作者:勇强,男,教授。E-mail:swhx@njfu.com.cn
Q53;TQ921
A
2096-1359(2017)03-0064-06

