全脑放疗联合替莫唑胺化疗与单纯全脑放疗对脑转移性肿瘤疗效探析
张殿宝 康议心 郭艳珍
全脑放疗联合替莫唑胺化疗与单纯全脑放疗对脑转移性肿瘤疗效探析
张殿宝 康议心 郭艳珍
目的分析全脑放疗联合替莫唑胺化疗与单纯全脑放疗治疗脑转移性肿瘤的临床疗效。方法62例脑转移性肿瘤患者, 将其随机分对照组和研究组, 每组31例。对照组接受单纯全脑放疗,研究组接受全脑放疗联合替莫唑胺化疗, 比较两组患者治疗效果、不良反应发生情况。结果研究组患者临床近期总有效率93.55%, 明显高于对照组的74.19%, 差异有统计学意义(P<0.05);研究组患者中位生存期为(14.07±1.52)个月, 无进展生存期为(12.16±2.55)个月, 均长于对照组的(9.53±1.76)、(9.08±2.23)个月, 差异有统计学意义(P<0.05);两组不良反应发生率对比差异无统计学意义(P>0.05)。结论采取全脑放疗联合替莫唑胺化疗对脑转移性肿瘤进行治疗, 可提高脑转移肿瘤患者的局部控制率, 延长患者的生存时间, 并且安全可靠, 临床应用及推广价值大。
替莫唑胺;化疗;全脑放疗;脑转移性肿瘤;临床疗效
脑转移性肿瘤为临床常见的一种颅内恶性肿瘤, 主要有消化道肿瘤、乳腺癌及肺癌等恶性肿瘤转移引起, 临床症状主要表现为视力下降、恶心、呕吐、头晕及头痛等作为特征的一种颅内压升高的症候群[1,2]。临床主要治疗措施为手术治疗、激素治疗、化疗、全脑放射治疗及立体定向放疗等,由于其受到组织的耐受量有限, 技术方式不够成熟, 血脑屏障直接限制了普通化疗效果等的影响, 其效果并不令人满意,并且复发率较高。为此, 寻找有效治疗方案为临床至今关注的重点。此次将62例患者纳入研讨范围中, 其目的则在于分析全脑放疗联合替莫唑胺化疗与单纯全脑放疗治疗脑转移性肿瘤的临床疗效。具体报告如下。
1 资料与方法
1. 1 一般资料选取本院2014年1月~2016年12月收治的62例脑转移性肿瘤患者, 患者所对应的原发病灶均通过病理组织学、临床细胞学确诊为脑转移性肿瘤[3]。将患者随机分为对照组和研究组, 每组31例。对照组男17例, 女14例,年龄47~79岁, 平均年龄(56.18±7.61)岁;其中6例乳腺癌, 8例结肠癌, 17例肺癌。研究组男16例, 女15例, 年龄48~78岁, 平均年龄(55.73±7.42)岁;其中7例乳腺癌, 9例结肠癌, 15例肺癌。排除标准:①严重心脑血管疾病者;②患有精神疾病者;③有脑转移灶放疗史者。两组患者一般资料比较差异无统计学意义(P>0.05), 具有可比性。
1. 2 方法对照组患者接受单纯全脑放疗。予以连续直线加速器(6 MV)的光子线进行放射治疗, 取常规体位, 并对患者进行固定, 采取对穿照射, 行全脑照射, DT为40 Gy, 2 Gy/次,共放射治疗4周, 分20次完成。研究组患者在对照组治疗基础上加用替莫唑胺治疗, 替莫唑胺75 mg/(m2·d ) , 持续口服14 d。两组患者治疗期间按照患者病情实际状况, 予以对应的脱水药物进行治疗, 如地塞米松、甘露醇, 医护人员应当检测研究组患者治疗期间血象状况, 予以粒细胞集落刺激因子, 皮下注射, 进行升白细胞治疗, 对于有需求的患者可采取止吐进行治疗。
1. 3 观察指标及疗效判定标准观察记录两组患者近期治疗效果、生存时间及不良反应发生状况。按照WHO肿瘤疗效判定标准[4]对患者的近期治疗效果进行评判, 可分为完全缓解(CR)、部分缓解(PR)、无变化(NC)、进展(PD)。CR:经治疗4周后, 未出现新病变, 并且肿瘤完全消退;PR:经治疗4周后, 未出现新病变, 且肿瘤消退>50%;NC:患者肿瘤增大小<25%, 或者消退<50%;PD:患者出现新病灶或者出现一个或者多个肿瘤病变增大>25%。近期总有效率=(CR+PR)/总例数×100%。
1. 4 统计学方法采用SPSS13.0统计学软件对数据进行统计分析。计量资料以均数±标准差(x-±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2. 1 两组患者近期治疗效果对比研究组患者临床近期总有效率93.55%, 明显高于对照组的74.19%, 差异有统计学意义(P<0.05)。见表1。
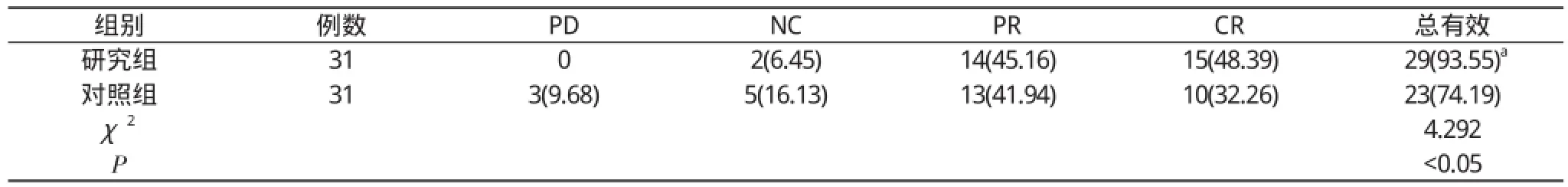
表1 两组患者近期治疗效果对比[n(%)]
2. 2 两组患者生存状况对比研究组患者中位生存期为(14.07± 1.52)个月, 无进展生存期为(12.16±2.55)个月, 均长于对照组的(9.53±1.76)、(9.08±2.23)个月, 差异有统计学意义(t=10.8697、5.0623,P<0.05)。
2. 3 两组不良反应发生状况对比研究组5例血液系统毒性, 2例头痛, 4例胃肠道反应, 不良反应发生率为35.48%;对照组6例血液系统毒性, 1例头痛, 5例胃肠道反应, 发生率为38.71%。两组不良反应发生率对比差异无统计学意义(χ2=0.0691,P>0.05)。患者不良反应出现后, 均可以耐受。
3 讨论
由于脑转移肿瘤常合并其他脏器多发或者转移, 全脑放疗可作为治疗脑转移肿瘤有效, 并且常用的措施, 缓解率比较高[5-9]。全脑放疗并不受原发病灶控制状况及血脑屏障的影响, 可广泛用在脑转移肿瘤治疗中[10-12]。可是因正常脑组织会受放射治疗剂量的限制, 很难把所有恶性肿瘤灭杀和彻底消除, 此方法可有效消除脑转移肿瘤的周边浸润细胞, 对一些影像学不能发现的亚病灶有着较好的灭杀能力[6,13-17]。也有一些不能忽视的问题, 经全脑放射治疗后, 还有30%以上的患者局部肿瘤未得到控制, 为此, 患者生存获益相对有限,此类患者中位生存期最高仅6个月[18-20]。所以结合其他治疗措施加强肿瘤局部控制非常关键。替莫唑胺化疗药物是一种新型的咪唑四嗪类药物, 可用于口服化疗, 具有脂溶性高、分子量小的特点[7]。此药物对于血脑屏障有很好的通透性,可快速穿过血脑屏障, 经口服后, 生物利用度比较高。
此次纳入62例患者研究结果显示, 研究组患者临床近期总有效率93.55%, 明显高于对照组的74.19%, 差异有统计学意义(P<0.05);研究组患者中位生存期为(14.07±1.52)个月,无进展生存期为(12.16±2.55)个月, 均长于对照组的(9.53±1.76)、(9.08±2.23)个月, 差异有统计学意义(t=10.8697、5.0623,P<0.05);两组不良反应发生率对比差异无统计学意义(P>0.05)。由此可见, 全脑放疗联合替莫唑胺化疗可延长患者生存时间,可缩短时间, 安全可靠。
综上所述, 采取全脑放疗联合替莫唑胺化疗对脑转移性肿瘤进行治疗, 可提高脑转移肿瘤患者的局部控制率, 延长患者的生存时间, 并且安全可靠, 临床应用及推广价值大。
[1] 任爱军. 全脑放疗联合替莫唑胺化疗对脑转移肿瘤的疗效及安全性. 中国实用神经疾病杂志, 2016(3):85-86.
[2] 高力英, 冉俊涛, 郭浩楠, 等. 放化综合治疗在脑转移癌治疗中的临床应用研究. 现代肿瘤医学, 2015, 23(2):195-197.
[3] 陈雁秋, 林清, 容景瑜, 等. 全脑放疗同步替莫唑胺化疗治疗脑转移瘤. 肿瘤基础与临床, 2014(2):166-167.
[4] 张渝, 陶海涛, 汪进良, 等. 替莫唑胺联合同步放疗对肺癌脑转移的临床观察. 中国药物应用与监测, 2015(3):133-136.
[5] 尤光贤, 文强, 蒋先明, 等. 全脑放疗联合替莫唑胺治疗脑转移性肿瘤的临床疗效分析. 中华全科医学, 2014, 12(7):1056-1058.
[5] 杨宏山, 瞿广桥. 替莫唑胺联合全脑放疗治疗非小细胞肺癌脑转移瘤的近期临床疗效观察. 国际医药卫生导报, 2015, 21(17):2588-2589.
[7] 员建中. 全脑放疗联合替莫唑胺化疗治疗脑转移肿瘤的疗效及安全性分析. 中外医疗, 2016, 35(28):115-117.
[8] 汪彬彬, 张秋宁, 田金徽, 等. 替莫唑胺联合全脑放疗治疗恶性肿瘤脑转移的Meta分析. 实用肿瘤杂志, 2014, 29(6):564-570.
[9] 李亚辉. 替莫唑胺同期全脑放疗治疗脑转移瘤的疗效观察. 山西医科大学, 2015.
[10] 谢家印, 向德兵, 王阁, 等. 替莫唑胺联合全脑放疗治疗非小细胞肺癌脑转移临床研究. 重庆医学, 2007, 36(19):1941-1942.
[11] 曹晓慈. 三维立体定向放疗配合全脑放疗同步替莫唑胺化疗治疗脑转移瘤的疗效分析. 河北医科大学, 2014.
[12] 张明, 冉俊涛, 王小虎, 等. 全脑放疗联合替莫唑胺治疗肺癌脑转移疗效观察. 现代肿瘤医学, 2016, 24(3):371-374.
[13] 廖恺, 毕卓菲, 何艳, 等. 全脑放疗联合替莫唑胺治疗非小细胞肺癌脑转移的荟萃分析. 中华医学杂志, 2012, 92(45):3199-3203.
[14] 程魏, 张兰凤, 肖娜, 等. 替莫唑胺联合全脑放疗治疗非小细胞肺癌脑转移疗效观察. 河北医药, 2013, 35(15):2307-2308.
[15] 胡晓, 张欣, 何佳倬, 等. 全脑放疗联合替莫唑胺治疗实体瘤脑转移的系统评价. 现代预防医学, 2014, 41(10):1913-1918.
[16] 宋文玲. 替莫唑胺联合全脑放疗治疗脑转移瘤患者的疗效及安全性. 医学信息, 2016, 29(7):375-376.
[17] 杨立峰. 替莫唑胺联合全脑放疗治疗脑转移瘤患者的疗效及安全性分析. 医学信息, 2016, 29(8):135-136.
[18] 谢家印, 向德兵, 王阁,等. 替莫唑胺联合全脑放疗治疗非小细胞肺癌脑转移临床研究. 重庆医学, 2007, 36(19):1941-1942.
[19] 王红娜. 不同化疗药物联合全脑放疗治疗肺癌脑转移的疗效分析. 中国保健营养旬刊, 2013, 23(6):2814-2814.
[20] 董正, 范益民, 刘晓东, 等. 肺癌脑转移不同化疗药物联合全脑放疗治疗临床分析. 中西医结合心脑血管病杂志, 2010, 8(10):1263-1264.
Investigation of curative effect by whole brain radiotherapy combined with chemotherapy by temozolomide and single whole brain radiotherapy for brain metastatic tumor
ZHANG Dian-bao, KANG Yi-xin, GUO Yan-zhen. Department of Oncology, First Affiliated Hospital of Henan University of Science and Technology, Luoyang 471003, China
ObjectiveTo analyze clinical effect by whole brain radiotherapy combined with chemotherapy by temozolomide and single whole brain radiotherapy for brain metastatic tumor.MethodsA total of 62 patients with brain metastatic tumor were randomly divided into control group and research group, with 31 cases in each group. The control group received single whole brain radiotherapy, and the research group received whole brain radiotherapy combined with chemotherapy by temozolomide. Comparison was made on curative effects and occurrence condition of adverse reactions between the two groups.ResultsThe research group had obviously higher clinical short-term effective rate as 93.55% than 74.19% in the control group, and their difference had statistical significance (P<0.05). The research group had median survival time as (14.07±1.52) months and progression free survival as (12.16±2.55) months, which were all longer than (9.53±1.76) and (9.08±2.23) months in the control group, and their difference had statistical significance (P<0.05). There was no statistically significantdifference of incidence of adverse reactions between the two groups (P>0.05).ConclusionImplement of whole brain radiotherapy combined with chemotherapy by temozolomide in treating brain metastatic tumor can improve local control rate in brain metastatic tumor patients and prolong their survival time, along with safety and creditability. This method contains high value for clinical application and promotion.
Temozolomide; Chemotherapy; Whole brain radiotherapy; Brain metastatic tumor; Clinical effect
10.14164/j.cnki.cn11-5581/r.2017.08.008
2017-03-10]
471003 河南科技大学第一附属医院肿瘤内科
——中国居民收入分配中的逆向调节机制

