PVP辅助制备单分散纳米银颗粒研究
司华艳,毛晨憬,谢雅萌,常建辉,卢亚妹
(石家庄铁道大学a.材料科学与工程学院;b.河北省交通工程材料重点实验室,河北石家庄050043)
PVP辅助制备单分散纳米银颗粒研究
司华艳a,b,毛晨憬a,谢雅萌a,常建辉a,卢亚妹a
(石家庄铁道大学a.材料科学与工程学院;b.河北省交通工程材料重点实验室,河北石家庄050043)
为了可控制备超细银粉,采用水热法,以乙二醇为溶剂和还原剂,聚乙烯吡咯烷酮(PVP)为保护剂和分散剂,制备出了尺寸均匀分布、分散性良好的纳米银颗粒,并对其进行了扫描电镜(SEM)以及紫外可见吸收光谱(UV-vis)测试.结果表明:在高的硝酸银浓度下,容易得到粒径较大的纳米银颗粒,而一直增大PVP与硝酸银的比例并不能使纳米银颗粒的尺寸持续减小.PVP在该反应体系中不仅起到分散剂的作用,而且还能促进乙二醇还原银离子.
纳米银;水热法;聚乙烯吡咯烷酮
0 引言
纳米银由于其独特的物理和化学性能,被广泛应用于电学材料、光学材料、催化材料等众多领域[1-5].在传统导电胶中使用片状纳米银粉,由于彼此之间形状的差异,导致接触之间存在缝隙.加入适量的球状纳米银粒子填补缝隙,会增强导电胶的导电性.对于纳米银,其表面等离子体共振峰(SPR)峰位和数量以及表面增强拉曼散射(SERS)的有效光谱范围完全依赖于纳米银的形貌和尺寸,因此,研究纳米银的可控制备显得尤为重要.
根据原理的不同,纳米银粉制备方法可以分为化学法和物理法.而在这些方法中,化学还原法使用的仪器简单、成本低廉、工艺简便,在简单的湿化学反应中就可以实现对银纳米粒子尺寸和形貌的控制,因而成为大多数研究者在实验过程中所使用的方法.化学还原方法采用的含银化合物主要是硝酸银或者是银氨络合物,以及碳酸银或者氧化银的前躯体;还原剂的种类有很多,常用的有双氧水、抗坏血酸、甲醛、柠檬酸、水合肼、多元醇、乙醇、葡萄糖、亚铁盐、有机胺等;分散剂和保护剂有N-甲基吡咯烷酮、十六烷基三甲基溴化铵(CTAB)、聚乙烯吡咯烷酮(PVP)、聚乙烯醇(PVA)、聚乙二醇(PEG)、明胶、十二烷基磺酸钠(SDS)等.保护剂和分散剂的作用是防止生成的银粒子之间相互接触发生团聚,以此来保证银粉良好的分散性.
本研究采用多元醇法[6]与水热法相结合,以乙二醇为溶剂和还原剂,AgNO3为银源,PVP作为分散剂和保护剂,在水热条件下制备出纳米银颗粒.在此反应中,PVP不仅能够包覆在纳米银颗粒表面,得到单分散纳米粒子,还能与银离子形成络合物,降低其化学电位,从而促进银离子的还原.通过改变起始AgNO3的浓度、PVP与AgNO3的比例、反应时间以及反应温度来控制纳米银颗粒的大小和形状.采用紫外可见分光光度计(UV-vis)和扫描电子显微镜(SEM)对纳米银颗粒的形貌和尺寸进行了分析,研究了反应条件对纳米银的形貌和尺寸的影响.
1 实验
1.1 主要仪器和试剂
实验材料:硝酸银(分析纯,上海精细化工材料研究所),乙二醇(分析纯,天津永达化学有限公司),PVP(分析纯,天津博迪化工有限公司),上述实验药品使用前没有做进一步的提纯.
实验设备:HZK-FA210电子天平;2XZ-2型旋片真空泵,搭载YC7134单相双值电容电动机;DZ-2BCⅡ型真空干燥箱;UV-2450紫外可见光谱测试仪;Siemens D-500 X射线衍射仪;JEOL JEM-2010透射电子显微镜;Hitac hi S4800扫描电子显微镜.
1.2 制备过程
称取一定量的AgNO3和PVP分别加入到10 mL乙二醇溶液中,将含有AgNO3的溶液置于磁力搅拌器上搅拌,将含有PVP的溶液放在超声波清洗机中超声,待溶液变澄清之后,将含有PVP的溶液缓缓加入到含有AgNO3的乙二醇溶液中,并持续搅拌,在反应过程中,溶液的颜色由无色透明逐渐变为浅黄色,直到深黄色,最后呈暗黄色.将反应的溶液转移至水热反应釜中,调节反应温度和反应时间.反应完毕,静置室温后,使用高速离心沉降的方法用丙酮和去离子水反复清洗数次,然后在真空干燥箱中干燥,得到最终产物.
1.3 表征方法
采用紫外-可见分光光度计来表征纳米银粉的等离子体共振吸收峰.测试前,将适量样品超声分散于去离子水中,得到浓度适宜的样品溶液.取适量溶液置于石英样品池中(1 cm光程),在200-800 nm波长范围内测试.
采用扫描电子显微镜来表征纳米银颗粒的形貌和尺寸.测试前,将样品研磨成较细的粉末,均匀地洒在粘贴在样品台上的导电胶上,用纯净的高压氮气吹掉未被粘住的样品,喷金处理后进行测试.
2 结果与讨论
2.1 AgNO3初始浓度对纳米银颗粒形成的影响
在反应温度为160℃,反应时间为2.5 h的条件下,改变AgNO3的浓度,分别为0.1,0.2,0.3,0.4,0.5 mol/L,保证AgNO3与PVP的比例(摩尔比)始终为1∶3.图1为不同AgNO3浓度的纳米银颗粒的紫外吸收光谱,由图1可见,AgNO3的浓度对纳米银的形成尺寸有很大影响,不同浓度下制备的样品的最大吸收峰出现在420-440 nm附近,表明在5种硝酸银浓度下均能生成纳米银颗粒.随着AgNO3浓度的增大(0.1,0.2,0.3 mol/L),最大吸收峰(a,b,c)的位置发生蓝移,说明生成的纳米银颗粒尺寸在减小.出现这种现象的原因在于:在较低的AgNO3浓度下(0.1,0.2,0.3 mol/L),反应初期,在乙二醇的作用下,银离子被快速还原,成核速度大于生长速度,反应生成的银原子更加趋向于独立成核而不是依附在已经生成的银核上长大,如此导致溶液中出现大量的微小银纳米粒子.同时由于高的比表面积,纳米银颗粒表面吸附一层PVP,形成保护层,阻止了银粒子之间的团聚,从而得到了小尺寸的纳米银颗粒.当硝酸银浓度持续增大时(0.4,0.5 mol/L),最大吸收峰(d,e)的位置发生红移.这说明纳米银颗粒的尺寸逐渐增大,随着硝酸银溶液浓度的继续增大,反应的速度过快,导致新生的纳米银核不能及时被PVP包裹形成保护层,彼此之间相互接触,发生团聚,从而得到尺寸较大的纳米银颗粒.
2.2 PVP与AgNO3的比例对纳米银颗粒形成的影响
改变PVP与AgNO3的比例(摩尔比)分别为1∶1,2∶1,3∶1,4∶1,5∶1,据此探究PVP的存在对纳米银颗粒形成的影响.图2是不同比例下的纳米银颗粒的UV-vis光谱.如图所示,当比例为1∶1,2∶1,3∶1时,只在410 nm附近有最大吸收峰,证明生成的是纳米银颗粒.随着比例的增大,最大吸收峰位置发生红移,这表明纳米银颗粒尺寸变大.由此可见,在这个反应体系中,PVP作为表面活性剂,不仅有效阻止了纳米银颗粒之间的团聚,而且能够促进银离子被乙二醇还原.随着PVP比例的增加,溶液中PVP与银离子结合成络合物的量增大,导致银离子被还原的速度加快,由于反应体系中PVP量较少,不能充分包覆银纳米颗粒,导致生成的纳米银颗粒尺寸增大.同时,PVP包裹在纳米银颗粒的表面,可以阻止颗粒之间的团聚,生成了分散性较好的纳米银颗粒.当比例为4∶1和5∶1时,虽然最大吸收峰的位置仍在发生红移,但是两者之间的位置差距不大,并且比例为5∶1的半峰宽变小,表明纳米银颗粒的尺寸分布变小,分散性良好.推测其原因在于:当颗粒增大到一定程度之后,PVP的分散性起到了主要的作用.溶液中的银颗粒生长到一定的阶段,PVP才会起到表面修饰的作用,加入过量的PVP并不能一直使颗粒增大.
图3是对应图2中不同比例下的纳米银的SEM图.如图3(a)所示,当比例为1∶1时,溶液中生成大量的80 nm左右的纳米银颗粒,同时还存在相当一部分较大的颗粒(大于100 nm).随着比例的增加(2∶1),如图3(b),纳米银颗粒的尺寸增大到100 nm左右,同时尺寸不均匀性变得更加明显,出现了更多类似于纳米棒的颗粒.当比例为3∶1时,如图3(c)所示,纳米银颗粒的尺寸相比于比例为2∶1没有明显的变化,但是开始出现少量的银纳米棒.比例为4∶1和5∶1时,如图3(d)和(e),纳米银颗粒的尺寸没有很大的改变,稳定在120 nm左右的范围,从图3(d)上看,是由很多的小颗粒团聚在一起组成的团聚体,比表面积更大,与其他比例的形貌有很大的区别,至于这种形成机理还需要进一步的研究.图4为样品f的EDS能谱图,从图4的结果看所制备的纳米颗粒为纯银.
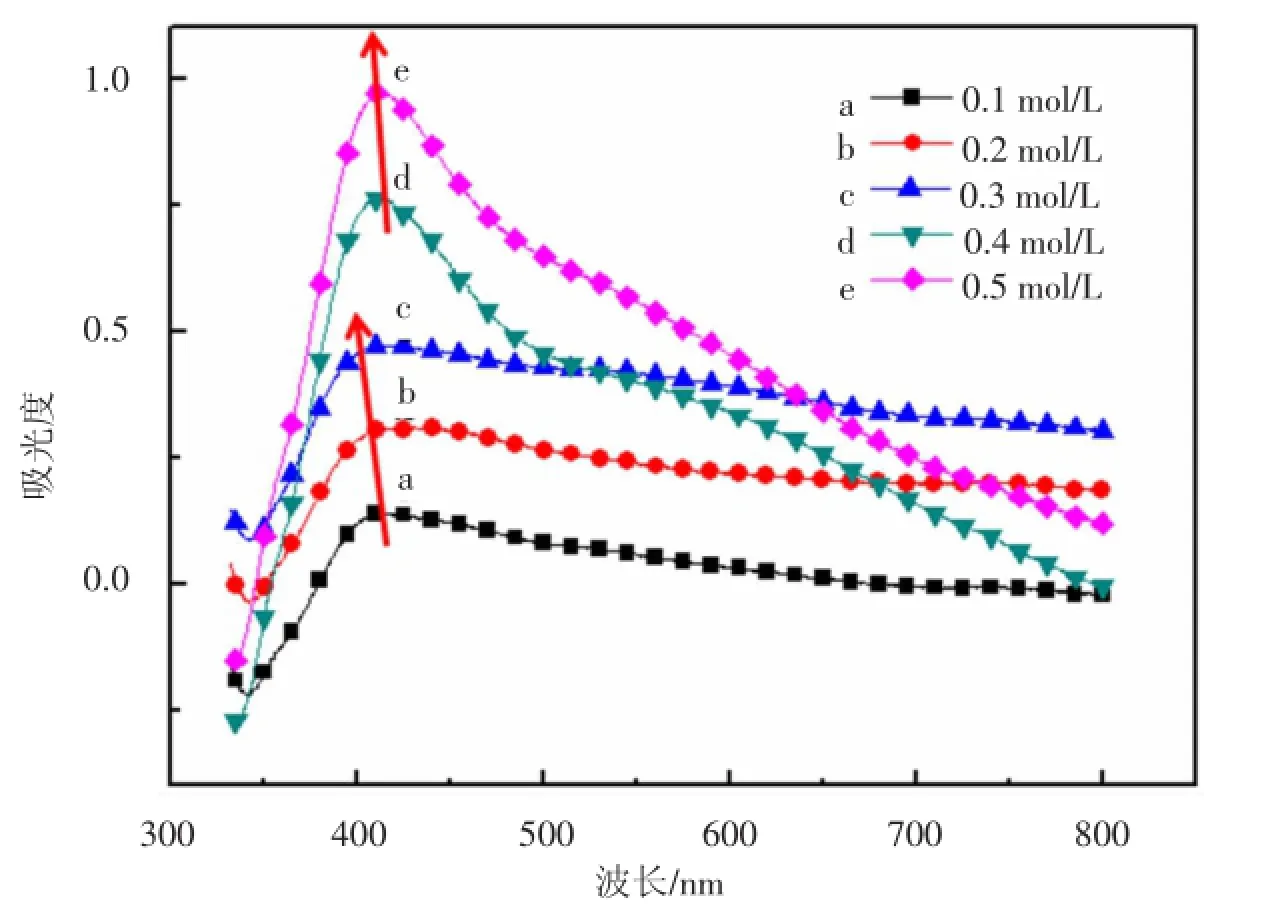
图1 不同AgNO3浓度的纳米银颗粒的紫外可见吸收光谱
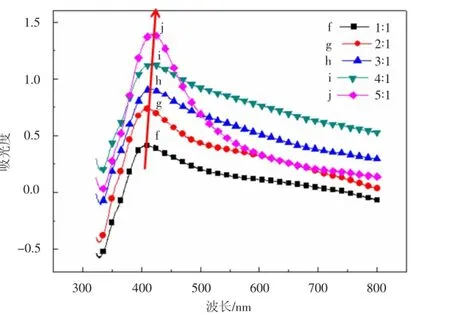
图2 不同PVP与AgNO3比例的纳米银颗粒紫外可见吸收光谱
2.3 反应时间对纳米银颗粒形成的影响
将反应的时间设置为1,1.5,2,2.5,3 h,探究反应时间对于纳米银颗粒形成的影响,结果见图5.从图5中曲线k和l可以看出,当反应时间为1 h和1.5 h时,在430 nm左右有一个最大吸收峰,此为纳米银颗粒的共振吸收峰.曲线l和k相比,半峰宽较小,说明随着反应时间的延长,生成的纳米银颗粒尺寸分布更加集中,粒径更加统一.由于PVP不仅能起到表面修饰的作用,还能跟银离子结合形成络合物,促进银离子的还原,因此在PVP高浓度下,当反应时间为1 h时,溶液中的银离子被迅速还原,出现大量的微小银核,银核各自生长,导致生成的纳米银颗粒尺寸不均匀.当反应时间为1.5 h时,溶液中的小的银核互相团聚在一起长大,而且不断还原出的银原子可以覆在已经成核的微小纳米银颗粒表面,尺寸继续增大,使得纳米银颗粒的尺寸更加均匀.当反应时间为2,2.5,3 h时,从图上看出对应的m,n,o曲线发生蓝移.理论上随着反应时间的延长,纳米银颗粒的尺寸应该变得更大,共振吸收峰发生红移,而在这里发生反常的蓝移,规律异常的原因是由于在3 h以内,发生了Ostwald熟化,即晶体再生长过程中存在一个临界尺寸,浓度越大,临界尺寸越小,反之,浓度越小,临界尺寸越大.随着反应时间增加,大颗粒表面一些未完全融合的小颗粒被重新分散,导致溶液中离子浓度增加,临界尺寸减小,因此使得纳米银颗粒的平均尺寸下降,得到的银粒子总体尺寸分布更加均匀[7].

图3 不同PVP与AgNO3比例下的纳米银颗粒SEM图谱
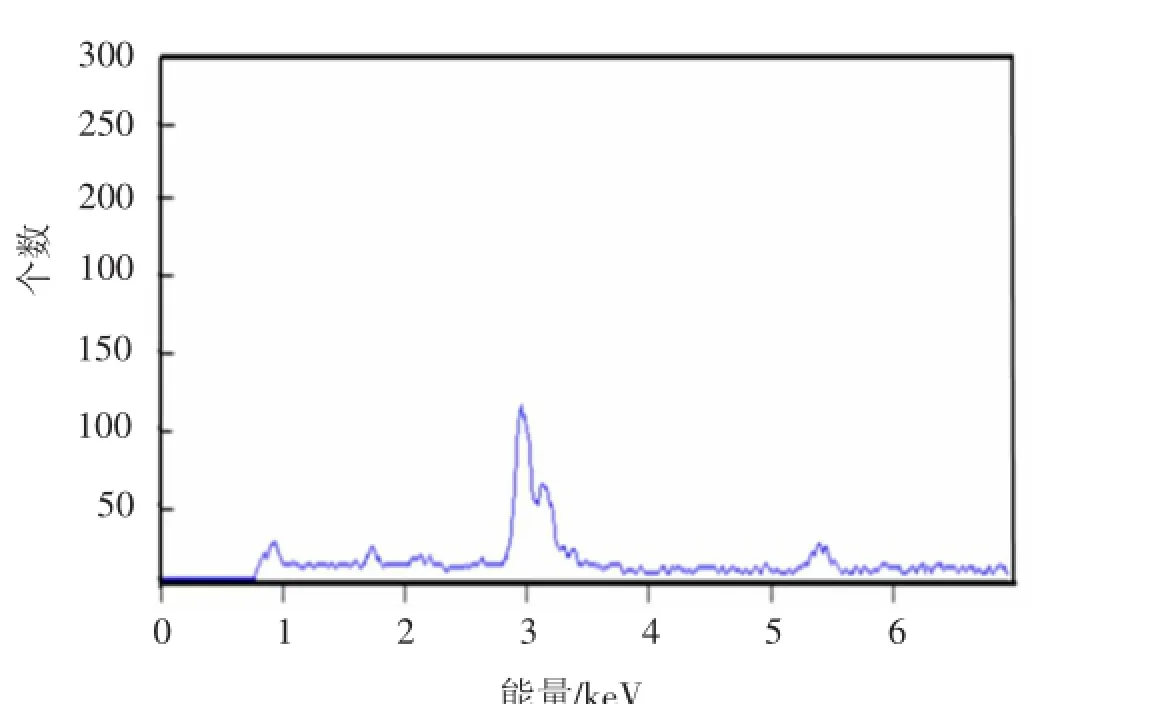
图4 样品f纳米颗粒的EDS能谱图
2.4 反应温度对纳米银颗粒形成的影响
为研究反应温度对纳米银颗粒形成的影响,将反应温度设置为120,140,160,180,200℃进行UV-vis测试.由于在120℃下反应1.5 h之后的溶液无法离心出纳米银颗粒,所以将反应后的溶液直接用去离子水稀释到合适的浓度进行UV-vis测试.图6为不同反应温度的UV-vis图谱.
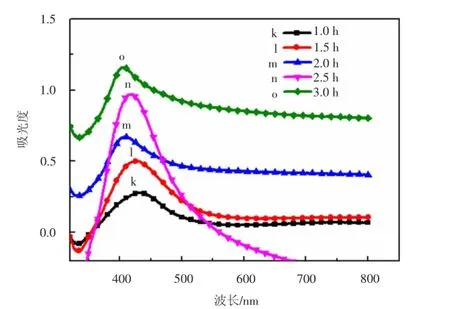
图5 不同反应时间的纳米银颗粒紫外可见吸收图谱

图6 不同反应温度的纳米银颗粒紫外可见吸收图谱
在本反应体系中,由于PVP能和银离子形成络合物,化学电位降低,银离子更容易被乙二醇还原.所以在120℃时,银离子也能够被还原成银原子从而生长成微小纳米银核.曲线p在400 nm附近出现最大共振吸收峰,证明生成了纳米银颗粒.由于反应温度较低,反应相对缓慢,生成的纳米银颗粒尺寸较小.并且生成的纳米银较少,所以难以从溶液中离心分离出来.当反应温度达到140-160℃,曲线q和r的最大吸收峰的位置相对于曲线p发生红移,表示纳米银颗粒尺寸变大.140℃时,由于温度增加,反应速率加快,生成的纳米银颗粒尺寸有所增加.而在160℃下,原子在成核过程中逐渐趋于饱和,且沿着晶核表面堆积生长,得到尺寸较大的纳米银颗粒[8].反应温度达到180和200℃时,银离子被还原的速率提高,银离子被很快还原成银原子,还原出的银原子成核成长成纳米银颗粒.PVP对银颗粒的吸附作用开始发挥出来,PVP将重新分散一些大颗粒表面的小的未被完全融合的纳米银颗粒,从而纳米银颗粒的平均尺寸下降,表现在图6中就出现了曲线s和t相对于曲线r再次发生蓝移.
对上述所制备样品进行了物相表征,图7为样品f的X射线衍射图.其纳米银的5个峰位(2θ分别为38.116°,44.277°,64.426°,77.472°,81.536°)与PDF卡片04-0783上的数据一致,分别对应立方晶系银的(111),(200),(220),(311),(222)晶面,证明样品为纯相银.由于衍射半峰宽度较窄,证明样品的尺寸较大.图7结果与图4的EDS能谱分析结果一致,表明利用多元醇能够还原制得纯净的单质银.
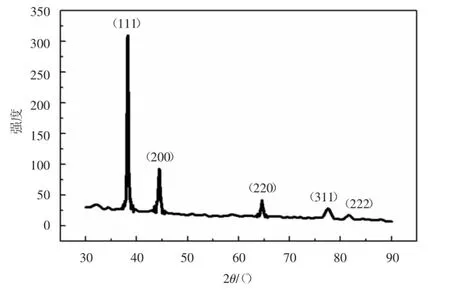
图7 样品f纳米银的X射线衍射图
3 结论
1)采用PVP为表面活性剂,用传统多元醇法和水热法相结合,乙二醇做溶剂和还原剂,还原硝酸银制备纳米银颗粒.通过UV-vis和扫描电子显微镜分析观察产物,结果表明所得产物为纳米银颗粒,且分散性良好.
2)通过分析不同反应条件下的纳米银颗粒,对纳米银的生长机制进行了初步探索.PVP在该反应体系中不仅起到保护剂和分散剂的作用,还能和银离子形成一种易被还原的络合物,使银离子更容易被还原成银原子.PVP的修饰作用只有在纳米银颗粒的尺寸达到一定的范围才会起作用.
3)对影响纳米银颗粒尺寸和形貌的反应条件进行讨论,得到最佳的反应条件:反应温度为160℃,反应时间为1.5 h,AgNO3浓度为0.4 mol/L,PVP与硝酸银的比例为5∶1.
[1]陈国杰,官永纯,马涛,等.纳米银的制备及应用[J].辽宁化工,2008,37(9):618-619.
[2]MANNO D,FILIPPO E,DIGIULIO M,et al.Synthesis and Characterization of Starch-stabilized Ag Nanostructures for Sensors Applications[J].JournalofNon-CrystallineSolids,2008,354(52-54):5515-5520.
[3]BERCIAUDS,COGNETL,TAMARATP,etal.ObservationofIntrinsicSizeEffectsintheOpticalResponseofIndividualGoldNanoparticles[J].NanoLetters,2005,5(3):515-518.
[4]SANGYY,LEEHJ,JEONGSH.PreparationofNanocompositeFibersforPermanentAntibacterialEffect[J].Journal of Materials Science,2003,38(38):2143-2147.
[5]KÖHLER J M,ABAHMANE L,WAGNER J,et al.Preparation of Metal Nanoparticles with Varied Composition for Catalytical ApplicationsinMicroreactors[J].ChemicalEngineeringScience,2008,63(20):5048-5055.
[6]HYUK I S,TACK L Y,BENJAMIN W,et al.Large-Scale Synthesis of Silver Nanocubes:The Role of HCl in Promoting Cube Perfection andMonodispersity[J].AngewandteChemieInternationalEdition,2005,44(14):2154-2157.
[7]陈大鹏.纳米银的可控制备及其应用研究[D].武汉:华中科技大学,2010.
[8]WANGLH,ZHONGJM,LIGL,etal.PreparationofSilverNanopowdersbyaControlledWet-chemicalSynthesis[J].MaterialsLetters,2016,173:39-42.
(责任编辑王颖莉)
Preparation of Monodisperse Superfine Silver Powder
SI Hua-yan1,2,MAO Chen-jing1,XIE Ya-meng1,CHANG Jian-hui1,LU Ya-mei1
(1.School of Materials Science&Engineering;2.Hebei Provincial Key Laboratory of Traffic Engineering Materials,Shijiazhuang Tiedao University,Shijiazhuang,Hebei 050043,China)
For controlling the monodisperse superfine silver powder,ethylene glycol as reducing agent and solvent,PVP as surfactant,uniform size distribution,good dispersion and highly purified silver nanoparticles are synthesized by using hydrothermal method.It is found that,with increasing the concentration of AgNO3,the size of nano-particles increases;however,the concentration of silver nitrate has a critical value,after that,the obtained size does not increase.In this work,PVP plays dual roles as both dispersant and assistant reducing agent.
silver nanostructure;hydrothermal;polyvinyl pyrrolidone
O614
A
1673-1972(2017)03-0005-06
2017-01-10
河北省高等学校科学技术研究青年项目(QN2015220);河北省留学回国基金(C2013001055);2016年省级大学生创新创业项目;河北省高校重点学科建设项目
司华艳(1980-),女,河北衡水人,副教授,博士,主要从事半导体纳米材料制备及应用研究.

