聚苯胺/氧化钕复合材料热降解过程的动力学分析
邢爱妮,张又右,王思雨,张施慧,王韶旭
(1.大连交通大学 环境与化学工程学院,辽宁 大连 116028; 2.大连交通大学 材料科学与工程学院,辽宁 大连 116028)*
聚苯胺/氧化钕复合材料热降解过程的动力学分析
邢爱妮1,张又右1,王思雨1,张施慧2,王韶旭1
(1.大连交通大学 环境与化学工程学院,辽宁 大连 116028; 2.大连交通大学 材料科学与工程学院,辽宁 大连 116028)*
采用热重(TG)分析法研究了磺基水杨酸掺杂的聚苯胺以及聚苯胺/氧化钕复合材料的热降解过程. 热重分析结果表明, 纯聚苯胺的失重过程分为两步: 第一步为吸附水的脱去, 温度范围在3 00~433 K; 第二步为聚苯胺分子链的大规模降解, 温度范围在447~930 K. 当PANI/氧化钕质量比为6∶1时, 复合材料的失重过程同样分为两步; 而当PANI/氧化钕质量比为2.6∶1时, 复合材料的失重过程变为三步. 分别使用Friedman和Flynn-Wall-Ozawa两种方法计算出聚苯胺和两种复合材料热降解过程的动力学参数,采用多步线性回归法, 并参考常用的15种热降解机理函数, 确定了聚苯胺和两种复合材料热降解过程的动力学模型: 聚苯胺为D1;PANI/氧化钕(6:1)的复合材料为D3;PANI/氧化钕(2.6∶1)的复合材料为B1.
聚苯胺;稀土氧化物;复合材料;热分析; 热分解动力学
0 引言
聚苯胺因其具有原料成本低廉, 合成工艺简单,电化学性能优异以及化学稳定性良好等优点,被认为是最具有实际应用前景的导电聚合物, 同时也是最为广泛研究的导电聚合物之一[1-6].稀土氧化物具有优异的物理及化学特性,其作为无机材料与聚苯胺复合的研究引起了人们广泛关注.因此, 合成了一系列聚苯胺/稀土氧化物复合材料, 并对其热稳定性, 电化学性能, 热力学函数以及热降解动力学进行研究. 在前期工作中, 研究了三个系列聚苯胺/稀土氧化物复合材料的制备、表征及其热稳定性和电化学性能[7-13].
本文作为该系列复合材料表征及热化学研究的一部分, 旨在研究磺基水杨酸掺杂的纯聚苯胺(PANI)以及聚苯胺/氧化钕(PANI/Nd2O3)复合材料的热降解过程动力学. 通过使用Friedman和Flynn-Wall-Ozawa两种方法计算出纯PANI和PANI/Nd2O3复合材料热降解过程中的动力学参数;并采用多步线性回归法,参考常用的15种热降解机理函数, 确定了纯PANI和PANI/Nd2O3复合材料热降解过程的动力学模型.
1 实验方法
1.1 实验试剂
苯胺(aniline, 分析纯)购自天津光复科技发展有限公司, 过硫酸铵(APS, 分析纯)购自天津博迪化工试剂厂, 磺基水杨酸(SSA, 分析纯)购自天津大茂化学试剂厂, 氧化钕(Nd2O3, 分析纯)购自上海跃龙新材料有限公司.
1.2 制备方法
1.2.1PANI的制备
采用化学氧化法制备纯PANI, 详细步骤如下:在冰水浴环境下, 取5mL磺基水杨酸(2mol/L)溶于50mL去离子水中, 在搅拌过程中加入1.6mL苯胺, 继续搅拌至上述溶液混合均匀. 称取4.56g过硫酸铵溶于50mL去离子水中, 将此过硫酸铵溶液均匀加入到搅拌均匀的苯胺溶液中, 反应10h.然后抽滤,用乙醇, 同浓度磺基水杨酸和去离子水洗涤滤饼至中性, 收集沉淀并将其在60 ℃下真空干燥24h. 所制样品命名为纯PANI.
1.2.2PANI/Nd2O3复合材料的制备
PANI/Nd2O3复合材料的制备采用溶液聚合原位复合法进行, 详细步骤如下: 在冰水浴环境下, 取5mL磺基水杨酸(2mol/L)溶于50mL去离子水中, 在搅拌过程中加入1.6mL苯胺和Nd2O3粉末, 继续搅拌至上述溶液混合均匀. 称取4.56g过硫酸铵溶于50mL去离子水中, 将此过硫酸铵溶液均匀加入到搅拌均匀的苯胺-Nd2O3溶液中, 反应10h. 然后抽滤,用乙醇, 同浓度磺基水杨酸和去离子水洗涤滤饼至中性, 收集沉淀并将其在60 ℃下真空干燥24h. 所制样品分别命名为PANI/Nd2O3-1,其中PANI/氧化钕质量比为6∶1和PANI/Nd2O3-2,其中PANI/氧化钕质量比为2.6∶1.1.3 实验仪器及条件
TG测试所用仪器为中国北京恒久科学仪器厂HCT-1/2微机差热天平.测试所用坩埚为Al2O3坩埚, 参比物为α-Al2O3粉末, 测试样品质量约为10mg, 测试气氛为静止空气,测试温度范围为室温至1 073.15K, 升温速率分别为10、12.5、 15、 17.5、 20K/min.
1.4 动力学分析方法
分别使用Friedman法和Flynn-Wall-Ozawa法13计算纯PANI和PANI/Nd2O3复合材料热降解过程的活化能. 两种方法的公式表示如下:
Friedman:
(1)
Flynn-Wall-Ozawa:
(2)
式中,α为转化率,β为加热速率(K/min),Ea为活化能(kJ/mol),A为指前因子,R为理想气体常数(8.314J·mol-1·K-1),T为温度(K),f(α)和g(α)分别为微分法(Friedman法)和积分法(Flynn-Wall-Ozawa法)中的机理函数. 将2个公式中的ln[(dα/dT)β]和lnβ分别对1/T作图, 可由直线斜率得到活化能值. 通过将最佳动力学模型代入上述2个公式中, 可由截距得到指前因子lnA.而最佳动力学模型是通过使用15种常用的机理函数, 对纯PANI和PANI/Nd2O3复合材料的热降解过程的动力学曲线进行拟合来确定的. 将热重实验数据代入到15种机理函数所对应的方程中, 使用多步线性回归法,相关系数最大(>0.99)的那一个函数即为最佳动力学模型.
2 实验结果与讨论
2.1 PANI/Nd2O3复合材料的热降解过程
图1为不同升温速率下PANI/Nd2O3-1和PANI/Nd2O3-2的TG曲线. 从图中可以看出,升温速率的不同, 对这两个复合材料的失重步骤没有影响, 说明升温速率对这两个复合材料的热降解过程没有影响; 随着升温速率的升高, TG曲线向高温方向移动, 这是由于在较高的升温速率下, 样品升至一定温度所需的时间较短造成的.
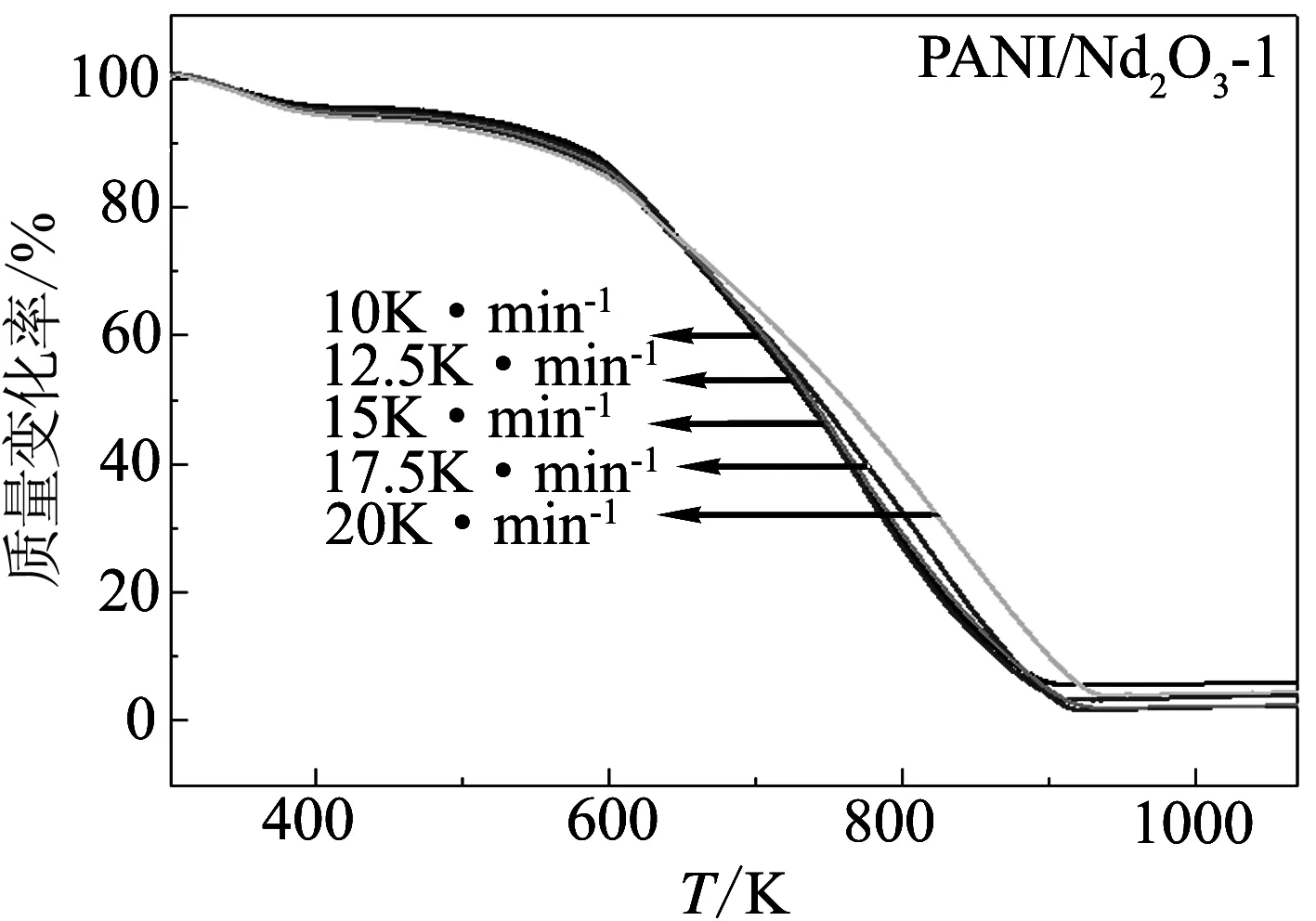
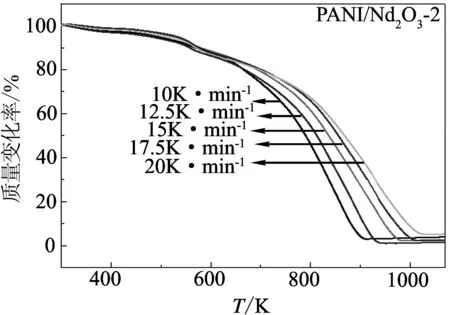
图1 复合材料PANI/Nd2O3-1和PANI/Nd2O3-2在不同升温速率下的TG曲线
图2给出了纯PANI以及两个复合材料在升温速率为10 K/min下的TG曲线. 从图中可看出, 磺基水杨酸掺杂的纯PANI有两步失重过程: 第一步为吸附水的脱去, 失重温度范围约为300~433 K; 第二步为聚苯胺分子链的大规模降解, 失重温度范围约为447~930 K. 对于PANI/Nd2O3-1复合材料, 其失重过程同样为两步: 第一步为吸附水的脱去, 温度范围约在300~418 K内; 第二步为聚苯胺分子链的大规模降解, 温度范围约在448~925 K内. 而对于Nd2O3含量较高的复合材料PANI/Nd2O3-2, 其失重过程变为三步: 第一步约发生在室温至347 K温度范围内, 为吸附水的脱去; 第二步约发生在380~534 K温度范围内, 为掺杂酸的提前脱出; 第三步约发生在560~886 K温度范围内, 为聚苯胺分子链的大规模降解.我们推测引起这种变化的原因是: 随着复合材料中Nd2O3含量的增多, 使得掺杂在聚苯胺上的磺基水杨酸容易脱出, 而掺杂酸的脱出改变了复合材料中聚苯胺的结构, 进而改变了其热降解行为.
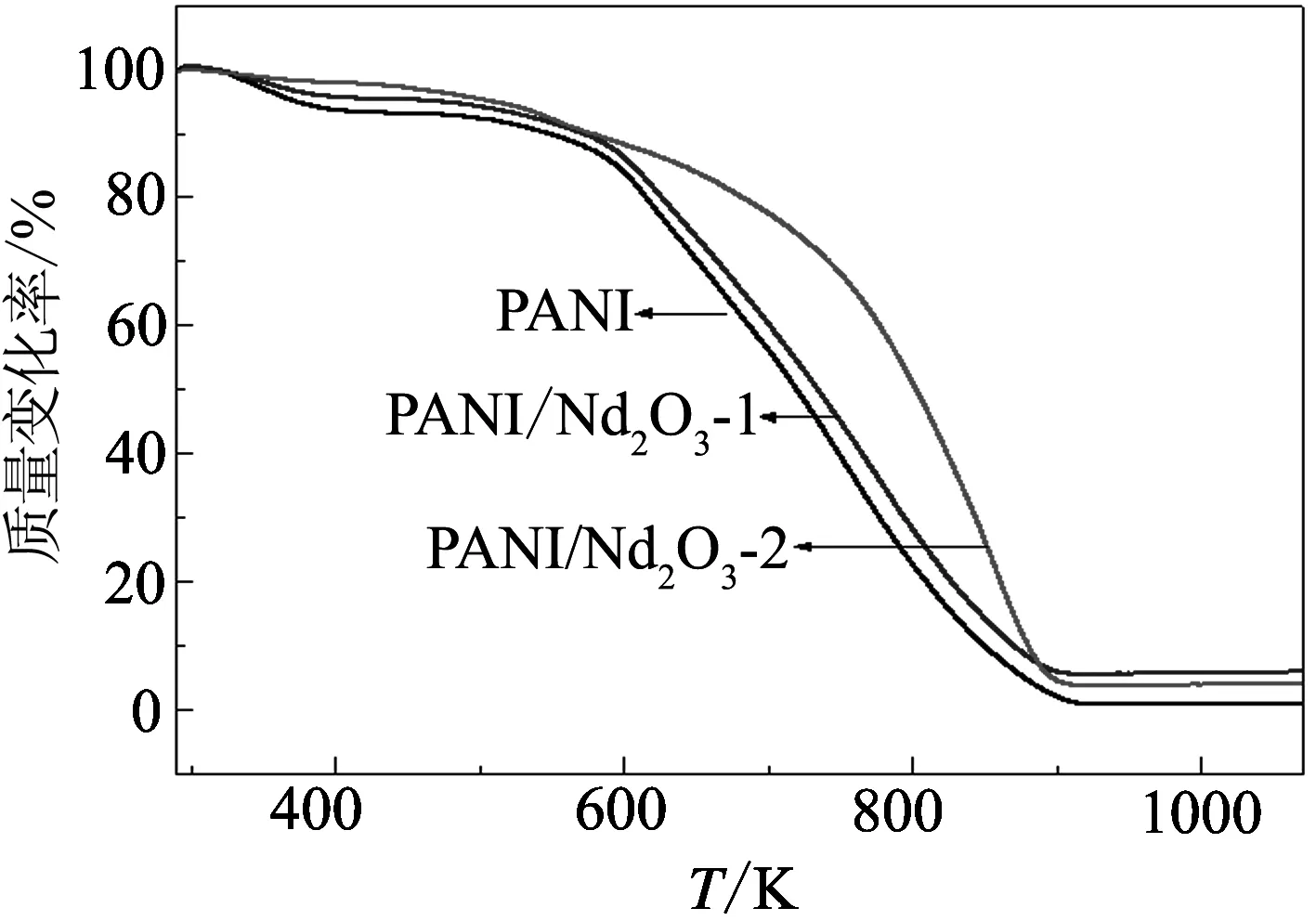
图2 纯PANI、PANI/Nd2O3-1和PANI/Nd2O3-2在升温速率为10 K/min下的TG曲线
2.2 PANI/Nd2O3复合材料的热降解动力学研究
2.2.1 PANI/Nd2O3复合材料热降解过程表观活化能的测定
对于纯PANI和PANI/Nd2O3-1复合材料, 第一步降解过程是吸附水分的脱离, 所以没有对这一步热降解进行动力学分析, 只研究第二步热降解过程的动力学. 而对于PANI/Nd2O3-2复合材料, 主要对聚苯胺分子链大规模降解的第三步进行动力学分析.
图3给出了用Flynn-Wall-Ozawa法计算的两个复合材料降解过程的活化能. 其中,曲线1-13分别代表转化分数为0.2,0.25,0.3,0.35,0.4,0.45,0.5,0.55,0.6,0.65,0.7,0.75,0.8. 从图中可以看出, 拟合得到的直线基本互相平行, 这说明不同转化率下的活化能值相近, 并且可以推测这些热降解过程的动力学模型都是单一的. 图4为用Flynn-Wall-Ozawa法和Friedman法计算得出的纯PANI以及两个复合材料热降解过程的活化能随转化率变化曲线, 其对应的详细数据列在表1中. 由图4和表1可以看出, 使用Flynn-Wall-Ozawa法和Friedman法计算得到的纯PANI以及两个复合材料的活化能变化趋势是一样的: 对于PANI/Nd2O3-1复合材料, 其降解的前半部分活化能高于纯聚苯胺, 而后部分则低于纯聚苯胺; 而PANI/Nd2O3-2复合材料在整个降解过程中的活化能都低于纯PANI. 这是由于稀土氧化物含量的增多, 导致PANI/Nd2O3-2中掺杂酸的提前脱出, 使聚苯胺的分子结构发生变化, 这一结果与TG分析结果相符合.
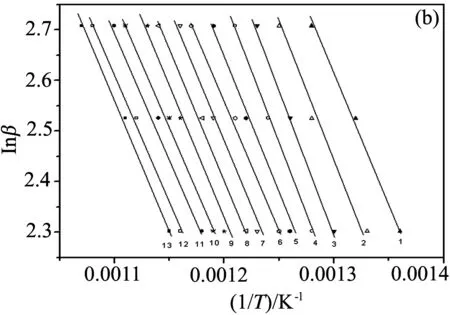
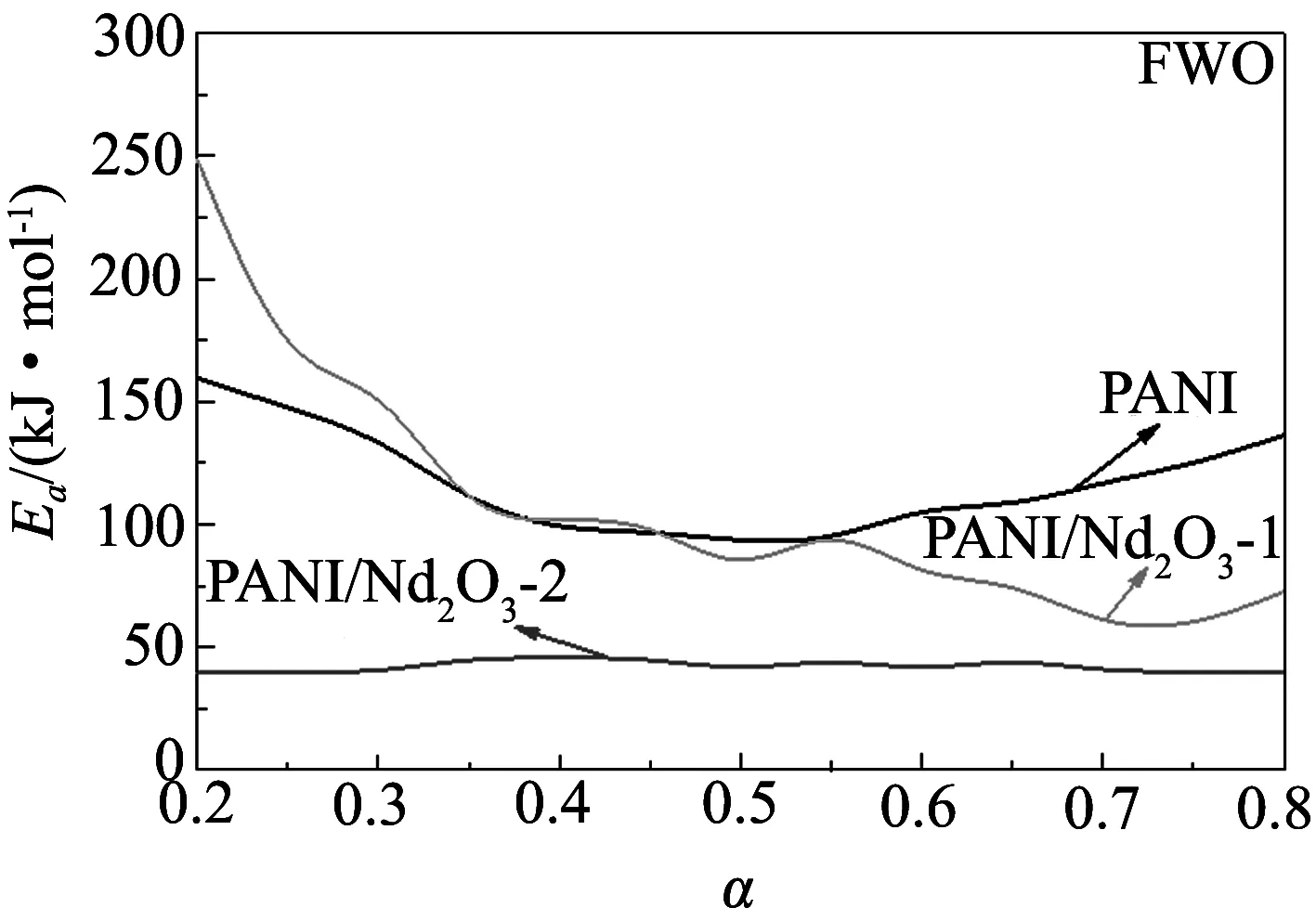
图3 复合材料PANI/Nd2O3-1(a)和PANI/Nd2O3-2(b)的lnβ对1/T关系曲线
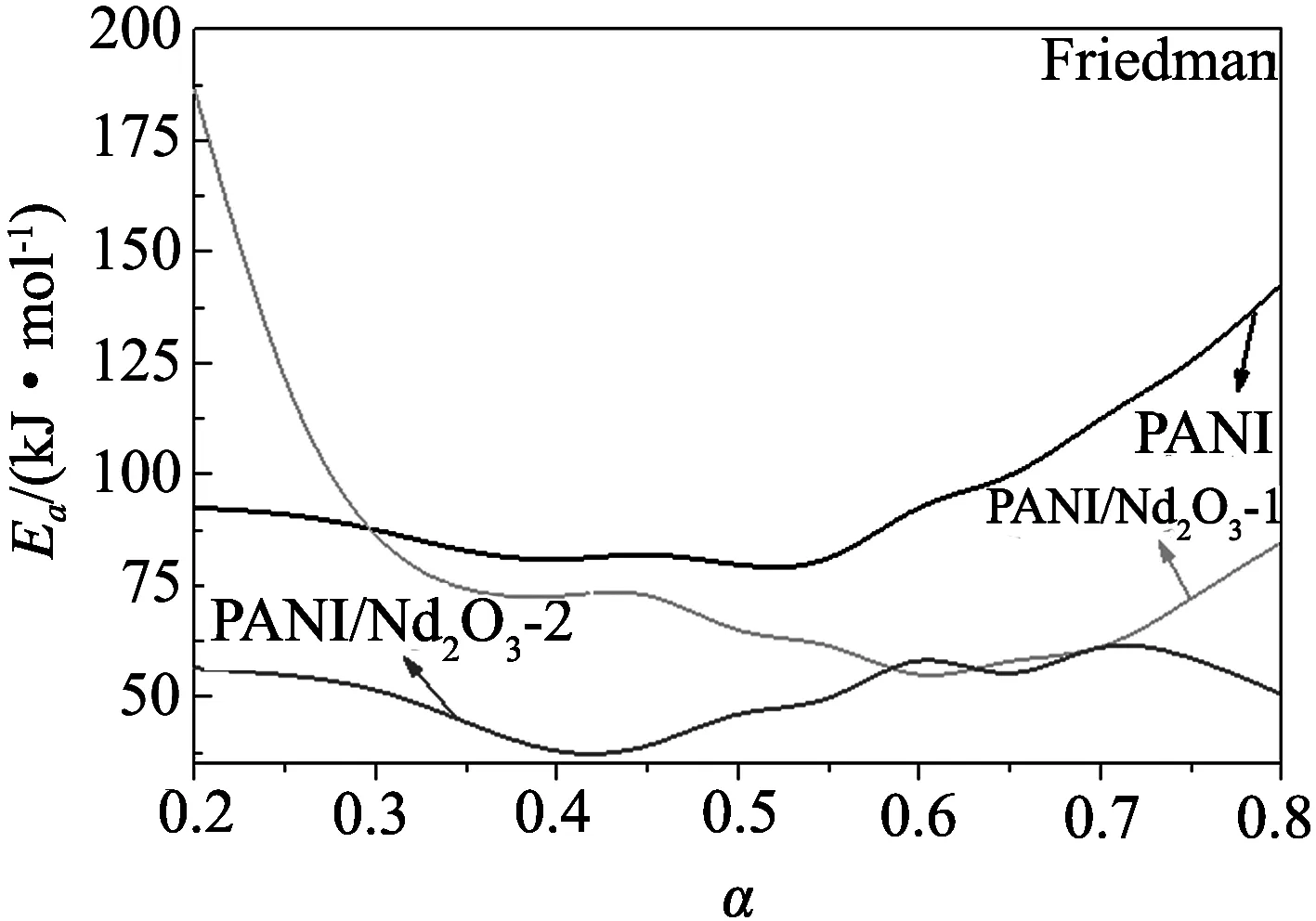
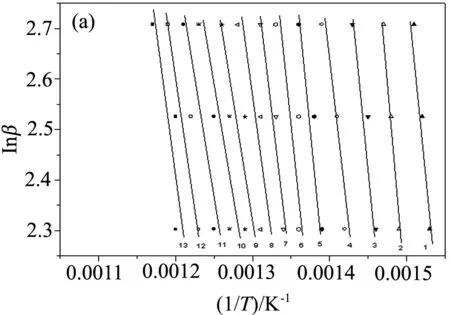
图4 PANI, PANI/Nd2O3-1和PANI/Nd2O3-2热降解过程活化能随转化率变化图
表1 PANI/Nd2O3-1和PANI/Nd2O3-2的降解过程活化能
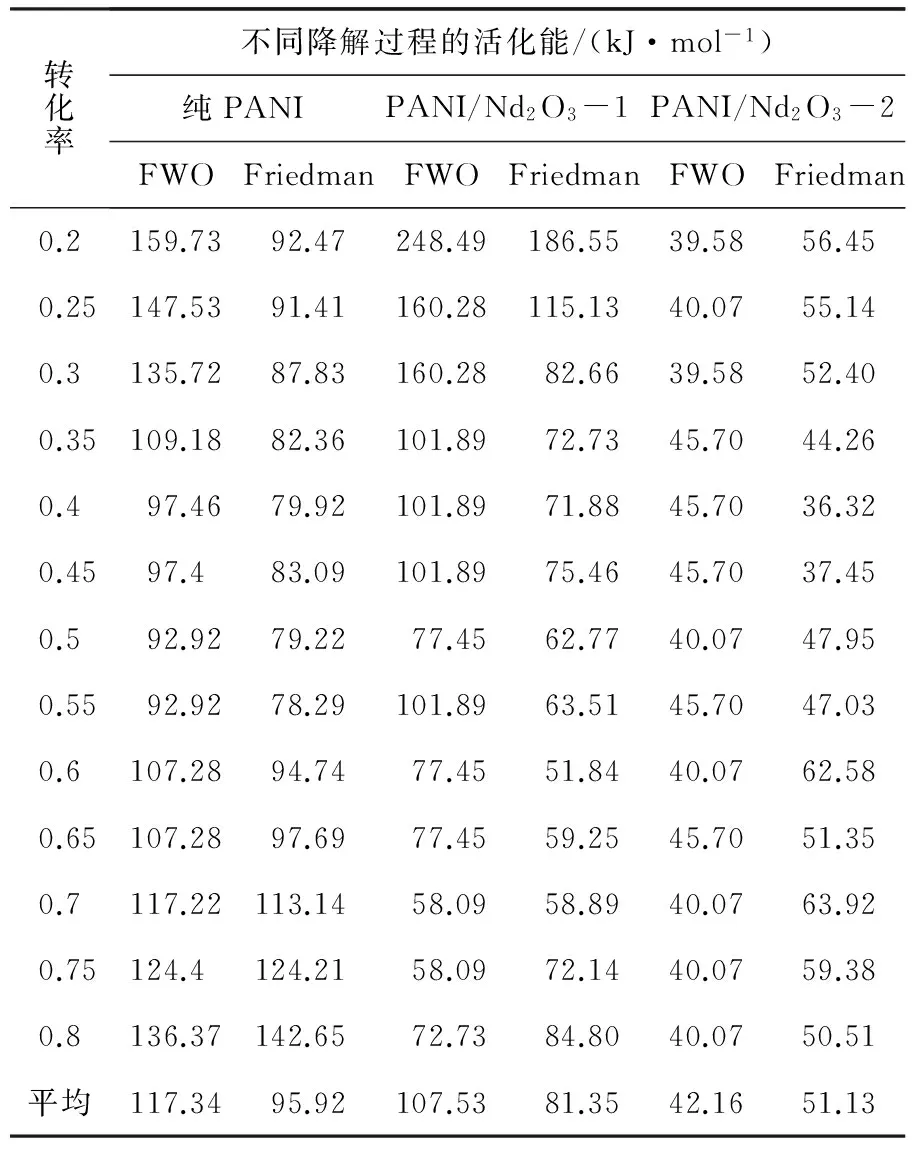
转化率不同降解过程的活化能/(kJ·mol-1)纯PANIPANI/Nd2O3-1PANI/Nd2O3-2FWOFriedmanFWOFriedmanFWOFriedman0.2159.7392.47248.49186.5539.5856.450.25147.5391.41160.28115.1340.0755.140.3135.7287.83160.2882.6639.5852.400.35109.1882.36101.8972.7345.7044.260.497.4679.92101.8971.8845.7036.320.4597.483.09101.8975.4645.7037.450.592.9279.2277.4562.7740.0747.950.5592.9278.29101.8963.5145.7047.030.6107.2894.7477.4551.8440.0762.580.65107.2897.6977.4559.2545.7051.350.7117.22113.1458.0958.8940.0763.920.75124.4124.2158.0972.1440.0759.380.8136.37142.6572.7384.8040.0750.51平均117.3495.92107.5381.3542.1651.13
2.2.2 PANI/Nd2O3复合材料热降解过程动力学模型的确定
通过文献[13]列出的15种函数,计算出PANI, PANI/Nd2O3-1及PANI/Nd2O3-2复合材料热降解过程的最佳动力学模型, 并应用这些动力学模型, 计算了这三种物质热降解过程的活化能Ea和指前因子lnA, 结果见表2. 从表2可以看出, 应用最佳动力学模型计算得出的活化能值与应用Flynn-Wall-Ozawa法和Friedman法计算而得的结果都非常相近. 对于磺基水杨酸掺杂的纯PANI, 其第二步热降解过程的活化能为114.13kJ/mol, 对应的最佳动力学模型为D1, 说明纯PANI的热降解过程遵从一维扩散机理; 复合材料PANI/Nd2O3-1的第二步热降解过程的活化能为92.64kJ/mol, 对应的最佳动力学模型为D3(三维扩散机理), 说明PANI在与Nd2O3复合的过程中形成了三维立体结构; 复合材料PANI/Nd2O3-2的第三步热降解过程的活化能为36.32kJ/mol,其最佳动力学模型为B1, 这一动力模型是由Prout和Tompkins在1944年提出的, 是一种通过在热降解过程中暴露更多的反应表面达到自催化效果的自催化模型.
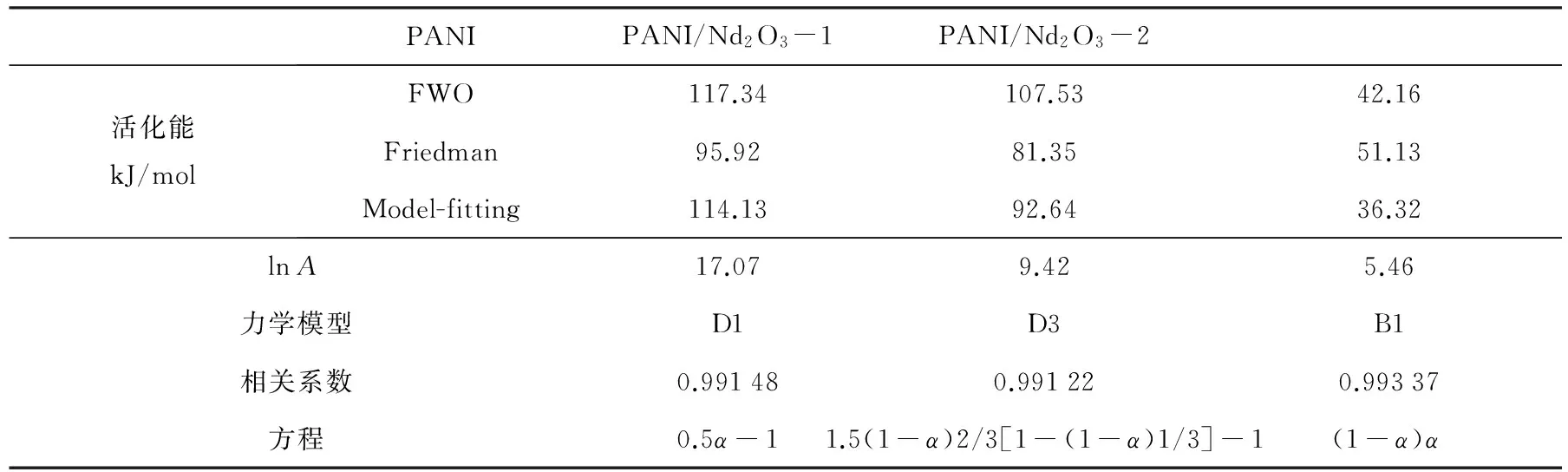
表2 三种复合材料热降解过程的最佳动力学模型及动力学参数
3 结论
利用TG分析方法研究了磺基水杨酸掺杂的纯PANI以及PANI/Nd2O3复合材料的热降解过程. 结果表明, 复合材料中Nd2O3含量的不同对PANI热降解过程的影响不同: 少量Nd2O3的存在会使PANI的热降解过程从纯PANI的一维扩散模型变为三维扩散模型; 大量Nd2O3的存在会导致掺杂酸的提前脱出, 进而改变复合材料中PANI的分子结构. 运用热分析动力学方法, 分别求出了纯PANI以及PANI/Nd2O3复合材料热降解过程的活化能并确定了其最佳动力学模型: 对于纯PANI, 其热降解活化能为114.13 kJ/mol, 对应的最佳动力学模型为D1; 对于复合材料PANI/Nd2O3-1, 其热降解活化能为92.64 kJ/mol, 对应的最佳动力学模型为D3; 对于复合材料PANI/Nd2O3-2, 其热降解活化能为36.32 kJ/mol, 对应的最佳动力学模型为B1.
[1]CHUANG F Y,YANG S M. Cerium dioxide/ polyaniline core-shell nancomposites[J]. J. Colloid Interface Sci., 2008, 320: 194-201.
[2]HAN D X, CHU Y,YANG LK,et al. Reversed micelle polymerization: a new route for the synthesis of DBSA-polyaniline nanoparticles[J]. Colloids Surf. A,2005, 259: 179-187.
[3]RATHER MS, MAJID K,WANCHOO R K,et al. Synthesis, characterization and thermal study of polyaniline composite with the photoadduct of potassium hexacyanoferrate (II) involving hexamine ligand[J]. J. Therm. Anal. Calorim., 2013, 112: 893-900.
[4]YAN H,SADA N,TOSHIMA N. Thermal transporting properties of electrically conductive polyaniline films as organic thermoelectric materials[J]. J. Therm. Anal. Calorim. ,2002, 69 : 881-887.
[5]KEPINSKI L,WOLCYRZ M,MARCHEWKA M. Structure Evolution of nanocrystalline CeO2supported on silica: effect of temperature and atmosphere[J]. J. Solid State Chem. ,2002, 168: 110-118.
[6]TROVARELLI A,BOARO M,ROCCHINI E, et al. Some recent developments in the characterization of ceria-based catalysts[J]. J. Alloys Compd., 2001,323/324: 584-591.
[7]WANG S X,HUANG Z H,WANG J H,et al. Thermal stability of several polyaniline/rare earth oxide composites (I): polyaniline /CeO2[J]. J. Therm. Anal. Calorim.,2012, 107:1199-1203.
[8]WANG S X, LI Y,HUANG Z H, et al. Synthesis and characteristic of polyaniline/Dy2O3composites :Thermal property and electrochemical performance[J]. J. Environ. Sci.-China., 2013, 25:36- 40.
[9]HUANG Z H., WANG S X, LI H, et al. Thermal stability of several polyaniline/rare earth oxide composites (Ⅲ): polyaniline/Nd2O3composites[J]. J. Therm. Anal. Calorim.,2013, 113: 667- 671.
[10]LI H, WANG S X,HUANG Z H, et al. Thermal stability and electrochemical performance of Polyaniline/Pr6O11composites[J]. Polym. Adv. Technol., 2014(1): 66-72.
[11]HUANG Z H, WANG S X,LI H,et al. Thermal stability of several polyaniline/rare earth oxide composites (Ⅳ) :Polyaniline/La2O3and polyaniline/Sm2O3composites[J]. J. Therm. Anal. Calorim.,2014, 115:259-266.
[12]LI H,WANG S X,HUANG Z H, et al. Effect Nd2O3content on electrochemical performance of polyaniline/Nd2O3composites Polym[J]. Adv. Technol., 2014,25: 1163-1168.
[13]ZHANG S H,WANG S X,HUANG Z H, et al. A kinetic analysis of thermal decomposition of polyaniline and its composites with rare earth oxides[J]. J. Therm. Anal. Calorim.,2015,119: 1853-1860.
A Kinetic Analysis of Thermal Decomposition of Polyaniline/Nd2O3Composite
XING Aini1, ZHANG Youyou1, WANG Siyu1, ZHANGShihui2, WANG Shaoxu1
(1.School of Environmental and Chemical Engineering, Dalian Jiaotong University, Dalian 116028, China; 2.School of Materials Science and Engineering, Dalian Jiaotong University, Dalian 116028, China)
The thermal decomposition kinetics of the sulfosalicylic acid (SSA) doped polyaniline(PANI) and PANI/Nd2O3composites were investigated by using thermogravimetry (TG) technique under air atmosphere. The TG curves show that the thermal decomposition process of the SSA doped PANI proceeded in two steps. The first step could be attributed to the expulsion of absorbed water in the temperature range of 300-433 K. The second step is corresponding to the large scale decomposition of the main chain of PANI in the temperature range of 447-930 K. There are also two steps in the process of decomposition of the PANI/Nd2O3(6∶1)(w/w)composite.However,thePANI/Nd2O3(2.6∶1)(w/w)compositeisdecomposedinthreesteps.Theactivationenergies(Ea)ofthermaldecompositionprocessesofthepurePANIandthecompositeswereobtainedbytwoisoconversionalmethods(FriedmanandFlynn-Wall-Ozawamethods).Accordingto15mechanismfunctions,thepossiblekineticmodelofthesethermaldecompositionprocesseswasestimatedasD1forthepurePANI;D3forthePANI/Nd2O3(6∶1) (w/w)compositeandB1forthePANI/Nd2O3(2.6∶1)(w/w)composite.
polyaniline; rare earth oxide; composite; thermal analysis; kinetic analysis
1673- 9590(2017)03- 0059- 05
2016-03-15
辽宁省教育厅高等学校优秀人才支持计划资助项目(LJQ2013051 )
邢爱妮(1987-),女,硕士研究生;王韶旭(1977-),女,教授,博士,主要从事复合材料的研究E- mail:kdwangsx@126.com.
A

