离体叶片接种法鉴定大豆疫霉根腐病抗病性
刘淼 来永才 李炜 毕影东 刘明 徐鹏飞 李琬 王玲 邸树峰 丁俊男

摘要[目的]探讨离体叶片接种法鉴定野生大豆抗病性的准确性和可靠性。[方法]利用24份栽培大豆对离体叶片接种法和下胚轴伤口接种法的可行性进行考察,并利用离体叶片接种法对177份黑龙江省采集的野生大豆资源进行了抗病性鉴定。[结果]离体叶片接种法与下胚轴接种法之间的相关呈极显著,且2种方法差异不显著,证明了离体叶片接种法进行大豆疫霉根腐病抗性鉴定同样准确可行。通过离体叶片接种法对177份黑龙江省采集的野生大豆资源的抗病性鉴定,获得27份抗病材料。[结论]离体叶片接种法操作简单,适合野生大豆抗病性鉴定。
关键词野生大豆;大豆疫霉根腐病;抗病鉴定;叶片
中图分类号S565.1文献标识码A文章编号0517-6611(2017)11-0043-04
Abstract[Objective] To explore accuracy and reliability of resistance identification of cultivated soybean sources to Phytophthora root rot by leaf inoculation method. [Method] We studied the accuracy of resistance identification of 24 soybean sources to Phytophthora root rot by leaf inoculation method and hypocotyl wound inoculation method, and identified 177 G. soja varieties from Heilongjiang by leaf inoculation method. [Result] There was significant correlation between leaf inoculation and hypocotyl inoculation method, and there were no significant differences between the two methods. At same time, 177 G. soja varieties from Heilongjiang were valuated the reactions to P. sojae race 1 by way of leaf inoculation. Of all the varieties tested, 27 were resistant. [Conclusion] The leaf inoculation is easy to operate and suitable for the resistant identification of wild soybean.
Key wordsGlycine soja;Phytophthora sojae;Disease resistance identification;Leaf
大豆疫霉根腐病(Phytophthora sojae Kaufmann & Gerdemann)是一种土传性真菌病害[1-3]。自1989年沈崇尧等[4]首次在我国大豆主产区分离到大豆疫霉根腐病病原菌以来,该病已成为大豆主要病害之一,一般可造成大豆减产10%~40%,严重的可造成绝产[5]。大豆对大豆疫霉菌的抗性由显性单基因控制[1]。虽然大豆疫霉根腐病的生理小种很多,新小种的出现也较快,但是种植抗、耐病品种仍然是防治大豆疫霉根腐病的有效手段[6]。
目前,用于大豆疫霉根腐病抗病性鉴定的方法还是以下胚轴接菌法为主。1958年,Kaufmann等[7]首先应用下胚轴伤口接种方法鉴定大豆对疫霉根腐病的抗性。此后,下胚轴接种法便成为鉴别大豆疫霉菌生理小种以及鉴定大豆抗病性的基本方法,人们只是在接种体的制备、接种方法、接种后保湿方法等方面加以改进,使接种方法更简便有效[8-13]。然而,活体接菌的最大弊端就是无法保留遗传分析过程中所需要保存的感病植株。为了解决这一问题,1978年Morrison等[14]利用子叶接种法进行抗病鉴定;2009年,于安亮等[11]再次证明了子叶接种法进行大豆疫霉根腐病抗性鉴定同样准确可行。这种离体的鉴定方式有效地解决了无法保留感病材料的问题。对于野生大豆来说,由于其独特的生长特点,使其在鉴定过程中操作比较困难。因此,建立适合野生大豆的快速、有效的疫霉根腐病抗病性鉴定体系,为挖掘野生大豆抗源提供有效快速的方法至关重要。离体叶片接种法作为一种抗病性鉴定方式目前已在水稻、小麦、油菜、苜蓿、西瓜、香蕉等作物上应用[15-22],但在野生大豆上鲜见报道。鉴于此,笔者利用24份黑龙江省栽培大豆对离体叶片接种法与下胚轴接种法进行比较,探讨了离体叶片接种法的准确性和可信程度,并利用2份已知抗性的野生大豆材料对离体叶片接种法的条件进行了摸索,同时利用离体叶片接种法对采集自黑龙江省的177份野生大豆资源进行了大豆疫霉根腐病抗病性鉴定,以期解决野生大豆抗病性鉴定困难的问题。
1材料与方法
1.1材料
1.1.1供试菌株。菌株为大豆疫霉菌1号生理小种,由东北农业大学张淑珍教授赠与,是黑龍江省优势生理小种。
1.1.2培养基。胡萝卜培养基(CA):将新鲜的胡萝卜洗净并切成小块,称取200 g,用植物组织搅碎机搅碎,加入1 000 mL蒸馏水煮沸30 min,用3层纱布滤去残渣,将过滤后的胡萝卜汁定容至1 000 mL,加入20 g琼脂,120 ℃高温高压灭菌20 min。灭菌后的培养基倒入灭菌的平皿中,高度为05 cm。
1.1.3试验品种。黑龙江省采集的野生大豆179份,其中ZYD594为已知的感病材料,龙野01-491为已知的抗病材料,用于离体叶片接种法条件摸索。栽培大豆品种24份,为黑龙江省部分育种单位育成的品种,用于离体叶片鉴定法的可行性验证。
1.2方法
1.2.1菌种培养。将大豆疫霉根腐病1号菌取10 mm×10 mm的正方形菌块接种于2%胡萝卜琼脂培养基,于25 ℃暗培养7 d。
1.2.2下胚轴接种和离体叶片接种。取健康无病的大豆种子种于混合有1/3草炭土的小钵中,待其出苗后分别采用下胚轴接种法和离体叶片接种法进行接种。
1.2.2.1下胚轴接种法。参照Kaufmann等[7]的接种方法。当待鉴定幼苗第1对对生真叶展开时,在距离子叶下方1 cm处用手术刀片切出伤口,深度为茎的1/3。将10 mm×10 mm的正方形菌块接种到伤口上。接种后将植株放入保湿箱中保温保湿。3 d后,转移至普通温室内等待发病,并调查发病率。每份材料每次处理30株,3次重复。
1.2.2.2离体叶片接种法。当待鉴定幼苗第一复叶完全展开时将其剪下,置于不锈钢托盘内,盘底放无菌纱布和适量蒸馏水。用灭菌后的手术刀在叶片上表面中心位置划出小伤口。在培养7 d的大豆疫霉根腐病菌株边缘切取适当大小的圆形菌块,接种于伤口之上。菌块的直径略小于叶片宽度。以只划伤口不接种为空白对照1组,接种空白胡萝卜培养基为空白对照2组。用保鲜膜覆盖托盘,保持相对湿度为100%。28 ℃、每日光照12 h培养,发病后调查发病率。每份材料每次处理30个叶片,3次重复。
1.2.3数据分析。统计分析用DPS(7.05 版)对离体叶片接种法和下胚轴接种法进行离相关分析,并对2种方法进行r×c独立性测验。
2结果与分析
2.1离体叶片接种法条件确定利用离体叶片接种法接种2 d后,感病材料ZYD594的接菌部位出现褐斑;接种5 d后,褐斑明显扩大,几乎蔓延整片叶;接菌7 d后,褐斑部位已明显失绿且腐烂;抗病材料龙野01-491的接菌部位始终未发生明显变化(图1)。因此,确定接菌5 d后对发病情况进行调查。
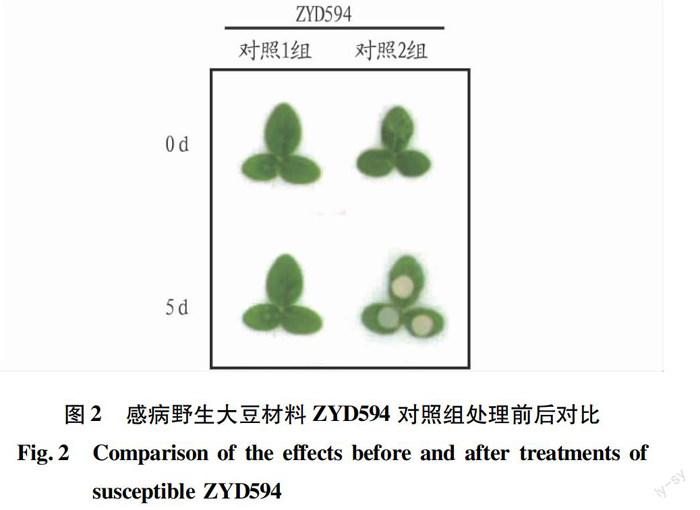
感病材料ZYD594经单纯划伤(对照1组)以及接种空白胡萝卜培养基(对照2组)2种处理5 d后,叶片均未发生明显变化(图2),说明伤口和培养基均未对叶片产生影响,叶片接菌后的发病情况均由大豆疫霉菌感染所致。
4离体叶片接种法的调查标准参考Yang[23]对大豆疫霉根腐病抗感情况的分型标准,调查叶片的发病数量并计算发病率(发病率=发病叶片数/接种叶片总数×100%)。发病率≥70%为感病(S),发病率≤30%为抗病(R),发病率在30%~70%为中间类型(I)。
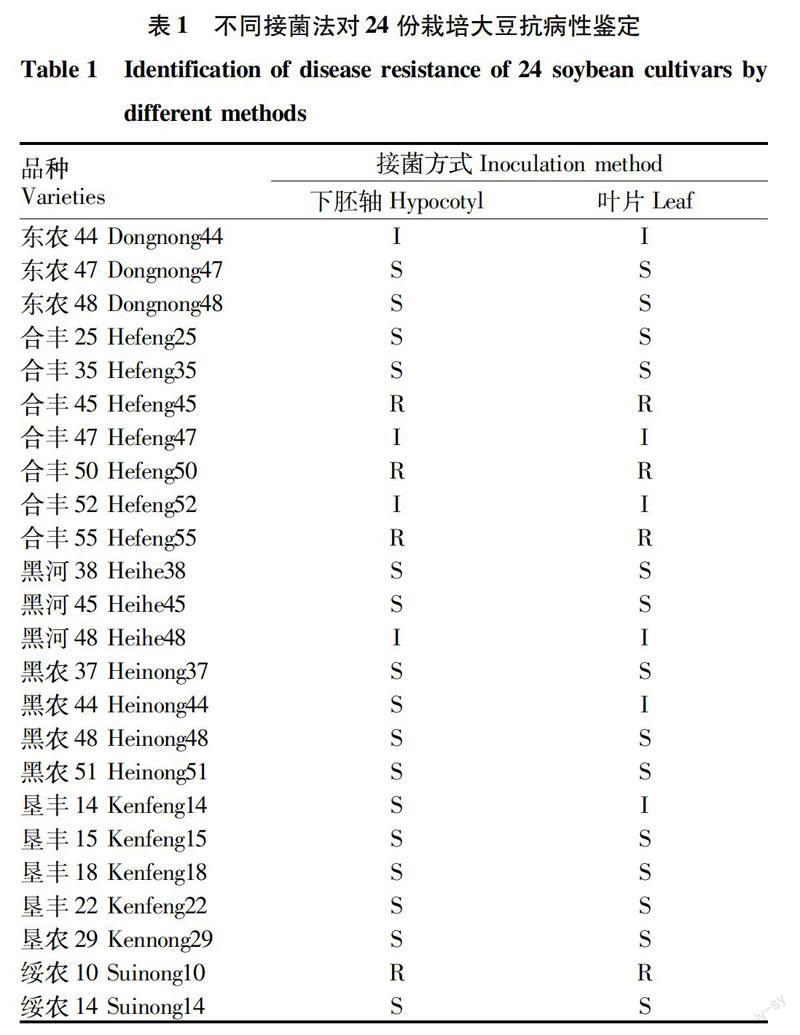
2.2离体叶片接种法的可行性验证 由于下胚轴接种法在野生大豆上不易操作、成功率极低,该研究选用24个黑龙江省栽培大豆品种进行离体叶片接种法与下胚轴接种法的比较研究,结果如表1所示。下胚轴接种法获得4个抗性品种、4个中间型品种和16个感病品种,分别为总数的17%、17%和66%。离体叶片接种法获得4个抗性品种、6个中间型品种和14个感病品种,分别为总数的17%、25%和58%。鉴定结果的一致率达91.67%。两者相比较,有2个品种在下胚轴接种法时表现为感病,而在离体叶片接种法時表现为中间类型。
2.3黑龙江省采集的野生大豆疫霉根腐病抗病性鉴定利用离体叶片接种法对黑龙江省采集的177份野生大豆的疫霉根腐病抗病性进行鉴定。由表4可知,177份野生大豆资源中,抗病材料27份,占供试材料的15.25%;中间类型材料84份,占供试材料的47.56%;感病材料66份,占供试材料的37.29%。
3结论与讨论
野生大豆在世界上分布范围非常狭窄,仅分布于中国、朝鲜半岛、日本列岛及俄罗斯的远东地区[24-25]。而我国的野生大豆资源占全世界的90%以上,其中80%以上野生大豆分布在35° N以北[26-27]。黑龙江省位于我国最北部,地处中温带与寒温带交界处,属于我国高寒地区。黑龙江省野生大豆资源丰富,具有寒地野生大豆的独特性,在我国乃至世界均占有非常重要的位置。然而,随着经济建设的快速发展以及生态环境的不断改变,野生资源的生存环境正面临着巨大威胁。野生大豆的分布面积在不断缩小,类型和数量在逐渐减少,尤其是特殊的生态环境和独特类型[27]。因此,对寒地野生大豆资源的研究与利用,不仅是为了保护与保存寒地野生大豆资源类型,而且对科研、育种以及农业可持续发展也具有重要意义。通过对野生大豆资源抗病性鉴定和抗病品种的筛选,不仅可以加速开展我国大豆种质资源的抗病性
鉴定,而且为抗病育种提供了丰富抗病资源,从而加速了大豆的抗病育种。
野生大豆是栽培大豆的近缘祖先种,在形态上与栽培大豆相似,但在一些性状及长势上差异显著。野生大豆的种子较小。在黑龙江省采集的野生大豆中,有84%的野生大豆其百粒重≤3 g[28],而栽培大豆的百粒重则多在22 g左右。野生大豆的茎细且蔓生缠绕,尤其在幼苗期,茎粗不足栽培大豆的1/2,这一特点令常用的下胚轴接种法在野生大豆下胚轴处很难操作,且野生大豆的下胚轴难以承载菌块重量。这些差异造成了常用的疫霉根腐病抗病性鉴定方法在野生大豆上应用困难的问题。离体叶片接种法能够很好地回避野生大豆下胚轴不易操作特点,又能保留感病材料。通过对离体叶片接种法与下胚轴接种法的相关分析以及独立性测验可知,2种方法的相关性非常高,且离体叶片接种法完全可以用来对大豆疫霉根腐病抗病性进行鉴定。因此,离体叶片接种法是适合野生大豆疫霉根腐病抗性鉴定的有效方法。
对于植物抗病性鉴定,1份材料通常要选择一定数量的单株作为检测样本,且一般要进行重复试验来避免偶然性并减小误差。对于特殊材料(如杂交后代)的检测,用常规的方法无法做到重复检测。叶片是植物的重要器官之一,且在一定的生育时期内,植物不断长出新叶。若利用离体叶片接种法鉴定植物抗病性,则为单株重复检测提供了可能,从而保证试验结果的准确性。但由于植物成株抗性的存在[29],不同时期的新生叶片是否均可作为抗病性检测的接菌体还有待进一步研究。
参考文献
[1] SCHMITTHENNER A F.Problems and progressing in control of Phytophthora root rot of soybean[J].Plant disease,1985,69(4):362-368.
[2] ERWIN D C,RIBEIRO O K.Phytophthora diseases worldwide[M].St.Paul MN,USA:APS Press,1996:592.
[3] WRATHER J A,ANDERSON T R,ARSYAD D M,et al.Soybean disease loss estimates for the top 10 soybean producing countries in 1994[J].Plant disease,1997,81(1):107-110.
[4] 沈崇尧,苏彦纯.中国大豆疫霉病菌的发现及初步研究[J].植物病理学报,1991,21(4):298.
[5] ANDERSON T R,TENUTA A.Phytophthora rot[C]//BAILEY K L,GOSSEN B D,GUGEL R K,et al.Diseases of field crops in Canada.Winnipeg:The Canadian Phytopathological Society,2003:155-156.
[6] 张淑珍,丁广文,李文滨,等.大豆疫霉根腐病研究进展[J].中国油料作物学报,2004,26(2):102-107.
[7] KAUFMANN M J,GERDEMANN J W.Root and stem rot of soybean caused by Phytophthora sojae n.sp.[J].Phytopathology,1958,48(4):201-208.
[8] 朱振东,王晓鸣.大豆对疫霉根腐病抗病性鉴定方法[J].中国油料作物学报,1999,21(2):52-54.
[9] PAZDERNIK D L,HARTMAN G L,HUANG Y H,et al.A greenhouse technique for assessing Phytophthora root rot resistance in Glycine max and G.soja[J].Plant disease,1997,81(10):1112-1114.
[10] 霍云龙,朱振东,李向华,等.抗大豆疫霉根腐病野生大豆资源的初步筛选[J].植物遗传资源学报,2005,6(2):182-185.
[11] 于安亮,徐鹏飞,陈晨,等.大豆疫霉根腐病子叶接种法抗病性鉴定[J].大豆科学,2009,28(5):879-882,888.
[12] 靳立梅,徐鹏飞,吴俊江,等.野生大豆种质资源对大豆疫霉根腐病抗性评价[J].大豆科学,2007,26(3):300-304.
[13] 李永刚,文景芝,郝中娜,等.大豆疫霉根腐病抗病性鉴定方法及抗源筛选的研究[J].东北农业大学学报,2008,39(5):1-5.
[14] MORRISON R H,THORNE J C.Inoculation of detached cotyledons for Screening soybeans against two races of Phytophthora megasperma var.sojae[J].Crop science,1978,18:1089-1091.
[15] 胡宝成,RIMMER S R.油菜菌核病离体叶片接种法研究初报[J].安徽农业科学,1989(3):56-58.
[16] 余毓君,彭生平,夏德术,等.小麦赤霉病抗性的离体叶片接种鉴定方法的应用及抗性评价的研究[J].华中农业大学学报,1991,10(1):1-8.
[17] 文生仓,王 鸣.西瓜炭疽病人工接种鉴定的新方法——离体叶接种和AD评价法[J].西北农业大学学报,1994,22(1):17-22.
[18] 袁慶华,张文淑,李敏.苜蓿褐斑病的离体叶接种研究[J].草地学报,2001,9(1):21-24.
[19] 赵艳龙,何衍彪,詹儒林.剑麻离体叶片接种剑麻茎腐病菌方法的研究[J].中国麻业,2005,27(3):142-145.
[20] 彭铁成,陈云云,罗静瑶,等.香蕉枯萎病的离体叶片接种技术研究[J].广东农业科学,2012(10):7-9.
[21] 张海旺,房文文,刘翠翠,等.离体水稻叶片划伤接种鉴定稻瘟菌的致病型[J].植物保护,2014,40(5):121-125.
[22] 江秀均,柴建萍,占世丰,等.桑褐斑病病原菌的分离及以离体叶片接种测定致病性的方法[J].蚕业科学,2015,41(1):37-41.
[23] YANG X B.Races of Phytophthora sojea in Iowa soybean fields[J].Plant disease,1996,80:1418-1420.
[24] 李向华,王克晶,李福山,等.野生大豆(Glycine soja)研究现状与建议[J].大豆科学,2005,24(4):305-309.
[25] 董英山.中国野生大豆研究进展[J].吉林农业大学学报,2008,30(4):394-400.
[26] 徐豹.中国野生大豆(G.soja)研究十年[J].吉林农业科学,1989(1):5-13.
[27] 林红,齐宁,李向华,等.黑龙江省野生大豆资源考察研究[J].中国油料作物学报,2006,28(4):427-430.
[28] 来永才.中国寒地野生大豆资源图鉴[M].北京:中国农业出版社,2015.
[29] 郝中娜,张红志,李永刚,等.植物成株抗性的机理研究[J].浙江农业学报,2007,19(6):457-462.

