一株产壳聚糖酶菌株的培养条件优化
赵玉巧 徐娜 杜云建

摘要[目的] 优化产壳聚糖酶菌株的培养条件。[方法] 对一株从海洋中筛选的假单胞菌XK-3菌株产壳聚糖酶条件进行优化。[结果]培养基最佳组成:葡萄糖30.0 g/L,牛肉膏为15.0 g/L,(NH4)2SO4 15.0 g/L,K2HPO4 2.0 g/L,KH2PO4 2.0 g/L,NaCl 5.0 g/L,MgSO4·7H2O 0.5 g/L。摇瓶培养最佳条件:培养初始pH 6.0,培养温度28 ℃,装液量20%。Mg2+、Ca2+ 、Mn2+对壳聚糖酶活力有一定的促进作用,Fe3+、Cu2+和Zn2+对壳聚糖酶活力有一定的抑制作用。摇瓶培养条件优化后得到的壳聚糖酶活力为3 430 U/L,优化前壳聚糖酶活力为1 072 U/L,优化后是优化前的3.2倍。摇瓶培养得到菌体的最适生长时间为24 h,发酵于64 h后结束。[结论] 优化后的培养条件提高了壳聚糖酶产量,使该菌株的工业应用成为可能。
关键词壳聚糖酶;假单胞菌;培养基;优化
中图分类号S18文献标识码
A文章编号0517-6611(2017)08-0007-03
Optimization of Culture Conditions of the Strain that Produced Chitosanase
ZHAO Yuqiao, XU Na, DU Yunjian
(Jiangsu Key Laboratory of Marine Biotechnology, Huaihai Institute of Technology, Lianyungang,Jiangsu 222005)
Abstract[Objective] To optimize culture conditions of the strain that produced chitosanase. [Method]The culture conditions of Rhodotorula sp.strain were optimized for the production of trehalose. [Result]The optimum medium consisted of 30.0 g/L sucrose, 15.0 g/L beef extract, 15.0 g/L(NH4)2SO4,2.0 g/L K2HPO4,2.0 g/L KH2PO4 ,5.0 g/L NaCl ,0.5 g/L MgSO4·7H2O . The optimum culture conditions were determined as follows: initial pH 6, temperature 28 ℃,fluid volume 20%.Mg2+, Ca2+ and Mn2+ had a certain promoting effect on the activity of enzyme, Fe3+, Cu2+ and Zn2+ had a certain inhibitory effect on the activity of the enzyme. The yield of the chitosan enzyme was 3 430 U/L through optimized shaking flask culture conditions, the yield of chitosan enzyme was 1 072 U/L before optimization, the optimized result was 3.2 times of that of the former.The optimum growth time was 24 h, and the fermentation time was 64 h. [Conclusion] The culture conditions that were optimized improve the chitosan enzyme production, and make the industrial application of the strains possible.
Key wordsChitosanase;Pseudomonas sp.;Medium;Optimization
殼聚糖是由D-氨基葡萄糖通过β-1,4-氨基糖苷键连接而成[1],其基本不溶于水,影响了其应用范围。壳聚糖酶可使壳聚糖水解为不同分子量的水解物,这些水解物大多数水溶性好,从而使其广泛应用。Harish Prashanth等[2]研究发现,壳寡糖能抑制肿瘤血管生成并促进癌细胞凋亡。
壳聚糖酶主要来自于细菌、放线菌、真菌等生物群中[3],由于一般的壳聚糖酶产生菌产酶活力都较低,为了得到活力较高的壳聚糖酶,需要对产壳聚糖酶菌株发酵条件进行优化。涂绍勇等[4]对从土样中分离到的一株产壳聚糖酶菌株的产酶条件进行了优化,发酵液中酶活力可达2.16 U/mL。孙菲等[5]对从土样中分离到的JH01菌株进行产酶条件优化,发酵液中壳聚糖酶活力可达26.03 U/mL。笔者对一株从海洋中筛选的假单胞菌XK-3菌株进行培养条件优化,以提高壳聚糖酶的产量,使该菌株的工业应用成为可能。
1材料与方法
1.1材料
1.1.1菌种。从海水中筛选的假单胞菌。
1.1.2培养基。①斜面培养基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂15.0~20.0 g,补煮沸过滤陈海水至1 000 mL,pH 7.0~7.2。②种子培养基:葡萄糖5.0 g,蛋白胨5.0 g,酵母提取物5.0 g,K2HPO4 2.0 g,KH2PO4 2.0 g,NaCl 5.0 g,Mg SO4·7H2O 0.5 g,补煮沸过滤陈海水至1 000 mL,pH 7.0。③ 基础培养基:粉末壳聚糖10.0 g,葡萄糖1.0 g,硫酸铵5.0 g,酵母提取物3.0 g,K2HPO4 2.0 g,KH2PO4 2.0 g,NaCl 5.0 g,MgSO4·7H2O 0.5 g,补煮沸过滤陈海水至1 000 mL,pH 6.5。
种子培养条件:250 mL三角瓶装75 mL培养基,摇床转速150 r/min,28 ℃培养12 h。摇瓶培养条件:接种量2%,培养时间72 h,其余条件与种子培养相同。
1.2方法
1.2.1培养基优化。①碳源的选择。碳源为淀粉、糊精、壳聚糖水解物(分子量50 000)、葡萄糖、壳寡糖、胶体壳聚糖、羧甲基纤维素钠,加入量均为10 g/L,其他成分及条件相同。②氮源的选择。以葡萄糖作为碳源,氮源为酵母膏、蛋白胨、牛肉膏、硫酸铵、硝酸钾、尿素、豆饼粉,浓度均为8 g/L,其他成分及条件都相同。③碳氮比的选择。以葡萄糖为碳源,牛肉膏和硫酸铵为氮源,2种氮源的比例为1∶1,采用的碳氮比例及加入量分别为2∶1(10∶5、20∶10、30∶15)、1∶1(10∶10、20∶20、30∶30)、1∶2(5∶10、10∶20、15∶30)及1∶3(5∶15、7.5∶22.5、10∶30) (括号中为碳、氮源的加入量之比,单位为 g/L),其他成分及条件相同。④金属离子对壳聚糖酶合成的影响。选择Mn2+、Zn2+、Cu2+、Mg2+、Ca2+、Fe3+共6种离子,其盐加入量均为0.5 g/L,用2.5%的氯化钠溶于蒸馏水替代海水。
1.2.2培养条件优化。①初始 pH。采用优化后的最佳培养基,初始pH分别为5.0、5.5、6.0、6.5、7.0、7.5,其他培养条件:培养温度28 ℃,装液量为250 mL三角瓶装75 mL培养基,培养时间72 h。② 培养温度:培养温度选择25、28、30、32、35 ℃,初始pH 6.0,其余条件同 ①。③ 装液量。在250 mL三角瓶中装液量分别选择37.5(15%)、50.0(20%)、62.5(25%)、75.0(30%)、87.5(35%)、100.0 mL(40%),培养温度28 ℃,其余条件同②。④ 菌体生长及壳聚糖酶产生过程。在250 mL三角瓶装50 mL培养基,培养温度28 ℃,pH 6.0,培养时间84 h,考察细胞生长量和壳聚糖酶产量,以此来考察参数之间的关联。
1.3测定项目与方法采用细胞干重法测定细胞生长量;采用DNS显色法测定壳聚糖酶活力[6]。
2结果与分析
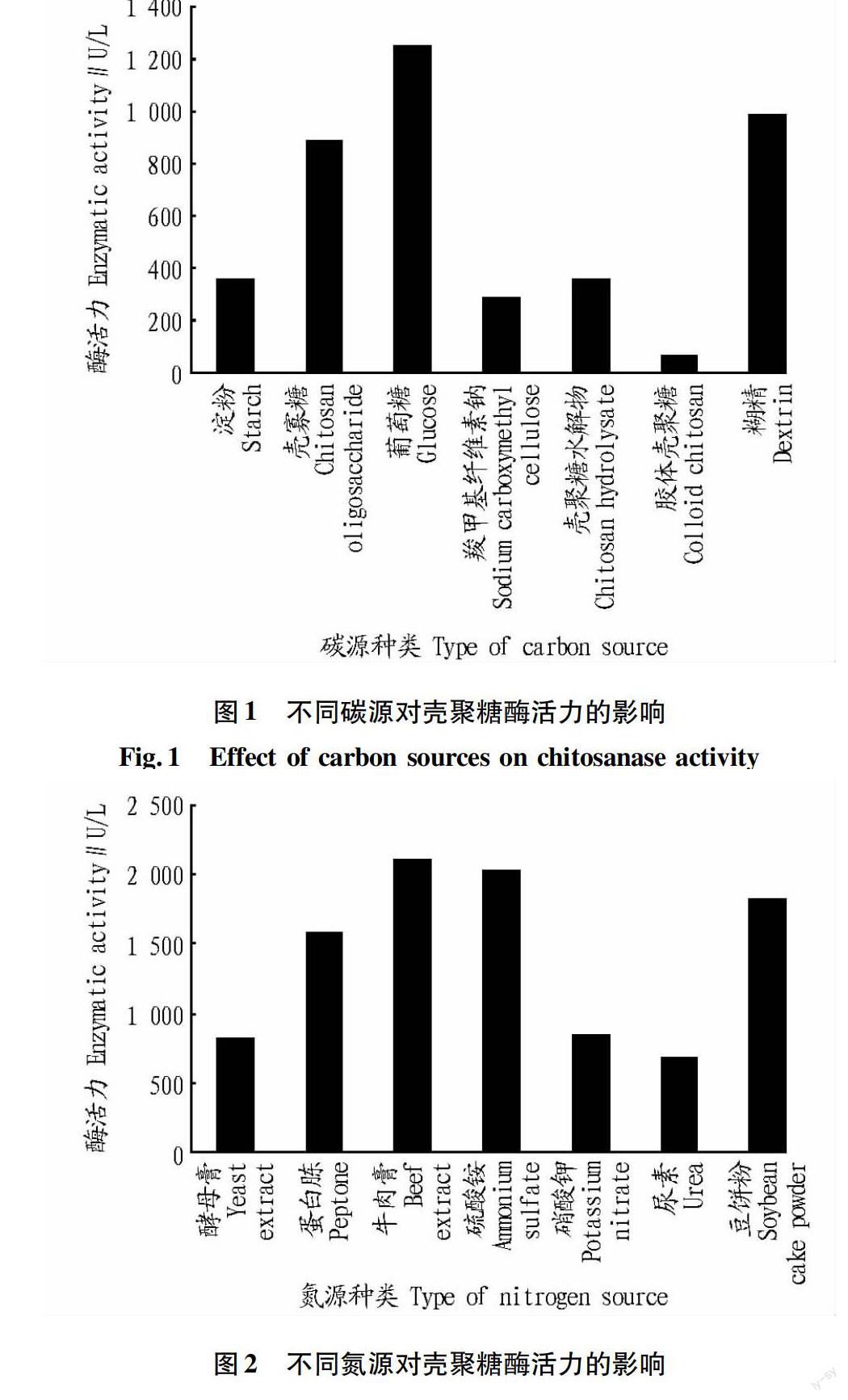
2.1碳源对壳聚糖酶活力的影响
由图1可知,菌株利用分子量大的多糖产酶能力低。以葡萄糖为碳源有利于该菌株产酶,菌体产酶活力最高,达1 253 U/L,糊精和壳寡糖次之,故选择葡萄糖作为碳源。
2.2氮源对壳聚糖酶活力的影响
由图2可知,在含有尿素的发酵液中,该菌株的产酶能力最低,仅679 U/L;采用牛肉膏和硫酸铵作为氮源,菌株的产酶活力分别为2 104和2 029 U/L,故选择牛肉膏和硫酸铵作为氮源。
2.3碳氮比对壳聚糖酶活力的影响
由表1可知,当培养基中碳氮比为1∶1时,壳聚糖酶活力最高,且碳氮源的加入量越高其酶活力也越高,当碳源与氮源加入量均为30.0 g/ L时,酶活力达3 960 U/L,即葡萄糖加入量为30.0 g/ L,牛肉膏和硫酸铵加入量均为15.0 g/ L。
2.4无机离子对壳聚糖酶活力的影响
由图3可知,不同离子对壳聚糖酶的影响不同,Mg2+、Ca2+ 、Mn2+对菌株产酶有明显促进作用,加入Mg2+菌株所产壳聚糖酶活力达3 744 U/L,Ca2+、Mn2+对酶活力也有一定的促进作用,而Fe3+、Cu2+和Zn2+对壳聚糖酶活力有一定的抑制作用。
2.5初始pH对壳聚糖酶活力的影响
由图4可知,当pH小于6.0时培养基初始pH對酶活力的影响较大;pH在5.0~6.0时酶活力呈上升趋势;当pH 6.0~7.5时,酶活力呈下降趋势;pH为6.0时酶活力最高,为3 848 U/L。故选择培养基最佳初始pH为6.0。
2.6装液量对壳聚糖酶活力的影响
由图5可知,装液量对假单胞菌XK-3菌株产壳聚糖酶有一定的影响,20%的装液量(250 mL三角瓶装液量为50 mL)酶活力最高,达3 076 U/L。随着装液量的增加,壳聚糖酶活力逐渐下降。因此,确定最佳装液量为20%(250 mL三角瓶装液量为50 mL)。
2.7培养温度对壳聚糖酶活力的影响
由图6可知,假单胞菌XK-3菌株在25~28 ℃培养时,酶活力增长较快,培养温度为28 ℃时,发酵液中酶活力最高,达3 704 U/L。温度高于28 ℃时,发酵液中酶活力下降较快,30~35 ℃时,酶活力下降缓慢。菌株XK-3产酶温度较低与菌株来自于海洋有一定关系。
2.8菌株XK-3的生长及产酶情况
由图7可知,0~32 h菌体生长速度较快,32 h后生长趋于平缓。酶活力呈逐渐增长的
倍。该菌株产酶量逐渐增加可能与所产酶为胞外酶有关,虽然菌体生长量在34 h后已不再增加,但胞内的酶逐渐透出细胞及细胞的自溶仍逐渐增加。结合菌株XK-3的生长及产酶曲线,确定培养结束时间为64 h。
3结论与讨论
该研究结果表明,菌株XK-3摇瓶培养最佳培养基:葡萄糖30.0 g/L,牛肉膏15.0 g/L,(NH4)2SO4 15.0 g/L,K2HPO4 2.0 g/L,KH2PO4 2.0 g/L,NaCl 5.0 g/L,MgSO4·7H2O 0.5 g/L。当培养基中碳氮比为1∶1时,壳聚糖酶活力最高,且碳氮源的加入量越高其酶活力也越高,但碳氮源含量过高会使原料利用率降低,并对环境造成污染, 故生产中可采取中间补料的方法。Ca2+ 、Mg2+ 和Mn2+对酶活力有一定的促进作用,而Cu2+、Fe3+和Zn2+对壳聚糖酶活力有一定的抑制作用,其他离子对酶活力无明显作用,而海水中Fe3+、Cu2+和Zn2+含量很低,说明用海水配制培养基对该菌株的产酶量无影响。
该菌株壳聚糖酶的产生均对初始pH、溶氧及培养温度敏感,特别是培养温度,低于或高于28 ℃酶活力均明显下降,这就要求生产过程中对温度的控制要尽量准确。
45卷8期赵玉巧等一株产壳聚糖酶菌株的培养条件优化
参考文献
[1]
季更生,陈爱春.微生物壳聚糖酶的研究进展[J].食品科学,2010,31(3):297-301.
[2] HARISH PRASHANTH K V,THARANATHAN R N.Depolymerized products of chitosan as potent inhibitors of tumorinduced angiogenesis[J].Biochip Biophys Acta,2005,1722(1):22-29.
[3] FUKUOKA T,SURAKARTA T,DAIKER Y,et al.Specificity of chittenango from Bacillus pilus[J].Bioethic Biophys Acta,1994,205(2):183-188.
[4] 涂绍勇,杨爱华,吴柏春,等.产壳聚糖酶菌株的筛选及其发酵产酶条件的研究[J].化学与生物工程,2009,26(9):52-55.
[5] 孙菲,陈山岭,李宜海,等.壳聚糖酶高产菌株的筛选、产酶条件的优化及壳聚糖酶的分离纯化[J].现代食品科技,2006,22(3):21-27.
[6] 曾嘉,郑连英.通过酶促反应制备壳寡糖[J].食品与发酵工业,2001,27(10):1-4.

