TEL/AML1基因阳性急性淋巴细胞白血病患儿CCLG-ALL-2008方案疗效分析
高 静 胡绍燕 卢 俊 何海龙 王 易 赵文理 李建琴 李 捷 肖佩芳 范俊杰 柴忆欢
苏州大学附属儿童医院血液科 (江苏苏州 215000)
·论 著·
TEL/AML1基因阳性急性淋巴细胞白血病患儿CCLG-ALL-2008方案疗效分析
高 静 胡绍燕 卢 俊 何海龙 王 易 赵文理 李建琴 李 捷 肖佩芳 范俊杰 柴忆欢
苏州大学附属儿童医院血液科 (江苏苏州 215000)
目的探讨CCLG-ALL-2008方案治疗TEL/AML1融合基因阳性儿童急性淋巴细胞白血病(ALL)效果以及影响因素。方法回顾分析2008年6月至2014年12月初诊并治疗的99例TEL/AML1融合基因阳性患儿及329例无特异性融合基因的B系ALL患儿的临床和生物学特征,随访至2015年10月,观察两组患儿的生存状态和影响因素。结果两组患儿初诊时的年龄和外周血白细胞数相近;在诱导缓解治疗第8天的泼尼松敏感实验、第15天骨髓呈M3状态、第33天和第12周微小残留病灶(MRD)>1.0×10-3的比例两组患儿的差异均无统计学意义(P>0.05)。随访期间,TEL/AML1融合基因阳性患儿的复发率为14.14%(14/99),无特异性融合基因组为20.97%(69/329),差异无统计学意义(χ2=2.27,P=0.132);无特异性融合基因组病死率(16.72%)高于TEL/AML1融合基因阳性组(8.08%),差异有统计学意义(χ2=4.52,P=0.033)。TEL/AML1融合基因阳性组与无特异性融合基因组的5年总生存率(OS)分别为(86.1±4.9)%和(79.0±2.8)%,5年无复发生存率(RFS)分别为(80.7±5.1)%和(72.0±3.1)%,5年无事件生存率(EFS)分别为(78.9±5.1)%和(69.6±3.1)%,差异均无统计学意义(P>0.05)。COX模型分析显示第12周MRD水平是影响OS、RFS、EFS的独立预后因素(P均<0.001)。结论接受CCLG-ALL-2008方案治疗的ALL患儿,TEL/AML1融合基因阳性是预后良好的指标,第12周MRD≥1.0×10-3应推荐更强烈的治疗方案。
急性淋巴细胞白血病; CCLG-ALL-2008方案; TEL/AML1基因; 总生存率; 无复发生存率; 无事件生存率; 儿童
急性白血病是儿童时期最为常见的恶性肿瘤,以急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)为主,约占70%~85%[1]。随着化疗方案不断完善、白血病危险度分级日趋精准、个体化用药以及支持治疗不断加强,其5年无事件生存率(EFS)可达85%以上[2]。影响儿童ALL治疗效果及预后的因素非常多,而特定的染色体易位及其形成的融合基因对ALL患儿治疗效果及预后有着重要影响[3,4]。目前儿童ALL较常见的染色体易位和融合基因类型包括:TEL/AML1融合基因,t(12;21)(p13;q22);BCR/ABL融合基因,t(9;22)(q34;q11);E2A/PBX1融合基因,t(1;19)(q23;p13);MLL/AF4融合基因,t(4;11)(q21;q23)等,其中以t(12;21)(p13;q22)易位形成的TEL/ AML1融合基因最常见,发生率为20%~25%[5],被认为是预后良好的融合基因类型。
TEL基因(又称EVT6)位于染色体12p13,AML1(又称RUNX1)基因位于21 q 22,染色体12 p 13与21q22断裂融合形成TEL/AML1融合基因,它可影响造血干细胞的自我更新与分化,从而诱发白血病[6]。国内外相关研究发现,TEL/AML1融合基因阳性患儿5年EFS可达86%~92.3%,远高于其他融合基因阳性的ALL患儿[2,5]。但是近年来有文献报道该基因阳性患儿易于出现晚期复发[7],危险度评估指标的争议性可能与不同治疗组采用不同的治疗方案有关。本研究回顾性分析采用CCLG-ALL-2008方案治疗的ALL患儿的临床特点及治疗效果,分析TEL/AML1融合基因阳性儿童和无任何融合基因标记的患儿对该方案的治疗反应及其预后因素,旨在探讨CCLG-ALL-2008方案的适用人群,为进一步优化特定亚型的儿童ALL治疗方案,提高治疗效果奠定基础。
1 对象与方法
1.1 研究对象
选择苏州大学附属儿童医院2008年6月至2014年12月使用CCLG-ALL-2008方案且免疫分型为B系(成熟B淋巴细胞除外)的ALL患儿为研究对象。入选标准:①初诊,年龄小于16周岁;②满足CCLGALL-2008方案入组标准[8],按照CCLG-ALL-2008方案正规化疗,并按CCLG-ALL-2008方案调整危险度及化疗强度,未完成CCLG-ALL-2008方案诱导缓解VDLD(长春新碱+柔红霉素+左旋门冬酰胺酶+地塞米松)疗程者除外。其中初诊时骨髓染色体检查或FISH荧光分析有t(12;21)(p13;q22)者,或29种多重RT-PCR检测有TEL/AML1融合基因阳性者,为TEL/AML1融合基因阳性组;无TEL/AML1基因、BCR/ ABL基因、E2A/PBX1基因、HOX11基因、MLL基因累及阳性表现者,为无特异性融合基因组。
1.2 方法
1.2.1 染色体核型、融合基因检测
初诊ALL患儿肝素抗凝骨髓标本,采用骨髓细胞直接培养法或24 h短期培养法,常规R显带技术进行核型分析;EDTA抗凝骨髓标本,以淋巴细胞分离液提取单个核细胞,用巢式RT-PCR技术检测29种融合基因,其中包括TEL/AML1融合基因;肝素抗凝骨髓标本、收集细胞,进行低渗处理,将固定的细胞进行滴片、老化和脱水,加入配制好的探针进行杂交[9],行Fish荧光分析。
1.2.2 免疫分型及微小残留病灶筛选 取肝素抗凝骨髓,常规分离有核细胞,将骨髓单个核细胞调整至每管(1.25~1.50)×106,用CD45-FITC、CD10-PE、CD34-Percp和CDl9-APC单抗染色,以能够明确区分白血病细胞和正常骨髓细胞作为抗体组合有效。取诱导缓解VDLD疗程结束后第33天肝素抗凝骨髓标本,经Ficoll分离单个核细胞,进行四色荧光标记检测(CD34/CD19/CD10组合基础上再添加CD58、CD66c、CD38及末端脱氧核苷酸转移酶TdT等),调出患儿初诊筛选存档的原始数据,在双参数图上,若在原白血病细胞出现区域仍有细胞存在,即判断为白血病微小残留(MRD),这些残留细胞占骨髓单个核细胞总数的比例即为MRD监测结果[10]。
1.2.3 化疗方案及危险度调整 所有患儿均采用CCLG-ALL-2008方案规律化疗及调整危险度,即:确诊且入组后均采用泼尼松预处理7天后评估是否敏感,继续开始VDLD诱导缓解治疗、早期强化CAM(环磷酰胺+阿糖胞苷+6-巯基嘌呤),mM(大剂量甲氨蝶呤+6-巯基嘌呤,或HR-1、HR-2、HR-3均行两轮),延迟强化VDLD、CAM方案(中间加8周维持化疗)1轮或2轮,最后维持化疗和定期鞘内注射等,具体药物剂量和危险度评估指标参考文献[8,11]。
1.2.4 治疗反应及疗效判断 ①泼尼松敏感实验:以泼尼松诱导第8天外周血幼稚淋巴细胞绝对计数<1 000×106/L者为敏感,≥1 000×106/L者为不敏感;②第15天骨髓涂片结果:VDLD治疗第15天患儿骨髓原始幼稚细胞<5%定义为M1,5%~25%为M2,>25%为M3;③第33天和第12周MRD:第33天MRD<1×10-4者归入标危组,居于1×10-4~1×10-2者归入中危组,≥1×10-2或第12周≥1×10-3者归入高危组;④复发:包含骨髓复发、中枢神经系统复发、睾丸复发、联合复发,骨髓复发即ALL完全缓解后,复查骨髓中原始+幼稚细胞比率>25%,中枢神经系统复发即脑脊液经离心涂片检测到原始/幼稚细胞或存在中枢神经系统浸润表现且其他原因不可解释者或CT/MRI显示脑或脑膜病变,睾丸复发即超声或者活检证实单侧或双侧睾丸白血病细胞浸润,联合复发即髓外复发(中枢和/或睾丸复发)、同时骨髓中的白血病细胞>5%;⑤事件包括:持续不缓解、复发、发生第二肿瘤、死亡等。
1.3 统计学分析
应用SPSS17.0软件包进行数据分析。计数资料以百分比表示,两组间率的比较采用χ2检验。中位数(四分位数范围)比较采用Wilcoxon秩和检验。两组间生存率的比较采用Kaplan-Meier曲线生存分析法,不同组生存情况采用双侧Log-Rank检验;对预后的影响因素分析,采用COX模型。
2 结果
2.1 一般情况
总共入组B系ALL患儿539例,其中TEL/AML1融合基因阳性者99例,阳性率18.37%,男53例、女46例,初诊中位年龄为54月龄(范围:18~160月龄);无特异性融合基因组共329例,男199例、女130例,初诊中位年龄为53月龄(范围:11~178月龄)。两组患儿的性别、初诊年龄、初诊白细胞数、最终危险度的差异无统计学意义(P均>0.05),具有可比性。见表1。两组患儿均随访至2015年10月11日,中位随访时间37个月(11~88个月)。
综上所述,低剂量罗哌卡因联合舒芬太尼腰-硬联合麻醉对行剖宫产孕妇麻醉质量好,可降低产妇疼痛程度,且对产妇血流动力学影响较小,对新生儿安全性高,但由于本研究样本量较小,尚需大样本多中心开展研究,并对麻醉药物的具体作用机制进行更加深入探讨。
2.2 治疗反应
两组患儿泼尼松反应敏感率的构成比差异无统计学意义(P=0.435)。两组间治疗第15天骨髓涂片白血病细胞百分比、第33天及第12周MRD水平差异均无统计学意义(P>0.05)。见表1。
2.3 治疗相关事件
TEL/AML1融合基因阳性患儿的复发率为14.14%,无特异性融合基因组为20.97%,两组间差异无统计学意义(χ2=2.27, P=0.132);无特异性融合基因组病死率(16.72%)高于TEL/AML1融合基因阳性组(8.08%),差异有统计学意义(χ2=4.52, P=0.033)。见表1。
2.4 生存状态及其预后影响因素分析
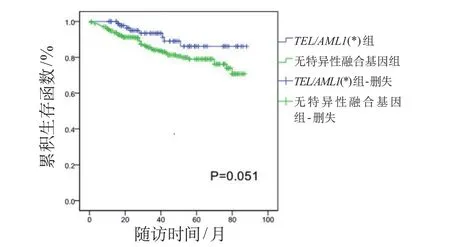
图1 总生存时间曲线
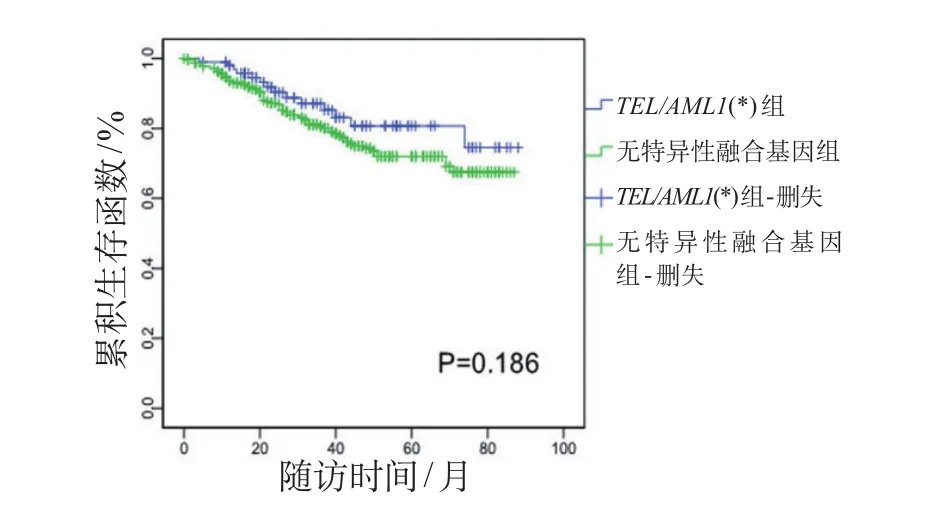
图2 无复发生存时间曲线
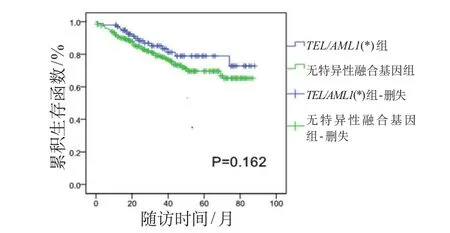
图3 无事件生存时间曲线
对两组患儿进行COX模型多因素分析显示,复发、第12周MRD水平≥1.0×10-3的患儿,总生存时间短;第15天骨髓涂片状态为M3的患儿,总生存时间短(表2);第12周MRD水平>1.0×10-3的患儿,RFS时间短(表3);第12周MRD水平≥1.0×10-3的患儿,EFS时间短(表4)。
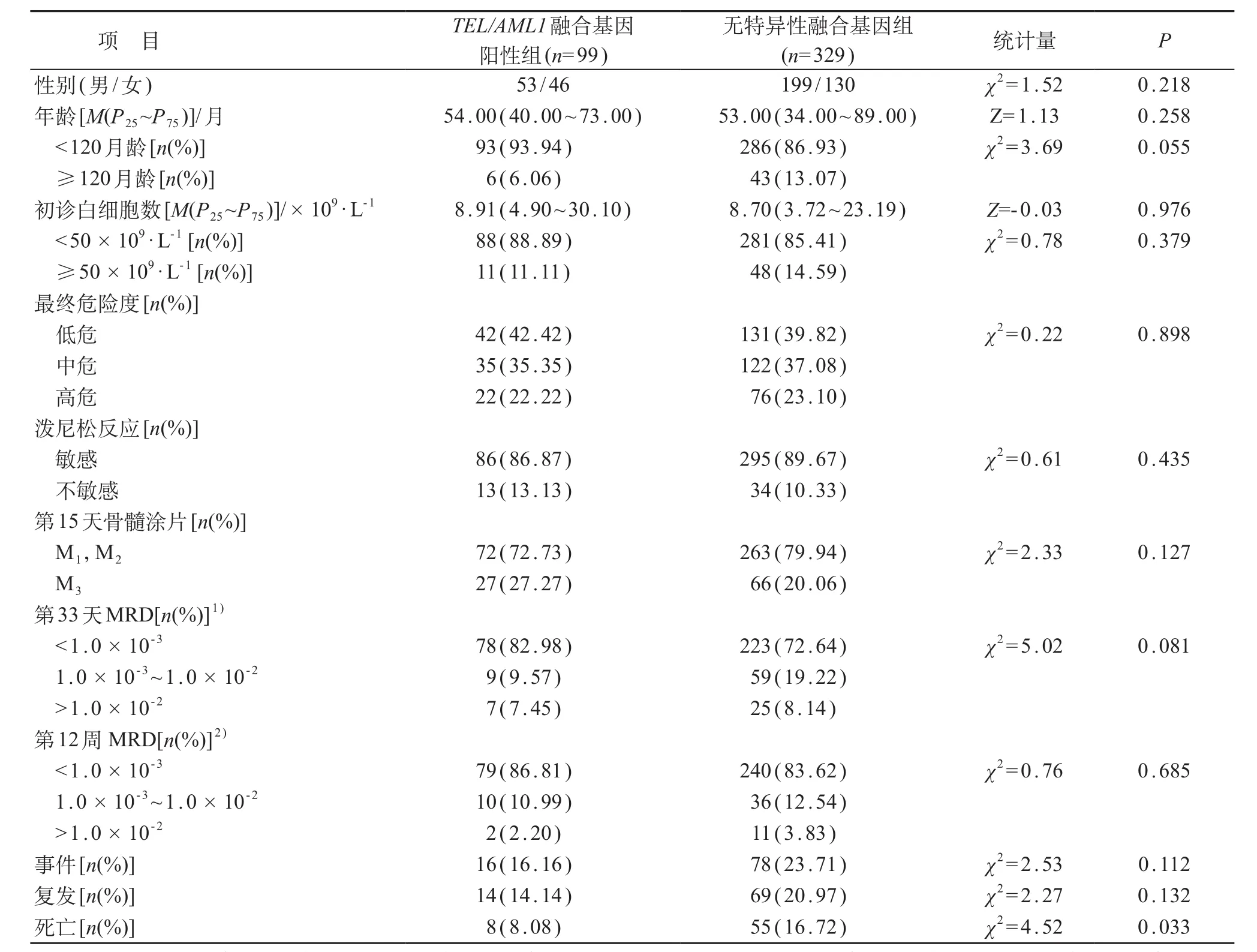
表1 TEL/AML1组与无特异性融合基因组患儿临床特征及治疗效果比较
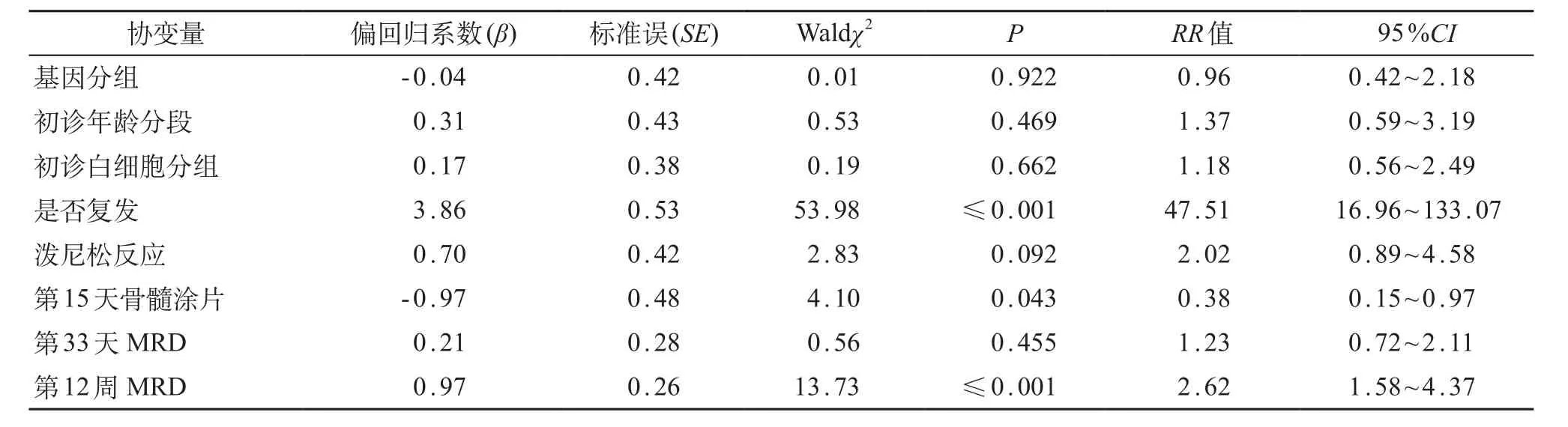
表2 COX回归模型分析影响总生存率风险因素
3 讨论
染色体/融合基因异常在儿童ALL危险度划分、个体化用药、临床疗效评估、评判预后中意义重大。目前TEL/AML1融合基因是儿童ALL中最为常见的融合基因,在我国儿童中阳性率约19.8%[11]。本研究显示阳性率为18.64%;国外TEL/AML1基因阳性患儿男女比例几近1:1[5],本研究男女比例为1.15:1。
临床研究发现,TEL/AML1融合基因阳性的儿童ALL治疗效果优于其他类型,是一个独立的预后因素,其5年EFS可达(86±2)%,而TEL/AML1阴性组患儿为(72±2)%[5]。但是,对应用荷兰儿童白血病研究协作组-Ⅷ方案(DCLSG-Ⅷ)治疗的105例儿童(其中TEL/AML1基因阳性者22例)回顾性研究发现,该融合基因在使用DCLSG-Ⅷ治疗的患儿中缺乏独立预后因素的作用[12]。本研究采用Kaplan-Meier生存分析法及COX回归模型两种方法,均显示TEL/AML1融合基因并非独立预后因素。由此可见,不同研究中心采用的化疗方案不同,预后指标的意义也会发生相应的改变。
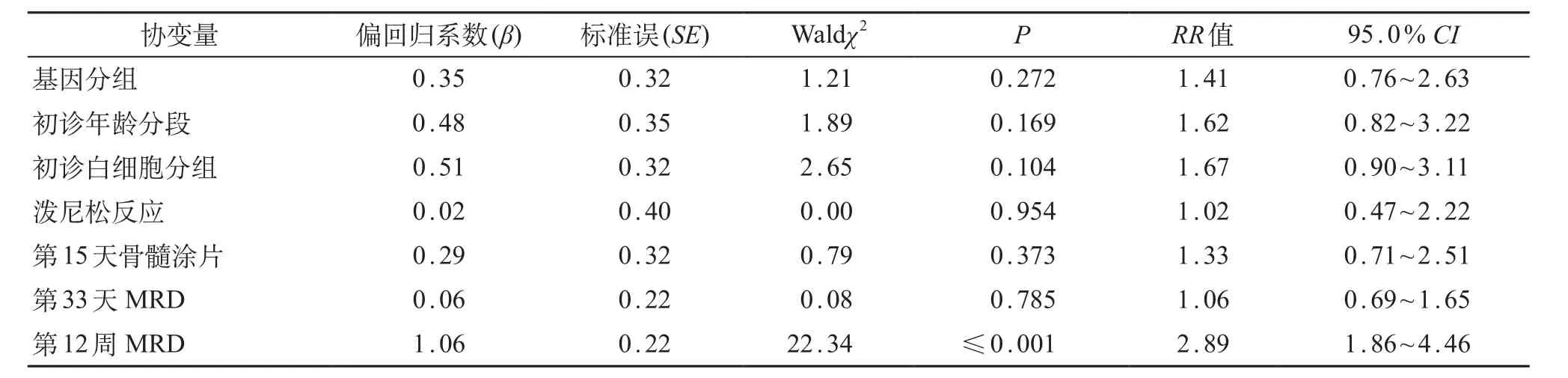
表3 COX回归模型分析影响无复发生存率风险因素
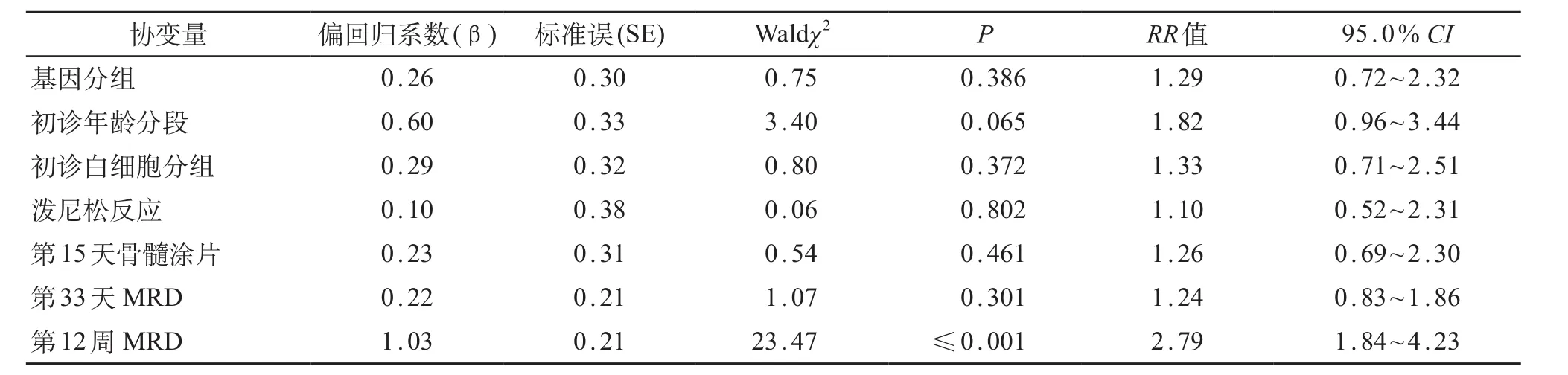
表4 COX回归模型分析影响无事件生存率风险因素
另外,国内外公认MRD水平可反映B系ALL患儿体内肿瘤细胞负荷,一定程度上可反映其临床治疗效果,作为调整危险度及化疗强度、评估预后的重要指标;更有研究机构认为,12周MRD水平至关重要,其水平升高的患儿治疗失败或复发风险更大[2]。本研究中,两组患儿的初诊中位年龄、性别、中位白细胞计数、最终危险度等因素方面差异无统计学意义,具有可比性;基因阳性组与阴性组的泼尼松敏感试验、第15天骨髓M3状态、第33天及第12周MRD差异均无统计学意义,提示TEL/AML1基因阳性在预测治疗反应方面并无优势;但两组患儿病死率差异有统计学意义,阴性组患儿病死率约为TEL/AML1基因阳性组的2倍。经Kaplan-Meier曲线分析发现,TEL/AML1基因阳性组患儿5年OS为(86.1±4.9)%,基因阴性组为(79.0±2.8)%,TEL/AML1基因阳性组有优于基因阴性组的趋势(P=0.051),与国外研究机构结论基本一致[2,3]。TEL/AML1基因阳性组患儿的5年EFS和RFS也高于基因阴性组,但差异无统计学意义。本研究5年OS、EFS和RFS均较国外或北京儿童医院等报道的偏低[1,2,5],可能与本研究中复发患儿放弃率较高和随访时间相对更长有关。对患儿进行COX模型分析发现,复发、第12周MRD水平是影响两组患儿OS的独立预后因素;第12周MRD水平最为重要,对两组患儿RFS、EFS影响均较大,与国外多数研究机构结果一致[2]。
综上所述,应用CCLG-ALL-2008方案的TEL/ AML1基因阳性组与无特异性融合基因组患儿在临床特点、早期治疗反应方面无显著性差别,TEL/AML1基因阳性组患儿总生存率较无特异性融合基因组高,疾病复发和第12周MRD水平是影响患儿生存的独立预后因素。若第12周MRD水平较高,应推荐更强烈的治疗方案,如造血干细胞移植,以降低复发率,提高长期生存率。
[1] 王凯玲, 梅妍妍, 崔蕾, 等.两种化疗方案对于TEL/ AML1融合基因阳性儿童急性淋巴细胞白血病的疗效比较[J].中国实验血液学杂志, 2014, 22(2): 285-290.
[2] Tasian SK,Loh ML,Hunger SP. Childhood acute lymphoblastic leukemia: Integrating genomics into therapy [J]. Cancer, 2015, 21(20): 3577-3590.
[3] Moorman AV. The clinical relevance of chromosomaland genomic abnormalities in B-cell precursor acute lymphoblastic leukaemia [J]. Blood Rev, 2012, 26(3): 123-135.
[4] Braoudaki M, Tzortzatou-Stathopoulou F. Clinical cytogenetics in pediatric acute leukemia: an update [J]. Clin Lymphoma Myeloma Leuk, 2012, 12(4): 230-237.
[5] Rubnitz JE, Wichlan D, Devidas M, et al. Prospective analysis of TEL gene rearrangements in childhood acute lymphoblastic leukemia: a Children's Oncology Group study [J]. J ClinOncol, 2008, 26(13): 2186-2191.
[6] 郭霞,李强. TEL/AML1融合基因与儿童急性淋巴细胞白血病[J].实用儿科临床杂志, 2007, 22(3): 227-229.
[7] Forestier E, Heyman M, Andersen MK, et al. Outcome of ETV6/RUNX1-positive childhood acute lymphoblastic leukaemia in the NOPHO-ALL-1992 protocol: frequent late relapses but good overall survival [J]. Br J Haematol, 2008, 140(6): 665-672.
[8] 中华医学会儿科学分会血液学组, 中华儿科杂志编辑委员会. 儿童急性淋巴细胞白血病诊疗建议(第四次修订) [J].中华儿科杂志, 2014, 52(9): 641-644.
[9] 何亚香, 薛永权, 王红英, 等.伴有11q23/MLL重排的儿童急性髓系白血病的临床及实验室分析[J]. 中华遗传学杂志, 2012, 29(6): 677-682.
[10] Hu YX, Lu J, He HL, et al. A prospective evaluation of minimal residual disease as risk stratification for CCLGALL-2008 treatment protocol in pediatric B precursor acute lymphoblastic leukemia [J]. Eur Rev Med Pharmacol Sci, 2016, 20(9): 1680-1690.
[11] Gao C, Zhao XX, Li WJ, et al. Clinical features, early treatment responses, and outcomes of pediatric acute lymphoblastic leukemia in China with or without specific fusion transcripts: a single institutional study of 1, 004 patients [J]. Am J Hematol, 2012, 87(11): 1022-1027.
[12] Hubeek I, Ramakers-van Woerden NL, Pieters R, et al. TEL/ AML1 fusion is not a prognostic factor in Dutch childhood acute lymphoblastic leukaemia [J]. Br J Haematol, 2001, 113(1): 254-255.
Effect of chemotherapy regimen CCLG-ALL-2008 on children with TEL/AML1 fusion gene positive of acute
lymphoblastic leukemia
GAO Jing,HU Shaoyan,LU Jun,HE Hailong,WANG Yi,ZHAO Wenli,LI Jianqin,LI Jie,XIAO
Peifang,FAN Junjie,CHAI Yihuan
(Department of Hematology,Children’s Hospital of Soochow University,Suzhou 215000,Jiangsu,China)
ObjectiveTo evaluate the predictive role of TEL/AML1 fusion gene in protocol CCLG-ALL-2008 and to identify relevant factors in fl uencing the outcome of ALL with TEL/AML1 fusion gene.MethodsNinety-nine patients with ALL harboring TEL/AML1 fusion gene (positive) and 329 cases without any speci fi c fusion genes (negative) at diagnosis of B-lineage ALL from June 2008 to December 2014 were enrolled and their clinical and biological features were analyzed. Following-up ended in October 2015, the survival status was calculated by K-M curve and prognostic factors were analyzed by COX model.ResultsThere were no differences between the two groups in age, white blood cell at the diagnostic stage, and treatment responses at 4 time points, namely, prednisone good response on day 8, M3 status of BM on D15, and the minimal residual disease (MRD) more than 1.0×10-3on day 33 and 12th week. During the follow-up period, the relapse rate was lower in the positive group than that in the negative group (14/99 vs 69/329), the mortality rate of the negative group was twice of that in the positive group (55/329 vs 8/99). The fi ve-year overall survival (OS) rate, relapse-free survival (RFS) rate and event-free survival (EFS) rate of the positive group were (86.1 ± 4.9)%, (80.7 ± 5.1)% and (78.9 ± 5.1)%, respectively, and (79 ±2.8)%, (72± 3.1)%, and (69.6+ 3.1)% for the negative group as well. COX regression analysis indicated that relapse and MRD level at the 12thweekwere independent prognostic factors on OS, RFS, and EFS (P<0.05) for the two groups.ConclusionsTEL/AML1 fusion gene could be regarded as a relatively good indicator of risks in ALL children treated by CCLG-ALL-2008 protocol. ALL patients with TEL/AML1 are recommended to receive more intensive therapy including hematopoietic stem cell transplantation when the patients were high level of MRD on the 12thweek after treatment.
acute lymphoblastic leukemia; CCLG-ALL-2008 protocol; TEL/AML1 fusion gene; overall survival; relapse free survival; event-free survival; child
10.3969/j.issn.1000-3606.2017.05.002
2016-09-30)
(本文编辑:梁 华)
国家自然科学基金项目(No.NSCF81170513和81370627);江苏省重点专病项目(No.BL2013014);苏州市儿童白血病重点实验室(No.LCZX201507);苏州市小儿内科临床医学中心(No.SZZX201504);苏州市临床重点专病(No.SZS201615)
胡绍燕 电子信箱:hsy139@126.com;肖佩芳 电子信箱:xpfdr@163.com

