茶树越冬芽在休眠与萌发时期的物质交流变化及其分子调控
唐 湖 郝心愿 王 璐 肖 斌 王新超,* 杨亚军,,*
茶树越冬芽在休眠与萌发时期的物质交流变化及其分子调控
唐 湖1,2,**郝心愿2,**王 璐2肖 斌1王新超2,*杨亚军1,2,*
1西北农林科技大学园艺学院, 陕西杨凌712100;2中国农业科学院茶叶研究所 / 国家茶树改良中心/ 农业部茶树生物学与资源利用重点实验室, 浙江杭州310008
为揭示不同萌发物候型茶树的休眠机制, 以特早生茶树品种龙井43和中生茶树品种碧云为材料, 利用钙黄素处理茶树茎段, 检测越冬芽在休眠与萌发时期与其他器官的物质交流情况。利用同源比对鉴定胼胝质水解相关基因, 并分析其序列特征及在冬季不同时期的表达模式。结果表明, 越冬芽在茶树生长阶段和休眠阶段都存在着与着生茎段和母叶间的物质交流; 从茶树越冬芽休眠形成到解除的不同时期, 其物质交流存在“强-弱-强”的变化规律, 但龙井43的与碧云相比存在较短的物质交流减弱时期; 两种茶树的物质交流变化模式与鉴定到的茶树胼胝质水解正向调控相关基因的表达模式密切相关; 启动子序列分析进一步证实启动子区有多个与激素信号以及低温和休眠响应相关转录因子结合的保守序列。茶树越冬芽在休眠和非休眠状态下都存在与茎和母叶之间的物质交流, 且物质交流强弱与茶树越冬芽休眠状态改变密切相关。可能是参与胼胝质水解调控, 改变茶树越冬芽物质交流水平, 进而影响茶树休眠状态的关键基因。这对明确茶树越冬芽休眠状态变化和深入揭示不同萌发物候型茶树休眠机理有重要意义。
茶树; 越冬芽休眠; 物质交流; 钙黄素
植物特别是多年生植物的整个生命周期中, 常常会遭遇恶劣环境条件, 植物的活跃生长器官或组织进入休眠状态来增加对逆境的抵御能力, 安全度过不利的时期, 并在环境适宜时解除休眠, 重新恢复生长。休眠是指含有分生组织的植物结构可见生长的暂时停止[1]。芽休眠是多年生木本植物最为常见的休眠方式, 其影响因素主要分为环境因素和生理因素; 包括日照、温度、水分、激素、糖、胼胝质的形成等[2]。在植物休眠与解除休眠过程中, 涉及到芽及其生长部位以及其他器官之间的物质交流, 包括水分、营养物质、植物激素及生长调节物质等等[1]。也有研究表明, 在植物休眠与解除休眠过程中, 物质运输的畅阻也相应变化[3-4]。van der Schoot和Rinne[5]发现, 糖作为信号和营养物质, 会从叶片运输到芽, 影响芽休眠的形成和解除。胞间连丝是细胞间物质交流的通道, 胼胝质的形成和消解则是调控胞间连丝开闭的重要途径[6]。Rinne等[7-8]证实芽从休眠解除到处于可增生的活跃状态是与1,3-b-D-葡聚糖在胞间连丝的活动密不可分的。在植物芽休眠的不同阶段, 休眠芽与其他器官的物质交流状态会发生明显的变化, Rinne等[8]据此将芽休眠分为3个时期。活跃期, 细胞间信号与物质交流强度大; 休眠期, 胞间连丝被胼胝质填充而关闭共质体途径, 交流被阻; 休眠解除期, 胼胝质从胞间连丝括约肌和通道撤离, 共质体组织活性恢复。
茶树作为叶用为主的经济林木, 其芽叶的生长与休止, 不仅关系到其对环境的适应, 且关系到其经济价值[9], 因此, 研究茶树芽休眠形成与解除的机制具有重要的意义。前人对于茶树越冬芽的研究, 主要集中在外界环境和激素动态变化及相应分子机制上。如钱利生等[10]、黄亚辉等[11]和禹利君等[12]研究了茶树内源激素GA3、ABA、IAA、ZT等对茶树芽休眠和萌发的影响。王新超等[13-15]通过分子手段研究了相应的分子机理, 如构建茶树休眠芽与萌动芽的正、反向抑制消减杂交文库, 克隆细胞周期蛋白基因()、细胞周期素依赖激酶基因()等, 并分析它们在不同休眠阶段的表达变化和表达, 初步揭示了茶树越冬芽休眠与解除的分子机理。但是在茶树休眠形成和解除过程中, 对越冬芽如何与其他器官进行物质和信号交流的研究鲜有报道。另外, 茶树为常绿木本植物, 冬季休眠阶段成熟老叶并不脱落。成熟叶片中的物质成分是否会影响相邻腋芽的休眠仍未可知。
为明确冬季不同阶段茶树越冬芽与其他器官物质交流的动态变化及其分子调控机制, 本试验以不同萌发物候期茶树为研究对象, 采用钙黄素荧光法来研究茶树越冬芽在不同休眠阶段与其他器官物质交流的动态变化, 通过鉴定葡聚糖酶基因及其表达模式, 验证胼胝质在调控茶树越冬芽与其他器官物质交流中的作用, 初步揭示调控茶树越冬芽休眠形成与解除的可能机制。
1 材料与方法
1.1 试验材料
材料为20年生国家级茶树品种龙井43和碧云, 种植于中国农业科学院茶叶研究所试验茶园。其中龙井43为特早生品种, 碧云为中生品种。
1.2 样品采集
从2015年9月23日到2016年3月15日, 每间隔一段时间进行采样, 分别采集2个品种健康生长的当年生枝条, 立即带回实验室进行后继的钙黄素处理, 同时采集同一时期2个品种的顶芽, 直接投入液氮, 随后放入–80℃冰箱保存, 用于RNA提取。每次采样设3个生物学重复。
1.3 钙黄素处理及荧光观察
参考Rinne等[7]的方法, 配制0.1%钙黄素(Sigma, C0875)并于4℃避光保存。采集枝条, 剪成一叶一芽的茎段, 随后放入加有钙黄素染液的50 mL离心管中, 染液以刚淹没剪口为宜, 管口用脱脂棉封堵。将处理茎段置室温24 h。之后除去母叶, 在荧光显微镜(尼康80i)下用4倍物镜观察腋芽荧光情况, 并使用Axio Vision Rel.4.6软件照相。在照相时将钙黄素染液处理样品和对照样品一起放在显微镜下, 分别在绿光和紫外光下观察激发荧光。绿光通道下, 植物组织呈现红色自发荧光, 紫外光下, 组织内的钙黄素受激发后发出绿色荧光。
每个品种每次采样所得茎段, 一半将茎底端没入钙黄素染液, 用于检测“茎-芽”的物质交流情况; 一半剪掉一半叶片后, 将叶片剪口端没入染液, 检测“叶-芽”的物质交流情况。每种处理设3个生物学重复, 每个生物学重复至少处理5个茎段。以清水处理为对照。
1.4 胼胝质水解相关基因的鉴定及序列分析
依据拟南芥及杨树糖基水解酶17家族(Glycosyl hydrolase family 17)序列信息(https://www.arabidopsis. org/)[16-17], 通过与本实验室建立的茶树核酸序列数据库进行同源比对, 筛选目的基因。利用MEGA5建立基因编码蛋白的系统发育树; 并利用Plant PAN2.0预测基因启动子区可能的转录因子结合序列(http://plantpan2.itps.ncku.edu.tw/)。
1.5 RNA提取及qRT-PCR检测
采用CTAB法[18]提取总RNA。分别利用NanoDrop ND-100微量核酸蛋白测定仪(Pittsburgh, PA, USA)和1.0%琼脂糖凝胶电泳检测RNA浓度和完整性。取每个样品5mg总RNA用于cDNA合成。cDNA采用SuperScript III第一链合成系统(Invitrogen, CA, USA)合成, 用超纯水稀释获得产物20倍后作为qRT-PCR检测模板。利用PrimerSelect (Lasergene 8, DNASTAR) 进行的qRT-PCR引物设计(FP: 5¢-TGGTGGTGGTTCGGTTATTATT CTGC-3¢, RP: 5¢-GGATCGCCGGCCTATTCACTCG -3¢),作为内参基因[19]。在ABI PRISM7500实时定量PCR仪上进行qPCR, 反应条件为95℃预变性5 min; 95℃ 5 s, 62℃ 34 s, 40个循环。反应体系为10mL, 含5mLSYBR Green Master Mix+0.5mL FP引物+0.5mL RP引物+4mL cDNA模板。每个反应3个技术重复。采用2–ΔΔCT法分析, GraphPad Prism 5绘图。
2 结果与分析
2.1 茶树“茎-芽”与“叶-芽”的物质交流
从图1可以看出, 2个品种在2个不同时期(活跃/休眠), “茎-芽”与“叶-芽”的都存在着一定程度的物质交流, 只是物质交流的强度不同, 在休眠阶段, 无论是“茎-芽”还是“叶-芽”, 荧光反应较弱, 表明休眠时茶树芽与母叶以及着生部位节间的物质交流不太活跃。而进入活跃生长期后, “茎-芽”和“叶-芽”的荧光强度明显增强, 说明此时芽与母叶以及节间活跃的物质交流为芽的生长提供了必要的物质营养。
“茎-芽”处理越冬芽, A和B为活跃生长期(2015-10-31)样品, E和F为休眠期(2016-01-16)样品; “叶-芽”处理越冬芽, C和D为活跃生长期(2015-10-31)样品, G和H为休眠期(2016-01-16)样品。4倍物镜观察, 绿色荧光为钙黄素在紫外光激发下的荧光信号, 红色荧光为越冬芽在绿光通道下的自发荧光。CTB: 钙黄素处理; CK: 水处理对照。
In stem to bud treatment, samples A and B were active-growing buds (2015-10-31) and samples E and F were dormant buds (2016-01-16). In leaf to bud treatment, samples C and D were active-growing buds (2015-10-31) and samples G and H were dormant buds (2016-01-16). Pictures were taken under 4´objective lens. The green signals show fluorescence produced by calcein under UV light stimulation and the red signals show autofluorescence of bud under green light stimulation. CTB: calcein treatment; CK: control (H2O).
2.2 冬季不同时期的茶树越冬芽与其他器官物质交流动态变化
从图2看出, 在10月底到11月初, 茶树芽感知外界信号的变化, 生长发育逐渐从活跃转入休眠状态, 物质交流的强度由强变弱。随着时间的推移, 芽的休眠程度加深, 进入了深度休眠状态, 此时的荧光反应强度很弱, 说明物质交流极不活跃。进入第2年春季以后, 随着气温回升和光照时间增加, 芽的生长发育也逐渐恢复, 荧光强度逐渐增加, 说明芽与着生部位之间的物质交流强度提高, 为芽的萌发提供足够的营养物质。
中生种碧云和特早生种龙井43春季萌发物候期存在明显差异。虽然二者在冬季休眠形成到第2年春季萌发过程中, 越冬芽与其他器官物质交流都存在“强-弱-强”的变化规律, 但是二者越冬芽与其他器官物质交流强弱变化的时间和程度都存在明显的不同。其中, 龙井43腋芽的荧光信号在12月份开始逐渐减弱, 1月份最弱, 2月初开始迅速加强; 而碧云处理腋芽的荧光信号在11月份开始减弱, 1月份和2月初最弱, 且荧光强度明显弱于龙井43同时期腋芽, 2月底才逐渐加强。物质交流变化的差异可能是影响茶树春季萌发早晚的重要因素, 是反映越冬芽休眠状态的重要指标。
2.3 葡聚糖酶基因的鉴定及表达分析
通过同源比对, 从茶树核酸序列数据库中筛选了一条β-1,3-葡聚糖酶同源基因, 命名为茶树β-1,3-葡聚糖酶基因1 (β-1,3-glucanase gene 1,), 基因序列已上传至GenBank (KX982263)。因葡聚糖酶基因家族成员较多, 不同亚家族的基因成员的功能不同。为鉴定基因可能的功能, 利用该基因编码氨基端序列, 与拟南芥葡聚糖酶基因家族成员及杨树中已经鉴定出的葡聚糖酶同源基因编码蛋白一起构建了系统发育树(图4)。结果显示CsGLU1为α亚家族成员, 与拟南芥中的AT5G42100.1蛋白同源性较高, 与杨树中鉴定的GH17-33和GH17-65的同源性最高。为分析基因可能的调控因子, 对该基因启动子区1500 bp长度序列中的转录因子结合序列进行了分析(表1)。结果显示, 该基因的启动子区有密集的转录因子结合序列分布, 可以被多种转录因子调控, 如bZIP、bHLH、dehydrin、AP2/ERF、Myb、B3/ARF/RAV、ARR、MADS/MIKC、WRKY及Homeodomain等。
为明确基因表达与物质交流变化的关系, 检测了基因在2个品种冬季不同时期的表达模式(图4)。在龙井4中,表达水平在12月底前存在波动, 之后持续降低, 在第2年1月达到最低, 在3月初迅速上调。在碧云中,表达自11月底迅速下调, 在12月中旬至第2年2月都保持较低的水平, 在3月初逐渐升高, 但是升高速率较慢。总之, 该基因在2个茶树品种中都有一个表达水平较低的时期。我们将前面物质交流检测中, 越冬芽与其他器官物质交流减弱的时期在图4中标出后, 发现基因表达显著下调的时期与物质交流减弱的时期几乎完全吻合。
3 讨论
茶树芽的休眠与解除是一个复杂的生理过程, 涉及基因表达、物质代谢等变化, 同时受到多种内外因素影响, 且与物质的交流密切相关。Jian等[20]通过研究杨树休眠芽细胞壁中胞间连丝的收缩和阻断探索休眠时的物质交流情况; 刘芳等[21]研究细叶百合鳞茎打破休眠时的形态及茎尖细胞超微结构的变化发现, 当休眠解除时, 胞间连丝变粗, 细胞新陈代谢加强, 胞间物质交流经多种途径重新建立; Ruonala等[22]进一步表明杨树侧芽与茎之间的物质交流对于茎生长和进入休眠有重要作用。本试验证实, 茶树越冬芽的生长状态与其他器官的物质交流水平密切相关。每年1~2月份为一年中温度最低的时期, 此时茶树处于深休眠时期, 芽与其他器官物质交流明显减弱。当休眠芽与其他器官物质交流加强后, 茶树开始萌动。而且茶树休眠及活跃生长阶段, “茎-芽”、“叶-芽”之间的物质交流并无差异, 作为常绿木本植物, 母叶对腋芽休眠的影响还有待进一步研究。
Rinne等[7]用赤霉素处理杨树休眠芽, 发现有解除休眠的作用。通过进一步的钙黄素处理和组织学观察发现, 在用赤霉素处理休眠芽后, 休眠芽与其他器官的物质交流的通道被打开, 胞间的胼胝质被水解。说明胞间胼胝质的形成和水解是调控植物芽休眠形成和解除的重要机制。近来, Rinne等[17]证实β-1,3-葡聚糖酶基因是响应赤霉素信号的下游基因。β-1,3-葡聚糖酶是一个复杂的多基因家族, 参与抗病、细胞壁结构重塑等多种生理和发育过程, 具有水解胼胝质的活性[16]。拟南芥中被鉴定的葡聚糖酶基因有50个, 被分为α、β和γ亚家族。该基因家族成员都含有一个N端信号肽和一个糖基水解酶17家族的保守域, 只有α亚家族成员可以定位到胞间连丝[23]。在杨树中已鉴定到的葡聚糖酶基因约100个, α和γ亚家族成员都可以定位到胞间连丝[24]。但是在赤霉素信号诱导下, α亚家族基因表达会被显著上调, 相反γ亚家族基因表达被显著下调[17]。Nagar等[25]检测了茶树多种内源激素从休眠形成到休眠解除过程中的含量变化, 结果表明自由态的赤霉素浓度在茶树休眠形成和深休眠阶段都处于较低的水平,而在休眠解除前快速升高。本研究中鉴定到的β-1,3-葡聚糖酶基因为α亚家族基因, 在赤霉素信号诱导下应上调表达[17]。表达结果显示, 该基因在茶树越冬芽休眠解除阶段表达显著上调。表明该基因可能通过改变胞间连丝周围胼胝质的水解速率来调控越冬芽与其他器官的物质交流通道, 进而影响茶树越冬芽休眠的解除。
采样日期为2015-10-31 (A和B)、2015-11-16 (C和D)、2015-12-17 (E和F)、2016-01-06 (G和H)、2016-02-02 (I和J)、2016-02-25 (K和L)及2016-03-09 (M和N)。4倍物镜观察, 绿色荧光为钙黄素在紫外光激发下的荧光信号, 红色荧光为越冬芽在绿光通道下的自发荧光。CTB: 钙黄素处理; CK: 水处理对照。
The sampling dates were 2015-10-31 (A and B), 2015-11-16 (C and D), 2015-12-17 (E and F), 2016-01-06 (G and H), 2016-02-02 (I and J), 2016-02-25 (K and L), and 2016-03-09 (M and N). Pictures were taken under 4´objective lens. The green signals show fluorescence produced by calcein under UV light stimulation and the red signals show autofluorescence of bud under green light stimulation. CTB: calcein treatment; CK: control (H2O).
蓝色、红色和紫色字体分别显示α、β和γ亚家族基因。■拟南芥葡聚糖酶基因家族; ▼杨树葡聚糖酶基因家族; ●茶树CsGUL1。
α-, β-, and γ-clade genes are in blue, red, and purple font, respectively. ■ Genes from; ▼ Genes from; ● CsGLU1.
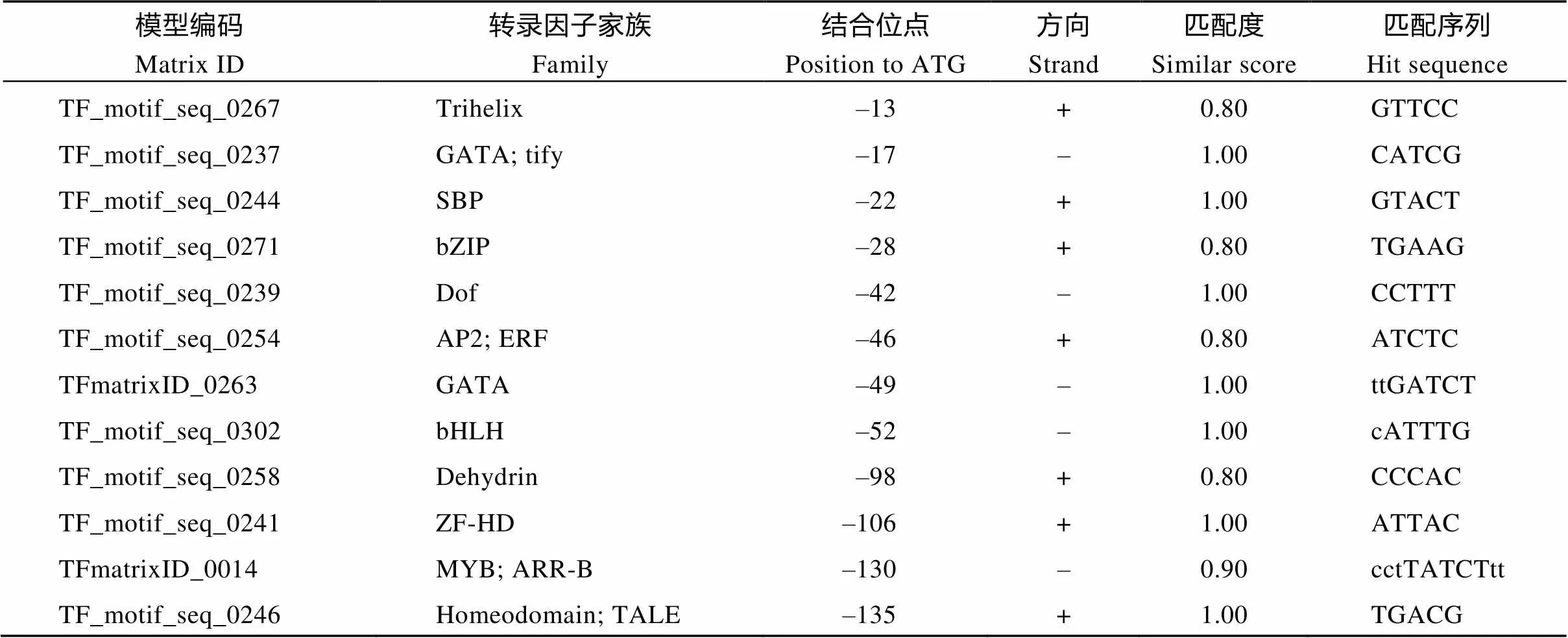
表1 CsGLU1启动子区转录因子结合位点信息
(续表1)

模型编码Matrix ID转录因子家族Family结合位点Position to ATG方向Strand匹配度Similar score匹配序列Hit sequence TF_motif_seq_0255AP2; RAV; B3–138–1.00TGTTG TFmatrixID_0461WRKY–140–0.98aatgTTGACg TFmatrixID_0154AT-Hook–189+1.00aAAATAat TFmatrixID_0099Myb/SANT; trp; MYB–199+0.87agcTCAGCcca TFmatrixID_0508MADS box; MIKC–225+0.88cCAAAAtagca TF_motif_seq_0252Myb/SANT; MYB; ARR-B–244+1.00GGATT TFmatrixID_0051LOB; LBD–248+0.96atCCGGAttc TFmatrixID_0486Myb/SANT; ARR-B–250–1.00AGATCcgg TFmatrixID_0156B3; ARF–259+0.96tgCGACAga TFmatrixID_0605B3–503–0.86aaaTACACgg TFmatrixID_0047bZIP; Homeodomain; HD-ZIP–670+0.92ccaATTATta TFmatrixID_0392NAC; NAM–713–1.00gatcACGCAa TFmatrixID_0302Homeodomain–763–0.98gGACTAagct TF_motif_seq_0251TCP–826+1.00GCCCG TF_motif_seq_0072HD-ZIP–835–0.82gcaatgAATGC TFmatrixID_0089AP2;B3;RAV–974+0.96cggCAACAggat TF_motif_seq_0331TCP–1023+1.00tCGGGT TFmatrixID_0283Homeodomain; HD-ZIP–1072+0.96aggTGATTga TFmatrixID_0589MYB–1090–0.93ggtTGGTTca TFmatrixID_0495BES1–1109–0.97cggacACGTGgcgc TFmatrixID_0636C2H2–1116+0.94atCAGCTcgg TFmatrixID_0050Myb/SANT; MYB;G2-like–1225+0.92gacTATTCtc TFmatrixID_0359Myb/SANT; G2-like–1285+0.99caaGAATCtt TFmatrixID_0057AP2; RAV–1303+0.94aCAACAtt TFmatrixID_0256EIN3; EIL–1358–0.99cgaTGCATga
的表达模式分析表明, 该基因的表达水平与茶树越冬芽与其他器官物质交流的强弱变化密切相关, 而且在不同萌发物候期的茶树品种中的表达模式不同。该试验结果不但揭示了胼胝质在调控物质交流中的重要作用, 同时对于快速鉴定茶树越冬芽休眠状态有重要意义。为进一步了解该基因可能的调控机制, 我们分析了该基因的启动子序列。结果发现在该基因启动子区有多种转录因子结合序列, 这些转录因子家族基因参与植物多种的激素反应、抗逆及生理发育过程。在茶树抗寒研究中已证实, bZIP基因家族部分成员参与茶树低温响应的调控[26]。激素及脱水蛋白等相关基因在茶树冷驯化过程中存在显著表达差异[27]。生长素调控相关的ARF家族基因也参与了茶树的休眠调控[28]。MADS家族的基因被认为是参与植物休眠调控的关键基因[2, 29]。推测基因可能是茶树休眠调控的下游基因, 受多个休眠相关的信号途径共同调控。植物休眠是受光周期、温度等多种环境因素共同作用的结果, 多种激素及光周期、温度感受基因参与这一过程[2]。对单个信号的研究很难检测植物的休眠状态, 深入研究基因的作用机制, 对于准确鉴定越冬芽的休眠状态有重要的指导意义。
4 结论
茶树芽与茎及其母叶都有着相似强度的的物质交流; 茶树芽从活跃期到休眠再到活跃时的生长状态可以通过荧光反应的强弱来反映; 2个茶树品种休眠解除时间及休眠期的长短与越冬芽物质交流强弱密切相关。茶树基因是参与胼胝质水解正向调控的基因, 其冬季不同时期的表达模式与物质交流强弱变化存在一致性。胼胝质水解调控可能是影响物质交流变化的必要机制。
References
[1] Ruttink T, Arend M, Morreel K, Storme V, Rombaut sS, Fromm J, Bhalerao R, Boerjan W, Rohde A. A molecular timetable for apical bud formation and dormancy induction in poplar., 2007, 19: 2370–2390
在本次调查期间,参与口语报告检测的学生共有45名,其中学习质量相对较好、学习质量中等、学困生各15名。
[2] Cooke J E, Eriksson M E, Junttila O. The dynamic nature of bud dormancy in trees: environmental control and molecular mechanisms., 2012, 35: 1707–1728
[3] Rinne P L, van der Schoot C. Symplasmic fields in the tunica of the shoot apical meristem coordinate morphogenetic events., 1998. 125: 1477–1485
[4] Nathalie D, Annika J, Baba K, Schrader J, Sjödin A, Bhalerao R R, Resman L, Trygg J, Moritz T, Bhalerao R P. Environmental and hormonal regulation of the activity–dormancy cycle in the cambial meristem involves stage-specific modulation of transcriptional and metabolic networks., 2007, 50: 557–573
[5] van der Schoot C, Rinne P L. Dormancy cycling at the shoot apical meristem: transitioning between self-organization and self-arrest., 2011, 180: 120–131
[6] Low H P, Gréco B, Tanahashi Y, Gallant J, Jones S N, Billings- Gagliardi S, Recht L D, Schwartz W J. Plasmodesmata at the crossroads between development, dormancy, and defense., 2004, 81: 1182–1197
[7] Rinne P L, Welling A, Vahala J, Ripel L, Ruonala R, Kangasjarvi J, van der Schoot C. Chilling of dormant buds hyperinduces FLOWERING LOCUS T and recruits GA-inducible 1, 3-beta-glucanases to reopen signal conduits and release dormancy in., 2011, 23: 130–146
[8] Rinne P L, Kaikuranta P M, van der Schoot C. The shoot apical meristem restores its symplasmic organization during chilling- induced release from dormancy., 2001, 26: 249–264
[9] 晏嫦妤, 李家贤, 黄华林, 何雨媚. 茶树休眠的研究进展. 安徽农业科学, 2012, 40: 10387–10389 Yan C Y, Li J X, Huang H L, He Y M. Research progress of tea plant dormancy., 2012, 40: 10387–10389 (in Chinese with English abstract)
[11] 黄亚辉, 粟本文, 郑红发, 曾贞, 刘霞林. 茶树春梢萌动期间内源激素含量的变化. 植物生理学通讯, 2001, 37: 306–307 Huang Y H, Su B W, Zheng H F, Zeng Z, Liu X L. Changes of endohormone in prouting shoot of tea plant., 2001, 37: 306–307 (in Chinese with English abstract)
[12] 禹利君, 史云峰, 肖海云, 刘富知, 刘仲华. 不同物候型茶树内源GA3和ABA的变化及其对腋芽萌发调控的影响. 作物学报, 2008, 34: 277–283 Yu L J, Shi Y F, Xiao H Y, Liu F Z, Liu Z H. Dynamic changes of endogenous GA3and ABA contents in tea culticars with different phenological characters and their impact on the regulation axillary buds sprouting., 2008, 34: 277–283 (in Chinese with English abstract)
[13] Wang X, Hao X, Ma C, Cao H, Yue C, Wang L, Zeng J, Yang Y. Identification of differential gene expression profiles between winter dormant and sprouting axillary buds in tea plant () by suppression subtractive hybridization., 2014, 10: 1149–1159
[14] 王新超, 杨亚军, 马春雷, 金基强, 曹红利. 茶树细胞周期蛋白基因的克隆与表达. 西北植物学报, 2011, 31: 2365–2372 Wang X C, Yang Y J, Ma C L, Jin J Q, Cao H L. Cloning and expression analysis of cyclin gene () of tea plant., 2011, 31: 2365–2372 (in Chinese with English abstract)
[15] 王新超, 马春雷, 杨亚军, 金基强, 马建强, 曹红利. 茶树细胞周期蛋白依赖激酶()基因cDNA全长克隆与分析. 园艺学报, 2012, 39: 333–342 Wang X C, Ma C L, Yang Y J, Jin J Q, Ma J Q, Cao H L. cDNA cloning and expression analysis of cyclin-dependent kinase () gene in tea plant., 2012, 39: 333–342 (in Chinese with English abstract)
[16] Doxey A C, Yaish M W, Moffatt B A, Griffith M, McConkey B J. Functional divergence in thebeta-1,3-glucanase gene family inferred by phylogenetic reconstruction of expression states., 2007, 24: 1045–1055
[17] Rinne P L, Paul L K, Vahala J, Kangasjarvi J, van der Schoot C. Axillary buds are dwarfed shoots that tightly regulate GA pathway and GA-inducible 1,3-beta-glucanase genes during branching in hybrid aspen., 2016, 67: 5975–5991
[18] Chang S, Puryear J, Cairney J. A simple and efficient method for isolating RNA from pine trees., 1993, 11: 113–116
[19] Hao X, Horvath D P, Chao W S, Yang Y, Wang X, Xiao B. Identification and evaluation of reliable reference genes for quantitative real-time PCR analysis in tea plant ((L.) O. Kuntze)., 2014, 15: 22155–22172
[20] Jian L C, Li P H, Sun L H, Chen T H H. Alterations in ultrastructure and subcellular localization of Ca2+in poplar apical bud cells during the induction of dormancy., 1997, 48: 1195–1207
[21] 刘芳, 王家艳, 王晓丽, 周蕴薇. 细叶百合鳞茎在低温解除休眠过程中茎尖细胞超微结构的变化. 园艺学报, 2013, 40: 1110–1118 Liu F, Wang J Y, Wang X L, Zhou Y W. The apical bud cell ultra-structure changes ofbulbs during breaking dormancy under refrigerated condition., 2013, 40: 1110–1118 (in Chinese with English abstract)
[22] Ruonala R, Rinne P L, Kangasjärvi J, van der Schoot C.expression in the rib meristem affects stem elongation and the transition to dormancy in., 2008, 20: 59–74
[23] Knox J P, Benitez-Alfonso Y. Roles and regulation of plant cell walls surrounding plasmodesmata., 2014, 22: 93–100
[24] Paul L K, Rinne P L, van der Schoot C. Refurbishing the plasmodesmal chamber: a role for lipid bodies?, 2014. 5: 40
[25] Nagar P K, Kumar A. Changes in endogenous gibberellin activity during winter dormancy in tea ((L.) O. Kuntze)., 2000, 22: 439–443
[26] Cao H, Wang L, Yue C, Hao X, Wang X, Yang Y. Isolation and expression analysis of 18genes implicated in abiotic stress responses in the tea plant ()., 2015, 97: 432–442
[27] Wang X C, Zhao Q Y, Ma C L, Zhang Z H, Cao H L, Kong Y M, Yue C, Hao X Y, Chen L, Ma J Q, Jin J Q, Li X, Yang Y J. Global transcriptome profiles ofduring cold acclimation., 2013, 14: 415
[28] 郝心愿, 曹红利, 杨亚军, 王新超, 马春雷, 肖斌. 茶树生长素响应因子基因的克隆与表达分析. 作物学报, 2013, 39: 389–397 Hao H X, Cao C H, Yang Y J, Wang X C, Ma C L, Xiao B. Cloning and expression analysis of auxin response factor gene () in tea plant ([L.] O. Kuntze)., 2013, 39: 389–397 (in Chinese with English abstract)
[29] Jimenez S, Lawton-Rauh A L, Reighard G L, Abbott A G, Bielenberg D G. Phylogenetic analysis and molecular evolution of the dormancy associated MADS-box genes from peach., 2009, 9: 81
Molecular Regulation and Substance Exchange Dynamics at Dormancy and Budbreak Stages in Overwintering Buds of Tea Plant
TANG Hu1,2,**, HAO Xin-Yuan2,**, WANG Lu2, XIAO Bin1, WANG Xin-Chao2,*, and YANG Ya-Jun1,2,*
1College of Horticulture, Northwest A&F University, Yangling 712100, China;2Tea Research Institute, Chinese Academy of Agricultural Sciences / National Center for Tea Improvement / Key Laboratory of Tea Plant Biology and Resources Utilization, Ministry of Agriculture, Hangzhou 310008, China
Early-sprouting cultivar Longjing 43 and late-sprouting cultivar Biyun were employed in this study to disclose the dormancy mechanism in tea plant with different sprouting phenophases. The levels of substance exchange were monitored by detecting the fluorescence signal in calcein treated overwintering buds. The glucanase related genes were identified by sequence homology analysis. Their characteristics and expression patterns during different time of winter were further analyzed. The substance exchanges were detected either in stem-bud unit or mother leaf-stem unit. From the initial formation to release in dormancy, the substance exchange in overwintering buds showed strong-weak-strong variation patterns in both cultivars, however, the duration of weak exchange stage was much shorter in Longjing 43 than in Biyun. Moreover, there was a close correlation between substance exchange variation pattern and the expression pattern of, a gene identified in tea plant with positive callose hydrolyzation activity. On the basis of promoter sequence analysis, plenty of transcription factor binding sequences related to hormone signaling, cold stimulation and dormancy regulation were found inpromoter region, which validates its putative functions in dormancy regulation. In conclusion, overwintering buds of tea plant have substance exchange with stem and mother leaf both in dormancy and non-dormancy status, furthermore, the variation of substance exchange level was consistent to the changes of dormancy status.is a callose hydrolyzation related gene, which is supposed to be a key gene regulating tea plant dormancy transition through affecting the substance exchange in overwintering buds. The study provides meaningful results for understanding the changes of dormancy statuses in overwintering buds and deeply exploring the regulation mechanism in tea plant with different sprouting phenophase.
Tea plant; Overwinter bud dormancy; Substances exchange; Calcein
10.3724/SP.J.1006.2017.00669
本研究由国家自然科学基金项目(31370690), 国家现代农业产业技术体系建设专项(CARS-23)和中国农业科学院农业科技创新工程(CAAS-ASTIP-2014-TRICAAS)资助。
This study was supported by the National Natural Science Foundation of China (31370690), the China Agriculture Research System (CARS-23), and the Agricultural Science and Technology Innovation Program of CAAS (CAAS-ASTIP-2014-TRICAAS).
(Corresponding authors): 王新超, E-mail: xcw75@tricaas.com, Tel: 0571-86653162 ; 杨亚军: Email: yjyang@tricaas.com
唐湖, E-mail: tanghu@tricaas.com; 郝心愿, E-mail: haoxy@tricaas.com, Tel: 0571-86653162
**同等贡献(Contributed equally to this work)
(收稿日期): 2016-10-17; Accepted(接受日期): 2017-01-21; Published online(网络出版日期): 2017-02-17.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20170217.1020.030.html

