夷陵黄牛mtDNA D-loop区遗传多样性研究
夏小婷,贾 媛,赵 明,熊 雄,党瑞华,蓝贤勇,黄永震,陈 宏,雷初朝*
(1.西北农林科技大学 动物科技学院,陕西 杨凌 712100;2. 宜昌市动物疫病预防控制中心,湖北 宜昌 443000;3. 宜昌市畜牧技术推广站,湖北 宜昌 443000)
夷陵黄牛mtDNA D-loop区遗传多样性研究
夏小婷1,贾 媛1,赵 明2,熊 雄3,党瑞华1,蓝贤勇1,黄永震1,陈 宏1,雷初朝1*
(1.西北农林科技大学 动物科技学院,陕西 杨凌 712100;2. 宜昌市动物疫病预防控制中心,湖北 宜昌 443000;3. 宜昌市畜牧技术推广站,湖北 宜昌 443000)
【目的】为了探究夷陵黄牛的母系起源与遗传多样性。【方法】采用PCR扩增、测序及生物信息学方法。【结果】在27头夷陵黄牛mtDNA D-loop区共检测到54个变异位点,界定了13个mtDNA单倍型,单倍型多样度为0.7720,平均核苷酸多样度为0.0228,表明夷陵黄牛具有比较丰富的遗传多样性。构建的系统发育树显示夷陵黄牛具有普通牛和瘤牛两大母系起源。【结论】夷陵黄牛受瘤牛的影响大,属于中国南方黄牛,具有普通牛与瘤牛的种质特征。
夷陵黄牛;mtDNA D-loop;遗传多样性;起源
牛的驯化进程促进了人类农业社会历史的发展。中国黄牛根据体态特征可分为有峰、低峰、无峰三种,按照地理分布分为北方的蒙古组(北方黄牛)、黄河中下游和淮河流域的黄淮组(中原黄牛)、南方长江和珠江流域的长珠组(南方黄牛)三组[1,2]。目前,对我国地方黄牛品种的起源、进化和遗传多样性,国内外已经做了大量的研究工作,在Y染色体分子遗传多态性[3,4]、血液蛋白多态性[5]及线粒体DNA限制性片段长度多态性(mtDNA RFLP)[1]等多个层面的研究结果均支持我国黄牛多元起源的观点,普通牛(Bos taurus)主要影响北方黄牛,瘤牛(Bos indicus)由南向北主要影响南方黄牛,而中原地区的黄牛同时受到普通牛和瘤牛的影响。
线粒体DNA控制区(D-loop区)一直是研究家畜母系遗传的热点。高等动物的线粒体DNA(mtDNA)是共价闭合的环状双链DNA分子,其遗传过程严格遵守单性母性遗传方式,且mtDNA的变异主要来源于突变而非重组,可以真实地反映家畜的母系起源,在家畜的品种起源、遗传分化和亲缘关系等方面得到了广泛的应用[6-9]。Lei等[10]对我国28个地方黄牛品种的线粒体D-loop序列进行分析,发现mtDNA在不同牛种间存在丰富的遗传多样性,揭示我国黄牛主要为普通牛和瘤牛起源。
湖北宜昌市古称夷陵,位于湖北省西南部,地处长江上游与中游交界处。夷陵黄牛是宜昌地区特有的地方黄牛群体,其形成过程可追溯到夏商时期[11]。夷陵黄牛体质粗壮,结构匀称,耐粗饲,属肉役兼用型,自古以来就是当地农业生产的主要役力。由于夷陵黄牛是近年才发现的地方黄牛群体,其遗传多样性研究未见报道。本研究对夷陵黄牛mtDNA D-loop区全序列进行分析,以探究夷陵黄牛的母系遗传多样性,为夷陵黄牛的保种和开发利用提供理论依据。
1 材料与方法
1.1 样品采集
采集27头湖北夷陵黄牛耳组织样本,用75%酒精保存,于-20℃冰箱保存备用。
1.2 基因组DNA提取及PCR扩增测序
利用酚-氯仿法提取基因组DNA。线粒体DNA D-loop全序列采用雷初朝等[13]设计的引物,正链序列为:5′- CTGCAGTCTCACCATCAACC-3′; 反链序列为:5′-GGGGTGTAGATGCTTGC-3′。PCR反应体系为20 μL,扩增条件:95℃预变性4 min;94℃变性30 s,59℃退火60 s,72℃延伸90 s,40个循环;最后72℃延伸10 min,4℃保存。采用1.0%的琼脂糖凝胶检测PCR扩增产物,将符合测序要求的PCR产物送至西安擎科泽西生物科技有限责任公司测序。
1.3 数据处理与统计分析方法
利用DNASTAR中的SeqMan程序进行同源序列比对,并进行人工校正,以确保所测序列的可靠性。用DNASP 5.0统计核苷酸多态位点、单倍型数量、单倍型多样度、核苷酸多样度、平均核苷酸差异等。用MEGA5.0软件中的Neighbor-Joining法构建系统发育树。
2 结果与分析
2.1 夷陵黄牛mtDNA D-loop区核苷酸变异与单倍型多样性
对27头夷陵黄牛D-loop区全序列的分析表明,21头黄牛 D-loop区长度为910 bp,5头黄牛D-loop区长度为911 bp,1头黄牛D-loop区长度为912 bp,这是由于D-loop区存在碱基的插入与缺失引起的。共发现27头夷陵黄牛D-loop区全序列的变异位点为54个,占核苷酸总数的5.93%,其中转换53个(C/T转换33个,A/G转换20个),颠换1个(C/G颠换)。A、T、C、G的含量分别为33.3%、28.3%、24.8%、13.6%,C+G平均含量为38.4%。利用DNASP 5.0软件比对分析27头夷陵黄牛mtDNA D-loop序列,共发现13种单倍型(图1),其中7个属于普通牛单倍型,6个属于瘤牛单倍型。在这13个单倍型中,有13个个体属于YL2单倍型,占48.1%。平均核苷酸差异(k)为20.6895,单倍型多样度(Hd)为0.7720,平均核苷酸多样度(Pi)为0.0228。根据Tajima's D值1.8162(P>0.05)可知,所有的变异在进化过程中均遵循中性进化模型。

图1 夷陵黄牛13个mtDNA D-loop单倍型及其多态位点
参考Loftus等[6]发表的瘤牛序列(No. L27733)定义变异类型。
“.”代表与第一条序列相同,“*”代表碱基的插入/缺失。
2.2 夷陵黄牛系统发育树的构建
为了研究各单倍型间的系统发生关系,根据GenBank发布的欧洲普通牛(No.V00654)和印度瘤牛(No.L27733)作为参考序列,用MEGA5.0软件对夷陵黄牛的13个单倍型构建邻接树(图2)。结果表明,夷陵黄牛明显分为普通牛和瘤牛两大分支,说明夷陵黄牛是普通牛和瘤牛的混合母系起源。
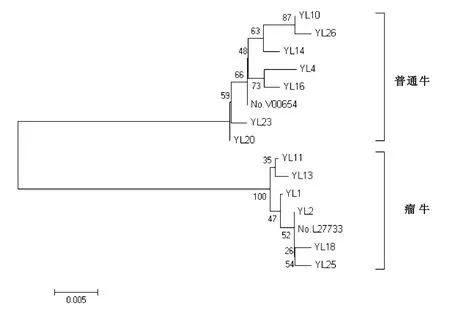
图2 基于夷陵黄牛13个mtDNA D-loop单倍型构建的NJ系统树
3 讨论
近年来,国内有关地方黄牛品种mtDNA D-loop区序列的核苷酸变异分析的报道较多[1, 7, 8, 10, 12-19],但有关夷陵黄牛mtDNA D-loop区序列遗传多样性研究尚属空白。本研究通过对夷陵黄牛27个个体mtDNA D-loop区910-912 bp序列比对分析发现,碱基A、T、C、G的平均百分比为33.3%、28.3%、24.8%和13.6%,说明其富含A、T碱基;共有54个核苷酸位点发生突变,其中转换53个、颠换1个。核苷酸多样度(Pi)和单倍型多样度(Hd)是衡量群体遗传变异的重要指标。雷初朝等[12]通过分析中国8个黄牛品种mtDNA D-loop区序列的遗传多态性,发现其Pi值为0.0055~0.0539;蔡欣[17]分析中国17个黄牛品种的Pi值为0.0268。本研究发现夷陵黄牛的平均Pi值为0.0228,表明夷陵黄牛的mtDNA具有比较丰富的遗传多样性。本研究发现夷陵黄牛平均单倍型多样度为0.7720,与蔡欣[17]研究的中国17个黄牛品种的平均单倍型多样度(0.919)相比要低一些,这可能与宜昌地处环境封闭、不具备大量引进外地家畜的条件有关[11]。在27个夷陵黄牛个体中,9个普通牛起源的个体(占33.33%)共享7个单倍型,18个瘤牛起源的个体(占66.67%)共享6个单倍型,表明夷陵黄牛受瘤牛的影响更大。周艳等[18]对中国部分南方黄牛mtDNA D-loop区的研究发现,在40个黄牛个体中,14个普通牛起源的个体共享11个单倍型,26个瘤牛起源的个体共享6个单倍型,表明南方黄牛受瘤牛的影响更大。总之,本研究发现夷陵黄牛mtDNA遗传多样性比较丰富,更偏向于南方黄牛,具有普通牛和瘤牛两大母系起源,且具有普通牛与瘤牛的种质特征。
[1] Yu Y, Nie L, He Z Q, et al. Mitochondrial DNA variation in cattle of south China:origin and introgression[J]. Animal Genetics, 1999, 30(4):245-250.
[2] 陈幼春, 曹红鹤. 中国黄牛品种多样性及其保护[J]. 生物多样性, 2001, 9(3):275-283.
[3] Li R, Xie W M, Chang Z H, et al. Y chromosome diversity and paternal origin of Chinese cattle[J]. Molecular Biology Reports, 2013, 40(12):6633-6636.
[4] Li R, Zhang X M, Campana M G, et al. Paternal origins of Chinese cattle[J]. Animal Genetics, 2013, 44(4):446-449.
[5] 陈幼春. 中国黄牛生态种特征及其利用方向[M]. 北京:农业出版社, 1990.
[6] Loftus R T, MacHugh D E, Bradley D G, et al. Evidence for two independent domestications of cattle[J]. PNAS, 1994, 91(7): 2757-2761.
[7] Jia S G, Zhou Y, Lei C Z, et al. A new insight into cattle's maternal origin in six Asian countries[J]. Journal of Genetics and Genomics, 2010, 37(3):173-180.
[8] Lai S, Liu Y, Liu Y, et al. Genetic diversity and origin of Chinese cattle revealed by mtDNA D-loop sequence variation[J]. Molecular Phylogenetics Evolution, 2006, 38(1):146-154.
[9] Achilli A, Bonfiglio S, Olivieri A, et al. The multifaceted origin of taurine cattle reflected by the mitochondrial genome[J]. PLOS ONE, 2009, 4(6):e5753.
[10] Lei C Z, Chen H, Zhang H C, et al. Origin and phylogeographical structure of Chinese cattle.[J]. Animal Genetics, 2006, 37(6):579-582.
[11] 沈洪学, 朱德江, 田彦孜, 等. 夷陵黄牛品种资源调查报告(一)-夷陵黄牛形成过程的考证[J]. 中国牛业 科学, 2016, 42(4) :76-79.
[12] 雷初朝, 陈宏, 杨公社, 等. 中国部分黄牛品种mtDNA遗传多态性研究[J]. 遗传学报, 2004, 31(1):57-62.
[13] 汪琦, 钟金城, 柴志欣, 等. 三江黄牛mtDNA D-loop区遗传多样性及系统进化[J]. 西北农业学报, 2016, 25(9):1269-1278.
[14] 刘若余, 夏先林, 雷初朝, 等. 贵州黄牛mtDNA D-loop遗传多样性研究[J]. 遗传, 2006, 28(3):279-284.
[15] 张桂香, 郑友民, 王志刚, 等. 我国部分黄牛品种线粒体D-loop区遗传多样性与起源分化[J]. 遗传, 2009, 31(2):160-168.
[16] 赖松家, 刘延鑫, 李学伟, 等. 四川黄牛品种线粒体DNA遗传多样性研究[J]. 畜牧兽医学报, 2005, 36(9):887-892.
[17] 蔡欣, 陈宏, 雷初朝, 等. 中国17个黄牛品种mtDNA变异特征与多态性分析[J]. 中国生物化学与分子生物学报, 2007, 23(8):666-674.
[18] 周艳, 陈宏, 贾善刚, 等. 中国南方部分黄牛品种mtDNA D-loop区的遗传变异与分类分析[J]. 西北农林科技大学学报(自然科学版), 2008, 36(5):7-11.
[19] Cai X, Chen H, Lei C, et al. mtDNA Diversity and genetic lineages of eighteen cattle breeds from Bos taurus and Bos indicus in China[J]. Genetica, 2007, 131(2):175-183.
Genetic Diversity of Mitochondrial DNA D-oop Region in Yiling Cattle
XIA Xiao-ting1, JIA Yuan1, ZHAO Ming2, XIONG Xiong3, DANG Rui-hua1, LAN Xian-yong1, HUANG Yong-zhen1, CHEN Hong1, LEI Chu-zhao1
(1.CollegeofAnimalScienceandTechnology,NorthwestA&FUniversity,Yangling,Shaanxi712100,China; 2.AnimalDiseasePreventionandControlCenterofYichang,Yichang,Hubei443000,China; 3.PopularizationandServiceStationofAnimalScienceandTechnologyofYichang,Yichang,Hubei443000,China)
[Objective] To analyze the maternal origin and genetic diversity of Yiling cattle. [Method] Using PCR, sequencing and bioinformatics methods. [Result] The complete mitochondrial DNA D-loop sequences from 27 individuals of Yiling cattle revealed that 54 mutation sites and 13 haplotypes were found, haplotype diversity was 0.7720 and nucleotide diversity was 0.0228, showing rather abundant mitochondrial genetic diversity in Yiling cattle. Phylogenetic analysis showed that the maternal origins of Yiling cattle were fromBostaurusandBosindicus. [Conclusion] Yiling cattle, which was mainly affected byBosindicus, belongs to Southern cattle type of China, with the germplasm characteristics of bothBosTaurusandBosindicus.
Yiling cattle;mitochondrial DNA D-loop;genetic diversity;origin
2016-11-20 接收日期:2016-12-05
国家肉牛牦牛产业技术体系(CARS-38)资助。
夏小婷(1991-),女,山东威海人,硕士生,主要从事动物遗传资源研究。
*通讯作者:雷初朝(1968-),男,湖南常宁人,教授,博士生导师,主要从事牛遗传资源研究。
S823
A
1001-9111(2017)01-0004-04

