基于冠状动脉CT血管造影的支架置入前后计算血流动力学技术
徐洪增 侯阳 马跃
·新技术介绍·
基于冠状动脉CT血管造影的支架置入前后计算血流动力学技术
徐洪增 侯阳 马跃
冠状动脉CT血管造影; 支架置入
冠心病在国内发病率高。经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)呈稳定增长趋势,2014年达到500 946例[1]。PCI是一种治疗冠状动脉狭窄性心脏病的微创手术,已经在冠心病的治疗中成为常用治疗方法,被认为在高风险的冠心病患者中可以提高患者生存率[2],但是PCI在治疗稳定性冠心病方面仍难以把握。冠状动脉血流处于生物力学环境中,且冠状动脉粥样硬化好发于特殊几何构型的血管部位,均提示血流动力学对动脉粥样硬化具有重要的影响[3-4]。血管内支架作为一种微型管状结构可以改变血管三维几何结构,改善血流动力学。探讨冠状动脉粥样硬化狭窄塑形前后的血流动力学机制,并通过对血流动力学参数分布的分析,可为临床治疗提供理论依据。直接测量冠状动脉内的血流动力学效果是不理想的,但基于冠状动脉CT血管造影(CT angiography, CTA)的支架置入前后计算血流动力学技术出现,实现深入研究血流动力学因素,准确获得个体化的冠状动脉血流动力学参数,为干预粥样硬化斑块预后提供了重要依据。
基于冠状动脉CTA影像的支架置入前后计算血流动力学技术共分为三步。第一步是冠状动脉CTA图像信息采集,应用256层iCT(Philips公司)扫描图像,成像数据保存为医学数字成像和通信(digital imaging and communications in medicine,DICOM)格式,所选择序列为302帧图像,图像像素为512×512,每层图像分辨率为0.351 mm(图1A)。第二步使用三维重建软件 MIMICS(Materialise公司)进行逆向工程图像几何重构,将具有DICOM格式的冠状动脉CTA数据导入,利用软件中的图像灰度阈值分割、三维区域增长算法等功能制作冠状动脉狭窄模型(图1B)。图像编辑功能在冠状动脉狭窄部位进行管腔扩张来虚拟置入支架。置入支架后血管狭窄程度由80%~90%降为30%~40%。最终生成.stl格式的三维冠状动脉几何模型。将三维模型文件导入Geomagic Studio 2013软件模块中,进行网格文件校正裁剪,进一步经过Solidworks转换为实体文件,导入到ANSYS workbench 16.0中。经过网格划分为下一步的有限元处理做准备。网格划分采用自由网格划分中的四面体网格划分技术。图2A模型节点数为300 339,网格单元数为1 511 487;图2B模型节点数为308 487,网格单元数为1 556 401。第三步假定血液是不可压缩的牛顿流体并且是无渗透性的刚性血管,血液流动为定常、绝热层流,血液黏滞系数0.0035 Pa·s,血液密度1060 kg/m3,血液流动遵循质量、动量守恒定律:Navier-Stokes方程(1)和连续方程(2):
(1)
Δμ=0
(2)
ρ为密度,P为压力,T为应力张量,μ是速度矢量,t为时间。

图1 冠状动脉CT血管造影图像及三维几何模型构建 A:冠状动脉CT血管造影图像;B:冠状动脉几何模型构建图像
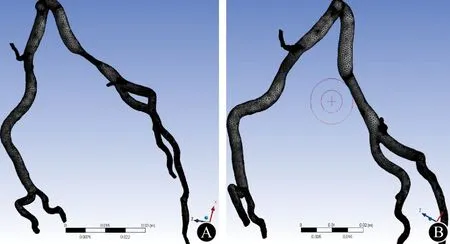
图2 左冠状动脉网格划分图像 A:冠状动脉狭窄模型网格划分;B:虚拟支架干预后网格划分
模拟软件采用ANSYS Fluent 16.0 CFD模块,边界条件设置:入口平面血液流速选择典型的静息状态下冠状动脉流速0.4 m/s[5],出口选择压力为0 N。冠状动脉血流在流动过程中要克服重力的影响,因此,在本技术中垂直方向的重力加速度设为-9.8 m/s2。设定上述边界条件与计算初始条件后,ANSYS Fluent软件进行稳态二阶运算,迭代100次后,当残差<10-4时得到收敛的解。数值模拟过程使用自组装刀片式服务器,计算机CPU配置为英特尔至强6核处理器,型号E5670,主频2.93 GHz,12 M缓存,内存配置为16 G。成功构建为个体化冠状动脉血流动力学模型后,模型计算结果包括冠状动脉内血液的管壁剪切力(wall shear stress, WSS)分布、壁面压力(wall pressure,WP)、血流速度场及血流储备分数(fractional flow reserve,FFR)。
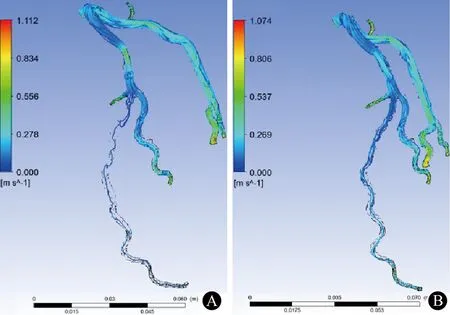
LAD,左前降支图3 左冠状动脉血流速度场 A:LAD冠状动脉狭窄模型血流场;B:支架置入LAD狭窄处后血流场
图3为左冠状动脉管腔内模拟的血流速度场示意图。通过有限元分析仿真软件的后期处理技术可以获取直观准确的瞬态速度流线,而在体有创介入手术及动物模型实验难以获取这些血流动力学参数。后处理软件根据运算自动生成速度标尺为0~1 m/s,颜色阶梯代表血流速度大小,蓝色趋向于低速,红色趋向于高速。血液沿左前降支(LAD)血管近端向远端流动过程中,在支架置入前的管腔狭窄处血流速度快,形成了一个高尖的喷射样血流速度场,其高峰流速达0.62 m/s,这个血流场严重影响了下游的血流,使得LAD远端血流大大减少。支架置入后,在冠状动脉相同的入口条件下,冠状动脉狭窄处最大血流速度降为0.36 m/s,同时LAD远端血流明显增多。
图4为血管壁面压力分布示意图。不同压力以不同色阶表示,蓝色代表低压力值,红色代表高压力值。壁面压力沿血液流动方向逐渐降低,在血管狭窄邻近区域出现高低不均一,在血管狭窄处壁面压力明显下降。支架置入后,原有血管狭窄处壁面压力相应提高,其沿着LAD远端走行处也相应下降,但趋于缓和。基于冠状动脉CTA计算出的FFR定义为冠状动脉狭窄远端压力(Pd)与冠状动脉狭窄近端压力(Pa)的比值,即FFR=Pd/Pa。
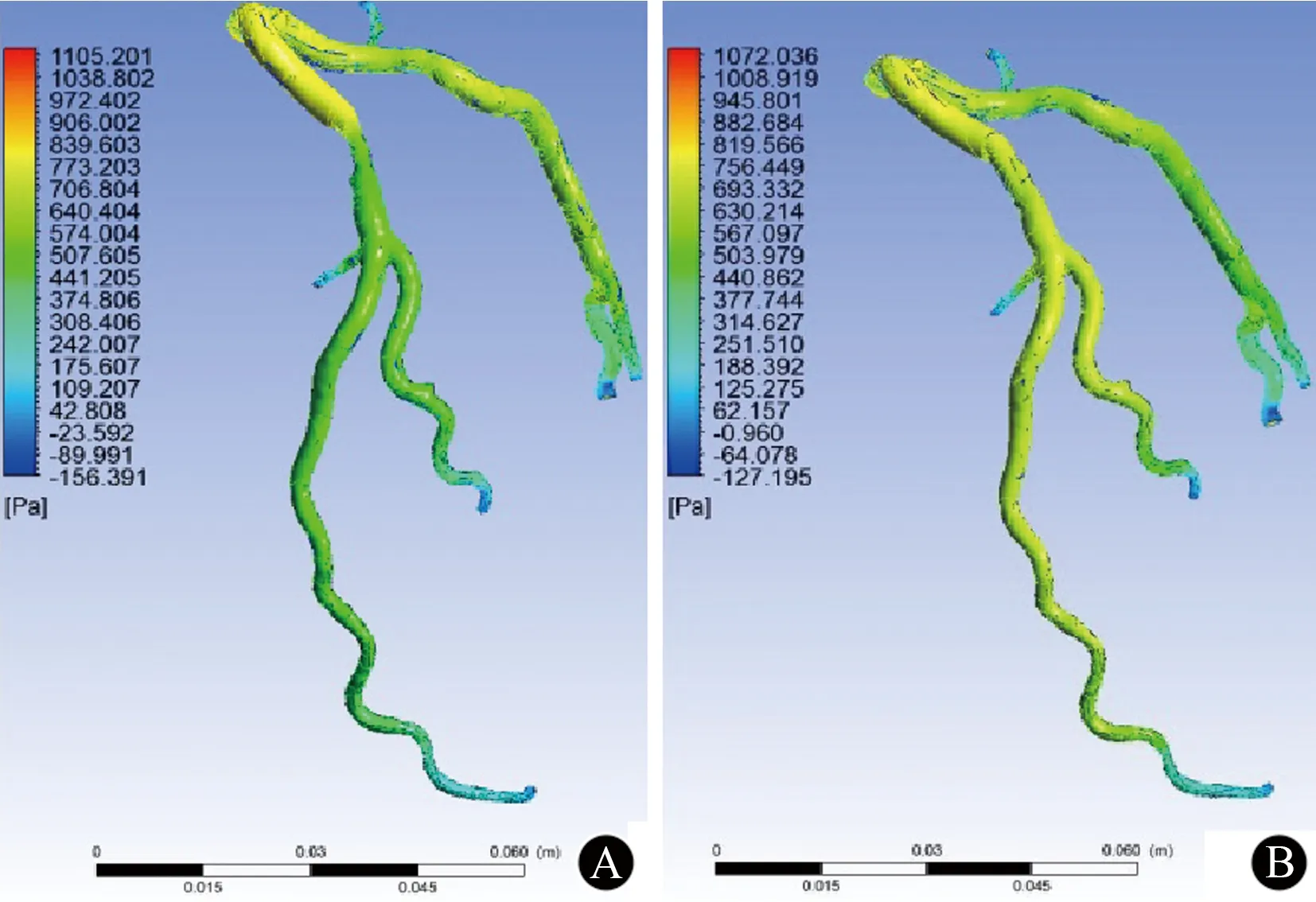
LAD,左前降支;WP,壁面压力图4 左冠状动脉WP场 A:LAD冠状动脉狭窄模型WP分布;B:支架置入LAD狭窄处后WP分布

WSS,管壁剪切力;LAD,左前降支图5 左冠状动脉WSS场 A:LAD冠状动脉狭窄模型WSS分布;B:支架置入LAD狭窄处后WSS分布
WSS对动脉粥样硬化斑块具有重要的作用,高的WSS能够启动斑块破裂,低的WSS促进斑块生长。支架置入前后的WSS分布如图5所示,压力数值为相对值,不同颜色图像代表不同WSS的大小,蓝色为低压力值,红色为高压力值。在临近血管狭窄处WSS高低不均,总体趋于增高,最大狭窄处有最大WSS为10 Pa,而在支架置入干预后的血管外侧壁均出现不规则的深蓝色低WSS 分布,原有血管狭窄处最大WSS为3.4 Pa。这表明支架置入可以明显降低WSS。有研究表明,在正常的LAD模型中,一个心动周期平均WSS在12 Pa以下,相对于正常的LAD,只有严重狭窄(>75%)斑块病变能够明显影响WSS[6]。
本技术的优势:(1)冠心病不恰当介入治疗会改变冠状动脉内的局部血流动力学状况,干扰心肌内血液的正常流动,从而引起血栓、动脉内膜增生、粥样硬化及冠状动脉内再狭窄的发生[7]。冠状动脉血管内支架置入术中,支架尺寸和置入方式的选择以及支架的准确定位对于手术是否成功十分关键。本技术在冠状动脉三维模型上,无需额外的有创干预,模拟支架对冠状动脉血管重塑可以改善冠状动脉的血流动力学参数,得到有效血管的血流模式、涡流、剪切力等血流动力学参数的三维空间分布。(2)个体化设计虚拟支架,可对支架置入后的治疗效果进行直观的预评估,干预冠状动脉对血流动力学影响具有更深入的理解。有助于术者精确地选择支架的类型及大小,而不是简单地依靠粗略的测量或术者经验,从而降低手术时间、曝光量、减少不必要的支架置入。
本技术的局限性:(1)在高分辨率CTA数据的基础上,应用数字三维建模软件重建冠状动脉的几何模型,通过CFD技术分析了支架置入前后局部血流动力学的特性。受限于图像分辨率、计算量等因素,只有少数的研究基于临床实际患者数据构建冠状动脉个体化几何模型[8]。虽然血管内超声或光学相干断层成像等影像设备具有高的横断面分辨率,近年来有研究应用于冠状动脉CFD模型,但是其三维重构难度大,且三维分辨率精度不够[9-10]。(2)血流动力学模拟结果与CFD软件求解时设定的入口压力、入口速度、出口压力、流速等边界条件密切相关。本技术未考虑心脏运动及血管弹性方面对血流的影响[11]。(3)流体性质方面也基于一些简化的假设,如血流为稳态、牛顿流体,管壁为刚性等,进一步的研究可以采用更接近患者实际的生理参数作为边界条件进行建模评估。随着计算机技术的不断发展及与临床医学更为广泛的结合,以CFD技术为代表的无创数值模拟技术将成为探索冠状动脉粥样硬化斑块形成机制及干预粥样硬化斑块转归的有效手段,对动脉粥样硬化的预警、诊断及选择最佳治疗方式起到重要的指导作用。
本技术的应用体会:通过对冠状动脉塑性实现从血流动力学角度预测个体冠状动脉血管内支架置入后的血流动力学改变,为冠状动脉虚拟支架置入带来新方法,帮助医师评估支架对冠状动脉局部血流动力学的影响。本研究表明基于冠状动脉CTA的虚拟支架置入对预测冠状动脉血流动力学的模型可行,并且可能在临床有创介入冠状动脉支架置入前提供优化治疗策略。
[1] 陈伟伟,高润霖, 刘力生, 等.《中国心血管病报告2015》概要. 中国循环杂志,2016,31(6): 521-528.
[2] 中华医学会心血管病学分会介入心脏病学组, 中国医师协会心血管内科医师分会血栓防治专业委员会, 中华心血管病杂志编辑委员会.中国经皮冠状动脉介入治疗指南(2016). 中华心血管病杂志,2016,44(5):382-400.
[3] Warboys CM, Amini N, de Luca A,et.al.The role of blood flow in determining the sites of atherosclerotic plaques. F1000 Med Rep,2011,3:5
[4] Cheng C, Tempel D, van Haperen R,et al. Atherosclerotic lesion size and vulnerability are determined by patterns of fluid shear stress. Circulation,2006,113(23):2744-2753.
[5] Johnston BM, Johnston PR, Corney S,et.al. Non-Newtonian blood flow in human right coronary arteries: steady state simulations. J Biomech,2004,37(5): 709-720.
[6] Su B, Huo Y, Kassab GS, et al. Numerical investigation of blood flow in three-dimensional porcine left anterior descending artery with various stenoses. Comput Biol Med,2014,47:130-138.
[7] Kim KH, Doh JH, Koo BK, et al. (2014) A novel noninvasive technology for treatment planning using virtual coronary stenting and computed tomography-derived computed fractional flow reserve. JACC Cardiovasc Interv,2014, 7(1): 72-78.
[8] Foin N, Torii R, Mortier P, et al., Kissing balloon or sequential dilation of the side branch and main vessel for provisional stenting of bifurcations: lessons from micro-computed tomography and computational simulations. JACC Cardiovasc Interv,2012,5(1): 47-56.
[9] Chiastra C, Montin E, Burzotta F, et.al.Coronary stenting: From optical coherence tomography to fluid dynamic simulations. IEEE International Conference on Bioinformatics & Bioengineering, 2013,7789(1):1-4.
[10] Ellwein LM, Otake H, Gundert TJ, et al. Optical coherence tomography for patient-specific 3D artery reconstruction and evaluation of wall shear stress in a left circumflex coronary artery. Cardiovascular Engineering and Technology,2011,2(3): 212-227.
[11] Li G, Hu R, Gao F. Numerical simulation of coronary artery stenosis before and after stenting. Journal of Medical & Biological Engineering, 2015,35(4):1-7.
10.3969/j.issn.1004-8812.2017.04.014
辽宁省博士启动基金资助(20160119)
110004 辽宁沈阳,中国医科大学附属盛京医院影像科(徐洪增、侯阳、马跃);中国医科大学附属第四医院心内科(徐洪增)
侯阳,Email:houyang1973@163.com
R541.4
2016-11-22)

