纤维素酶解法提取黄花蒿中青蒿素的工艺研究
刘 畅,唐小飞,欧艳阳,刘海林,李海波
(第三军医大学:1药学院学员18营,2原学员旅20队,3药学院微生物与生化药学教研室,重庆400038)
·药学与转化医学·
纤维素酶解法提取黄花蒿中青蒿素的工艺研究
刘 畅1,唐小飞2,欧艳阳2,刘海林2,李海波3
(第三军医大学:1药学院学员18营,2原学员旅20队,3药学院微生物与生化药学教研室,重庆400038)
目的:建立并优化纤维素酶解法提取黄花蒿中青蒿素的最佳工艺条件.方法:以青蒿素的提取率为指标,通过正交实验法对酶解浓度、酶解时间、提取时间和料液比四个因素进行优选实验.结果:最佳提取工艺:酶解浓度为0.05 mg/mL,酶解时间为30 min,提取时间为60 min,料液比为1∶80.与回流提取法相比青蒿素提取率提高了34.76%.结论:采用酶解法提取黄花蒿中的青蒿素,工艺方法简单,可大大提高原料利用率,同时缩短提取时间.
黄花蒿;青蒿素;纤维素酶;提取工艺
0 引言
菊科植物黄花蒿(Artemisia annua L.)中所含的青蒿素(Artemisinin,图1)是由我国自主研发,并被世界卫生组织(WHO)认定为治疗恶性疟疾的有效药物[1].我国科学家屠呦呦因为发现抗疟疾药物青蒿素获得2015年诺贝尔生理学或医学奖.我国所产的青蒿素占全球总产量的90%以上,而重庆又是我国最早开展黄花蒿人工种植的省市之一,依托重庆黄花蒿种植的资源优势,开展青蒿素提取工艺的研究对青蒿素的进一步产业化具有重要意义.

图1 青蒿素的化学结构
现有青蒿素的提取方法主要有传统提取法和超临界流体提取法两种.传统提取法包括回流提取法、冷浸提取法和索氏提取法等[2-4].传统提取法溶剂成本高,提取率和原料利用率较低,而超临界流体法虽提取率高,但因设备昂贵,其普及受到限制[5-6].根据传质理论,在天然活性成分的提取过程中,溶剂首先向固体表面扩散,渗透到固体表面,然后进入固体内部及其微孔隙内溶解天然活性成分,最后通过固体微孔隙向固体表面扩散,并在固体表面与溶剂主体间浓度差作用力下,天然活性成分向溶剂主体扩散,完成提取传质过程[7-8].而青蒿素全部被纤维素构成的细胞壁所包围,传统的提取方法无法使细胞壁破裂,因此存在巨大的传质阻力,致使提取效果受到很大的限制.近年研究表明,采用纤维素酶能使细胞壁疏松、破裂,减小传质阻力,可有效提高提取效率[9],而采用酶解法提取黄花蒿中的青蒿素,鲜有文献报道.本文以石油醚为提取溶剂,研究酶解浓度、酶解时间、液固比、提取时间等因素对提取率的影响,建立并选出酶解法提取黄花蒿中青蒿素的最佳工艺条件,现报道如下.
1 材料和方法
1.1 主要仪器与试剂电子天平(上海精密科技有限公司),旋转蒸发仪(上海振捷实验设备有限公司),双光束紫外可见分光光度计(北京普析通用仪器有限公司),青蒿素标准品(中国药品生物制品检定所),黄花蒿药材(产地重庆酉阳),纤维素酶(15 U/mg,上海博奥生物科技有限公司),95%乙醇[重庆川东化工(集团)有限公司化学试剂厂],氢氧化钠(天津市大茂化学试剂厂),石油醚,蒸馏水.
1.2 样品的制备
1.2.1 纤维素酶解法样品的制备 精确称取50 mg纤维素酶,用蒸馏水溶解并定容于50 mL容量瓶中,配制得到浓度为15 U/mL的纤维素酶溶液.
取干燥黄花蒿叶样品约1 g,加入20 mL稀硫酸溶液(pH为4.5)和定量的酶溶液,置于50℃恒温水浴中,酶解一定时间后,抽滤,滤渣烘干至恒重.在滤渣中加入定量的石油醚,并于50℃条件下进行加热.加热一定时间后,冷却至室温,抽滤,滤液用2%的氢氧化钠溶液(10 mL×2)进行洗涤,再用水洗至中性.最后在水浴温度为50℃的条件下进行减压浓缩,并用95%乙醇定容于50 mL容量瓶中,得纤维素酶解法样品供试液.
1.2.2 回流提取法样品的制备 称取干燥黄花蒿叶样品约1 g,加入60 mL石油醚,控制内温为50℃进行加热.加热一定时间后,冷却至室温,抽滤,滤液处理方法同纤维素酶解法,得回流提取法样品供试液.
1.3 最大吸收波长的确定取青蒿素标准品10 mg,用95%乙醇溶解并定容于100 mL容量瓶中.吸取上述溶液2 mL加入到50 mL容量瓶中,补加2 mL 95%乙醇,并用0.2%的氢氧化钠溶液定容,得标准液.另外,将4 mL 95%乙醇加入到50 mL容量瓶中,并用0.2%的氢氧化钠溶液定容,得空白液.
将标准液和空白液同时置于50℃恒温水浴中反应30 min[10-11].冷却至室温后用紫外分光光度计先用空白校正,然后对标准液进行紫外光谱扫描,标准液的最大吸收波长(λmax)为291 nm(文献[12]λmax为292 nm).
1.4 正交设计中提取液中青蒿素含量的测定为了简化正交设计的实验流程,提取液中青蒿素的含量按以下方法进行测定:
吸取提取液的续滤液2 mL于25 mL容量瓶中,补充2 mL 95%乙醇,加人0.2%氢氧化钠溶液至刻度.再于50℃恒温水浴中反应30 min,冷却至室温,在291 nm处测得吸光度值AS.并通过如下公式将其换算为每克黄花蒿叶所对应的吸光度值AH:

其中:MS——实际称取的干燥黄花蒿叶的质量.
青蒿素含量W计算公式:
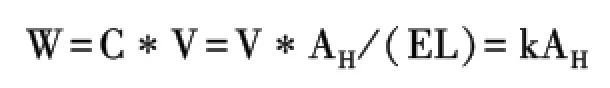
其中:W——样品的质量,C——样品的浓度,V——样品的体积,E——百分吸收系数,L——比色杯的厚度,k——常数.
2 结果
2.1 酶解法正交实验与结果分析经过预试验发现,酶(15 U/mL)的用量(mL)、酶解时间(min)、回流时间(min)、石油醚的用量(mL)为影响青蒿素提取率的主要因素,以此设计四因素三水平正交实验表(表1).

表1 因素与水平
酶解法正交实验结果如表2、3所示,从方差分析可知,四个因素对青蒿素提取率影响由大到小的顺序如下:D>A>C>B.说明溶剂体积的改变对青蒿素提取影响最大,其次为酶的用量和回流提取时间.其最佳组合为T4(D3A2C2B1);即石油醚的用量为80 mL(料液比为1∶80),酶的用量为1.00 mL(反应体系中的浓度为0.05 mg/mL),提取时间为60 min,酶解时间为30 min.

表2 正交实验结果

表3 青蒿素提取率方差分析
2.2 验证试验为了验证正交试验结果的准确性,按最佳提取工艺进行了重复性试验.验证性试验结果表明所筛选的工艺具有可操作性和稳定性(表4).
表4 最佳提取工艺的验证试验
2.3 提取工艺对比分析纤维素酶解法:称取250 g黄花蒿叶粉末,按照优化后的参数用纤维素酶解法进行提取,提取液于50℃减压浓缩,得粗品.精制后得青蒿素纯品2.911 g.
回流提取法:称取250g黄花蒿叶粉末,按回流提取法进行提取,精制后得青蒿素纯品2.160 g.
纤维酶解法提取青蒿素所得收率较回流提取法提高了34.76%.
2.4 样品的薄层色谱(TLC)分析取精制后的青蒿素以及青蒿素标准品各10 mg,加1 mL丙酮溶解,分别点于同一硅胶GF254薄层板上,以石油醚(沸程60~90℃)⁃丙酮⁃冰醋酸(8∶2∶0.1)为展开剂,展开后取出,晾干,喷以含2%香草醛的20%硫酸乙醇溶液,在85℃加热10~20 min至斑点清晰.样品试液与标准试液相同位置处有相同颜色的斑点;在青蒿素斑点的前后无其它斑点,说明青蒿素的纯度符合要求.
3 讨论
青蒿素在丙酮、乙酸乙酯、氯仿、苯及冰醋酸中易溶,在乙醇、甲醇、乙醚及石油醚中可溶,在水中几乎不溶[13].综合考虑青蒿素与杂质在各个溶剂中的溶解度,采用石油醚作为提取的溶剂,并将其作为正交实验的主要影响因素来进行研究.另外,利用青蒿素在水中几乎不溶的特点,酶解反应选择在水溶液中进行,并在萃取过程中用蒸馏水进行洗涤,除去样品中的水溶性成分[14-15].
青蒿素在温度超过60℃的环境下过氧桥结构很快被破坏,完全失去药效,所以青蒿素的提取不宜使用较高的温度,控制在50℃比较适宜[11].从青蒿素的提取收率、提取时间、生产成本等指标综合考虑,以T4(D3A2C2B1)为最优组合,推荐为生产工艺.虽然T3(D3A1B3C3)的收率也比较高,但是耗时太长,并且长时间的加热也可能导致青蒿素的分解,因此在生产过程中应避免采用.本提取方法与以往的冷浸提取法相比,大大缩短了提取的时间,减少了溶剂的容量,提高了青蒿素的收率.酶解法在天然活性成分的提取中有着重要的地位,并具有广泛应用的潜力,除了应用于本研究提到的青蒿素的提取,也可考虑运用于其它研究中去,以提高生产效率,降低生产成本等.
[1]国家药典委员会.中国药典,一部[S].北京:化学工业出版社,2005:137,附录ⅨH.
[2]Tian N,Li J,Liu S,et al.Simultaneous isolation of artemisinin and its precursors from Artemisia annua L.by preparative RP⁃HPLC[J].Biomed Chromatogr,2012,26(6):708-713.
[3]Nageeb A,Al⁃Tawashi A,Mohammad Emwas AH,et al.Comparison of artemisia annua bioactivities between traditional medicine and chemical extracts[J].Curr Bioact Compd,2013,9(4):324-332.
[4]Engeu PO,Omujal F,Agwaya M,et al.Variations in antimalarial components of Artemisia annua Linn from three regions of Uganda[J].Afr Health Sci,2015,5(3):828-834.
[5]Kohler M,Haerdi W,Christen P,et al.Extraction of artemisinin and artemisinic acid from Artemisia annua L.using supercritical carbon dioxide[J].J Chromatogr A,1997,785(1-2):353-360.
[6]Ivanescu B,Miron A,Corciova A.Sesquiterpene lactones from arte⁃misia genus:biological activities and methods of analysis[J].J Anal Methods Chem,2015,2015:247685.
[7]吴梅林,周春山,陈龙胜,等.酶法提取银杏黄酮类化合物研究[J].天然产物研究与开发,2004,16(6):557-560.
[8]Pan S,Wu S.Cellulase⁃assisted extraction and antioxidant activity of the polysaccharides from garlic[J].Carbohydr Polym,2014,111:606-609.
[9]Zhao YM,Song JH,Wang J,et al.Optimization of cellulase⁃assisted extraction process and antioxidant activities of polysaccharides from Tricholoma mongolicum Imai[J].J Sci Food Agric,2016,96(13):4484-4491.
[10]赵 兵,王玉春,欧阳藩.青蒿药用成分提取分离技术现状[J].中草药,1998,29(11):784-786.
[11]赵 兵,王玉春,吴 江,等.青蒿素提取条件研究[J].中草药,2000,31(6):421-423.
[12]李春莉,王莎莉,王亚平,等.紫外分光光度法测定青蒿素的含量[J].重庆医科大学学报,2007,32(4):413-415.
[13]Kim MH,Seo JY,Liu KH,et al.Protective effect of artemisia annua L.extract against galactose⁃induced oxidative stress in mice[J].PLoS One,2014,9(7):e101486.
[14]Tang C,Zhao Y,Huang S,et al.Influence of Artemisia annua extract derivatives on proliferation,apoptosis and metastasis of osteo⁃sarcoma cells[J].Pak J Pharm Sci,2015,28(2 Suppl):773-779.
[15]Patindol J,Wang L,Wang YJ.Cellulase⁃assisted extraction of oligo⁃saccharides from defatted rice bran[J].J Food Sci,2007,72(9):C516-C521.
Study on extraction process of artemisinin from Artemisia annua L.by cellulase⁃assisted technique
LIU Chang1,TANG Xiao⁃Fei2,OU Yan⁃Yang2,LIU Hai⁃Lin2,LI Hai⁃Bo3
Third Military Medical University:1Battalion Eighteen,College of Pharmacy,2The 20th Team of Cadet Brigade,3Department of Microbiology and Biochemical Pharmacy,College of Pharmacy,Chongqing 400038,China
AIM:To establish and optimize the extraction process of artemisinin from Artemisia annua L.by cellulase⁃assisted technique.METHODS:With the extraction rate of artemisinin as index,the orthogonal test was adopted to examine the effects of the 4 factors consisting of enzyme concentration,enzymatic hydrolysis time,the rate of liquid to material and extraction times.RESULTS:The optimum extraction conditions were established as following:enzymeconcentration 0.05mg/mL,enzymatic hydrolysis time 30 minutes,the rate of material to liquid 1:80,extraction time 60 minutes.The yield of artemisinin increased by 34.76%comparing with the traditional technique of extraction.CONCLUSION:The method is simple and it can increase material utility effectively,extracted time is reduced as well.
ArtemisiaannuaL.;artemisinin;cellulose;extraction process
R965.1
A
2095⁃6894(2017)04⁃64⁃04
2016-12-06;接受日期:2016-12-22
国家自然科学基金(31400788,31670936)
刘 畅.E⁃mail:756648273@qq.com
李海波.副教授,硕士生导师.研究方向:化学生物学.
E⁃mail:lihaibo@tmmu.edu.cn

