蓉丹口服液干预糖尿病周围神经病变的疗效分析
梁思虹,陈小燕,黄晓淳,许启锋(广州医科大学附属第一医院:内分泌科,肌电图室,广东广州500)
·临床与转化医学·
蓉丹口服液干预糖尿病周围神经病变的疗效分析
梁思虹1,陈小燕1,黄晓淳1,许启锋2(广州医科大学附属第一医院:1内分泌科,2肌电图室,广东广州510120)
目的:观察蓉丹口服液干预糖尿病周围神经病变(DPN)的临床疗效.方法:该项为期12周、随机、对照的临床研究共纳入DPN患者85例,其中蓉丹口服液组(蓉丹组,n=34)、甲钴胺组(n=34)及对照组(n=17).主要观察指标包括神经症状、体征评分(密歇根神经病变筛查量化表,MNSI)、神经肌电图结果、血清内皮素⁃1(ET⁃1)、胱抑素⁃C(Cys⁃C)、不良反应等.结果:①3组患者的血糖、Cys⁃C、ET⁃1、MNSI症状分值、体征分值神经传导速度(NCV)、波幅基线比较,差异无统计学意义(P>0.05).②蓉丹组干预后Cys⁃C、ET⁃1水平均显著低于基线,差异具有统计学意义(P<0.05),而甲钴胺组干预前后无明显变化,对照组干预后ET⁃1水平较基线值呈上升趋势,而Cys⁃C则无明显变化.③蓉丹组及甲钴胺组干预后MNSI症状分值、体征分值显著低于基线(P<0.05),两组间干预前后ΔMNSI症状、体征分值比较,差异无统计学意义(P>0.05).④蓉丹组及甲钴胺组干预后NCV、波幅显著高于基线,差异具有统计学意义(P<0.05),对照组呈下降趋势(P<0.05);蓉丹组及甲钴胺组干预前后ΔNCV、Δ波幅显著高于对照组(P<0.05),两组间干预前后ΔNCV比较,差异无统计学意义(P>0.05),但蓉丹组干预前后Δ波幅显著高于甲钴胺组,差异具有统计学意义(P<0.05).结论:采用蓉丹口服液干预12周能显著改善DPN患者的临床症状,有效提高NCV、波幅,尤其在改善足部皮肤干燥开裂、波幅方面效果优于甲钴胺,且能降低血清Cys⁃C、ET⁃1水平,在治疗DPN中安全有效.
蓉丹口服液;糖尿病周围神经病变;神经传导速度;内皮素;抗神经节苷脂抗体
0 引言
糖尿病周围神经病变(diabetic peripheral neurop⁃athy,DPN)是糖尿病最常见的慢性并发症之一,据统计,其患病率为10%~96%[1].近年来,其死亡率不断上升[2],因此倍受关注.该病典型的临床特点是感觉异常和对称性疼痛,患者多表现为肢端麻木、冰凉、触痛、手套⁃袜套样感觉障碍,夜间尤甚.DCCT研究[3]提出积极控制血糖可有效降低和延缓糖尿病及其并发症的发生和发展.但大量临床研究证实,一旦DPN损伤到神经结构,暂无特效药能完全逆转周围神经病变的进展.目前主要的治疗手段是在积极控制血糖的基础上,阻断代谢紊乱、改善微循环、抗氧化、营养修复神经、止痛等[1].其中,活血化瘀类中药在改善微循环上的疗效得到了肯定.“蓉丹口服液”为纯中药制剂,基础研究[4-5]显示该药具有降低血液粘稠度、活血化瘀之功效.该药上市10余年,主要推荐作为糖尿病人群的辅助治疗药物,可改善患者口渴多饮、消谷善饥、多尿、肢麻胸闷等症状,目前尚无该药对DPN干预疗效确切的报道.前期研究[6]中,蓉丹口服液干预DPN患者12周,其麻木、疼痛等症状及神经传导速度(nerve conduction velocity,NCV)均显著改善,且安全性良好.基于此,本研究设计了前瞻、随机、对照的临床研究,以甲钴胺作为阳性对照,评价蓉丹口服液在DPN治疗中的有效性及安全性,现报道如下.
1 资料和方法
1.1 一般资料选取广州医科大学附属第一医院2015-02/2015-12收治的DPN患者85例作为研究对象,随机分为蓉丹组(n=34)、甲钴胺组(n=34)及对照组(n=17).
1.2 纳入标准①符合2014年美国糖尿病学会提出的2型糖尿病诊断标准[7];②HbA1c≤7.5%;③符合2013年中华医学会公布的DPN的诊断标准[1]:存在DPN症状和/(或)体征,且神经传导功能异常;④纳入课题前签署知情同意书;本研究经医院伦理委员会通过(医科伦审2013第2号).⑤患者无足部感染、水肿,无严重血管病变所致下肢病变.排除其他病因所导致的神经病变,包括遗传因素、药物、相关手术、其他代谢性疾病以及因皮肤病、外伤史、肢体骨折、长期接触毒性物质等所导致的神经病变.
1.3 排除标准①Ⅰ型糖尿病和继发性糖尿病患者;②对蓉丹口服液过敏者;③处于急性感染期、围手术期及应激状态,近期有使用糖皮质激素、急性心、肾功能不全等糖尿病急症患者;④处于糖尿病酮症酸中毒或高血糖高渗状态患者;⑤研究者认为患者存在不能顺利完成研究的任何状况患者;⑥有遵从方案或用药依从性风险的个人;⑦排除正在使用对神经病变症状等检查有影响的药物的患者.
1.4 病例剔除和脱落①患者依从性差,不能依照规定坚持服药者;不愿意接受神经肌电图检查者;不愿意继续进行临床试验,要求退出临床试验者均为脱落病例.②治疗期间,出现影响试验观察的症状患者;试验过程中出现严重不良反应,无法耐受者,均予以剔除.
1.5 方法本研究为一项为期12周、单中心、前瞻、随机、对照研究.基础治疗:所有患者入组前均予糖尿病饮食、运动教育,继续入组前的降糖、降脂、降压、抗血小板聚集等方案.研究期间无特殊情况不予调整以上基础治疗方案.蓉丹组:在基础治疗上,予加用“蓉丹口服液20 mL,tid”(济人药业林州有限公司生产,规格:10 mL/支),甲钴胺组:在基础治疗上,予加用“甲钴胺片500 μg,tid”(卫材药业有限公司生产,规格:500 μg),对照组:维持原基础治疗.
1.6 监测项目
1.6.1 一般项目 血常规、肝肾功能、血压、心电图、眼底照相.
1.6.2 采用密歇根神经病变筛查量化表[8](Michigan neuropathy screening instrument,MNSI)症状评分系统检查评估患者干预前后的神经症状、体征.检测NCV、波幅评估神经损害程度.依据相关资料[9]及本研究室的数据制定NCV异常判定标准:SNCV<50 m/s为异常,正中神经、尺神经运动纤维传导速度<50 m/s为异常,腓总神经、胫神经运动纤维传导速度<45 m/s为异常,引不出电位或以上参数一项以上出现异常,即电生理异常.波幅下降指波幅下降超过50%.
1.6.3 血液及尿液相关指标的检测 检测干预前后血肌酐(SCr)、血尿素(BUN)、胱抑素C(Cys⁃C)、FPG、HbA1c、血脂、内皮素⁃1(endothelin⁃1,ET⁃1)、肝功、尿白蛋白含量,尿肌酐,计算尿白蛋白排泄率(urinary albumin excretion rate,UAER).
1.6.4 记录不良反应 记录随访期间患者有无出现药物说明书上所列举的(新发生的发热、恶心、返酸、食欲下降、头痛、胸痛、腹泻、黑便、便秘、头晕、失眠等)以及不在说明书上的情况.评估不良事件(AE)、低血糖事件.
1.7 疗效判定标准参照相关文献并根据患者的临床症状、体征及NCV制定相关疗效判定标准[10]如下.显效:患者临床症状、体征较治疗前明显好转甚至消失,NCV较治疗前增加≥5 m/s;有效:患者临床症状、体征均较治疗前有所改善,NCV较治疗前增加至少3 m/s;无效:患者临床症状、体征较治疗前无改善,且NCV无变化或者变差.总有效率=(显效例数+有效例数)/总例数×100%.
1.8 统计学处理采用SPSS19.0统计学软件对数据进行分析.计量资料用或中位数及范围表示,计数资料直接计数或用百分数表示.计量资料组间比较采用单因素方差分析或Kruskal Wallis检验,必要时再进行两两比较.组内比较采用配对样本t检验或配对符号秩和检验.所有计数资料的比较采用χ2检验或秩和检验.P<0.05表示差异有统计学意义.
2 结果
2.1 各组基线特征比较3组患者的性别、年龄、DM病程、血压、FPG、HbA1c、血脂、Cys⁃C、ET⁃1、UAER、MNSI分值、NCV、波幅基线比较,差异均无统计学意义(P>0.05).3组患者基线资料均衡性好,具有可比性.
2.2 MNSI分值的比较干预后蓉丹组及甲钴胺组MNSI症状、体征分值均显著低于基线值,差异具有统计学意义(P<0.05),对照组12周后MNSI症状、体征分值呈上升趋势(P<0.05),蓉丹组及甲钴胺组干预前后ΔMNSI症状、体征分值显著低于对照组,差异具有统计学意义(P<0.05,表1),但两组间比较,差异无统计学意义(P>0.05).
表1 干预前后MNSI分值的比较

表1 干预前后MNSI分值的比较
aP<0.05 vs本组基线值;cP<0.05 vs对照组.
2.3 干预前后症状比较患者常见的症状为皮肤干燥开裂、趾或指端麻木、刺痛、灼痛、感觉过敏,其中上述症状夜间加重的达1/3以上.χ2检验结果显示,蓉丹组及甲钴胺组干预12周后,上述症状均有不同程度改善.其中,蓉丹组干预12周后,皮肤干燥开裂、趾或指端麻木、刺痛及感觉过敏的比例显著低于基线值,差异具有统计学意义(P<0.05),甲钴胺组干预12周后,趾或指端麻木、刺痛、灼痛、感觉过敏的比例显著低于基线值,差异具有统计学意义(P<0.05).蓉丹组对皮肤干燥开裂的改善明显优于甲钴胺组,差异具有统计学意义(P<0.05).而两者在改善麻木、疼痛、感觉过敏方面比较,差异无统计学意义(P>0.05,表2).

表2 干预前后MNSI症状比较[n=32,n(%)]
2.4 干预前后体征比较患者常见的体征为踝反射异常、振动觉异常、10 g尼龙丝异常、温度觉异常.χ2检验结果显示,蓉丹组及甲钴胺组干预后上述体征均有不同程度改善.其中,蓉丹组及甲钴胺组干预后振动觉及踝反射异常的比例显著低于基线值,差异具有统计学意义(P<0.05).蓉丹口服液组及甲钴胺组在改变振动觉、温度觉、10 g尼龙丝、踝反射方面比较,差异无统计学意义(P>0.05,表3).

表3 干预前后MNSI体征比较[n=32,n(%)]
2.5 干预前后生化指标的比较蓉丹组干预前后FPG、HbA1c、TG、TC、LDL、HDL、UAER无明显变化,干预后Cys⁃C、ET⁃1显著低于基线值,差异具有统计学意义(P<0.05).甲钴胺组干预前后FPG、HbA1c、TG、TC、LDL、Cys⁃C、ET⁃1、UAER无明显变化,干预后HDL显著高于基线值(P<0.05).对照组干预后ET⁃1较干预前明显升高,干预前后FPG、HbA1c、TG、TC、LDL、HDL、Cys⁃C、UAER无明显变化.蓉丹组及甲钴胺组干预前后ΔET⁃1显著低于对照组,差异具有统计学意义(P<0.05),两组间的ΔET⁃1比较,差异无统计学意义(P>0.05,表4).

表4 干预前后生化指标比较
2.6 干预前后神经肌电图指标变化比较蓉丹组及甲钴胺组干预后正中神经MNCV、腓总神经MNCV、胫神经MNCV、正中神经SNCV、腓肠神经SNCV均显著高于基线值,差异具有统计学意义(P<0.05),对照组12周后正中神经MNCV、腓总神经MNCV、胫神经MNCV、正中神经SNCV、腓肠神经SNCV呈下降趋势(P<0.05),3组干预后尺神经MNCV、SNCV较干预前无明显变化.蓉丹组和甲钴胺组干预前后正中神经、腓总神经、胫神经ΔMNCV及正中神经、腓肠神经ΔSNCV均显著高于对照组,差异具有统计学意义(P< 0.05),但两组间比较,差异无统计学意义(P>0.05).
蓉丹组及甲钴胺组干预后腓肠神经感觉神经动作电位波幅(sensory nerve action potential ampli⁃tude,SNAPA)显著高于基线值,差异具有统计学意义(P<0.05),对照组12周后腓肠神经SNAPA呈下降趋势(P<0.05).蓉丹组及甲钴胺组干预前后Δ腓肠神经SNAPA显著高于对照组,差异具有统计学意义(P<0.05),且蓉丹组干预前后ΔSNAPA显著高于甲钴胺组,差异有统计学意义(P<0.05,表5).
表5 干预前后神经肌电图指标变化的比较
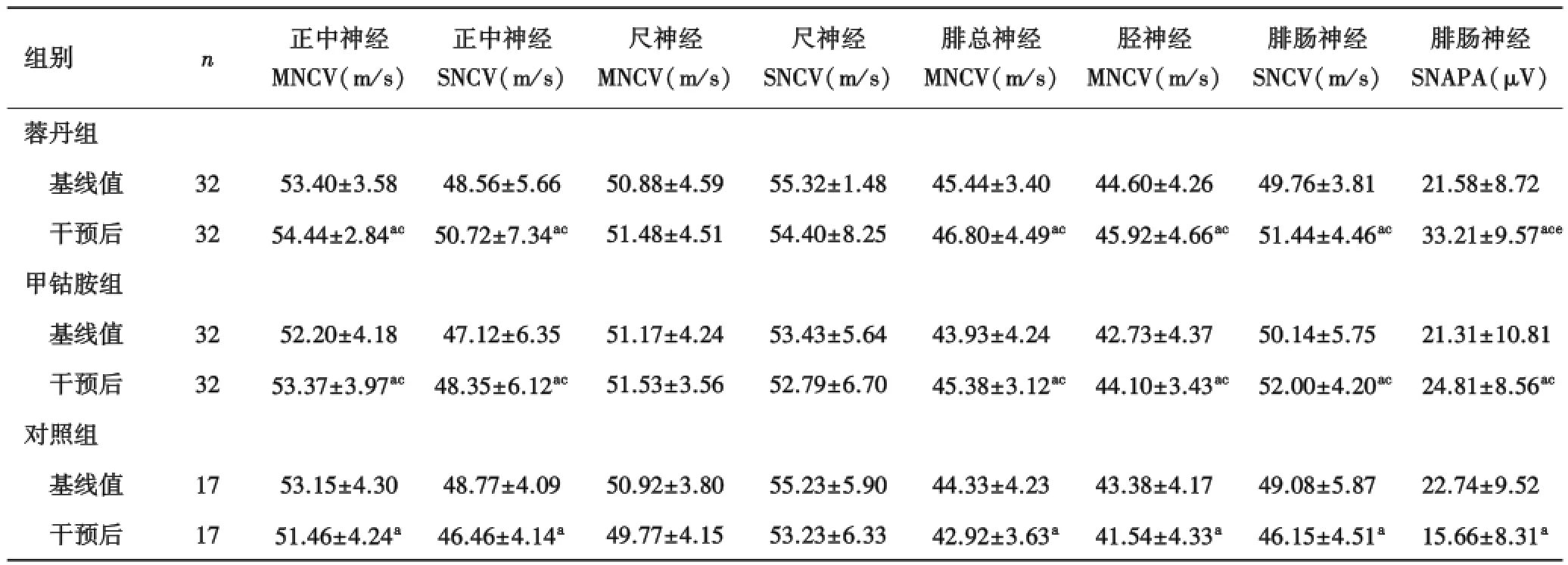
表5 干预前后神经肌电图指标变化的比较
aP<0.05 vs基线;cP<0.05 vs对照组;eP<0.05 vs甲钴胺组.
2.7 临床疗效比较依据干预前后患者临床症状、体征及神经电生理变化情况判定疗效,蓉丹组、甲钴胺组、对照组总有效率分别为81.25%(26/32),84.38%(27/32),5.88%(1/17).蓉丹组及甲钴胺组的总有效率均显著高于对照组,差异具有统计学意义(P<0.01),但两者之间的总有效率比较,差异无统计学意义(P>0.05,表6).

表6 3组患者干预疗效的比较
2.8 安全性及随访情况所有入组患者均在干预前后进行血常规、肝、肾功能检查,均在正常范围内.随访过程中,蓉丹组1例患者因出现排尿困难(既往有前列腺增生病史)于第6周退出,蓉丹组另1例自觉效果不明显于第4周要求退出,甲钴胺组2例分别自诉出现皮肤瘙痒、头晕要求退出,拒绝到医院进一步确认是否与药物有关,分别于第3周、第5周要求退出.最后纳入统计的患者81例.3组随访期间均无严重不良事件发生,干预前后血压、心电图、眼底无明显变化.
3 讨论
DPN是糖尿病最常见的慢性微血管并发症之一,其患病率逐年增加.目前DPN的病因、发病机制尚未完全明确,其临床治疗仍处于一种探索性阶段,无特效药物及治疗方案.DPN在中医方面属于“消渴病”的“痹症”,中医药经过千百年的累积,对糖尿病慢性并发症的防治具有一定作用.DPN的治疗除了积极控制血糖外[11],改善微循环也是DPN综合治疗的重要组成部分之一[1],其中活血化瘀类中药的疗效得到了肯定.“蓉丹口服液”作为一种纯中药制剂,药物说明书显示其主要成分为蚕茧、黄芪、黄精、丹参、茯苓、肉苁蓉.基础研究[4-5]显示其具有抗血小板聚集、降低血液粘稠度、活血化瘀之功效.
本研究采用了经典的MNSI评分对干预前后患者神经病变症状及体征的有无进行定性评估,更好地评估DPN病情[8];同时通过检测DPN诊断的金标准NCV[12]及波幅的变化,对神经病变进行量化性评估,反映神经病变的严重程度并动态了解神经病变的情况,从而更客观、全面地评估蓉丹口服液干预DPN的疗效.本研究中患者DPN多表现为皮肤干燥开裂、麻木、灼痛、刺痛、踝反射异常、振动觉异常、10 g尼龙丝检查异常.蓉丹口服液干预12周后DPN患者肢端麻木、感觉过敏、疼痛、皮肤干燥开裂、振动觉及踝反射异常的比例均有不同程度的下降,其中在改善皮肤干燥开裂方面最为明显.蓉丹口服液干预后MNSI症状分值由基线值4.25降至3.82,MNSI体征分值由基线值2.04降至1.70;干预后正中神经MNCV、SNCV、腓总神经MNCV、胫神经MNCV、腓肠神经SNCV较干预前明显提高,与文献报道一致[13],以正中神经和腓肠神经SNCV改善较为明显.另外,在改善皮肤干燥开裂及腓肠神经波幅方面蓉丹口服液优于甲钴胺,推测该药治疗DPN的获益可能与其药物说明书所示的化瘀生津相关.蓉丹口服液可能通过改善血液高凝状态和微循环,提高神经细胞的血氧供应,从而有效改善DPN的临床症状及提高NCV、波幅.
蓉丹口服液干预12周后MNCV及SNCV均有一定程度的改善,提示蓉丹口服液对DPN运动、感觉神经纤维损害均可获益,但以改善SNCV及波幅最为明显.本研究应用了MNSI评分中的振动觉、10 g尼龙丝检查、踝反射检测大神经纤维功能,同时进行了温度觉检测小神经纤维[11].蓉丹口服液干预后振动觉、10 g尼龙丝检查、踝反射、温度觉均有不同程度的改善,考虑可能蓉丹口服液对大、小神经纤维损害均可获益.本研究结果显示,蓉丹组及甲钴胺组治疗总有效率分别为81.25%、84.38%,两组间总有效率比较,差异无统计学意义,提示总体疗效评价上蓉丹口服液并非劣于目前临床上各大指南推荐[1,14]的治疗DPN的甲钴胺,再次证实了活血化瘀类中药在治疗DPN中的有效性及安全性,且其在改善波幅及皮肤干燥开裂方面优于甲钴胺.
蓉丹口服液干预后ET⁃1水平显著下降,DPN一定程度的改善,与文献报道一致[15].考虑其可能通过活血化瘀增加局部循环的血流量,改善微循环,改善内皮功能,减少内皮细胞损伤所致ET⁃1升高.另外,由ET⁃1收缩血管导致的神经缺血缺氧性的神经损害[16]也可在一定程度上得以改善.蓉丹口服液干预后Cys⁃C水平显著下降,UAER也有下降的趋势,但由于本研究选择肾功能正常的患者,不能明确该药对存在肾功能损害的患者是否更能发挥肾保护作用,有待设计针对糖尿病肾病患者的干预性研究进一步探索.
糖脂代谢紊乱是DPN的发病机制之一[17],本研究蓉丹口服液干预前后DPN患者血糖、血脂、血压无明显变化,提示该药改善DPN的临床症状、NCV、波幅的机制可能独立于上述代谢紊乱的改善,考虑可能与该药所包含的6种主要成分相关.有研究显示蚕茧[18]、黄芪[19]、丹参[20]、黄精[21]、茯苓[22]、肉苁蓉[23]均具有抗氧化的作用.还有研究显示蚕茧具有维持胰岛素活性的作用[18],黄芪具有降低醛糖还原酶活性的作用[24],丹参具有抗血小板聚集、改善血液流变学的作用[25],黄精具有抑制α⁃葡萄糖苷酶活性的作用[26],肉苁蓉具有神经保护作用[27].蓉丹口服液可能改善了DPN患者体内的糖代谢紊乱、微循环、内皮功能障碍、氧化应激状态等,进而延缓了DPN的进展.蓉丹口服液改善DPN的具体机制有待进一步的基础研究进行探讨.本研究患者干预前后血压、肝肾功能、心电图无明显变化,随访期间未发现不良事件,提示该药安全性及耐受性良好.另外,本研究显示,蓉丹口服液和甲钴胺对DPN均有效,但这两种药物作用机制不同,暂未能明确两种药物联合运用的治疗效果是否优于单药治疗,有待进一步的研究探讨.
综上所述,蓉丹口服液干预DPN患者12周后,不仅能显著改善患者的麻木、疼痛、皮肤干燥开裂等症状,尤其在改善皮肤干燥开裂方面作用突出,且可有效提高NCV和波幅,值得临床推广应用.如能进行该药改善DPN的作用机制的基础研究,可能有助于更好地评估该药改善DPN的临床疗效及相关的作用机制.
[1]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[J].中国糖尿病杂志,2014,22(8):2-42.
[2]Tesfaye S,Selvarajah D,Gandhi R,et al.Diabetic peripheral neuropathy may not be as its name suggests:evidence from magnetic resonance imaging[J].Pain,2016,157 Suppl 1:S72-S80.
[3]Nathan DM,Lachin J,Cleary P,et al.Intensive diabetes therapy and carotid intima⁃media thickness in type 1 diabetes mellitus[J].N Engl J Med,2003,348(23):2294-2303.
[4]李月华,腊胜明,张 艳,等.蚕宝口服液活血化瘀作用的实验研究[J].中国中医药信息杂志,1997,4(6):18-19.
[5]李月华,张 艳,腊胜明,等.蚕宝口服液对模型动物活血化瘀作用的实验研究[J].中成药,1997(7):29-31.
[6]陈小燕,黄晓淳,许启峰,等.蓉丹口服液干预糖尿病性周围神经病变的疗效观察[J].中华生物医学工程杂志,2015,21(5):470-474.
[7]American Diabetes Association.Diagnosis and classification of diabe⁃tes mellitus[J].Diabetes Care,2014,37 Suppl 1:S81-S90.
[8]Feldman EL,Stevens MJ,Thomas PK,et al.A practical two⁃step quantitative clinical and electrophysiological assessment for the diag⁃nosis and staging of diabetic neuropathy[J].Diabetes Care,1994,17(11):1281-1289.
[9]汤晓芙.临床肌电图学[M].北京:北京医科大学中国协和医科大学联合出版社,1995:29-64.
[10]Xu Q,Pan J,Yu J,et al.Meta⁃analysis of methylcobalamin alone and in combination with lipoic acid in patients with diabetic peripheral neuropathy[J].Diabetes Res Clin Pract,2013,101(2):99-105.
[11]Microvascular Complications and Foot Care[J].Diabetes Care,2016,39 Suppl 1:S72-S80.
[12]Perkins BA,Olaleye D,Zinman B,et al.Simple screening tests for peripheral neuropathy in the diabetes clinic[J].Diabetes Care,2001,24(2):250-256.
[13]Jiang DQ,Li MX,Ma YJ,et al.Efficacy and safety of prostaglandin E1 plus lipoic acid combination therapy versus monotherapy for patients with diabetic peripheral neuropathy[J].J Clin Neurosci,2016,27:8-16.
[14]中华医学会神经病学分会肌电图与临床神经电生理学组,中华医学会神经病学分会神经肌肉病学组.糖尿病周围神经病诊断和治疗共识[J].中华神经科杂志,2013,46(11):787-789.
[15]Itoh Y,Yasui T,Kakizawa H,et al.The therapeutic effect of lipo PGE1 on diabetic neuropathy⁃changes in endothelin and various angiopathic factors[J].Prostaglandins Other Lipid Mediat,2001,66(3):221-234.
[16]Smith TP,Haymond T,Smith SN,et al.Evidence for the endothelin system as an emerging therapeutic target for the treatment of chronic pain[J].J Pain Res,2014,7:531-545.
[17]Singh R,Kishore L,Kaur N.Diabetic peripheral neuropathy:current perspective and future directions[J].Pharmacol Res,2014,80:21-35.
[18]王淑芹,马爱国,孙永叶,等.蚕茧、马齿苋对2型糖尿病大鼠糖脂代谢影响的实验研究[J].国际中医中药杂志,2009,31(5):395-396.
[19]范 颖,李 新.黄芪部分有效部位对糖尿病模型大鼠氧化应激的影响及其交互关系[J].中华中医药杂志,2014,29(11):3432-3436.
[20]高雪可,王 叨,张靖宇,等.丹参酮ⅡA对柔红霉素致大鼠心肌损伤的保护作用及其机制[J].中华肿瘤防治杂志,2015,22(23):1797-1802.
[21]杨 阳,巫永华,陈安徽,等.黄精提取物不同极性组分的体外抗氧化活性研究[J].食品工业,2016(4):42-45.
[22]郑林龙,蒋剑平,许海顺,等.响应面法优化土茯苓多糖的提取工艺及抗氧化活性研究[J].中华中医药杂志,2014,29(3):918-922.
[23]孟新珍,王晓雯,蒋晓燕,等.肉苁蓉总苷对清醒小鼠脑缺血再灌注致脑组织生化改变的影响[J].中华老年心脑血管病杂志,2004,6(1):16.
[24]杨红舟,周明眉,赵爱华,等.黄芩苷、小檗碱及黄芪多糖对醛糖还原酶的体外作用及合并效应研究[J].中药材,2009(8):1259-1261.
[25]王 磊,丁 黎,都 婧.丹参的研究近况[J].药品评价,2009,6(2):69-73.
[26]高 英,叶小利,李学刚,等.黄精多糖的提取及其对α⁃葡萄糖苷酶抑制作用[J].中成药,2010,32(12):2133-2137.
[27]刘文滨.中药肉苁蓉有效化学成分对神经系统作用研究[J].内蒙古中医药,2014,33(25):118-120.
Clinical effect of Rongdan oral liquid on diabetic peripheral neuropathy
LIANG Si⁃Hong1,CHEN Xiao⁃Yan1,HUANG Xiao⁃Chun1,XU Qi⁃Feng21Department of Endocrinology,2Department of Electromyography,the First Affiliated Hospital of Guangzhou Medical University,Guangzhou 510120,China
AIM:To evaluate the clinical efficacy of Rongdan oral liquid on diabetic peripheral neuropathy.METHODS:A total of 85 patients with diabetic peripheral neuropathy were enrolled in the study,and randomly divided into Rongdan oral liq⁃uid group(Rongdan group,n=34),methylcobalamine group(n=34),and control group(n=17).Therapeutic effect was assessed according to clinical symptoms and physical examinations by using Michigan Neuropathy Screening Instrument(MNSI),electrophysiological test and serum biomarkers,which included cystatin⁃C(Cys⁃C),endothelin⁃1(ET⁃1)and so on.During the follow⁃up medication,it is necessary to record the adverse reac⁃tions of medication.RESULTS:No significant differences were found among three groups of the baseline of blood glucose,Cys⁃C,ET⁃1,MNSI scores,nerve conduction velocity(NCV)and ampli⁃tude.Serum level of Cys⁃C and ET⁃1 after Rongdan intervention was significantly lower than those of baseline,with statistically significant differences(P<0.05).While no differences were no⁃ticed between baseline and after intervention in methylcobalamine group,and the serum level of ET⁃1 was increased than before.There was no obvious change of Cys⁃C.Compared with the base⁃line,MNSI scores after intervention decreased significantly in Rongdan group and methylcobalamine group,with statistically significant differences(P<0.05),There were no statistically significant differences between Rongdan group and methylcobal⁃amine group in ΔMNSI scores(P>0.05).Compared with the baseline,NCV and amplitude after intervention increased signifi⁃cantly in Rongdan group and methylcobalamine group,while a decrease was found in control group after 12 weeks,with statisti⁃cally significant differences(P<0.05).ΔNCV and Δamplitude in Rongdan group and methylcobalamine group were significantly higher than those of control group,with statistically significant differences(P<0.05).There were no differences between Rong⁃ dangroupandmethylcobalaminegrouponΔNCV,while Δamplitude in Rongdan group was significantly higher than that of methylcobalamine group,with statistically significant differences(P<0.05).CONCLUSION:There were significant improve⁃ments of clinical manifestation,nerve conduction velocity and amplitude in the Rongdan group after Rongdan oral liquid inter⁃vention.Furthermore,Rongdan oral liquid was more effective in ameliorating cracks of dry skin and amplitude than methylcobal⁃amine.Serum of Cys⁃C and ET⁃1 was significantly lower than that of baseline.Rongdan oral liquid is effective and safe in the treat⁃ment of diabetic peripheral neuropathy.
Rongdan oral liquid;diabetic peripheral neuropa⁃thy;nerveconductionvelocity;endothelin;anti⁃ganglioside antibody
R587.2
A
2095⁃6894(2017)04⁃34⁃06
2016-12-20;接受日期:2017-01-08
梁思虹.硕士.研究方向:糖尿病周围神经病变.E⁃mail:lshzixi@126.com
陈小燕.博士,主任医师.研究方向:糖尿病慢性并发症.
E⁃mail:gzscxy@126.com

