血浆EGF水平对乳腺癌新辅助化疗疗效的预测价值
王佳, 马哿, 黄华兴, 梁梦迪, 李明卉, 夏添松
论 著
血浆EGF水平对乳腺癌新辅助化疗疗效的预测价值
王佳, 马哿, 黄华兴, 梁梦迪, 李明卉, 夏添松
目的 探讨血浆表皮生长因子(EGF)水平变化对于新辅助化疗疗效的预测价值。方法 检测2015年9月20日至2016年5月31日江苏省人民医院乳腺外科空心针穿刺活检证实为浸润性导管癌的49例女性患者(乳腺癌组)新辅助化疗前后血浆EGF水平,对照组为同期入院穿刺活检证实为乳腺纤维腺瘤的36例女性患者。新辅助化疗方案为EC-T(表阿霉素75 mg/m2静滴,环磷酰胺600 mg/m2静滴,序贯多西他赛100 mg/m2静滴),21天为1个周期,术前给予8周期化疗。血浆EGF检测采用ELISA法。分析两组患者血浆EGF水平差异,乳腺癌患者化疗前血浆EGF水平与临床病理特征的关系,以及新辅助化疗前后不同疗效组间EGF的变化情况。结果 乳腺癌组患者血浆EGF明显高于对照组(P<0.05)。血浆EGF水平与患者年龄、淋巴结转移情况以及术前穿刺病理标本的激素受体状态、HER-2状态均无关。化疗前两组患者EGF水平相近,化疗后化疗反应4~5级组EGF水平明显低于化疗反应1~3级组(P<0.05)。化疗反应4~5级组EGF化疗后水平/化疗前水平明显低于1~3级组(P<0.05)。化疗反应性较差的患者化疗后血浆EGF水平明显上升(P<0.05),化疗反应性较好的患者化疗后血浆EGF水平明显下降(P<0.05)。结论 血浆EGF可能与新辅助化疗的疗效相关,监测血浆EGF水平变化对预测乳腺癌新辅助化疗疗效有一定的作用。
乳腺癌; 新辅助化疗; 表皮生长因子; 疗效预测
乳腺癌新辅助化疗是目前针对局部晚期乳腺癌的标准治疗之一。新辅助化疗可以达到肿瘤降期的目的,使部分不可手术的乳腺癌患者获得手术机会,或满足部分不可保乳患者的保乳意愿。然而不同患者对化疗的敏感性各不相同。无效或低效新辅助化疗不但延误患者的治疗,也给患者增加无谓的经济负担。目前,新辅助化疗疗效的监测主要依靠影像学方法,但无论是乳腺超声还是磁共振成像,对于疗效的评估都存在一定程度的滞后。如何有效预测患者化疗敏感性是乳腺癌新辅助化疗所面临的重要问题之一。
表皮生长因子(epidermal growth factor,EGF)最早由Levi-Montalcini等[1]发现,是含有53个氨基酸残基的单链多肽类物质。EGF是表皮生长因子受体(epidermal growth factor receptor,EGFR)的配体之一,是一种强效的有丝分裂促进因子。近年来,EGF在肿瘤的发生发展中的作用受到广泛关注。目前,大量研究已经证实EGFR与头颈部恶性肿瘤、消化系统肿瘤、非小细胞肺癌等恶性肿瘤存在密切关系[2-4]。在乳腺癌中,已有多项研究表明EGFR/EGF信号通路在乳腺癌的侵袭转移中发挥重要作用且与不良预后相关[5-6]。但是,血浆游离EGF水平与乳腺癌患者化疗疗效的关系,尤其是在新辅助化疗疗效的预测中的作用研究尚少。本研究通过观察49例局部晚期乳腺癌患者新辅助化疗前后的血浆EGF水平,探讨血浆EGF水平变化对于新辅助化疗疗效的预测价值。
1 资料与方法
1.1 一般资料 乳腺癌患者外周血标本取自2015年9月20日至2016年5月31日江苏省人民医院乳腺外科空心针穿刺活检证实为浸润性导管癌的49例女性患者,平均年龄49.8岁。对照组为同期入院穿刺活检证实为乳腺纤维腺瘤的36例女性患者,平均年龄36.9岁。采血时间为患者首次入院当日,接受新辅助化疗的乳腺癌患者在化疗结束后,术前进行第二次采血。所有患者均为清晨空腹采血。采血材料为EDTA抗凝真空采血管,每次采血量约为3 ml,采血后2 h内进行血浆分离,置于-80℃保存待测。
1.2 治疗方案 所有乳腺癌患者均于术前行空心针穿刺活检,穿刺标本由江苏省人民医院病理科行免疫组化染色。化疗方案为EC-T:表阿霉素75 mg/m2静滴、环磷酰胺600 mg/m2静滴,序贯多西他赛100 mg/m2静滴。21天为1个周期,术前给予8周期化疗。化疗结束后行乳房全切术+前哨淋巴结活检±腋窝淋巴结清扫术。
1.3 血浆EGF测定 采用酶联免疫吸附试验测定血浆EGF水平。试剂盒购自杭州联科生物技术股份有限公司,具体操作严格按照说明书执行。根据说明书绘制EGF标准品浓度与吸光度标准曲线,并按照标准曲线计算样品EGF浓度。
1.4 疗效评价 新辅助化疗的疗效评价根据术后病理Miller-Payene分级系统,将化疗前粗针穿刺标本与化疗后的手术标本进行比较,根据残余的细胞丰度进行分级。1级:浸润性癌细胞无改变或仅个别癌细胞发生改变,癌细胞数量总体未减少;2级:浸润性癌细胞轻度减少,但总数量仍高,癌细胞减少不超过30%;3级:浸润性癌细胞减少介于30%~90%;4级:浸润性癌细胞显著减少超过90%,仅残存散在的小簇状癌细胞或单个癌细胞;5级:原肿瘤瘤床部位已无浸润性癌细胞,但可存在导管原位癌[7]。
1.5 统计学方法 采用SPSS 21.0进行统计学分析。不同组别血浆EGF表达水平均用均数±标准差表示,行独立样本t检验或配对t检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 两组血浆EGF水平比较 检测结果显示,乳腺癌组血浆EGF含量为(74.81±39.16)pg/ml,明显高于对照组的(26.26±25.10)pg/ml,差异有统计学意义(P<0.05),见图1。
2.2 血浆EGF水平与乳腺癌分期及分子病理特征的关系 乳腺癌组血浆EGF水平与患者的年龄、淋巴结转移情况以及术前穿刺病理标本的激素受体状态、HER-2状态均无关(均P>0.05),见表1。
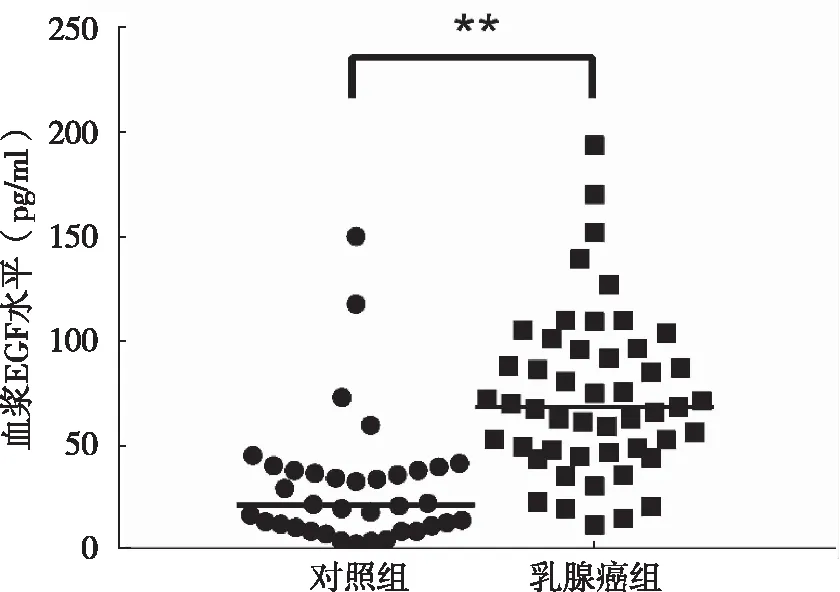
图1 乳腺癌组与对照组患者血浆EGF的表达水平,** P<0.001
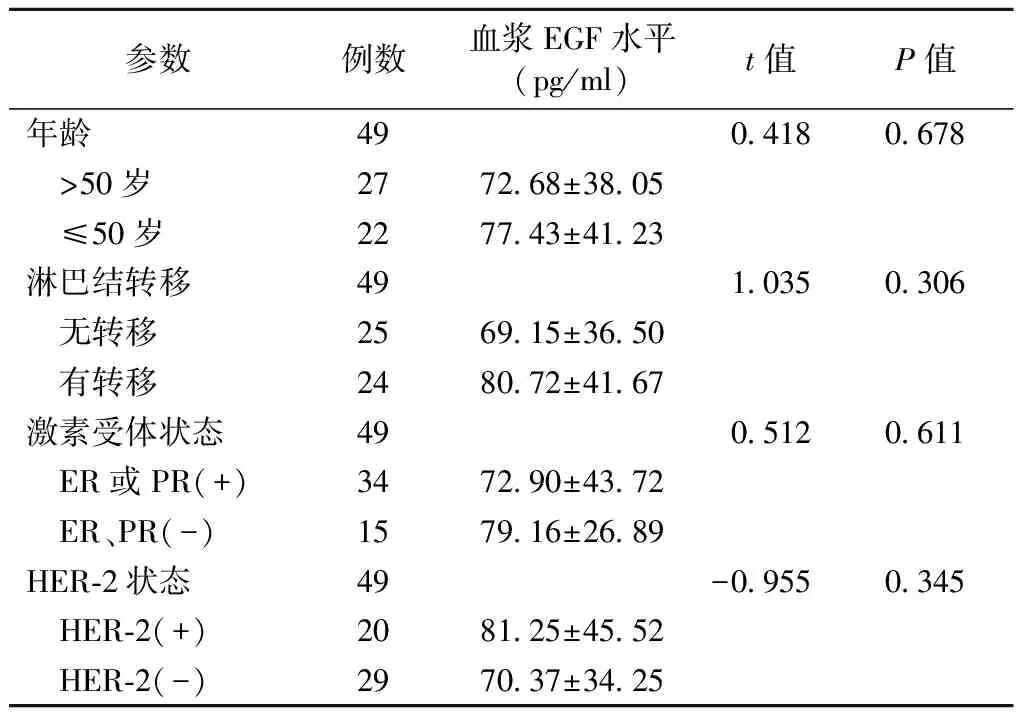
表1 乳腺癌患者血浆EGF水平与临床病理特征的关系
2.3 新辅助化疗前后血浆EGF水平与患者化疗疗效的关系 49例乳腺癌患者均完成新辅助化疗全疗程治疗。化疗后根据Miller-Payne分级评估患者病理反应性:1级8例,2级9例,3级11例,4级13例,5级8例。1~3级占57.14%(28/49),4~5级占4.86%(21/49)。化疗前1~3级组与4~5级组患者的血浆EGF水平分别为(79.08±45.38)pg/ml和(69.12±29.01)pg/ml,差异无统计学意义(P>0.05)。Miller-Payne分级化疗反应4~5级组的血浆EGF水平为(33.38±29.80)pg/ml,明显低于化疗反应1~3级组的(132.15±72.13)pg/ml(P<0.05)。进一步比较这两组间血浆EGF指标在化疗前后的变化,可以发现化疗反应4~5级组血浆EGF化疗后水平/化疗前水平明显低于1~3级组(P<0.05),见表2。根据疗效分组后,分别比较两组患者化疗前后的血浆EGF变化,可以发现化疗反应性较差的患者化疗后血浆EGF水平明显上升(P<0.05),而化疗反应性较好的患者化疗后血浆EGF水平明显下降(P<0.05),见图2。
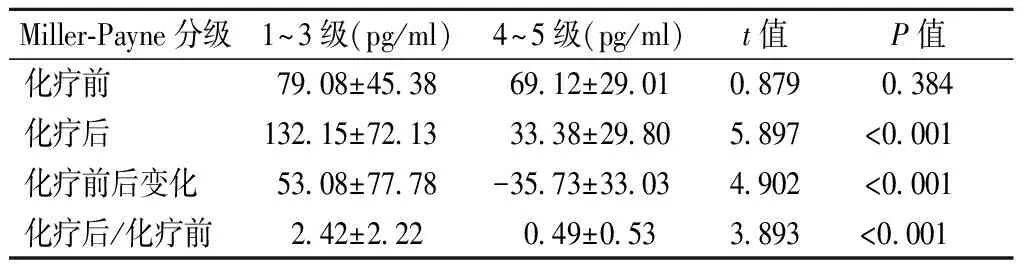
表2 血浆EGF水平与新辅助化疗疗效间的关系
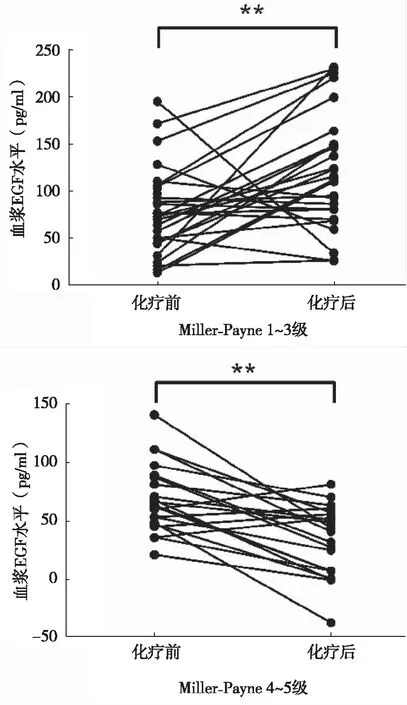
图2 新辅助化疗患者化疗前后血浆EGF水平的变化,**P<0.001
3 讨论
本研究显示,乳腺癌患者血浆中EGF水平明显高于乳腺纤维腺瘤患者,提示EGF与乳腺癌的发生密切相关。已有研究证实,EGF水平在肺癌、胃癌等患者血清中水平升高[8-9]。在乳腺癌的相关研究中,国内学者报道乳腺癌患者血清中EGF水平明显高于对照组,而EGF水平在发生骨转移的乳腺癌患者血清中升高更加明显[10],这一研究结果与本研究一致。在本研究中,不同亚型或分期的乳腺癌患者血浆EGF水平的差异无统计学意义。新辅助化疗后共21例患者化疗反应较好,结果表明疗效好的患者化疗后血浆EGF的水平下降明显,而在疗效较差的28例患者中血浆EGF水平未见降低。曲娴等[11]发现肿瘤细胞自身也可以分泌EGF,进而作用于细胞膜表面EGFR达到促进增殖的效应。曾有学者检测了荷瘤小鼠化疗前后血清EGF的水平变化,证明阿霉素能以浓度依赖性的方式降低血清EGF蛋白水平,进而降低肿瘤细胞的分裂增殖[12]。部分患者接受化疗可能正是打破了EGF/EGFR这一自身刺激的环路抑制了肿瘤细胞的增殖,同时导致血浆EGF水平急剧下降,而对于化疗不敏感的患者,血浆EGF水平则保持在相对较高的水平。
新辅助化疗后原发灶达到病理完全缓解的患者可以显著延长无进展生存期,化疗过程中病理缓解分级4~5级的患者血浆EGF水平明显下降,提示血浆EGF可能与新辅助化疗的疗效相关。血浆EGF水平监测对乳腺癌新辅助化疗的疗效存在一定的预测作用。
[1] Levi-montalcini R, Cohen S. Effects of the extract of the mouse submaxillary salivary glands on the sympathetic system of mammals[J]. Ann N Y Acad Sci, 1960, 85: 324-341.
[2] Ang KK, Berkey BA, Tu X, et al. Impact of epidermal growth factor receptor expression on survival and pattern of relapse in patients with advanced head and neck carcinoma[J]. Cancer Res, 2002, 62(24): 7350-7356.
[3] Wang L, Yuan H, Li Y, et al. The role of HER3 in gastric cancer[J]. Biomedecine & pharmacotherapie, 2014, 68(6): 809-812.
[4] Paek AR, Lee C, You HJ. A role of zinc-finger protein 143 for cancer cell migration and invasion through ZEB1 and E-cadherin in colon cancer cells[J]. Mol Carcinog, 2014,53 Suppl 1:E161-E168.
[5] Hardy KM, Booth BW, Hendrix MJ, et al. ErbB/EGF signaling and EMT in mammary development and breast cancer[J]. J Mammary Gland Biol Neoplasia, 2010, 15(2): 191-199.
[6] McIntyre E, Blackburn E, Brown PJ, et al. The complete family of epidermal growth factor receptors and their ligands are co-ordinately expressed in breast cancer[J]. Breast Cancer Res Treat, 2010, 122(1): 105-110.
[7] 杨文涛, 步宏. 乳腺癌新辅助化疗后的病理诊断专家共识[J]. 中华病理学杂志, 2015, 44(4): 232-236.
[8] Blanco-Prieto S, Vázquez-Iglesias L, Rodríguez-Girondo M, et al. Serum calprotectin, CD26 and EGF to establish a panel for the diagnosis of lung cancer[J]. PLoS One, 2015, 10(5): e0127318.
[9] Masiak W, Szponar A, Chodorowska G, et al. Evaluation of endostatin and EGF serum levels in patients with gastric cancer[J]. Pol Przegl Chir, 2011, 83(1): 42-47.
[10] 宋红蕾, 卢绪章, 毕延智, 等. 血清EGF及TRACP-5b水平在乳腺癌患者骨转移中的应用价值[J]. 甘肃医药, 2012, 31(12): 894-895.
[11] 曲娴, 陈杰, 刘彤华, 等. 人结肠癌中EGFR、EGF及TGF-α的基因表达[J]. 中国医学科学院学报, 1994, 16(4): 259-263.
[12] 郭春宝, 陈峰, 金先庆. 荷瘤小鼠多柔比星化疗后表皮生长因子(EGF)表达的检测[J]. 中国癌症杂志, 2004, 14(3): 251-253,257.
Predictive role of plasma EGF level for efficacy of neoadjuvant chemotherapy in patients with breast cancer
WANGJia1,MAGe1,HUANGHuaxing2,LIANGMengdi1,LIMinghui1,XIATiansong1.
(1.DepartmentofBreastSurgery,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,China;2.DepartmentofGeneralSurgery,NanjingMedicalUniversity,Nanjing211166,China)
Correspondingauthor:XIATiansong,Email:xiatsswms@163.com
Objective To explore the predictive value of the epidermal growth factor (EGF) in plasma in neoadjuvant chemotherapy (NCT) in breast cancer. Methods A total of 49 patients with breast carcinoma and 36 females with fibroadenoma from Department of Breast Surgery, the First Affiliated Hospital of Nanjing Medical University from September 20, 2015 to May 31, 2016 was included in this study. Patients with breast cancer received EC-T regimen (epirubincin 75 mg/m2iv d1, cyclophosphamide 600 mg/m2iv d1, and docetaxel 100 mg/m2iv d1) for 8 cycles with 21 days per cycle. The level of plasma EGF was detected by ELISA. The difference between patients with breast cancer and the negative control group was analyzed. The relationship between clinical efficacy of NCT, clinicopathological features and plasma EGF was analyzed. Results Levels of plasma EGF were significantly increased in patients with breast cancer compared with the control group (P<0.05). No significant differences were observed among age, lymph node metastasis, biopsy results and HER-2 status. The levels of plasma EGF of pre-neoadjuvant chemotherapy between different groups of chemotherapy response showed no significance. The plasma EGF level of the chemotherapy response 4~5 grade group decreased significantly after NCT (P<0.05). The plasma EGF level of 1~3 grade group increased significantly after NCT (P<0.05). The plasma EGF level was significantly increased in patients with poor response to chemotherapy (P<0.05), and significantly decreased in patients with better response to chemotherapy after NCT (P<0.05). Conclusions The plasma EGF level is related with the efficacy of NCT. Monitoring of the level of plasma EGF may predict the efficacy of NCT in breast cancer.
Breast cancer; Neoadjuvant chemotherapy; Epidermal growth factor; Efficacy prediction
210029 江苏 南京,南京医科大学第一附属医院 乳腺病科(王佳,马哿,梁梦迪,李明卉,夏添松);211166 江苏 南京,南京医科大学 外科学总论教研室(黄华兴)
夏添松,Email:xiatsswms@163.com
10.3969/j.issn.1674-4136.2017.01.003
1674-4136(2017)01-0009-04
2016-12-20][本文编辑:李庆]

