饵料与底质对三角帆蚌稚蚌早期生长的影响
张佳康,马学艳,闻海波1、,邹军,徐跑1、,华丹,顾若波1、
(1.南京农业大学无锡渔业学院,江苏无锡214081;2.中国水产科学研究院淡水渔业研究中心,中美淡水贝类种质资源保护及利用国际联合实验室,江苏无锡214081;3.中国水产科学研究院淡水渔业研究中心,农业部淡水鱼类遗传育种与养殖生物学重点开放实验室,江苏无锡214081)
饵料与底质对三角帆蚌稚蚌早期生长的影响
张佳康1,2,马学艳2、3,闻海波1、2、3,邹军1、2,徐跑1、2、3,华丹2,顾若波1、2、3
(1.南京农业大学无锡渔业学院,江苏无锡214081;2.中国水产科学研究院淡水渔业研究中心,中美淡水贝类种质资源保护及利用国际联合实验室,江苏无锡214081;3.中国水产科学研究院淡水渔业研究中心,农业部淡水鱼类遗传育种与养殖生物学重点开放实验室,江苏无锡214081)
为寻找三角帆蚌Hyriopsis cumingii合适的饵料和底质,提高三角帆蚌稚蚌成活率,在水温(24±1)℃下分两个阶段测试了不同饵料和底质对三角帆蚌稚蚌的生长影响,第一阶段测试了两种底质(黄泥、黄泥加钙粉)和两种饵料(Nanno 3600藻、Shellfish diet 1800藻)对1~30 d稚蚌成活和生长的影响,第二阶段测试了5种饵料(Nanno 3600藻、Shellfish diet 1800藻、普通小球藻、四尾栅藻、卵囊藻)对31~60 d稚蚌成活及生长的影响。结果表明:第一阶段中,投喂Nanno 3600藻且以黄泥为底质的组(A3)与投喂两种混合藻且以黄泥为底质的组(A1)稚蚌成活率无显著性差异(P>0.05),但二者均显著高于投喂两种混合藻且以黄泥+钙粉为底质的组(A2)(P<0.05),A1、A2、A3组均与投喂Shellfish diet 1800藻且以黄泥为底质的组(A4)和池塘水养殖且不投喂的组(A5)呈极显著性差异(P<0.01),A2组稚蚌生长最快,壳长显著高于A1、A3组(P<0.05),A1、A2、A3组极显著高于A4、A5组(P<0.01);第二阶段中,池塘水养殖组(B5)成活率显著高于卵囊藻组(B1)、小球藻组(B2)、Nanno 3600藻组(B4)(P<0.05),极显著高于四尾栅藻组(B3)(P<0.01),B5组与B4组稚蚌壳长无显著性差异(P>0.05),均显著高于B1、B2组(P<0.05),极显著高于B3组(P<0.01)。研究表明:稚蚌在1~30 d时添加藻类可提高稚蚌存活率,且以微拟球藻效果最好,底质中添加钙粉有利于稚蚌生长;稚蚌在31~60 d阶段,投喂微拟球藻更有利于稚蚌的生长。
三角帆蚌稚蚌;饵料;底质;成活率
三角帆蚌Hyriopsis cumingii是中国特有的淡水经济贝类[1-2],是最重要的淡水优质育珠蚌,目前,超过70%的世界淡水珍珠由三角帆蚌培育而成,其培育的珍珠质地细腻、光滑,色泽鲜艳,质量佳。由于三角帆蚌特殊的滤水特性,其在生态养殖、水质净化上也有着广泛的应用[3-7],如用于池塘控制蓝藻等[8]。
绝大多数蚌类的生活史均有一个寄生过程[9-10],它们需要寄生在鱼体上才能完成从钩介幼虫到稚蚌的变态,寄主鱼在蚌类的生活史中扮演着重要角色。体外培养是指在没有寄主鱼的情况下完成钩介幼虫非寄生变态发育成为稚蚌的过程,因此,钩介幼虫体外培养逐渐成为贝类种质资源恢复较为先进的手段之一。近年来,研究者已对42个物种培养成功且获得较高的变态率[11]。在国内,闻海波等[12]对三角帆蚌钩介幼虫进行了体外培养试验,并已取得了一定的进展。三角帆蚌现在主要靠人工培育种苗供应生产所需,其生命力非常脆弱,特别是壳长小于1 cm的幼蚌死亡率很高,稚蚌期是直接影响到人工繁育成败的关键阶段[13]。稚蚌的高死亡率很可能是由于缺乏足够适口的饵料生物和相适应的环境造成的[14-15],因此,饵料和底质是贝类人工繁育成功的两个关键因素[16-17]。
目前,国内外有许多对蚌科类物种食性分析的研究报道[18-19],但对三角帆蚌稚蚌的食性及底质环境的实验研究较少。本试验中,选取体外培养的三角帆蚌稚蚌,测试了不同底质及饵料条件对1~30 d、31~60 d两个阶段稚蚌的影响。通过对比稚蚌的成活率及生长情况,评估了不同饵料及底质对三角帆蚌稚蚌的影响,旨在寻找三角帆蚌合适的饵料和底质,提高稚蚌成活率,为三角帆蚌的人工繁殖提供基础依据。
1 材料与方法
1.1 材料
试验用三角帆蚌采自中国水产科学研究院淡水渔业研究中心南泉养殖基地,均为4龄成熟母蚌。试验用黄颡鱼也取自该基地,体质量为(90±25) g,采血前在循环养殖系统中暂养2周,每日早、中、晚各投喂黄颡鱼配合饲料1次。
1.2 方法
1.2.1 试验方法 从4月中旬开始,检查雌蚌外鳃丝是否有成熟钩介幼虫,判断钩介幼虫成熟与否的标准可依据闻海波等[12]采用的方法。
试验中将有成熟钩介幼虫的雌蚌外壳洗净,使用开壳器于雌蚌后端轻轻打开,用5 mL注射器吸入灭菌纯水,穿刺雌蚌外鳃,将纯水注入,此时成熟的钩介幼虫会随水流出至事先准备好的灭菌烧杯中;向烧杯中加入无菌纯水200 mL,洗去残留的组织、黏液和钩介幼虫的碎壳,重复3~4次;然后向烧杯中加入配制好的抗生素混合液100 mL,清洗钩介幼虫,重复3~4次。钩介幼虫清洗完成后,应尽快移入培养基中,避免因放置过久对其活性产生影响。
1.2.2 血清样品的制备 选取体格健壮、外表无伤的黄颡鱼作为血清采集试验鱼,采血前,将试验鱼用50~100 mg/L的MS-222[生工生物工程(上海)股份有限公司]麻醉,从尾静脉采血[20],注射器用肝素钠润洗;采集的血液以3000 r/min离心10 min,取上清液;用0.22 μm无菌过滤器过滤,于超低温冰箱(-80℃)中保存备用。
1.2.3 试验饵料及底质 Nanno 3600藻(微拟球藻Nannochloropsis oculata)和Shellfish diet 1800藻(包含4种藻:Isochrysis sp.,Pavlova sp.,Thalossiosira weissflogii,Tetraselmis sp.)购自Reed Mariculture Inc.,两种藻均为浓缩藻液。普通小球藻Chlorella vulgaris、四尾栅藻Scenedesmus quadricauda、卵囊藻Oocystis sp.藻种购自中国科学院野生生物种质库(淡水藻种库),藻种在试验前两周开始培养,培养基为BG-11。藻类使用前先使用曝气除氯自来水清洗,在离心机上离心10 min,倒出上清液,重复5次,以降低藻液中的氨氮。
钙粉的获得是将三角帆蚌贝壳晒干后打碎,过 200目筛网,水洗后高温灭菌并烘干。底泥为未施肥的花园土,加入水后过200目筛网,并静置于水桶中,待沉淀后倒出上清液,泥浆经微波炉高温处理10 min,冷却后再使用。
1.2.4 钩介幼虫的体外培养 培养配方及钩介幼虫变态标准参照Uthaiwan等[21]的方法,培养液体积为3.5 mL,其中选用黄颡鱼的血清作为幼虫体外培养配方的重要营养源,以L-15培养液[购自生工生物工程(上海)股份有限公司]为基础培养液,每个培养皿(60 mm×15 mm)幼虫数量为(300±10)只,每3 d换液1次,设置5个重复。将培养皿置于生化培养箱(上海博迅实业有限公司医疗设备厂SPX-100B-Z)中,温度控制在(24±0.5)℃。
1.2.5 底质和藻类对1~30 d稚蚌成活及生长的影响试验 取刚变态成功的稚蚌,试验方案见表1,每组设置3个重复,每个重复放100只稚蚌,分别放在塑料箱子(32 cm×21 cm×10 cm)中培育,养殖水体为5 L。将自来水和池塘水分别放于300 L与140 L的塑料水箱中充分曝气,试验水温控调在(24±1)℃,气泵分管悬吊于每个箱子上方进行增氧。利用虹吸法每天换水1/2,换水时用200目筛网过滤,确保稚蚌不丢失。换水后再投喂藻类并添加少量底质(添加量根据稚蚌大小控制,其中黄泥和钙粉的添加比例为1∶1)。藻类投喂密度为1×106cells/mL,A1、A2组中两种藻类投喂比例为1∶1,投喂时用手掌翻动水体,使藻类与水体充分混匀。养殖30 d后,使用气压式喷壶冲洗底泥,将稚蚌洗脱于培养皿中,在光学显微镜(Olympus CX41)下拍照、测量稚蚌壳长(精确至0.01 mm),并使用藻类计数器统计成活率。
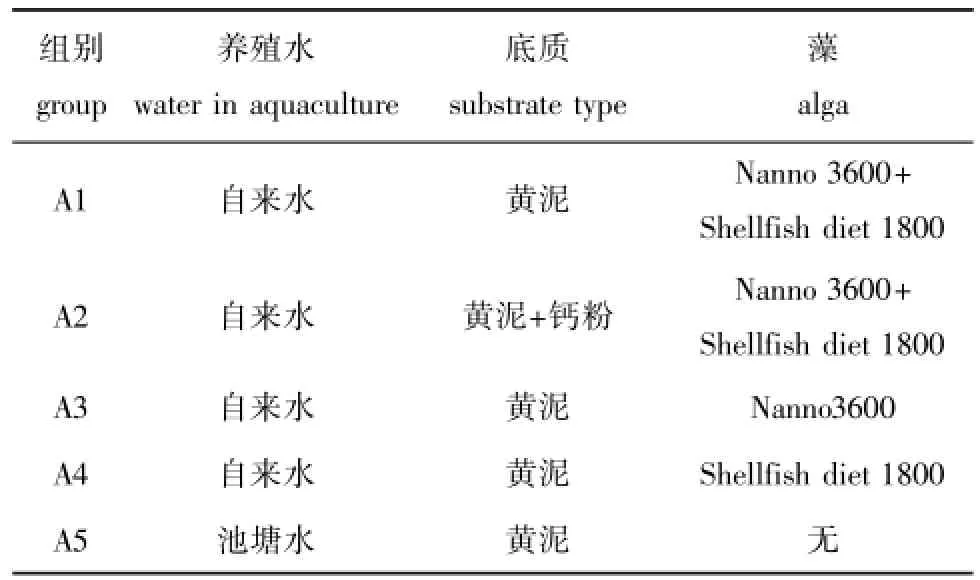
表1 第1~30天各组底质与饵料试验方案Tab.1 Testing plan of substrate and diet on group from 1 d to 30 d
从养殖三角帆蚌稚蚌的池塘水取样固定,并分析浮游植物组成及数量,结果见表2。
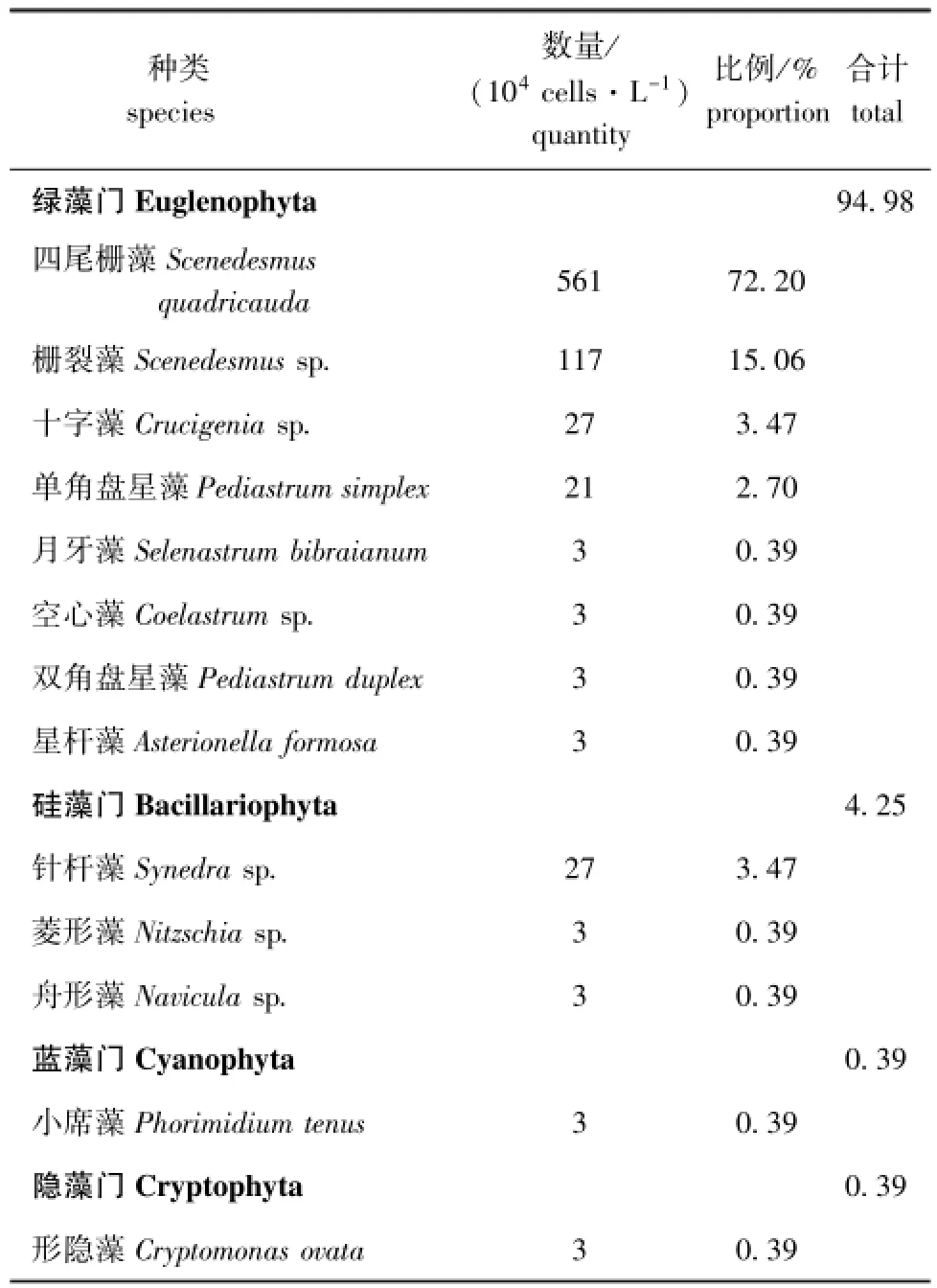
表2 池塘水中浮游植物组成及数量Tab.2 Species composition and quantity of phytoplankton in water of the ponds
1.2.6 藻类对31~60 d稚蚌成活及生长的影响试验 取池塘水养殖30 d的稚蚌,测量得稚蚌壳长为(2.57±0.28)mm,用曝气后的自来水暂养1 d,设定为B1、B2、B3、B4、B5组,以黄泥为底质,试验方案见表3,每组同样设置3个重复,每个重复放150只。养殖方式同第一阶段,其中每种藻类投喂密度为5×105cells/mL。养殖30 d后,将稚蚌洗脱于玻璃培养皿中,在光学显微镜(Olympus CX41)下拍照、测量幼蚌壳长(精确至0.01 mm),并统计成活率。
1.2.7 水质检测 对试验养殖用水进行检测和分析,使用Palintest水质检测仪及配套试剂检测溶解氧、pH、氨氮、亚硝酸盐,其中溶氧>8.68 mg/L, pH为7.6~8.4,氨氮<0.05 mg/L,亚硝酸盐氮<0.01 mg/L。
1.3 数据处理
试验结果采用SPSS 20软件进行统计分析,采用One-Way ANOVA进行单因素方差分析,用最小显著性差异法进行组间多重比较。
2 结果与分析
2.1 两种藻类及两种底质对变态稚蚌生长的影响
从表4可见,投喂Nanno 3600单一藻且以黄泥为底质的组(A3)稚蚌成活率最高,为42.33%±2.08%,投喂Shellfish diet 1800藻且以黄泥为底质的组(A4)成活率最低,仅为29.33%± 2.08%。多重比较结果表明:A3组与投喂两种混合藻且以黄泥为底质的组(A1)的成活率无显著性差异(P>0.05),但与投喂两种混合藻且以黄泥+钙粉为底质的组(A2)有显著性差异(P<0.05),A1、A2、A3组均极显著高于A4组和A5组(P<0.01);A2组稚蚌生长最快,壳长显著高于A1、A3组(P<0.05),A1、A2、A3组壳长均极显著高于A4、A5组(P<0.01),A5组壳长显著高于A4组(P<0.05)。

表4 藻类与底质对稚蚌存活和生长的影响Tab.4 Effects of alga and substrate on growth and survival of juvenile freshwater mussel
2.2 4种藻类在相同底质下对变态稚蚌成活和生长的影响
从表5可见,池塘水养殖组(B5)成活率最高,为57.33%±2.37%,投喂四尾栅藻组(B3)成活率最低,仅为26.67%±3.33%。多重比较结果表明:B5组成活率显著高于卵囊藻组B1、小球藻组B2、Nanno 3600藻组(B4)(P<0.05),极显著高于B3组(P<0.01);B5组与B4组稚蚌壳长无显著性差异(P>0.05),但均极显著高于B1、B2、B3组(P<0.01),B1组与B2组壳长无显著性差异(P>0.05),B3组与其他组间有极显著性差异(P<0.01)。

表5 藻类对稚蚌存活和生长的影响Tab.5 Effects of alga on growth and survival of juvenile freshwater mussel
3 讨论
3.1 非寄生变态发育稚蚌的生长发育
Uthaiwan等[21]用4种鱼血清和马血清对一种帆蚌钩介幼虫进行体外培养试验,结果表明,用鲤血清培养的钩介幼虫成活率及变态率显著高于用其他4种血清,并证实只有鲤血清培养的稚蚌可以存活2个月以上,而用尼罗罗非鱼Oreochromis niloticus和杂交鲶Clarias macrocephalus×C.garienus血清培养的钩介幼虫只存活1个月,用马血清培养的钩介幼虫只存活2~3周,用条纹鲶Pangasius pangasius血清培养的稚蚌只存活了1周。Reece[22]比较了鱼体寄生和利用马血清体外培养两种方法获得的Lampsilis fasciola稚蚌的变态率、后期生长和存活差异,结果显示,添加马血清体外培养的幼虫变态率为92%,显著高于鱼体寄生(69%),但鱼体寄生变态稚蚌生长比体外培养快,一周后鱼体寄生稚蚌的成活率为82%,而体外培养成活率仅为45%。从已开展的42种钩介幼虫的体外培养配方可知,不同蚌科钩介幼虫变态发育时对营养的需求不尽相同[13]。理论上,无论是体外培养还是鱼体寄生方式,只有满足了钩介幼虫的营养需求才能正常变态发育。因此,稚蚌的后期生长发育评估将有利于筛选出更加科学的钩介幼虫体外培养方法及配方。
3.2 底质对稚蚌生长的影响
适合的底质对稚蚌存活及生长具有重要作用[23-28]。Gatenby等[28-29]研究表明,Villosa iris稚蚌在底泥中的生长速度明显快于无底质条件下的。Isom等[30]研究发现,在Anodonta imbecilis稚蚌养殖时添加底泥可提高稚蚌成活率。Hua等[31]比较了在底泥(于河中采集,过200 μm筛网并高温灭菌)、细沙、石灰石和无底质条件下V.iris稚蚌的存活及生长,结果表明,底泥组的稚蚌成活率显著高于其他3组,而无底泥组稚蚌则全部死亡。本试验中测试了黄泥+钙粉对稚蚌存活和生长的影响,黄泥+钙粉组稚蚌的壳长显著大于同等饲养条件下的黄泥组,表明底质中的钙粉对稚蚌的生长起到了一定的作用,这与Hua等[31]的研究结果不同,推测钙粉补充了稚蚌生长所需的钙元素,单纯石灰石作为底质不能为稚蚌生长提供最适环境,稚蚌生长中必须添加底泥。底泥与钙粉添加的最佳比例需后续试验进行研究。
3.3 藻类对稚蚌生长的影响
淡水蚌类的饵料一般有藻类、浮游动物、细菌和底泥等[32],藻类被认为是稚蚌的最重要食物,其所占比例高达90%[16]。Gatenby等[28]用(3.0~5.0)×105cells/mL密度的藻类对V.iris进行投喂, 45 d时稚蚌成活率为66.5%。Hua等[31]测试了3.5×104、8.75×104、1.75×105cells/mL藻类密度对稚蚌成活率及生长的影响,结果表明,在3种藻类密度下稚蚌成活率及生长无显著性差异,且稚蚌30 d后成活率为40%。Kovitvadhi等[33]用4种藻混合物(小球藻Chlorella sp.、扭曲蹄形藻Kirchneriella incurvata、舟形藻Navicula sp.、胶球藻Coccomyxa sp.)对体外培养成功的0~60 d稚蚌Hyriopsis myersiana进行养殖试验,投喂密度为1.00×103cells/mL,60 d后稚蚌成活率为8.00%,用4种藻类单独和混合对60~120 d稚蚌投喂,结果表明,投喂K.incurvata组稚蚌成活率最高,为65.00%± 8.32%,只投喂Navicula sp.和Coccomyxa sp.组稚蚌全部死亡,混合组成活率仅为27.00%± 17.63%。Kovitvadhi等[34]用两种藻(小球藻、扭曲蹄形藻)对体外培养成功的0~60 d Hyriopsis myersiana稚蚌进行养殖试验,120 d后成活率为82.74%,推测成活率差异较大的原因是养殖系统的不同,也可能是投喂藻类不同的原因。本试验中投喂密度为2.0×106cells/mL,投喂组1~30 d成活率最高为40.33%,31~60 d成活率最高为43.33%,有研究显示,蚌类对藻类的吸收是被动吸收[18-19],对食物大小的选择上限为20~25 μm的藻类等悬浮颗粒[35],试验中通过显微镜观察稚蚌的肠道,显示稚蚌对所有试验藻类均有摄食。综合本研究与Kovitvadhi等[32-33]试验结果,笔者推断,投喂不适合的藻类会占据稚蚌肠道空间,但不会被其吸收,从而导致稚蚌营养不足而死亡。
本试验中,1~30 d的稚蚌,池塘水养殖组成活率及稚蚌壳长显著低于3个微拟球藻组,而31~60 d中池塘水养殖的稚蚌成活率显著高于其他组,而养殖稚蚌的池塘水中,四尾栅藻占总藻类的72.2%,是优势藻种,故稚蚌成活率显著高于投喂四尾栅藻组。这可能是由于刚完成变态发育的稚蚌,鳃丝等摄食器官未发育完全,不能像成蚌一样正常滤食水中藻类,而是主要靠斧足摄食,随着稚蚌生长活动能力增强,鳃丝及其他器官逐渐发育完全,滤食能力增强,能够滤食池塘水中藻类、细菌等,从而加快了稚蚌生长。
[1] 王小冬,王岩,王伟良,等.不同放养和管理模式下三角帆蚌养殖水体的水化学特征[J].水产学报,2008,32(2):303-308.
[2] Wang Y,Wang W L,Qin J G,et al.Effects of integrated combination and quicklime supplementation on growth and pearl yield of freshwater pearl mussel,Hyriopsis cumingii(Lea,1852)[J].Aquaculture Research,2009,40(14):1634-1641.
[3] 费志良,潘建林,徐在宽,等.三角帆蚌对水体悬浮物和叶绿素a消除量的研究[J].海洋湖沼通报,2005,11(2):40-45.
[4] Hosper S H.Biomanipulation,new perspectives for restoration of shallow,eutrophic lakes in the Netherlands[J].Hydrobiological Bulletin,1989,23(1):5-10.
[5] Richter A F.Biomanipulation and its feasibility for water quality management in shallow eutrophic water bodies in the Netherlands [J].Hydrobiological Bulletin,1986,20(1-2):165-172.
[6] Shapiro J,Wright D I.Lake restoration by biomanipulation:Round Lake,Minnesota,the first two years[J].Freshwater Biology,1984, 14(4):371-383.
[7] Way C M,Hornbach D J,Miller Way C A,et al.Dynamics of filter feeding in Corbicula fluminea(Bivalvia:Corbiculidae)[J].Canadian Journal of Zoology,1990,68(1):115-120.
[8] 杨东妹,陈宇炜,刘正文,等.背角无齿蚌滤食对营养盐和浮游藻类结构影响的模拟[J].湖泊科学,2008,20(2):228-234.
[9] 吴小平,梁彦龄,王洪铸,等.蚌科钩介幼虫的比较形态学研究:Ⅱ.六个种幼虫的形态[J].水生生物学报,2000,24(3): 252-256.
[10] Araujo R,Ramos M A.Description of the glochidium of Margaritifera auricularia(Spengler 1793)(Bivalvia,Unionoidea)[J]. Philosophical Transactions of the Royal Society B:Biological Sciences,1998,353:1553-1559.
[11] Lima P,Lima M L,Kovitvadhi U,et al.A review on the“in vitro”culture of freshwater mussels(Unionoida)[J].Hydrobiologia, 2012,691(1):21-33.
[12] 闻海波,顾若波,华丹,等.三角帆蚌钩介幼虫体外培养及变态稚贝的形态变化[J].武汉大学学报:理学版,2011,57(1): 57-62.
[13] 陈修报,杨健,闻海波,等.椭圆背角无齿蚌发育关键阶段形态结构以及寄生有效积温的研究[J].南京农业大学学报, 2010,33(4):100-104.
[14] Meghann E V.Development of a suitable diet for endangered juvenile oyster mussels,Epioblasma capsaeformis(Bivalvia:Unionidae),reared in a captive environment[D].Blacksburg,USA: Virginia Tech,2009.
[15] Beck K M.Development of an algal diet for rearing juvenile freshwater mussels(Unionidae)[D].Blacksburg,USA:Virginia Tech,2001.
[16] 王扬才,叶显峰.饵料藻类对贝类育苗的影响[J].齐鲁渔业, 2003,20(11):6-8.
[17] 龚世园,朱子义,杨学芬,等.网湖绢丝丽蚌食性的研究[J].华中农业大学学报,1997,16(6):589-593.
[18] 郑光明,魏青山.武昌南湖圆背角无齿蚌食性与生长的研究[J].华中农业大学学报,1999,18(1):62-67.
[19] 吴庆龙,陈宇炜,刘正文.背角无齿蚌对浮游藻类的滤食选择性与滤水率研究[J].应用生态学报,2005,16(12):2423-2427.
[20] 刘波,王美垚,谢骏,等.低温应激对吉富罗非鱼血清生化指标及肝脏HSP70基因表达的影响[J].生态学报,2011,31 (17):4866-4873.
[21] Uthaiwan K,Noparatnaraporn N,Machado J.Culture of glochidia of the freshwater pearl mussel Hyriopsis myersiana(Lea,1856)in artificial media[J].Aquaculture,2001,195(1-2):61-69.
[22] Reece F T.Studies on the in vitro propagation of freshwater mussels with implications for improving juvenile health[D].North Carolina:North Carolina State University,2014.
[23] Zimmerman L L.Propagation of juvenile freshwater mussels(Bivalvia:Unionidae)and assessment of habitat suitability for restoration of mussels in the Clinch River,Virginia[D].Blacksburg: Virginia Polytechnic Institute and State University,2003.
[24] Henley W F,Zimmerman L L,Neves R J,et al.Design and evaluation of recirculating water systems for maintenance and propagation of freshwater mussels[J].North American Journal of Aquaculture,2001,63(2):144-155.
[25] Hua Dan.Biology,captive propagation,and feasibility of pearl culture in the pink heelsplitter(Potamilus alatus)(Say,1817) (Bivalvia:Unionidae)[D].Blacksburg,VA,USA:Virginia Polytechnic Institute and State University,2005.
[26] Mummert A K.Evaluating the feasibility of rearing juvenile freshwater mussels in a flow-through pond system at white sulphur springs national fish hatchery[D].Blacksburg,VA,USA:Virginia Polytechnic Institute and State University,2001.
[27] 郭良勇,刘海映,陈雷,等.底质粒径和水温对不同规格毛蚶苗潜沙能力的影响[J].大连海洋大学学报,2016,31(3): 295-300.
[28] Gatenby C M,Neves R J,Parker B C.Influence of sediment and algal food on cultured juvenile freshwater mussels[J].Journal of the North American Benthological Society,1996,15(4):597-609.
[29] Gatenby C M,Parker B C,Neves R J.Growth and survival of juvenile rainbow mussels,Villosa iris(Lea,1829)(Bivalvia: Unionidae),reared on algal diets and sediment[J].The American Malacological Bulletin,1997,14(1):57-66.
[30] Isom B G,Hudson R G.Freshwater mussels and their fish hosts; physiological aspects[J].The Journal of Parasitology,1984,70 (2):318-319.
[31] Hua D,Neves R J,Jiao Y.Effects of algal density,water flow and substrate type on culturing juveniles of the rainbow mussel(Villosa iris)(Bivalvia:Unionidae)in a laboratory recirculating system [J].Aquaculture,2013,416-417:367-373.
[32] Kovitvadhi S,Kovitvadhi U,Sawangwong P,et al.Optimization of diet and culture environment for larvae and juvenile freshwater pearl mussels,Hyriopsis(Limnoscapha)myersiana Lea,1856 [J].Invertebrate Reproduction&Development,2006,49(1-2): 61-70.
[33] Kovitvadhi S,Kovitvadhi U,Sawangwong P,et al.A laboratoryscale recirculating aquaculture system for juveniles of freshwater pearl mussel Hyriopsis(Limnoscapha)myersiana(Lea,1856) [J].Aquaculture,2006,275(1-4):169-177.
[34] Boltovskoy D,Izaguirre I,Correa N.Feeding selectivity of Corbicula fluminea(Bivalvia)on natural phytoplankton[J].Hydrobiologia,1995,312(3):171-182.
[35] 费志良,吴军,赵钦,等.三角帆蚌对藻类滤食及消化的研究[J].淡水渔业,2006,36(5):24-27.
Effects of diet and substrate on early growth of juvenile freshwater mussel Hyriopsis cumingii
ZHANG Jia-kang1,2,MA Xue-yan2,3,WEN Hai-bo1,2,3,ZOU Jun1,2,XU Pao1,2,3,HUA Dan2,GU Ruo-bo1,2,3
(1.Wuxi Fisheries College,Nanjing Agricultural University,Wuxi 214081,China;2.Sino-US Cooperative Laboratory for Germplasm Conservation and Utilization of Freshwater Mollusks,Freshwater Fisheries Research Center,Chinese Academy of Fishery Sciences,Wuxi 214081,China;3.Key Laboratory of Genetic Breeding and Aquaculture Biology of Freshwater Fishes,Ministry of Agriculture,Freshwater Fisheries Research Center,Chinese Academy of Fishery Sciences,Wuxi 214081,China)
Two feeding trails were conducted to study effects of different diets and sediments on growth of juvenile freshwater mussel Hyriopsis cumingii at water temperature of(24±1)℃in order to find suitable diets and sediment for survival of freshwater mussel juveniles.In the first trail,effects of two different substrates(fine sediment and fine sediment with calcium powder)and two diets(Nanno 3600 and Shellfish diet 1800)on survival and growth of 1-30 d old freshwater mussel juveniles(freshly metamorphosed)were tested,and in the second trail,influences of five diets(Nanno 3600,Shellfish diet 1800,Chlorella vulgaris,Scenedesmus quadricauda and Oocystis sp.)on survival and growth of 31-60 d old juveniles were studied.The one-way analysis of variance revealed that there was no significant difference in survival between the juveniles in group A3 fed Nanno 3600 and fine sediment(P>0.05)and in group A1 fed mixed algae and fine sediment,significant difference(P<0.05)that in the juveniles fed mixed algae in group A2 and fine sediment with calcium,and very significant difference(P<0.01)with group A5 which was cultured in pond water collected from the Freshwater Fisheries Research Center.The best growth was observed in the juveniles in group A2,with far higher shell length than those in groups A1 and A3(P<0.05)and very far higher than those in groups A4 and A5(P<0.01).In the second stage,group B5 presented significantly higher survival rate compared to groups B1,B2 and B4(Shellfish diet 1800)(P<0.05),and very significantly higher survival rate compared to group B3(P<0.01).There was no significant difference in shell length between group B5 and groups B4(P>0.05),significance difference in groups B1 and B2(P<0.05),and very significant difference with group B3(P<0.01).It can be concluded that the survival will be improved in 1-30 d old juveniles fed Nannochloropsis oculata in Nanno 3600,and that adding calcium in sediment is conducive to the growth of the juveniles.Nannochloropsis oculata is more conducive to growth of the 31-60 d old juvenile freshwater mussel.
Hyriopsis cumingii;diet;sediment;survival rate
10.16535/j.cnki.dlhyxb.2017.02.006
2095-1388(2017)02-0155-06
S966.2
:A
2016-06-06
江苏省水产三新工程项目(Y2014-38);中央基本科研业务费专项(2015JBFM02)
张佳康(1994—),男,本科生。E-mail:615141413@qq.com
马学艳(1990—),女,研究实习员。E-mail:maxy@ffrc.cn

