宫颈癌术后输注细胞因子诱导的杀伤细胞治疗前后外周血免疫指标的变化
赵 花,刘征丽,许 霞
宫颈癌术后输注细胞因子诱导的杀伤细胞治疗前后外周血免疫指标的变化
赵 花1,刘征丽2,许 霞1
目的 观察鳞癌、腺癌、腺鳞癌3种类型宫颈癌根治术后使用细胞因子诱导的杀伤细胞(cytokine induced killer,CIK)治疗前后外周血中免疫指标的变化,为临床使用CIK治疗宫颈癌效果评估提供依据。方法 收集我院2014-01至2016-05肿瘤科和妇产科行宫颈癌根治术后患者98例(其中鳞癌56例,腺癌25例,腺鳞癌17例)CIK治疗前1 d和治疗1个周期后的外周血各5 ml,收集的外周血按CIK细胞治疗流程进行血清分离,分离后的血清用流式细胞计数仪对血清中CD3+、CD4+、CD8+、CD4/CD8、NK细胞的比例进行检测分析。结果 (1)98例宫颈癌根治术后使用CIK细胞治疗前后外周血中免疫指标的对比显示CD3+、NK细胞的比例均升高,CD4+、CD4/CD8比例仅在鳞癌和腺癌中升高,CD8+治疗前后变化不明显。(2)以CD3+和NK细胞为例可以看出使用CIK细胞治疗后腺癌免疫指标较鳞癌、腺鳞癌有显著提升(P<0.05),鳞癌治疗前后,CD3+:(60.71±5.84)/(67.27±3.04),NK细胞:(8.92±3.64)/(12.93±6.25);腺癌治疗前后,CD3+:(59.91±2.49)/(68.32±8.24),NK细胞:(9.04±5.31)/(17.87±6.46);腺鳞癌治疗前后,CD3+:(59.01±5.90)/(65.23±7.07),NK细胞:(8.59±3.97)/(15.07±2.71)。结论 CIK 细胞治疗可以显著提升宫颈癌根治术后患者的免疫功能,对延长生存期,提高生存质量具有重要意义。
细胞因子诱导的杀伤细胞; 宫颈癌; 免疫指标
宫颈癌是最常见的妇科恶性肿瘤之一,高发年龄为30~55岁,是我国女性生殖系统恶性肿瘤发生率最高的肿瘤[1]。近年来,临床上宫颈癌治疗主要以手术与放化疗为主,随着宫颈细胞学筛查的普遍应用,宫颈癌早期病变得以发现和治疗,宫颈癌的发病率、病死率均有明显下降[2]。但宫颈癌的转移、预后不良一直是临床治疗上的难题,尤其是晚期宫颈癌患者自身免疫功能缺陷[3],以及放疗、化疗后造成的免疫系统紊乱,严重影响患者的生活质量[4]。目前,细胞因子诱导的杀伤细胞(cytokine induced killer,CIK)因其增殖速度快、强大的抗瘤活性、毒性小等特点,已被应用在肾癌、结肠癌 、淋巴瘤等多种恶性肿瘤的过继性细胞免疫治疗,并取得了较好的临床治疗效果[5],但有关CIK 治疗宫颈癌的报道较少。本研究通过收集98例(鳞癌56例,腺癌25例,腺鳞癌17例)宫颈癌根治术后患者进行CIK细胞治疗前后的外周血清,检测相关的免疫指标并整理分析,为临床不同类型宫颈癌根治术行CIK细胞治疗疗效观察提供有力依据。
1 对象与方法
1.1 对象 收集2014-01至2016-05在我院肿瘤科和妇产科行宫颈癌根治术后患者98例。入选标准:经影像学诊断无局部复发和转移,无免疫系统疾病,无慢性感染疾病,无输血和脏器移植史。所有患者签署知情同意书,实验设计经医院医学伦理委员会批准。
1.2 CIK细胞治疗 抗凝管采集肿瘤患者外周血50 ml,加入等量细胞分离液,采用Ficoll离心法分离淋巴细胞,置于无血清培养基中培养(37 ℃、5%CO2),加入IL-2和抗CD-3单克隆抗体,观察细胞培养情况,每3 d换液,2周左右回收细胞。检查细菌、真菌、支原体、内毒素等,对CIK细胞进行百分比计数,经质量检测合格后收集培养的细胞,予以静脉回输治疗。
1.3 免疫指标检测 抗凝管分别抽取5 ml肿瘤患者治疗前1 d和CIK细胞治疗1个周期[(28±3)d]的血清,检测相关的免疫指标,包括CD3+、CD4+、CD8+、CD4/CD8、NK细胞(CD16+CD56+)。
1.4 仪器和试剂 流式细胞仪为BD FASCalibur;人淋巴细胞分离液由天津市灏洋生物制品科技有限责任公司提供;CD3、GM-CSF、尤尼芬、白介素2由北京达科为生物技术有限公司提供;TNF-G由上海唯科生物制药有限公司提供。
1.5 统计学处理 采用SPSS19.0软件进行统计分析,对3种不同类型宫颈癌患者外周血中免疫指标进行单因素方差分析,治疗前后患者免疫指标采用配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况 总共收集56例鳞癌,平均(52.7±6.3)岁;25例腺癌,平均(54.1±3.8)岁;17例腺鳞癌,平均(53±2.7)岁,3种不同类型宫颈癌患者年龄和治疗前免疫指标差异无统计学意义,具有可比性。
2.2 免疫指标结果 治疗后CD3+、CD4+、NK细胞差异有统计学意义(P<0.05),CD8和NK细胞差异无统计学意义;在鳞癌中,CD3+、CD4+、CD4/CD8、NK细胞有统计学差异(图1);在腺癌中,CD3+、CD4+、CD4/CD8、NK细胞有统计学差异(图2)。在腺鳞癌中,仅有CD3+、NK细胞有统计学差异(图3);CIK细胞治疗不同类型宫颈癌前后免疫指标变化(表1)。
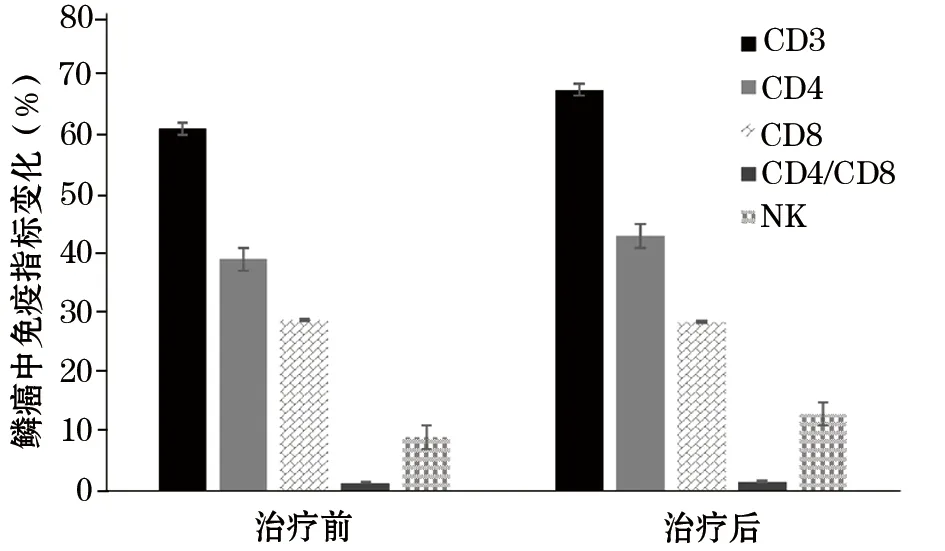
图1 宫颈癌鳞癌术后患者输注CIK细胞治疗前后外周血中免疫指标变化

图2 宫颈癌腺癌术后患者输注CIK细胞治疗前后外周血中免疫指标变化

图3 宫颈癌腺鳞癌术后患者输注CIK细胞治疗前后外周血免疫指标变化
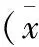

项目鳞癌(n=56)治疗前治疗后腺癌(n=25)治疗前治疗后腺鳞癌(n=17)治疗前治疗后CD3+60.71±5.8467.27±3.04①59.91±2.4968.32±8.24①59.01±5.9065.23±7.07①②CD4+38.87±8.4442.73±7.83①39.64±8.4943.78±7.62①39.71±9.4040.01±10.38②CD8+28.72±8.3228.34±8.1628.37±7.9427.92±8.7429.07±7.6827.31±11.97CD4/CD81.35±0.571.51±0.73①1.40±0.431.57±0.53①1.37±0.571.47±0.62NK8.92±3.6412.93±6.25①9.04±5.3117.87±6.46①8.59±3.9715.07±2.71①②
注:与治疗前比较,①P<0.05;不同肿瘤之间比较,②P<0.05
3 讨 论
宫颈癌已成为妇科常见肿瘤,药物和手术治疗对宫颈癌虽取得一定疗效,但术后复发和转移十分常见,而且患者存在免疫功能低下,导致疗效较差[6]。寻找新的治疗方案,为提高患者机体免疫力、改善治疗效果具有重要意义。近年来,随着对肿瘤患者发病机制研究的深入,发现免疫功能与肿瘤发生发展有着密不可分的关系。有研究表明,提高免疫功能可消除和减缓肿瘤的发生和发展[7]。CIK作为一种新型的免疫活性细胞,被认为是肿瘤过继细胞免疫治疗首选方案。CIK细胞通过体外培养,在白介素-2、TNF-G等细胞因子的刺激下,大量扩增、成熟,然后回输给患者使其获得抗原特异性的肿瘤免疫效应,CIK还具有只识别杀灭肿瘤细胞而不对机体正常细胞产生作用[8,9]。CIK细胞治疗的临床效果已经在胃癌、直肠癌、胆管癌等多种肿瘤治疗中的得到验证[10]。
有研究发现,恶性肿瘤患者的免疫抑制与CD4+、CD8+增多有关[11]。CD3+是T细胞表面特异性表达的分子,CD4+、CD8+是辅助性T细胞,具有细胞毒性作用,CD4+能介导机体再次免疫,CD8+是抑制性T细胞,能够促进B细胞增值产生抗体,生成CIK细胞[12]。在正常情况下 CD4/CD8比值处在动态平衡,以维持机体内环境的稳定[13]。NK细胞可以不用识别直接对肿瘤细胞产生杀伤作用[14]。本研究中治疗前相对于治疗后,CD3+、CD4+的比例均有所上升,但是CD8+在3种肿瘤中均下降不明显。CD3+、CD4+比例上升,CD4/CD8升高,表明经CIK治疗后,机体免疫功能增强,但CD4+、CD4/CD8在腺鳞癌中变化差异无统计学意义,表明CIK治疗改善腺鳞癌的机体免疫功能不明显。该结果可能是腺鳞癌样本只有17例,数据离散程度(标准差)比鳞癌和腺癌高引起的。本研究中CD8+比例下降不明显,可能与两方面原因有关:(1)CD4+比例升高,影响CD8+在细胞中的比例;(2)CD8+实际下降不明显。NK细胞是参与机体细胞免疫的重要细胞,CIK细胞在受到抗CD-3刺激后会释放CD16+CD56+,这些胞浆颗粒释放到细胞外,通过细胞毒性杀死肿瘤细胞[15]。本研究3组肿瘤前后对比中NK细胞(CD16+CD56+)比例上升,提示经CIK细胞治疗宫颈癌后,机体免疫功能加强。通过此研究数据结果显示与国内外文献报道CIK细胞治疗肿瘤效果评价一致,接受CIK细胞治疗后的患者淋巴细胞水平都有不同程度增高,而且远期效果观察对促进患者免疫系统重建,消除微小病灶有良好效果。
综上所述,CIK细胞治疗在宫颈癌根治术后,尤其是腺癌患者有明显的临床效果。CIK细胞治疗对提高机体免疫功能、改善机体的抗瘤能力、延长生存期、提高生存质量具有重要意义。
[1] 雷张涛,叶 红.宫颈癌肿瘤干细胞的研究进展[J]. 医学综述, 2012, 7(8): 1156-1158.
[2] Antill Y C,Dowty J G,Win A K,etal. Lynch Syndrome and Cervical Cancer[J]. Int J Cancer, 2015, 137(11): 2757-2761.
[3] Schmeel L C,Schmeel F C,Coch C,etal. Cytokine-induced Killer (cik) Cells in Cancer Immunotherapy: Report of the International Registry on Cik Cells (ircc)[J]. J Cancer Res and Clin Oncol, 2015, 141(5): 839-849.
[4] Dasari S,Wudayagiri R,Valluru L. Cervical Cancer: Biomarkers for Diagnosis and Treatment[J]. Clin Chim Acta, 2015, 445(9): 7-11.
[5] 罗光华,马 鸣,郭莉莉,等. CIK细胞治疗对肿瘤患者外周血免疫细胞亚型的影响[J]. 中国肿瘤生物治疗杂志, 2013, 12(4): 475-477.
[6] 吕晓霞,陈帼玲,王学群,等. 自体CIK细胞治疗21例中晚期恶性实体瘤的肿瘤标志物变化观察[J]. 中华细胞与干细胞杂志, 2014, 7(3): 165-174.
[7] 林 兰,刘继斌. 中晚期消化系恶性肿瘤CIK细胞治疗前后免疫功能变化的价值[J]. 肿瘤基础与临床, 2010, 12(5): 399-401.
[8] 赵 华,贾咏梅. DC-CIK免疫治疗联合常规化疗对非小细胞肺癌患者血清学及外周血免疫功能指标的影响[J]. 海南医学院学报, 2015, 6(7): 967-970.
[9] 苏小岩,胡 艳,张文涛,等. DC-CIK细胞免疫治疗联合放疗治疗中晚期宫颈癌的疗效观察[J]. 长江大学学报(自科版), 2014, 4(33): 4, 77-79.
[10] 田志刚. 基于NK细胞的肿瘤免疫治疗研究进展[J]. 中国肿瘤生物治疗杂志,2009,1:2-5.
[11] 周 怡,蒋敬庭. 细胞因子在CIK细胞抗肿瘤治疗中的作用[J]. 临床检验杂志,2014,32(2):115-117.
[12] 邢 宏,韩方正,汪莉萍. 细胞因子诱导的杀伤细胞CIK的基础与临床研究新进展[J].中国免疫学杂志,2011,27(1):88-92.
[13] 张丽鹏,李新伟,黄宽军,等. DC-CIK细胞免疫治疗晚期结直肠癌患者的远期疗效及影响因素分析[J].现代生物医学进展,2016,22(16):4348-4351.
[14] 李晓英,鲍杨漪,江蓓蕾,等. 不同类型肿瘤患者自体CIK 细胞治疗对机体免疫状态及临床症状改善的影响[J].安徽医科大学学报,2012,47(4):434-437.
[15] Akyol M,Ulger E,Alacacioglu A,etal.Quality of life in colorectal cancer patients:an Izmir Oncology Group (IZOG)study[J]. J Buon,2015,20(4):1015-1022.
(2016-08-11收稿 2016-11-18修回)
(责任编辑 岳建华)
Changes of immune parameters in cervical cancer patients after CIK cell therapy
ZHAO Hua1,LIU Zhengli2,and XU Xia1.
1.Department of Clinical Laboratory,2.Department of Gynaecology and Obstetrics,Shaanxi Provincial Corps Hospital of Chinese People’s Armed Police Force,Xi’an 710054
Objective To observe the changes of immune parameters of patients with different cervical cancer treated with cytokine-induced killer(CIK)cells after radical hysterectomy in order to provide data for clinical evaluation.Methods 50 ml peripheral blood was collected the day before CIK cell therapy and after a course of treatment from ninety-eight radical hysterectomy patients(56 cases of squamous carcinoma, 25 cases of adenocarcinoma,and 17 cases of adenosquamous carcinoma) treated in the Department of Gynaecology and Obstetrics and Department of Oncology between January 2014 and September 2016.According to the process of CIK cell therapy, the serum was separated, and the proportion of CD3+、CD4+、CD8+、CD4/CD8、and NK cells in the serum was analyzed using flow cytometry (FCM).Results 1.The proportion of CD3+and NK cells in the 98 patients was increased after CIK cell therapy.The proportion of CD4+and CD4/CD8 rose only in patients of squamous carcinoma and adenocarcinoma.The proportion of CD8+did not change significantly.2.The result of CD3+and NK cells suggested that after treatment the immune parameters in patients of adenocarcinoma were significantly higher than those in patients of squamous carcinoma and adenosquamous carcinoma (P<0.05).After treatment, CD3+and NK cells increased from 60.71±5.84 to 67.27±3.04 and from 8.92±3.64 to 12.93±6.25 respectively in patients of squamous carcinoma, from 59.91±2.49 to 68.32±8.24 and from 9.04±5.31 to 17.87±6.46 respectively in patients of adenocarcinoma,and finally from 59.01±5.90 to 65.23±7.07 and from 59±3.97 to 15.07±2.71 respectively in patients of adenosquamous carcinoma.Conclusions CIK cell therapy can markedly enhance the immunity of patients after radical hysterectomy. It’s of great significance for improving the quality of survival.
cytokine induced killer;cervical cancer;immune parameters
赵 花,本科学历,主管技师。
710054 西安,武警陕西总队医院:1.检验科,2.妇产科
R737.3

