阿托伐他汀对脂多糖诱导小鼠胰岛β细胞NF-κB、TLR4表达与胰岛素分泌的影响
肖 潇,杜万红,刘小阳,夏亚玲,杨小平,苏琼丽
(1.湖南师范大学第二附属医院,解放军第163医院,长沙 410003;2.湖南师范大学医学院,长沙市410006)
阿托伐他汀对脂多糖诱导小鼠胰岛β细胞NF-κB、TLR4表达与胰岛素分泌的影响
肖 潇1,杜万红1,刘小阳1,夏亚玲1,杨小平2,苏琼丽2
(1.湖南师范大学第二附属医院,解放军第163医院,长沙 410003;2.湖南师范大学医学院,长沙市410006)
目的:研究阿托伐他汀对脂多糖诱导小鼠胰岛β细胞活力,核转录因子(NF-κB)、Toll样受体4(TLR4)表达与胰岛素分泌影响的机制。方法:MTT测定细胞活性,ELISA检测胰岛素浓度,Western blotting检测NF-κB、TLR4蛋白水平。结果:与对照组相比,LPS干预24h后,MIN6细胞活力、胰岛素分泌功能下降,TLR4、NF-κB蛋白水平上调。与LPS组相比,LPS+阿托伐他汀各浓度组干预24h后细胞活力呈浓度依赖性增加。LPS+阿托伐他汀高浓度组较LPS组胰岛素分泌水平增加。LPS+阿托伐他汀中、高浓度组TLR4、NF-κB蛋白水平较LPS组呈浓度依赖性下调。结论:阿托伐他汀可逆转LPS诱导MIN6损伤并与TLR4/NF-κB通路的激活有关。
阿托伐他汀;脂多糖;Toll样受体;核转录因子-κB;胰岛β细胞
阿托伐他汀作为一种降脂药物被广泛应用于心血管疾病和高脂血症的治疗。最新研究发现,除了降脂作用外,它还有改善细胞炎症、调节细胞功能等作用[1-2]。而炎症和胰岛β功能障碍有关,研究显示糖尿病患者体内常合并脂多糖(Lipopolysaccharide,LPS)水平增高,增高的LPS通过Toll样受体4(Toll-like receptors 4,TLR4)参与细胞自身炎症反应凋亡。LPS与TLR4结合后,经过系列信号通路激活NF-κB,启动或抑制相关基因表达、调节细胞功能[3]。本实验旨在研究阿托伐他汀对LPS诱导MIN6细胞的NF-κB、TLR4蛋白表达量和胰岛素分泌的影响及可能机制。
1 材料与方法
1.1 主要材料设备 胰岛β细胞株MIN6细胞(购自湘雅医学院细胞中心);兔抗小鼠TLR4抗体(武汉博士德公司),鼠抗小鼠NF-κB抗体、HRP标记羊抗小鼠抗体(SantaCruz公司),HRP标记羊抗兔抗体、β-actin兔抗小鼠抗体(Cell Signaling公司),LPS、阿托伐他汀钙、MTT(Sigma公司),ECL酶底物显色试剂盒(Thermo公司),小鼠胰岛素ELISA试剂盒(上海西塘生物公司),多功能酶标仪-SynergyHTX(BioTek公司),Tanon 5200化学发光图像分析系统(天能公司)。
1.2 细胞培养 MIN6细胞株按已有方案进行培养[8]
1.3 实验分组 实验分为空白对照组,LPS组(1mg/L),DMSO组(0.5% W/V),阿托伐他汀低、中、高浓度组(0.1μmol/L、1μmol/L、10μmol/L),LPS+阿托伐他汀低、中、高浓度组9组。LPS+阿托伐他汀组,先加入阿托伐他汀原药预处理30min,再加入 LPS处理。
1.4 MTT法检测LPS对MIN6细胞活力的影响MIN6细胞按每孔5×103个接种于96孔板,24h后干预。于6、12、24h检测细胞活力。检测方法:每孔加入MTT 20μL,避光孵育5h,吸弃上清,每孔加入DMSO 150μL,避光震荡10min,酶标仪检测波长490nm处吸光度。细胞活力为各处理组OD值与对照组OD值之比。
1.5 葡萄糖刺激胰岛素释放 MIN6细胞按每孔5× 104个接种于12孔板,培养24h后,弃上清,PBS清洗2次,加入含2.8mmol/L葡萄糖的克-林重碳酸盐(Krebs-Ringer bicarbonate,KRB)缓冲液500μL,孵育30min,弃上清,加入含2.8mmol/L葡萄糖KRB缓冲培养液孵育1h,取100μL上清检测胰岛素;弃上清,加入含16.7mmol/L葡萄糖的KRB缓冲液1mL,孵育1h,取上清检测胰岛素。胰岛素释放指数(Insulin Serection Index,ISI)=高糖(16.7mmol/L)KRB缓冲液中的胰岛素浓度与低糖(2.8mmol/L)KRB缓冲液的胰岛素浓度比值表示。
1.6 Western blotting检测LPS对MIN6细胞NF-κB、TLR4蛋白表达的影响。 WB按已有的方法进行[4],使用TLR4(1:600)、NF-κB(1:1000)及β-actin (1:1000)等一抗,4℃孵育过夜。TBST冲洗15min×3,按1∶5000加入HRP标记二抗,室温孵育1h,TBST冲洗15min×3,ECL试剂盒处理。最后扫描图片,Image J软件分析条带灰度值。
1.7 统计方法 使用SPSS 22.0处理数据,均数表示为平均值±标准差。两组均数比较采用独立样本的T检验,多组均数比较采用方差分析和NS-K检验。双侧P<0.05认为差异有统计学意义。
2 结 果
2.1 阿托伐他汀对LPS刺激后胰岛β细胞活力的影响


阿托伐他汀本身对细胞活力无影响。LPS处理使得细胞活力呈随LPS处理时间增加而降低(P<0.01),而阿托伐他汀能逆转LPS降低的细胞活力(P<0.05)(图1)。图 1 阿托伐他汀对LPS刺激后胰岛β细胞活力的影响(n=6),A、B、C、D干预时间分别为24h、6h、12h、24h。a为P<0.05与对照组相比,b、c为P<0.05与LPS组相比。
2.2 阿托伐他汀对LPS刺激对胰岛β细胞胰岛素分泌功能的影响。 阿托伐他汀和DMSO对胰岛素分泌无明显影响(图2A)。在低糖及高糖环境下LPS处理使胰岛素分泌减少(P<0.05;图2B)。阿托伐他汀能提升LPS在高糖刺激下胰岛素分泌量的减低(P<0.05;图2B)。
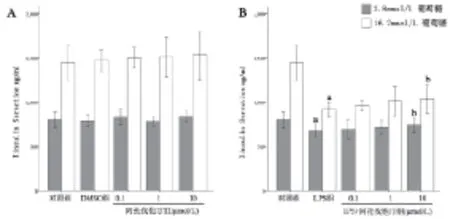
图 2 阿托伐他汀对LPS刺激后胰岛β细胞胰岛素分泌的影响a为P<0.05与对照组相比,b为P<0.05与LPS组相比。
2.3 阿托伐他汀对LPS刺激后胰岛β细胞NF-κB、TLR4蛋白表达量的影响。

DMSO以及阿托伐他汀对TLR4、NF-κB蛋白表达无影响。LPS处理使TLR4、NF-κB表达量增高(P<0.01),阿托伐他汀逆转LPS引起的TLR4和NF-κB蛋白的降低,并呈现浓度依赖性(r=-0.905,P<0.01;r=-0.824,P<0.01)。图 3 阿托伐他汀对LPS刺激后胰岛β细胞TLR4、NF-κB蛋白表达的影响a为P<0.05与对照组相比,b为P<0.05与LPS组相比。
3 讨论
研究显示糖尿病患者肠道菌群水平明显高于正常人群、菌群结构紊乱[5-7]。LPS是革兰氏阴性细菌细胞壁的主要成分,它通过与肠粘膜免疫细胞表面的TLR4结合,激活下游的靶蛋白,通过LPS/TLR4/NF-κB激活炎症的级联反应,从而诱发慢性炎症[8]。炎症水平的增加导致糖尿病患者自身异常的免疫反应上调,加重胰岛素抵抗和胰岛β细胞的损伤。
本研究选取LPS刺激胰岛β细胞建立慢性炎症损伤模型[9]。结果显示LPS刺激后,细胞活力呈时间依赖性降低。LPS处理MIN6细胞,胰岛素分泌水平显著降低。说明LPS影响胰岛β细胞的活性和胰岛素分泌功能。MTT法验证了阿托伐他汀对LPS刺激后的胰岛β细胞的保护作用。ELISA实验显示,阿托伐他汀可改善受损胰岛细胞在胰岛素分泌水平。Western Blot结果显示,阿托伐他汀不改变TLR4、NF-κB的表达水平,而LPS刺激后,TLR4和其下游的NF-κB大幅增加。但阿托伐他汀干预组,TLR4、NF-κB蛋白表达水平明显回落。研究结果显示,LPS使胰岛β细胞高表达TLR4。而阿托伐他汀可降低炎症损伤胰岛β细胞中的TLR4水平,下调下游NF-κB蛋白表达水平。因NF-κB是调节细胞活力的重要因子,细胞活性增加,最终影响胰岛素分泌水平。在单独使用阿托伐他汀干预过程中,未使用LPS刺激的正常胰岛β细胞的TLR4低表达,使用阿托伐他汀干预并不能下调TLR4表达,下游NF-κB不能激活,故细胞活性、胰岛素分泌功能和TLR4、NF-κB表达水平没有产生明显变化。
综上所述,阿托伐他汀可剂量依赖性改善LPS刺激后受损的Min6细胞的活力,增加胰岛素分泌水平,其机制与阿托伐他汀干预TLR4/NF-κB信号通路相关
[1] 中国成人血脂异常防治指南制订联合委员会. 中国成人血脂异常防治指南[J]. 中华心血管病杂志, 2007, 35(05): 390-419.
[2] Kearney PM, Blackwell L, Collins R, et al. Cholesterol Treatment Trialists’ (CTT) Collaborators. Efficacy of cholesterol-lowering therapy in 18, 686 people with diabetes in 14 randomised trials of statins: a metaanalysis[J]. Lancet, 2008, 371(9607): 117-125.
[3] Jagannathan M, McDonnell M, Liang Y, et al. Toll-like receptors regulate B cell cytokine production in patients with diabetes[J]. Diabetologia, 2010, 53(7): 1461-1471.
[4] Su Q, Peng M, Zhang Y, et al. Quercetin induces bladder cancer cells apoptosis by activation of AMPK signaling pathway[J]. American journal of cancer research, 2016, 6(2): 498.
[5] Murri M, Leiva I, Gomez-Zumaquero J M, et al. Gut microbiota in children with type 1 diabetes differs from that in healthy children: a casecontrol study[J]. BMC medicine, 2013, 11(1): 46.
[6] Giongo A, Gano KA, Crabb DB, et al. Toward defining the autoimmune microbiome for type 1 diabetes[J]. The ISME journal, 2011, 5(1): 82-91.
[7] Brown CT, Davis-Richardson AG, Giongo A, et al. Gut microbiome metagenomics analysis suggests a functional model for the development of autoimmunity for type 1 diabetes[J]. PloS one, 2011, 6(10): e25792.
[8] Hakansson A, Molin G. Gut microbiota and inflammation[J]. Nutrients, 2011, 3(6): 637-682.
[9] Garay-Malpartida HM, Mourão RF, Mantovani M, et al. Toll-like receptor 4(TLR4) expression in human and murine pancreatic beta-cells affects cell viability and insulin homeostasis[J]. BMC immunology, 2011, 12(1): 18.
Effects of atorvastatin on NF-κB, TLR4 expression and insulin secretion in mouse pancreatic βcells stimulated with lipopolysaccharide
Xiao Xiao1, Du Wan-hong1, Liu Xiao-yang2, Xia Ya-Ling1, Yang Xiao-ping3, Su Qiong-Li3
(1. Second Hospital Affiliated to Hunan Normal University, Changsha 410003, China; 2.163 Military Hospital of China, Changsha410003, China; 3. Hunan Normal University School of Medicine, Changsha410006, China)
Objective Study the effects of atorvastatin on lipopolysaccharide induce NF-κB, TLR4 expression and insulin secretion in mouse pancreatic islet β cells. Methods Cell viability was measured by MTT. NF-κB and TLR4 protein expression was detected by Western blotting. insulin secretion function of MIN6 cells was measured by ELISA. Results Compared with the control group, the activity of MIN6 cells and the secretion of insulin were decreased after LPS intervention for 24 h, and the levels of TLR4 and NF-κB were up-regulated. Compared with LPS group, the cell viability of LPS + atorvastatin group was increased in a concentration-dependent manner. LPS + atorvastatin group had higher level of insulin secretion than LPS group. The levels of TLR4 and NF-κB in LPS + atorvastatin group were lower than those in LPS group. Conclusion LPS-induced injury of MIN6 is associated with the activation of TLR4 / NF-κB pathway. Atorvastatin can block this pathways, increase MIN6 cell viability andincerease insulin secretion.
atorvastatin; lipopolysaccharide; toll-like receptor; nuclear transcription factor-κB; islet β-cell
R96
A
1673-016X(2017)02-0051-03
2017-01-20
长沙市科技局科技攻关资金专项资助课题(NO.k1406022-31)
杜万红,E-mail:duge@263.net

